
Azote
Contexte des ??coles Wikip??dia
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
| Azote | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
7 N | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
gaz incolore, liquide ou solide  L'azote liquide Raies spectrales d'azote | |||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||
| Nom, symbole, nombre | azote, N, 7 | ||||||||||||||||||||||||
| Prononciation | / n aɪ t r ə dʒ ə n / -Jən de NY | ||||||||||||||||||||||||
| ??l??ment Cat??gorie | non m??talliques | ||||||||||||||||||||||||
| Groupe, p??riode, bloc | 15 (pnictogens), 2, p | ||||||||||||||||||||||||
| Poids atomique standard | 14,007 (1) | ||||||||||||||||||||||||
| Configuration ??lectronique | [Il] 2s 2 2p 3 2, 5 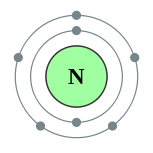 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| D??couverte | Daniel Rutherford (1772) | ||||||||||||||||||||||||
| Nomm?? par | Jean-Antoine Chaptal (1790) | ||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||
| Phase | gaz | ||||||||||||||||||||||||
| Densit?? | (0 ?? C, 101,325 kPa) 1,251 g / L | ||||||||||||||||||||||||
| Liquid densit?? ?? BP | 0,808 g ?? cm -3 | ||||||||||||||||||||||||
| Point de fusion | 63,15 K , -210,00 ?? C, -346,00 ?? F | ||||||||||||||||||||||||
| Point d'??bullition | 77,36 K, -195,79 ?? C, -320,33 ?? F | ||||||||||||||||||||||||
| Point triple | 63,1526 K (-210 ?? C), 12,53 kPa | ||||||||||||||||||||||||
| Point critique | 126,19 K, 3,3978 MPa | ||||||||||||||||||||||||
| La chaleur de fusion | (N 2) 0,72 kJ ?? mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | (N 2) 5,56 kJ ?? mol -1 | ||||||||||||||||||||||||
| Capacit?? thermique molaire | (N 2) 29,124 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||
| ??tats d'oxydation | 5, 4, 3, 2, 1, -1, -2, -3 (Fortement acide oxyde) | ||||||||||||||||||||||||
| ??lectron??gativit?? | 3,04 (??chelle de Pauling) | ||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 1402,3 kJ ?? mol -1 | ||||||||||||||||||||||||
| 2??me: 2856 kJ ?? mol -1 | |||||||||||||||||||||||||
| 3??me: 4578,1 kJ ?? mol -1 | |||||||||||||||||||||||||
| Rayon covalente | 71 ?? 13 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 155 h | ||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||
| Crystal structure | hexagonal  | ||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||
| Conductivit?? thermique | 25,83 x 10 -3 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||
| Vitesse du son | (Gaz, 27 ?? C) 353 m ?? s -1 | ||||||||||||||||||||||||
| Num??ro de registre CAS | 7727-37-9 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article d??taill??: Isotopes d'azote | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
L'azote est un ??l??ment chimique avec le symbole N et le nombre atomique 7. Azote ??l??mentaire est un gaz incolore, inodore, insipide, et la plupart du temps inerte au gaz diatomique conditions standard, constituant 78,09% en volume de l'atmosph??re terrestre . L'??l??ment azote a ??t?? d??couvert comme un ??l??ment s??parable de l'air, par le m??decin ??cossais Daniel Rutherford, en 1772. Il appartient ?? la pnictog??ne famille.
L'azote est un ??l??ment commun dans l'univers, estim?? ?? environ septi??me de l'abondance totale dans notre galaxie et de la syst??me solaire . Il est synth??tis?? par fusion de carbone et l'hydrog??ne en supernovas . En raison de la volatilit?? de l'azote ??l??mentaire et ses compos??s communs avec de l'hydrog??ne et de l'oxyg??ne, l'azote est beaucoup moins commune sur les plan??tes rocheuses du syst??me solaire interne, et ce est un ??l??ment relativement rare sur la Terre dans son ensemble. Cependant, comme sur Terre, de l'azote et ses compos??s se produisent couramment sous forme de gaz dans l'atmosph??re des plan??tes et des lunes qui ont atmosph??res.
De nombreux compos??s industriellement importants, tels que l'ammoniac , l'acide nitrique , les nitrates organiques ( propulseurs et explosifs), et cyanures, contenir de l'azote. La tr??s forte liaison dans l'azote ??l??mentaire domine chimie de l'azote, entra??nant des difficult??s pour les deux organismes et de l'industrie dans la conversion (ou ??fixer??) de la N 2 dans utiles compos??s , mais en m??me temps provoquant la lib??ration de grandes quantit??s d'??nergie souvent utile lorsque les compos??s br??ler, exploser ou se d??grader de nouveau dans de l'azote gazeux. Synth??tiquement-produit de l'ammoniac et de nitrates sont industriels cl??s engrais et les nitrates des engrais sont la cl?? provoquant polluants dans le eutrophisation des syst??mes d'eau.
En dehors de leurs principales utilisations que les engrais et l'??nergie-magasins, des compos??s azot??s organiques sont polyvalents. L'azote est partie de mat??riaux aussi divers que Kevlar tissu et colle cyanoacrylate "super". L'azote est un constituant de mol??cules dans chaque grande cat??gorie de drogues, y compris les pharmacologique antibiotiques . De nombreux m??dicaments sont imite ou pr??curseurs de mol??cules naturelles contenant de l'azote signaux: par exemple, les nitrates organiques nitroglyc??rine et nitroprussiate contr??le la pression sanguine en ??tant m??tabolis?? en naturelle l'oxyde nitrique. Usine alcalo??des (souvent des produits chimiques de d??fense) contenir de l'azote, par d??finition, et donc beaucoup de m??dicaments contenant de l'azote notables, comme la caf??ine et la morphine sont des alcalo??des ou imite synth??tiques qui agissent (comme de nombreux alcalo??des v??g??taux font) sur les r??cepteurs de l'animal neurotransmetteurs (par exemple, synth??tique amph??tamines).
L'azote se produit dans tous les organismes, essentiellement en acides amin??s (et donc des prot??ines ) et aussi dans la les acides nucl??iques ( ADN et ARN). Le corps humain contient environ 3% en poids d'azote, le quatri??me ??l??ment le plus abondant dans le corps apr??s l'oxyg??ne, du carbone et de l'hydrog??ne. Le cycle de l'azote d??crit mouvement de l'??l??ment de l'air dans les biosph??re et des compos??s organiques, puis de nouveau dans l'atmosph??re.
Histoire et ??tymologie
L'azote est formellement consid??r??e comme ayant ??t?? d??couvert par le m??decin ??cossais Daniel Rutherford en 1772, qui a appel?? ?? l'air nocif ou air fixe. Le fait qu'il n'y avait constituant de l'air qui ne supporte pas le combustion ??tait clair pour Rutherford. L'azote a ??t?? ??galement ??tudi?? ?? la m??me ??poque par Carl Wilhelm Scheele, Henry Cavendish, et Joseph Priestley, qui se est r??f??r?? ?? lui comme l'air br??l?? ou phlogiftiqu?? air. De l'azote gazeux ??tait assez inerte Antoine Lavoisier parl?? comme " l'air m??phitique "ou l'azote, du mot grec ἄζωτος (azotos) signifiant" sans vie ". Dans ce document, les animaux morts et les flammes se sont ??teintes. Le nom de Lavoisier pour l'azote est utilis?? dans de nombreuses langues (fran??ais, italien, polonais, russe, albanais, etc. .) et reste encore en anglais dans les noms communs des nombreux compos??s, tels que l'hydrazine et les compos??s de la ion azide.
Le mot anglais azote (1794) entr?? dans la langue de la nitrog??ne fran??ais, invent?? en 1790 par le chimiste fran??ais Jean-Antoine Chaptal (1756-1832), de la "nitron" Greek ( le carbonate de sodium) et le g??ne fran??ais (production). Le gaz avait ??t?? trouv?? dans l'acide nitrique . Le sens de Chaptal ??tait que de l'azote gazeux est la partie essentielle de l'acide nitrique, ?? son tour form?? ?? partir du salp??tre ( nitrate de potassium ), alors connu comme nitre. Ce mot dans le monde plus ancienne d??crite ?? l'origine sodium sels qui ne contiennent pas de nitrate, et est un apparent?? natron.
Les compos??s azot??s ??taient bien connus par les Moyen Age. alchimistes savaient acide nitrique comme l'eau-forte (eau forte). Le m??lange d'acide nitrique et les acides chlorhydrique ??tait connu comme l'eau r??gale (eau royale), c??l??bre pour sa capacit?? ?? dissoudre l'or (le roi des m??taux). Le premier militaire, et les applications industrielles, agricoles de compos??s azot??s utilis??s salp??tre ( nitrate de sodium ou le nitrate de potassium), notamment dans la poudre ?? canon , et plus tard comme engrais . En 1910, Lord Rayleigh a d??couvert que d'une d??charge ??lectrique dans le gaz d'azote produit "azote actif", une forme allotropique jug??e monoatomique. Le ??nuage tourbillonnant de lumi??re jaune brillante" produit par son appareil r??agit avec le mercure pour produire explosive nitrure de mercure.
Production
De l'azote gazeux est un gaz industriel produit par la fraction de distillation de liquide air , ou par des moyens m??caniques utilisant de l'air gazeux (ce est ?? dire, inverse sous pression membrane d'osmose ou Pressure Swing Adsorption). Commercial azote est souvent un sous-produit de traitement d'air pour la concentration industrielle de l'oxyg??ne pour la production d'acier et d'autres fins. Lorsque fourni comprim?? dans les cylindres, il est souvent appel?? OFN (de l'azote sans oxyg??ne).
Dans un laboratoire de chimie, il est pr??par?? en traitant une solution aqueuse de avec du chlorure d'ammonium le nitrite de sodium.
- NH4CI (aq) + NaNO 2 (aq) → N 2 (g) + NaCl (aq) + 2 H 2 O (l)
De petites quantit??s d'impuret??s N et HNO 3 sont ??galement form??s dans cette r??action. Les impuret??s peuvent ??tre ??limin??es en faisant passer le gaz ?? travers l'acide sulfurique aqueux contenant le dichromate de potassium. Tr??s azote pur peut ??tre pr??par?? par la d??composition thermique de azoture de baryum ou de l'azide de sodium.
- 2 NaN 3 → 2 Na + 3 N 2
Propri??t??s
L'azote est un non m??tallique, avec un ??lectron??gativit?? de 3,04. Il a cinq ??lectrons dans son coque externe et, par cons??quent, trivalent dans la plupart des compos??s. Le triple liaison dans de l'azote mol??culaire (N 2) est l'un des plus forts. La difficult?? r??sultant de la conversion N 2 en d'autres compos??s, et la facilit?? (et la lib??ration de haute ??nergie associ??e) de conversion des compos??s d'azote en ??l??mentaire N 2, ont domin?? le r??le de l'azote dans la nature et les activit??s ??conomiques humaines.
?? azote mol??culaire ?? la pression atmosph??rique condense ( liqu??fie ) ?? 77 K (-195,79 ?? C ) et g??le ?? 63 K (-210,01 ?? C) dans la b??ta hexagonale cristal serr??e allotropique forme. Ci-dessous 35,4 K (-237,6 ?? C) azote assume le forme allotropique cristalline cubique (appel??e la phase alpha). L'azote liquide, un fluide semblable ?? l'eau en apparence, mais avec 80,8% de la densit?? (masse volumique de l'azote liquide ?? son point d'??bullition est 0,808 g / ml), est un commune cryog??ne.
Allotropes instables d'azote constitu?? de plus de deux atomes d'azote ont ??t?? produites en laboratoire, comme N 3 et N 4. Sous des pressions extr??mement ??lev??es (1,1 millions atm) et des temp??ratures ??lev??es (2000 K), comme produit en utilisant un diamant cellule d'enclume, l'azote se polym??rise en la structure unique li?? cristal gauche cube. Cette structure est similaire ?? celle du diamant , et les deux ont extr??mement forte des liaisons covalentes. N 4 est surnomm??e ??diamant d'azote".
Autres allotropes (encore) comprennent unsynthesized hexazine (N 6, un benz??ne analogique) et octaazacubane (N 8, un cubane analogique). Le premier est pr??vu pour ??tre tr??s instable, tandis que le second est pr??vu pour ??tre cin??tiquement stable, pour des raisons de sym??trie orbital.
Isotopes
Il ya deux stables isotopes d'azote: 14 N et 15 N. De loin, le plus commun est 14 N (99,634%), qui est produite dans le Cycle CNO en ??toiles . Sur les dix isotopes produits par synth??se, 13 n a une demi-vie de dix minutes et les isotopes restants ont des demi-vies de l'ordre de quelques secondes ou moins.
R??actions biologiquement m??diation (par exemple, l'assimilation, la nitrification , et d??nitrification) contr??ler fortement dynamique de l'azote dans le sol. Ces r??actions entra??nent g??n??ralement 15 N enrichissement de la substrat et l'appauvrissement de la produit.
Une petite partie (0,73%) de l'azote mol??culaire dans l'atmosph??re de la Terre est le isotopologue 14 N 15 N, et presque tout le reste est 14 N 2.
Le radio-isotope N 16 le radionucl??ide est dominant dans le caloporteur de r??acteurs ?? eau pressuris??e ou r??acteurs ?? eau bouillante en fonctionnement normal. Il est produit ?? partir de 16 O (dans l'eau) via (N, p) une r??action. Il a une demi-vie courte d'environ 7,1 s, mais lors de son retour ?? la pourriture 16 O produit de haute ??nergie un rayonnement gamma (5-7 MeV).
De ce fait, l'acc??s ?? la tuyauterie de fluide de refroidissement primaire d'un r??acteur ?? eau sous pression doit ??tre r??duite pendant le fonctionnement en puissance du r??acteur. 16 N est l'un des principaux moyens utilis??s pour d??tecter imm??diatement, m??me de petites fuites du fluide de refroidissement primaire dans le cycle de vapeur secondaire.
De la m??me fa??on, l'acc??s ?? l'un des composants du cycle de vapeur dans un r??acteur ?? eau centrale nucl??aire ??bullition doit ??tre limit?? pendant le fonctionnement. Le condensat du condenseur est g??n??ralement retenu pendant 10 minutes pour permettre la d??composition de la 16 N. Ceci ??limine la n??cessit?? de prot??ger et limiter l'acc??s ?? l'une des conduites d'eau d'alimentation ou des pompes.
Spectre ??lectromagn??tique

L'azote mol??culaire (N 2 14) est en grande partie transparent ?? infrarouge et rayonnement visible parce que ce est un homonucl??aire mol??cule et, par cons??quent, n'a pas moment de dip??le pour se coupler ?? un rayonnement ??lectromagn??tique ?? ces longueurs d'onde. Significatif l'absorption se produit ?? extr??mes ultraviolets longueurs d'onde, en commen??ant autour de 100 nanom??tres. Ceci est associ?? ?? transitions ??lectroniques dans la mol??cule aux Etats dans lesquelles la charge ne est pas r??partie de mani??re ??gale entre des atomes d'azote. L'absorption d'azote conduit ?? une absorption importante de rayonnement ultraviolet dans la haute atmosph??re de la Terre et de l'atmosph??re d'autres corps plan??taires. Pour des raisons similaires, mol??culaire pur lasers ?? azote ??mettent typiquement de la lumi??re dans le domaine ultraviolet.
L'azote constitue ??galement une contribution ?? visibles air luminescence de la haute atmosph??re de la Terre, par excitation de l'impact d'??lectrons suivie par ??mission. Cette lueur d'air bleue visible (vu dans la polaire Aurora et ?? la lueur de rentr??e de retourner engin spatial) entra??ne g??n??ralement pas de l'azote mol??culaire mais plut??t parmi les atomes d'azote libres combinant avec l'oxyg??ne pour former l'oxyde nitrique (NO).
azote gazeux pr??sente ??galement scintillation.
R??actions


En g??n??ral, l'azote ne est pas r??actif ?? temp??rature et pression standard. N 2 r??agit spontan??ment avec quelques r??actifs, ??tant ??lastique pour acides et des bases et des oxydants et r??ducteurs plupart. Lorsque azote r??agit spontan??ment avec un r??actif, la transformation est souvent appel?? filet fixation de l'azote .
L'azote ??l??mentaire r??agit avec le lithium . Lithium br??le dans une atmosph??re de N 2 pour donner le nitrure de lithium:
- 6 Li + N 2 → 2 Li 3 N
Le magn??sium br??le aussi dans de l'azote, formant le nitrure de magn??sium.
- 3 Mg + N 2 → Mg 3 N 2
N 2 forme une vari??t?? de des produits d'addition avec des m??taux de transition. Le premier exemple d'un complexe de diazote est [Ru (NH 3) 5 (N 2)] 2+ (voir la figure ?? droite). Cependant, il est int??ressant de noter que le ligand N2 a ??t?? obtenu par la d??composition de l'hydrazine, et la coordination de diazote pas libre. De tels compos??s sont maintenant nombreux autres exemples comprennent IrCl (N 2) (PPh 3) 2, W (N 2) 2 ( Ph 2 PCH 2 CH 2 PPh 2) 2 et [(η 5 -C 5 H 4 Me) 2 Zr] 2 ( 2 μ, η 2, η 2 -N 2). Ces complexes illustrent la fa??on dont N 2 peut se lier au m??tal (s) dans nitrog??nase et le catalyseur pour la Proc??d?? Haber. Un proc??d?? catalytique ?? N 2 pour r??duire l'ammoniac avec l'utilisation d'une molybd??ne complexe en pr??sence d'une source de protons a ??t?? publi?? en 2005.
Le point de d??part pour la production industrielle de compos??s azot??s est le Proc??d?? Haber, dans lequel l'azote est fix?? par r??action de N 2 et H 2 sur un fer (II, III) oxyde (Fe 3 O 4) un catalyseur ?? environ 500 ?? C et 200 atmosph??res pression. La fixation biologique de l'azote en libre-vie cyanobact??ries et dans la nodules racinaires de plantes produit ??galement de l'ammoniac ?? partir d'azote mol??culaire. La r??action, qui est la source de la majeure partie de l'azote dans la biosph??re , est catalys??e par la nitrog??nase complexe enzymatique qui contient des atomes de Fe et Mo, en utilisant l'??nergie d??riv??e de l'hydrolyse de l'ad??nosine triphosphate (ATP) en l'ad??nosine diphosphate et inorganique phosphate (-20,5 kJ / mol).
Occurrence
L'azote est le principal constituant de la Terre de l ' atmosph??re (78,082% en volume de l'air sec, 75,3% en poids dans de l'air sec). Toutefois, cette forte concentration ne refl??te pas faible abondance globale de l'azote dans la composition de la Terre, d'o?? la plupart de l'??l??ment ??chapp?? par ??vaporation solaire, au d??but de la formation de la plan??te.
L'azote est un ??l??ment commun dans l'univers, et est estim?? ?? environ septi??me plus abondant ??l??ment chimique en masse dans l'univers, notre galaxie et le syst??me solaire. Sa pr??sence y est pens?? pour ??tre enti??rement due ?? la synth??se par fusion ?? partir de carbone et d'hydrog??ne en supernovae. Dans ces endroits, il a ??t?? cr???? par processus de fusion de carbone et d'hydrog??ne en supernovae . mol??culaire de l'azote et de l'azote compos??s ont ??t?? d??tect??s dans l'espace interstellaire par les astronomes utilisant le FUSE.
En raison de la volatilit?? de l'azote ??l??mentaire et ??galement ses compos??s communs avec l'hydrog??ne et de l'oxyg??ne, de l'azote et les compos??s ont ??t?? chass??s de la plan??t??simaux dans le syst??me solaire primitif par la chaleur du soleil, et sous la forme de gaz, ont ??t?? perdus aux plan??tes rocheuses du syst??me solaire interne. L'azote est donc un ??l??ment relativement rare sur ces plan??tes int??rieures, y compris la terre, dans son ensemble. En cela, l'azote ressemble n??on, qui a une abondance similaire dans l'univers, mais est ??galement rare dans le syst??me solaire interne. L'azote est estim?? ?? 30 e des ??l??ments en abondance cro??te. Il existe certains min??raux d'azote relativement peu r??pandue, comme le salp??tre (nitrate de potassium), Chili salp??tre (nitrate de sodium) et sel ammoniac (chlorure d'ammonium). M??me ceux-ci sont connus en tant que concentr?? principalement de fonds marins par ??vaporation, en raison de leur solubilit?? ais??e de la plupart d'origine naturelle de compos??s d'azote dans l'eau. Une tendance similaire se produit avec la solubilit?? dans l'eau de la lumi??re rare ??l??ment de bore .
Cependant, l'azote et ses compos??s se produisent beaucoup plus souvent sous forme de gaz dans l'atmosph??re des plan??tes et des lunes qui sont assez grand pour avoir atmosph??res. Par exemple, de l'azote mol??culaire est un constituant majeur non seulement de l'atmosph??re terrestre, mais aussi la Saturnian lune ??paisse atmosph??re de Titan. En outre, en raison de retendre par gravit?? ?? des temp??ratures plus froides, de l'azote et ses compos??s se produisent dans appr??ciable ?? des traces dans les atmosph??res plan??taires des plan??tes g??antes gazeuses.
L'azote est pr??sent dans tous les organismes vivants, des prot??ines, des acides nucl??iques et d'autres mol??cules. Il est g??n??ralement jusqu'?? environ 4% du poids sec de la mati??re v??g??tale, et d'environ 3% du poids du corps humain. Ce est une composante importante de d??chets d'origine animale (par exemple, guano), habituellement sous la forme d' ur??e , acide urique, compos??s d'ammonium, et les d??riv??s de ces produits azot??s, qui sont essentiels nutriments pour toutes les plantes qui ne peuvent pas fixer l'azote atmosph??rique .
Compos??s
Le principal neutre l'hydrure d'azote est l'ammoniac (N H 3), bien que l'hydrazine (N 2 H 4) est aussi couramment utilis??. L'ammoniac est plus base de l'eau par six ordres de grandeur. En solution d'ammoniac constitue la ammonium ions (NH +
4). Ammoniac liquide (point 240 K d'??bullition) est amphiprotique (affichant soit Br??nsted-Lowry de caract??re acide ou basique) et forme ammonium et moins commune ions amide (NH -
2); deux amides et nitrure (N 3-) sels sont connus, mais d??composer dans l'eau. S??par??ment, les compos??s d'alkyle doublement, triplement et quadruplement substitu??s de l'ammoniac sont appel??es amines (quatre substitutions dans le commerce, pour former les amines quaternaires et biologiquement importantes, conduit ?? un azote charg?? positivement, et ainsi une ??mulsion eau-soluble, ou au moins amphiphile, compos??). Les grandes cha??nes, des anneaux et des structures d'hydrures d'azote sont ??galement connus, mais sont g??n??ralement instables.
D'autres classes de l'azote anions (ions charg??s n??gativement) sont les toxiques azides (n -
3) qui sont lin??aires et iso??lectronique de dioxyde de carbone , mais qui se lient aux enzymes contenant du fer importantes dans le corps d'une mani??re plus semblable cyanure. Une autre mol??cule de la m??me structure est le gaz anesth??sique incolore et relativement inerte L'oxyde nitreux (protoxyde d'oxyde, N 2 O), ??galement connu sous le nom de gaz hilarant. Ce est l'une d'une vari??t?? d'azote oxydes qui forment une famille souvent abr??g??s NOx. L'oxyde nitrique ( le monoxyde d'azote, NO), est un produit naturel utilis?? radicaux libres dans la transduction du signal dans les plantes et les animaux, par exemple, dans vasodilatation en provoquant le muscle lisse des vaisseaux sanguins ?? se d??tendre. Le rouge et toxique le dioxyde d'azote NO 2 contient un non appari?? ??lectrons et est un ??l??ment important du smog . mol??cules d'azote contenant des ??lectrons non appari??s montrent une tendance ?? dim??riser (appariement ainsi les ??lectrons) et sont, en g??n??ral, tr??s r??actif. Les acides correspondants sont HNO 2 nitreux et l'acide nitrique HNO3, avec les sels correspondants appel??s nitrites et nitrates .}
Les oxydes sup??rieurs le trioxyde de diazote N 2 O 3, t??troxyde de diazote N 2 O 4 et pentoxyde de diazote N 2 O 5, sont instables et explosive, en cons??quence de la stabilit?? chimique de N 2. Presque tous Moteur de fus??e hypergolic utilise N 2 O 4 comme oxydant; les carburants, les diverses formes de hydrazine, sont ??galement des compos??s azot??s. Ces moteurs sont largement utilis??s sur les engins spatiaux tels que la navette spatiale et ceux de la Programme Apollo parce que leurs propulseurs sont liquides ?? temp??rature ambiante et l'allumage se produit au contact sans un syst??me d'allumage, ce qui permet de nombreuses br??lures pr??cis??ment contr??l??es. Certains v??hicules de lancement comme le Titan II et Ariane 1 ?? 4 aussi utiliser des combustibles hypergoliques, bien que la tendance est ?? l'??cart de ces moteurs, pour des raisons de co??t et de s??curit??. N 2 O 4 est un interm??diaire dans la fabrication d'acide nitrique HNO 3, l'un des rares acides plus forts que hydronium et une assez forte agent oxydant.
L'azote est remarquable pour la gamme de compos??s instables explosive qu'elle peut produire. Triiodure d'azote NI 3 est un extr??mement sensible contacter explosive. La nitrocellulose, produit par nitration de la cellulose avec de l'acide nitrique, est ??galement connu comme fulmicoton. Nitroglyc??rine, faite par nitration de la glyc??rine, l'ingr??dient est dangereusement explosif instable dynamite. L'explosif relativement stable, mais moins puissant trinitrotolu??ne (TNT) est l'explosif norme ?? laquelle la puissance des explosions nucl??aires sont mesur??s.
L'azote peut ??galement ??tre trouv??e dans les compos??s organiques . Azote commun groupes fonctionnels comprennent: des amines , les amides, des groupes nitro, imines, et ??namines. La quantit?? d'azote dans un substance chimique peut ??tre d??termin??e par la M??thode de Kjeldahl.
Applications

De l'azote gazeux
De l'azote gazeux a une vari??t?? d'applications, y compris comme une portion remplacement inerte pour l'air o?? oxydation ne est pas souhaitable;
- Comme un atmosph??re modifi??e, pur ou en m??lange avec du dioxyde de carbone , afin de pr??server la fra??cheur des aliments emball??s ou en vrac (en retardant rancissement et d'autres formes de dommages oxydatifs) d'azote pur comme additif alimentaire est ??tiquet?? dans le Union Eurpean avec le Num??ro E E941 .
- Dans ordinaire les ampoules ?? incandescence comme une alternative bon march?? ?? l'argon .
- La production de composants ??lectroniques tels que transistors, diodes et circuits int??gr??s .
- S??ch??s et mis sous pression, en tant que di??lectrique gaz pour ??quipements haute tension.
- La fabrication de acier inoxydable.
- Utilis?? dans les syst??mes de carburant d'a??ronefs militaires pour r??duire les risques d'incendie, (voir syst??me d'inertage).
- Au sommet de explosifs liquides en tant que mesure de s??curit??.
- Remplissage automobile et a??ronautique pneus en raison de son inertie et le manque d'humidit?? ou de qualit??s oxydantes, par opposition ?? l'air. La diff??rence de N 2 contenu entre l'air et N 2 pur est de 20%.
- Utilis?? comme un projet de propulseur pour le vin , et comme une alternative ?? ou avec du dioxyde de carbone pour d'autres boissons.
L'azote est souvent utilis?? au cours des proc??dures de pr??paration des ??chantillons pour l'analyse chimique. Il est utilis?? pour concentrer et r??duire le volume des ??chantillons liquides. Diriger un courant sous pression d'azote gazeux perpendiculaire ?? la surface du liquide permet au solvant de se ??vaporer tout en laissant le solut?? (s) et du solvant non ??vapor?? en arri??re.
les r??servoirs d'azote sont ??galement remplacer le dioxyde de carbone comme source d'??nergie principale pour pistolets de paintball. L'azote doit ??tre maintenu ?? une pression plus ??lev??e que le CO 2, N 2 r??servoirs faisant plus lourd et plus cher.
L'azote peut ??tre utilis?? en remplacement ou en combinaison avec du dioxyde de carbone pour mettre sous pression des f??ts de bi??re , en particulier stouts et les Britanniques ales, en raison de la plus petite il produit des bulles, ce qui rend la bi??re distribu??e plus lisse et plus capiteux. Une pression d'azote capsule sensibles commun??ment connu comme un " Widget "permet azote charg?? bi??res pour ??tre emball??s dans des canettes et bouteilles.
L'azote liquide
L'azote liquide est un liquide cryog??nique. A la pression atmosph??rique, il bout ?? -195,8 ?? C. Lorsque isol?? dans des r??cipients appropri??s tels que Flacons Dewar, il peut ??tre transport?? sans trop la perte par ??vaporation.
Comme la glace s??che , la principale utilisation de l'azote liquide est comme un r??frig??rant. Entre autres choses, il est utilis?? dans le cryoconservation du sang, des cellules reproductrices ( sperme et ??uf), et d'autres ??chantillons biologiques et de mat??riaux. Il est utilis?? dans le contexte clinique dans cryoth??rapie pour ??liminer les kystes et les verrues sur la peau. Il est utilis?? dans pi??ges ?? froid pour certains ??quipements de laboratoire et de refroidir les d??tecteurs infrarouges ou D??tecteurs de rayons X. Il a ??galement ??t?? utilis??e pour refroidir les unit??s centrales de traitement et d'autres dispositifs dans les ordinateurs qui sont overclock??, et qui produisent plus de chaleur que pendant le fonctionnement normal.
Les compos??s azot??s
Azote mol??culaire (N 2) dans l'atmosph??re est relativement non r??actif en raison de son lien tr??s fort, et N 2 joue un r??le inerte dans le corps humain, ne ??tant ni produite ni d??truite. Dans la nature, l'azote est converti en biologique (et industriellement) compos??s utiles par la foudre, et par certains organismes vivants, notamment certaines bact??ries (ce est- fixation d'azote bact??ries voient r??le biologique ci-dessous). Azote mol??culaire est lib??r?? dans l'atmosph??re dans le processus de d??composition, dans les tissus v??g??taux et animaux morts.
La capacit?? de combiner ou fixer, azote mol??culaire est un ??l??ment cl?? de la chimie industrielle moderne, o?? l'azote et le gaz naturel sont convertis en ammoniac via le Proc??d?? Haber. L'ammoniac, ?? son tour, peut ??tre utilis?? directement (principalement comme un engrais , et dans la synth??se des engrais nitr??s), ou en tant que pr??curseur de nombreux autres mat??riaux y compris importants explosifs, en grande partie par l'interm??diaire de la production d' acide nitrique par le Proc??d?? Ostwald.
Les organiques et inorganiques des sels d'acide nitrique ont ??t?? historiquement important que les d??panneurs de l'??nergie chimique. Ils comprennent des compos??s importants tels que le nitrate de potassium (utilis?? dans la poudre ) et nitrate d'ammonium, un engrais importante et explosive (voir ANFO). Divers autres compos??s organiques nitr??s, tels que nitroglyc??rine, trinitrotolu??ne, et nitrocellulose, sont utilis??s comme des poudres et explosifs d'armes ?? feu modernes. L'acide nitrique est utilis?? comme agent oxydant aliment?? en liquide roquettes. Hydrazine et d??riv??s d'hydrazine trouver utilisation comme fus??e combustibles et monergols. Dans la plupart de ces compos??s, l'instabilit?? de base et la tendance ?? br??ler ou exploser est d??riv?? du fait que l'azote est pr??sent sous forme d'un oxyde, et non pas comme la mol??cule d'azote beaucoup plus stable (N 2), qui est un produit des compos??s ' la d??composition thermique. Lorsque nitrates br??ler ou exploser, la formation de la triple liaison puissante dans le N 2 produit la plupart de l'??nergie de la r??action.
L'azote est un constituant de mol??cules dans chaque classe de m??dicaments majeur dans la pharmacologie et de la m??decine. Le protoxyde d'azote (N 2 O) a ??t?? d??couvert au d??but du 19e si??cle pour ??tre une anesth??sie partielle, si elle n'a pas ??t?? utilis??e comme anesth??sique chirurgical que plus tard. Appel?? " gaz hilarant ", il a ??t?? constat?? capable d'induire un ??tat de d??sinhibition sociale ivresse ressemblant. D'autres m??dicaments contenant de l'azote notables sont des m??dicaments d??riv??s de plantes alcalo??des, tels que la morphine (il existe de nombreux alcalo??des connus pour avoir des effets pharmacologiques; dans certains cas, ils apparaissent comme des d??fenses chimiques naturelles des plantes contre la pr??dation). Les m??dicaments qui contiennent de l'azote comprennent toutes les principales classes d'antibiotiques et de m??dicaments ?? base de nitrate organiques comme nitroglyc??rine et nitroprussiate que r??guler la pression art??rielle et de l'action du c??ur en imitant l'action de l'oxyde nitrique.
R??le biologique
L'azote est un ??l??ment essentiel du amin??s et acides nucl??iques, essentielle ?? la vie sur Terre.
Azote ??l??mentaire dans l'atmosph??re ne peut pas ??tre utilis?? directement soit par des plantes ou des animaux, et doit ??tre converti en un (ou ??fixe??) ??tat r??duit pour ??tre utile pour les plantes sup??rieures et les animaux. Pr??cipitations contient souvent des quantit??s importantes de ammonium et de nitrate , pens?? pour r??sultent de fixation de l'azote par la foudre et autres ph??nom??nes ??lectriques atmosph??riques. Ce fut d'abord propos?? par Liebig en 1827 et confirm?? plus tard. Cependant, parce que ammonium est pr??f??rentiellement retenue par la couvert forestier par rapport au nitrate atmosph??rique, plus l'azote fixe atteint le sol sous les arbres surface que le nitrate. nitrate du sol est pr??f??rentiellement assimil??e par arbre racines par rapport ?? d'ammonium du sol.
Sp??cifiques des bact??ries (par exemple, Rhizobium trifolium) poss??dent nitrog??nase enzymes qui peuvent fixer l'azote atmosph??rique (voir la fixation d'azote ) en une forme ( ion ammonium) qui est chimiquement utile pour les organismes sup??rieurs. Ce processus n??cessite une grande quantit?? d'??nergie et des conditions anoxiques. Ces bact??ries peuvent vivre librement dans le sol (par exemple, Azotobacter) mais normalement existent dans un dans la relation symbiotique nodules racinaires de l??gumineuses (par exemple, tr??fle, Trifolium, ou de soja plante, Glycine max ). bact??ries fixatrices d'azote sont ??galement symbiotique avec un certain nombre d'esp??ces v??g??tales ind??pendants, tels les aulnes ( Alnus) spp., Lichens, Casuarina, Myrica, h??patiques et Gunnera.
Dans le cadre de la relation symbiotique, la plante convertit le ??fixe?? ion ammonium, des oxydes d'azote et d'acides amin??s pour former des prot??ines et d'autres mol??cules (par exemple, les alcalo??des). En contrepartie de l'azote ??fixe??, la plante s??cr??te sucres aux bact??ries symbiotiques. L??gumineuses maintenir un ana??robie (sans oxyg??ne) environnement pour leurs bact??ries fixatrices d'azote.
Les plantes sont capables d'assimiler directement l'azote sous forme de nitrates qui peuvent ??tre pr??sents dans le sol de gisements naturels de min??raux, engrais artificiels, d??chets animaux, ou de la pourriture organique (comme le produit de bact??ries, mais pas les bact??ries sp??cifiquement associ??s ?? l'usine). Nitrates absorb??s dans ce mode sont convertis en nitrites par l'enzyme Nitrate R??ductase, et ensuite convertie en ammoniac par une autre enzyme appel??e nitrite r??ductase.
Les compos??s azot??s sont des blocs de construction de base en biologie animale ainsi. Les animaux utilisent contenant de l'azote des acides amin??s d'origine v??g??tale comme mati??res de d??part pour tous biochimie animale des compos??s d'azote, y compris la fabrication de prot??ines et acides nucl??iques. les insectes se nourrissant de plantes sont tributaires de l'azote dans l'alimentation, telles que variation de la quantit?? d'engrais azot?? appliqu?? ?? une plante peut affecter le taux d'insectes se nourrissant de plantes f??cond??s de reproduction.
Nitrate soluble est un facteur limitant important dans la croissance de certaines bact??ries dans les eaux oc??aniques. Dans de nombreux endroits dans le monde, artificiels engrais appliqu??s aux cultures des terres pour accro??tre les rendements r??sultent dans la livraison de ruissellement d'azote soluble aux oc??ans aux embouchures des rivi??res. Ce processus peut se traduire par eutrophisation de l'eau, car la croissance bact??rienne conduit azote ??puise l'oxyg??ne de l'eau au point que tous les organismes sup??rieurs meurent. Bien connu zones ??zone morte?? aux ??tats-Unis C??te du Golfe et la mer Noire sont dues ?? ce processus polluante importante.
Beaucoup de poissons d'eau sal??e la production de grandes quantit??s de oxyde de trim??thylamine pour les prot??ger de la haute effets osmotiques de leur environnement; conversion de ce compos?? de dim??thylamine est responsable de l'odeur au d??but de poissons d'eau sal??e unfresh. Chez l'animal, radical libre l'oxyde nitrique (NO) (d??riv?? d'un acide amin?? ), sert de mol??cule r??gulatrice importante pour la circulation.
R??action rapide de l'oxyde nitrique avec de l'eau chez les animaux se traduit par la production de son m??tabolite nitrite. Animal le m??tabolisme de l'azote dans les prot??ines, en g??n??ral, se traduit par L'excr??tion de l'ur??e , tandis que le m??tabolisme des animaux de acides nucl??iques r??sultats de l'excr??tion de l'ur??e et acide urique. L'odeur caract??ristique de la chair animale d??croissance est due ?? la cr??ation de longue cha??ne, contenant de l'azote des amines , tels que putrescine et cadav??rine, qui sont des produits de d??gradation des acides amin??s ornithine et lysine, respectivement, dans la d??composition des prot??ines.
Decay des organismes et de leurs produits de d??chets peut produire de petites quantit??s de nitrate, mais la plupart d??croissance revient finalement teneur en azote dans l'atmosph??re, que l'azote mol??culaire. La circulation de l'atmosph??re de l'azote, des compos??s organiques, puis retour ?? l'atmosph??re, est appel?? le cycle de l'azote .
S??curit??
Lib??ration rapide de l'azote gazeux dans un espace ferm?? peut d??placer l'oxyg??ne, et repr??sente donc un risque d'asphyxie. Cela peut se produire avec peu de sympt??mes d'alerte, car l'humain corps de la carotide est une fa??on relativement lente et une faible teneur en oxyg??ne (hypoxie) syst??me de d??tection pauvres. Un exemple se est produit peu de temps avant le lancement de la premi??re mission de la navette spatiale en 1981, lorsque deux techniciens ont perdu la conscience (et l'un d'eux sont morts) apr??s qu'ils marchaient dans un espace situ?? dans la navette de Plate-forme mobile de lancement qui est pressuris??e avec de l'azote pur ?? titre de pr??caution contre l'incendie. Les techniciens auraient pu quitter la salle se ils avaient ??prouv?? les premiers sympt??mes de l'azote respiration.
Lorsqu'il est inhal?? ?? haute pressions partielles (plus d'environ 4 bar, rencontr??es ?? des profondeurs inf??rieures ?? 30 m plong??e sous-marine), de l'azote commence ?? agir comme un agent anesth??sique. Il peut causer narcose ?? l'azote, un ??tat semi-anesth??si?? temporaire de d??ficience mentale semblable ?? celle caus??e par l'oxyde nitreux.
L'azote se dissout ??galement dans le la circulation sanguine et le corps gras. D??compression rapide (en particulier, dans le cas de plongeurs remontant trop rapidement, ou astronautes d??compression trop rapidement de la pression de la cabine ?? la pression de combinaison spatiale) peut conduire ?? une condition potentiellement mortelle appel??e la maladie de d??compression (anciennement connu sous le nom de maladie des caissons ou les coudes), lorsque les bulles d'azote se forment dans le sang, les nerfs, les articulations et d'autres zones sensibles ou vitales. D'autres gaz inertes "" (ces gaz autres que le dioxyde de carbone et d'oxyg??ne) provoquer les m??mes effets de bulles compos??es d'entre eux, de sorte que le remplacement de l'azote dans gaz respiratoires peuvent emp??cher narcose ?? l'azote, mais ne emp??che pas la maladie de d??compression.
Le contact direct de la peau avec azote liquide va causer de graves gelures (??br??lures?? cryog??niques). Ceci peut se produire presque instantan??ment au contact, ou apr??s une seconde ou plus, en fonction de la forme de l'azote liquide. Azote liquide en vrac provoque moins de congélation rapide qu'un jet de brume d'azote (comme est utilisé pour geler certaines excroissances de la peau dans la pratique de la dermatologie). La surface supplémentaire fournie par les matériaux d'azote imbibé est également important, avec des vêtements ou un coton imbibé causer beaucoup plus de dommages rapide qu'un déversement de liquide direct avec la peau. Complet "contact" entre la peau nue et grands-gouttelettes collectées ou des piscines de l'azote liquide peut être empêché pour une seconde ou deux, par une couche de gaz isolant de l' effet Leidenfrost. Cela peut donner à la peau une seconde de la protection de l'état liquide en vrac d'azote. Cependant, l'azote liquide appliqué sur la peau dans le brouillard, et sur ??????les tissus, contourne cet effet, les engelures et provoque immédiatement.
Les capteurs d'oxygène sont parfois utilisés comme une mesure de sécurité lorsque vous travaillez avec de l'azote liquide à avertir les travailleurs des déversements de gaz dans un espace confiné.
