
C??sium
Renseignements g??n??raux
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| C??sium | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
55 Cs | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
or argent??  | ||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | c??sium, Cs, 55 | |||||||||||||||||||||||||||||||||
| Prononciation | / s Je z Je ə m / VOIR -zee-əm | |||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??tal alcalin | |||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (1) des m??taux alcalins , 6, s | |||||||||||||||||||||||||||||||||
| Poids atomique standard | 132.9054519 (2) | |||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 6s 1 2, 8, 18, 18, 8, 1 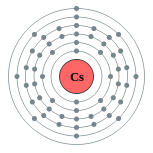 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| D??couverte | Robert Bunsen et Gustav Kirchhoff (1860) | |||||||||||||||||||||||||||||||||
| Premier isolement | Carl Setterberg (1882) | |||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 1,93 g ?? cm -3 | |||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 1,843 g ?? cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | 301,59 K , 28,44 ?? C, 83,19 ?? F | |||||||||||||||||||||||||||||||||
| Point d'??bullition | 944 K, 671 ?? C, 1240 ?? F | |||||||||||||||||||||||||||||||||
| Point critique | 1938 K, 9,4 MPa | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 2,09 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 63,9 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 32,210 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 1 (Fortement oxyde de base) | |||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 0,79 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 375,7 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| 2??me: 2234,3 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||
| 3??me: 3400 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon atomique | 265 h | |||||||||||||||||||||||||||||||||
| Rayon covalente | 244 ?? 23 heures | |||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 343 h | |||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centr??  | |||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 205 nΩ ?? m | |||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 35,9 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 97 um ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| Le module d'Young | 1,7 GPa | |||||||||||||||||||||||||||||||||
| Module Bulk | 1,6 GPa | |||||||||||||||||||||||||||||||||
| Duret?? Mohs | 0,2 | |||||||||||||||||||||||||||||||||
| Duret?? Brinell | 0,14 MPa | |||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-46-2 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de c??sium | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
C??sium ou de c??sium est un ??l??ment chimique avec le symbole Cs et de num??ro atomique 55. Ce est un argent??, or m??tal mou alcalin avec un point de 28 ?? C (82 ?? F), ce qui en fait l'un des cinq m??taux ??l??mentaires qui sont liquides ?? fusion (ou ?? proximit??) la temp??rature ambiante. Le c??sium est un m??tal alcalin et poss??de des propri??t??s physiques et chimiques similaires ?? celles de rubidium et de potassium . Le m??tal est extr??mement r??actif et pyrophore, r??agissant avec l'eau, m??me ?? -116 ?? C (-177 ?? F). Ce est le moins ??l??ment ??lectron??gatif ayant un isotope stable, le c??sium-133. Le c??sium est extrait principalement de pollucite, tandis que le des radio-isotopes, en particulier le c??sium-137, une produits de fission, sont extraites de d??chets produits par les r??acteurs nucl??aires.
Deux chimistes allemands, Robert Bunsen et Gustav Kirchhoff, d??couvert c??sium en 1860 par la m??thode de nouvellement d??velopp?? spectroscopie flamme. Les premi??res applications ?? petite ??chelle pour le c??sium ??taient comme une " getter "dans des tubes ?? vide et en cellules photo??lectriques. En 1967, une fr??quence sp??cifique de la spectre d'??mission du c??sium-133 a ??t?? choisi pour ??tre utilis?? dans la d??finition de la la seconde par Syst??me international d'unit??s. Depuis lors, le c??sium a ??t?? largement utilis?? dans horloges atomiques.
Depuis les ann??es 1990, la plus grande application de l'??l??ment a ??t?? aussi formiate de c??sium pour les fluides de forage. Il dispose d'une gamme d'applications dans la production d'??lectricit??, de l'??lectronique, et en chimie. L'isotope radioactif c??sium 137 a une demi-vie d'environ 30 ans et est utilis?? dans des applications m??dicales, jauges industrielles, et l'hydrologie. Bien que l'??l??ment ne est que l??g??rement toxique, il est une mati??re dangereuse comme un m??tal et ses radio-isotopes pr??sentent un risque de sant?? de haute se il est lib??r?? dans l'environnement.
Caract??ristiques
Propri??t??s physiques

Le c??sium est un tr??s doux (il a la duret?? plus faible de tous les ??l??ments, 0,2 Mohs), tr??s ductile, m??tal dor?? p??le, qui fonce dans la pr??sence de traces d' oxyg??ne . Il a un point de fusion de 28,4 ?? C (83,1 ?? F), ce qui en fait l'un des rares m??taux ??l??mentaires qui sont liquides ?? proximit?? la temp??rature ambiante. Le mercure est le seul m??tal ??l??mentaire avec un point de fusion inf??rieur ?? celui connu c??sium. En outre, le m??tal a une assez faible point d'??bullition , 641 ?? C (1186 ?? F), la le plus bas de tous les m??taux autres que le mercure. Ses compos??s br??lent avec une couleur bleue ou violette.

formes de c??sium alliages avec d'autres m??taux alcalins, ainsi qu'avec de l'or , et amalgames au mercure. Aux temp??ratures inf??rieures ?? 650 ?? C (1202 ?? F), il alliages avec cobalt , le fer , le molybd??ne , le nickel , le platine , le tantale ou le tungst??ne . Elle forme bien d??finie des compos??s interm??talliques avec de l'antimoine , le gallium , l'indium et le thorium , qui sont photosensible. Il se m??lange avec les autres m??taux alcalins (?? l'exception de lithium), et l'alliage ayant une la r??partition molaire de 41% de c??sium, de 47% de potassium , et 12% de sodium a le point de fusion le plus bas de tout alliage m??tallique connu, ?? -78 ?? C (-108 ?? F). A quelques amalgames ont ??t?? ??tudi??s: CsHg 2 est noir avec un violet m??tallique ??clat, tandis que CsHg est bien dor??e, aussi avec un ??clat m??tallique.
Propri??t??s chimiques
C??sium m??tallique est tr??s r??actif et tr??s pyrophore. En plus de l'allumage spontan??ment ?? l'air, elle r??agit de fa??on explosive ?? l'eau, m??me ?? basses temp??ratures, plus que les autres membres du premier groupe de la classification p??riodique des ??l??ments . La r??action se produit solide avec de l'eau ?? des temp??ratures aussi basses que -116 ?? C (-177 ?? F). En raison de sa forte r??activit??, le m??tal est class?? comme un mati??res dangereuses. Il est stock?? et envoy?? en hydrocarbures satur??s secs tels que l'huile min??rale. De m??me, il doit ??tre manipul?? sous gaz inerte tel que l'argon . Cependant, une explosion de c??sium-eau est souvent moins puissant que l'explosion d'une -eau de sodium avec une quantit?? similaire de sodium. Ce est parce que le c??sium explose instantan??ment au contact de l'eau, laissant peu de temps pour que l'hydrog??ne se accumule. Le c??sium peut ??tre stock?? sous vide scell?? verre de borosilicate ampoules. En quantit??s de plus d'environ 100 grammes (3,5 oz), le c??sium est livr?? dans des r??cipients herm??tiques, en acier inoxydable.
La chimie de c??sium est similaire ?? celle des autres m??taux alcalins, mais est plus ??troitement similaire ?? celle de rubidium , le c??sium ??l??ment ci-dessus dans le tableau p??riodique. Certaines petites diff??rences sont dues au fait qu'il a une ult??rieure masse atomique et est plus ??lectropositif que d'autres (non radioactifs) des m??taux alcalins. Le c??sium est l'??l??ment le plus ??lectropositif chimique stable. L'ion de c??sium est ??galement plus grande et moins "dur" que ceux du briquet m??taux alcalins .
Compos??s

La grande majorit?? des compos??s du c??sium contient l'??l??ment en tant que cations Cs +, qui se lie ioniquement ?? une grande vari??t?? d' anions . Une exception notable est fourni par le caeside anion (Cs -). Autres exceptions incluent les plusieurs sous-oxydes (voir la section sur les oxydes ci-dessous).
Revenant ?? des compos??s plus normaux, les sels de Cs + sont presque toujours incolore ?? moins que l'anion se est color??. Beaucoup de sels simples sont hygroscopique, mais moins que les sels correspondants des m??taux alcalins l??gers. Le phosphate, l'ac??tate, le carbonate , halog??nures, oxyde, nitrate et sulfate sont les sels solubles dans l'eau. Les sels doubles sont souvent moins soluble, et la faible solubilit?? du sulfate d'aluminium c??sium est exploit??e dans la purification de Cs ?? partir de ses minerais. Le double sel avec de l'antimoine (comme CsSbCl 4), bismuth , cadmium , cuivre , fer et plomb sont ??galement mal soluble.
C??sium hydroxyde (CsOH) est hygroscopique et une tr??s forte base. Il rapide d??cape la surface des semi-conducteurs tels que le silicium . CsOH a d??j?? ??t?? consid??r?? par les chimistes comme la "base la plus forte", refl??tant la relativement faible attraction entre la grande ion Cs + et OH -.; il est en effet le plus fort de base Arrhenius , mais un certain nombre de compos??s qui ne peuvent pas exister en solution aqueuse, tel que n-butyl-lithium et l'amidure de sodium, sont plus basique.
Un m??lange stoechiom??trique de c??sium et l'or va r??agir pour former Auride c??sium.
Complexes
Comme tous les cations m??talliques, CS + forme des complexes avec Lewis fonde en solution. En raison de sa grande taille, Cs + adopte habituellement des nombres sup??rieurs ?? six coordination, ce qui est typique pour les cations de m??taux alcalins l??gers coordination. Cette tendance est d??j?? apparente par la 8-coordination dans CsCl, vs le motif de halite adopt??e par les autres chlorures de m??taux alcalins. Son nombre ??lev?? de coordination et douceur (tendance ?? former des liaisons covalentes) sont la base de la s??paration des Cs + ?? partir d'autres cations, comme cela se pratique dans l'assainissement des d??chets nucl??aires, o?? 137 Cs + est s??par??e de grandes quantit??s de K + non radioactif.
Halog??nures
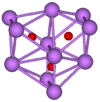
chlorure de c??sium (CsCl) cristallise dans la simple syst??me cristallin cubique. ??galement appel?? la ??structure de chlorure de c??sium", ce motif structural est compos?? d'un r??seau cubique primitive avec une base de deux atome, chacun avec un octuple coordination; les atomes de chlore se trouvent sur les points de r??seau au niveau des ar??tes du cube, tandis que les atomes de c??sium se trouvent dans les trous au centre des cubes. Cette structure est partag??e avec CsBr et CsI, et de nombreux autres compos??s qui ne contiennent pas Cs. En revanche, la plupart des autres halog??nures alcalins adoptent le chlorure de sodium structure (NaCl). La structure CsCl est pr??f??r?? parce Cs + a une rayon ionique de 174 h et Cl - 181 h.
Oxydes
Plus que les autres m??taux alcalins, le c??sium forme de nombreux compos??s binaires avec l'oxyg??ne . Lorsque le c??sium br??le dans l'air, le superoxyde CsO 2 est le principal produit. Le "normale" l'oxyde de c??sium (Cs 2 O) forme jaune-orange cristaux hexagonaux, et est le seul anti-oxyde de la CdCl2 Type. Il se vaporise ?? 250 ?? C (482 ?? F), et se d??compose de c??sium et le m??tal du peroxyde d'Cs 2 O 2 ?? des temp??ratures sup??rieures ?? 400 ?? C (752 ?? F). Mis ?? part le superoxyde et le ozonide CsO 3, plusieurs couleurs vives sous-oxydes ont ??galement ??t?? ??tudi??s. Il se agit notamment Cs 7 O, 4 O Cs, Cs 11 3 O, Cs 3 O (vert fonc??), CSO, Cs 2 O 3, ainsi que 7 Cs 2 O. Ce dernier peut ??tre chauff?? sous vide pour g??n??rer Cs 2 O. Compos??s binaires avec le soufre , le s??l??nium et le tellure existent ??galement.
Isotopes
Le c??sium a un total de 39 connus isotopes qui vont dans leur nombre de masse (ce est ?? dire de nombre de nucl??ons dans son noyau) de 112 ?? 151. Plusieurs de ceux-ci sont synth??tis??s ?? partir d'??l??ments plus l??gers par le processus de capture de neutrons lents ( S-processus) ?? l'int??rieur de vieilles ??toiles, ainsi que l'int??rieur de supernovae explosions ( R-processus). Cependant, la seule stable isotope est 133 Cs, qui a 78 neutrons . M??me se il dispose d'un grand spin nucl??aire (7/2 de +), Les ??tudes de r??sonance magn??tique nucl??aire peut ??tre fait avec cet isotope de r??sonance ?? une fr??quence de 11,7 MHz.

Le radioactifs 135 Cs a une demi-vie tr??s longue d'environ 2,3 millions d'ann??es, alors que 137 Cs et 134 Cs ont des demi-vies de 30 et deux ans, respectivement. 137 Cs se d??compose ?? une courte dur??e 137m Ba par d??sint??gration b??ta, puis de baryum non radioactif, tandis que 134 Cs transforme en 134 Ba directement. Les isotopes avec des nombres de masse de 129, 131, 132 et 136, ont des demi-vies entre un jour et deux semaines, alors que la plupart des autres isotopes ont des demi-vies de quelques secondes ?? quelques fractions de seconde. Il ya au moins 21 m??tastable isom??res nucl??aires. Autre que Cs 134m (avec une demi-vie de un peu moins de 3 heures), tous sont tr??s instables et se d??sint??grent avec des demi-vies de quelques minutes ou moins.
L'isotope Cs 135 est l'un des produits de fission ?? vie longue de l'uranium qui se forment dans les r??acteurs nucl??aires. Cependant, son le rendement des produits de fission est r??duite dans la plupart des r??acteurs parce que son pr??d??cesseur, 135 Xe, est un tr??s puissant poison neutronique et transmue souvent ?? stable 136 Xe avant qu'il peut se d??composer ?? 135 Cs.
En raison de sa d??sint??gration b??ta (?? 137m Ba), 137 Cs est un fort ??metteur rayonnement gamma. Sa demi-vie, il est le principal produits de fission ?? moyen v??cu avec 90 Sr-deux sont responsables de de radioactivit?? combustible nucl??aire us?? apr??s plusieurs ann??es de refroidissement jusqu'?? plusieurs centaines d'ann??es apr??s l'utilisation. Par exemple 137 Cs avec 90 Sr g??n??rer actuellement la plus grande source de radioactivit?? g??n??r??e dans la zone autour de la catastrophe de Tchernobyl . Il ne est pas possible de disposer de 137 Cs par capture des neutrons (en raison du faible taux de capture) et par cons??quent, il doit ??tre autoris?? ?? se d??sint??grer.
Presque tous c??sium produite ?? partir de la fission nucl??aire vient de d??sint??gration b??ta de l'origine plus de produits de fission riches en neutrons, en passant par diverses isotopes de l'iode et de x??non. Parce que l'iode et de x??non sont volatils et peuvent diffuser ?? travers le combustible nucl??aire ou de l'air, du c??sium radioactif est souvent cr???? loin de l'emplacement original de la fission. Avec le d??but de essais d'armes nucl??aires vers 1945, 137 Cs a ??t?? lib??r?? dans l' atmosph??re et est ensuite retourn?? ?? la surface de la terre comme une composante de retomb??es radioactives.
Occurrence

Le c??sium est un ??l??ment relativement rare, car on estime en moyenne ?? environ 3 parties par million dans la La cro??te terrestre. Cela en fait le 45e plus abondant de tous les ??l??ments et la 36e de tous les m??taux. N??anmoins, il est plus abondant que des ??l??ments tels que l'antimoine, le cadmium, l'??tain et le tungst??ne, et deux ordres de grandeur plus abondant que le mercure ou d'argent , mais de 3,3% aussi abondant que le rubidium -avec laquelle il est si ??troitement associ?? chimiquement.
En raison de sa grande rayon ionique, le c??sium est l'un des " ??l??ments incompatibles ". Au cours de magma cristallisation, le c??sium se concentre dans la phase liquide et cristallise dernier. Par cons??quent, les plus grands gisements de c??sium sont zone corps min??ralis??s pegmatite form??s par ce processus d'enrichissement. Parce que le c??sium ne remplace pas potassium aussi facilement que ne le rubidium, les min??raux alcalins ??vaporites sylvinite (KCl) et carnallite (KMgCl 3 ?? 6H 2 O) ne peuvent contenir que 0,002% de c??sium. Par cons??quent, Cs est trouv?? dans quelques min??raux. les pourcentages de c??sium peuvent ??tre trouv??s dans b??ryl (Be 3 Al 2 (SiO 3) 6) et avogadrite ((K, Cs) BF 4), jusqu'?? 15% en poids de Cs 2 O dans le min??ral ??troitement li?? pezzottaite (Cs (Be 2 Li) Al 2 Si 6 O 18), jusqu'?? 8,4% en poids de Cs 2 O dans le min??ral rare londonite ((Cs, K) Al quatre Soyez 4 (B, Be) 12 O 28), et moins dans la plus r??pandue rhodizite. Le min??ral seule source ??conomique importante pour le c??sium est pollucite Cs (AlSi 2 O 6), qui se trouve dans quelques endroits dans le monde dans les pegmatites zon??es, et est associ?? avec les plus importantes commercialement lithium min??raux l??pidolite et p??talite. Dans les pegmatites, le gros grain et la forte s??paration des min??raux cr??ent minerai ?? haute teneur pour l'exploitation mini??re.
L'une des sources du m??tal les plus importantes et les plus riches du monde est le ?? la mine Tanco au Bernic Lake, dans le Manitoba, Canada. Les d??p??ts on estime ?? 350 000 contenir tonnes m??triques de minerai de pollucite, qui repr??sentent plus des deux tiers de la base de r??serve du monde. Bien que la teneur stoechiom??trique de c??sium dans pollucite est de 42,6%, les ??chantillons de pollucite pures de ce d??p??t contiennent seulement environ 34% du c??sium, tandis que la teneur moyenne est de 24% en poids. Pollucite commercial contient plus de 19% du c??sium. Le D??p??t de pegmatite Bikita au Zimbabwe est exploit?? pour son p??talite, mais il contient ??galement une quantit?? importante de pollucite. Quantit??s notables de pollucite sont ??galement exploit??s dans le Karibib Desert, Namibie . Au rythme actuel de la production mini??re mondiale de 5 ?? 10 tonnes par an, les r??serves dureront pendant des milliers d'ann??es.
Production
L'extraction de minerai pollucite est un processus s??lectif et se d??roule sur une petite ??chelle en comparaison avec la plupart des op??rations des mines de m??taux. Le minerai est concass??, la main-tri??e, mais g??n??ralement pas concentr??e, puis broy??. Le c??sium est ensuite extrait de pollucite principalement par trois m??thodes: digestion acide, d??composition alcaline, et de r??duction directe.
Dans la digestion acide, le silicate pollucite roche est dissous avec des acides forts tels que chlorhydrique (HCl), sulfurique (H 2 SO 4), bromhydrique (HBr), ou (HF) d'acide fluorhydrique. Avec de l'acide chlorhydrique, un m??lange de chlorures solubles est produit, et le chlorure insoluble doubles sels de c??sium sont pr??cipit??s sous forme de chlorure de c??sium de l'antimoine (Cs 4 SbCl 7), le c??sium chlorure d'iode (Cs 2 ICl), ou le c??sium hexachlorocerate (Cs 2 (CeCl 6)). Apr??s la s??paration, le pr??cipit?? de sel double pur est d??compos??, et CsCl pur est obtenu apr??s ??vaporation de l'eau. La m??thode utilisant l'acide sulfurique donne le sel double insoluble directement comme le c??sium alun (csal (SO 4) 2 ?? 12H 2 O). Le sulfate d'aluminium, il est converti en au insoluble oxyde d'aluminium par calcination de l'alun avec le carbone , et le produit r??sultant est lixivi?? avec de l'eau pour donner une solution de Cs 2 SO 4.
Le grillage de pollucite avec du carbonate de calcium et chlorure de calcium rendements silicates de calcium insoluble et soluble dans le chlorure de c??sium. Lessivage avec de l'eau ou diluer l'ammoniac (NH 4 OH), on obtient alors un chlorure de dilu??e (CsCl) solution. Cette solution peut ??tre ??vapor??e pour produire du chlorure de c??sium ou transform?? en alun de c??sium ou le carbonate de c??sium. Mais pas commercialement faisable, la r??duction directe du minerai de potassium, de sodium ou de calcium dans le vide peut produire le c??sium m??tallique directement.
La plupart du c??sium extrait (sous forme de sels) est directement converti en formiate de c??sium (HCOO - Cs +) pour des applications telles que forage p??trolier. Pour approvisionner le march?? en d??veloppement, Cabot Corporation a construit une usine de production en 1997 ?? la mine Tanco pr??s Bernic Lake, au Manitoba, d'une capacit?? de 12 000 barils (1 900 m 3 par an) de la solution de c??sium formate. Les compos??s commerciaux de plus petite envergure primaire de c??sium sont chlorure de c??sium et son nitrate.
En variante, le c??sium m??tal peut ??tre obtenu ?? partir des compos??s purifi??s obtenus ?? partir du minerai. le chlorure de c??sium, et les autres halog??nures de c??sium, ainsi, peuvent ??tre r??duits ?? 700 ?? 800 ?? C (1292 ?? 1472 ?? F) avec du calcium ou du baryum , suivie d'une distillation du m??tal de c??sium. De la m??me mani??re, l'aluminate, carbonate, hydroxyde ou peuvent ??tre r??duits par du magn??sium . Le m??tal peut aussi ??tre isol?? par ??lectrolyse de c??sium condens?? cyanure (CSCN). Exceptionnellement c??sium pur et exempt de gaz peut ??tre effectu?? par la d??composition thermique ?? 390 ?? C (734 ?? F) de c??sium azide CSN 3, qui est produite ?? partir de solution aqueuse de sulfate de c??sium et de baryum azide. Dans les applications sous vide, le c??sium dichromate peut ??tre mis ?? r??agir avec le zirconium formant c??sium m??tal pur sans d'autres produits gazeux.
- Cs 2 Cr 2 O 7 + 2 → 2 Zr 2 Cs + ZrO 2 + Cr 2 O 3
Le prix de 99,8% du c??sium pur (du m??tal) en 2009 ??tait d'environ 10 $ US par gramme (280 $ l'once), mais ses compos??s sont nettement moins cher.
Histoire

En 1860, Robert Bunsen et Gustav Kirchhoff d??couvert c??sium dans le eau min??rale D??rkheim, Allemagne. En raison des lignes bleues lumineuses dans son spectre d'??mission, ils ont choisi un nom d??riv?? du mot caesius latin, signifiant bleu ciel. C??sium ??tait le premier ??l??ment ?? ??tre d??couvert par spectroscopie , un an seulement apr??s l'invention de la spectroscope par Bunsen et Kirchhoff.
Pour obtenir un ??chantillon pur du c??sium, 44 000 litres (9700 gallons imp; 12 000 US gal) d'eau min??rale a d?? ??tre ??vapor??e pour donner 240 kg (530 lb) de solution saline concentr??e. Les m??taux alcalino-terreux ont ??t?? pr??cipit??s sous forme de sulfates ou soit oxalates, laissant le m??tal alcalin dans la solution. Apr??s la conversion des nitrates et extraction avec de l'??thanol , on a obtenu un m??lange exempt de sodium. A partir de ce m??lange, le lithium a ??t?? pr??cipit?? par le carbonate d'ammonium. Le potassium, le rubidium et le c??sium forment des sels insolubles avec chloroplatinique l'acide, mais ces sels montrent une l??g??re diff??rence de solubilit?? dans l'eau chaude. Par cons??quent, le c??sium et le rubidium moins soluble dans l'hexachloroplatinate ((Cs, Rb) 2 PtCl 6) peut ??tre obtenu par cristallisation fractionn??e. Apr??s r??duction de l'hexachloroplatinate avec l'hydrog??ne , le c??sium et le rubidium pourraient ??tre s??par??s par la diff??rence de solubilit?? de leurs carbonates dans l'alcool. Le processus a donn?? 9,2 g (0,32 oz) de chlorure de rubidium et 7,3 grammes (0,26 onces) de chlorure de c??sium par les initiales 44 000 litres d'eau min??rale.
Les deux scientifiques ont utilis?? le chlorure de c??sium ainsi obtenu pour estimer la poids atomique du nouvel ??l??ment ?? 123,35 (par rapport ?? l'heure actuelle l'un des accept?? 132,9). Ils ont essay?? de g??n??rer c??sium ??l??mentaire par ??lectrolyse de fusion du chlorure de c??sium, mais au lieu d'un m??tal, ils ont obtenu une substance homog??ne bleue qui "ni sous l'??il nu, ni sous le microscope" a montr?? la moindre trace de substance m??tallique "; en cons??quence, ils ont attribu?? comme un protochlorure (Cs 2 Cl). En r??alit??, le produit ??tait probablement un m??lange collo??dal du m??tal et du chlorure de c??sium. L'??lectrolyse de la solution aqueuse de chlorure avec une anode de mercure produit un amalgame de c??sium qui facilement d??compos?? dans les conditions aqueuses. Le m??tal pur a finalement ??t?? isol?? par le chimiste allemand Carl Setterberg tout en travaillant sur son doctorat avec Kekul?? et Bunsen. En 1882, il a produit le c??sium m??tallique par ??lectrolyse c??sium cyanure, et ??vitant ainsi les probl??mes avec le chlorure.
Historiquement, l'utilisation la plus importante pour le c??sium a ??t?? dans la recherche et le d??veloppement, principalement dans les domaines chimiques et ??lectriques. Tr??s peu de demandes pour le c??sium existaient avant les ann??es 1920, quand il est venu ?? ??tre utilis?? dans la radio les tubes ?? vide. Il y avait deux fonctions; comme un getter, il ??limine l'exc??s d'oxyg??ne apr??s la fabrication, et en tant que rev??tement sur la chauff??e cathode, il a augment?? sa conductivit?? ??lectrique. C??sium ne est pas devenu reconnu comme un m??tal industriel performant jusqu'?? ce que les ann??es 1950. Applications de c??sium non radioactif inclus cellules photo??lectriques, des tubes photomultiplicateurs, des composants optiques de spectrophotom??tres infrarouges, plusieurs catalyseurs pour des r??actions organiques, cristaux pour compteurs ?? scintillation, et groupes ??lectrog??nes magn??tohydrodynamiques.
Depuis 1967, le Syst??me international des mesures a fond?? son unit?? de temps, la seconde, sur les propri??t??s de c??sium. Le Syst??me international d'unit??s (SI) d??finit la seconde comme 9192631770 cycles du rayonnement, qui correspond ?? la transition entre deux hyperfine les niveaux de l'??nergie ??tat fondamental du c??sium-133 atome . La 13e Conf??rence g??n??rale des poids et mesures de 1967 a d??fini une seconde que: "la dur??e de 9192631770 cycles de lumi??re ?? micro-ondes ??mise ou absorb??e par la transition hyperfine du c??sium-133 atomes dans leur ??tat fondamental perturb?? par des champs ext??rieurs".
Applications
L'exploration p??troli??re
La plus grande utilisation finale actuelle de c??sium non radioactif est en ?? base de formiate de c??sium les fluides de forage pour le industrie p??troli??re extractive. Les solutions aqueuses de formiate de c??sium (HCOO - Cs +) -en faisant r??agir l'hydroxyde de c??sium avec de l'acide formique -??taient d??velopp?? dans le milieu des ann??es 1990 pour l'utilisation de l'huile de forage de puits et fluides de compl??tion. La fonction de formiate de c??sium en tant que fluide de forage est de lubrifier les forets, pour amener les d??bris de roche ?? la surface, et de maintenir une pression sur la formation en cours de forage du puits. Comme fluide de compl??tion, qui assiste la mise en place de mat??riel de commande apr??s le forage, mais avant la production, la fonction de formiate de c??sium est de maintenir la pression.
La forte densit?? de la saumure c??sium de formiate (jusqu'?? 2,3 g ?? cm -3, soit 19,2 livres par gallon), associ??e ?? la nature relativement b??nigne de la plupart des compos??s du c??sium, r??duit le besoin pour les mati??res solides toxiques de haute densit?? en suspension dans le fluide de forage -a significative technologique, l'ing??nierie et avantage environnemental. Contrairement aux composants de nombreux autres liquides lourds, formate de c??sium est relativement respectueux de l'environnement. La saumure de formiate de c??sium peut ??tre m??lang?? avec des formiates potassium et de sodium de diminuer la densit?? des fluides vers le bas pour que de l'eau (1,0 g ?? cm -3, soit 8,3 livres par gallon). En outre, il est biod??gradable et r??cup??rable et peut ??tre recycl??, ce qui est important en raison de son co??t ??lev?? (environ 4000 $ par habitant le baril en 2001). Formiates alcalins sont s??rs ?? manipuler et ne endommagent pas la formation productrice ou des m??taux de fond que leurs alternatives corrosive, saumures ?? haute densit?? (comme bromure de zinc ZnBr 2 solutions), faire parfois; ils exigent ??galement diminu??e des co??ts de nettoyage et d'??limination.
Les horloges atomiques


Base de c??sium- horloges atomiques observent transitions ??lectromagn??tiques dans le structure hyperfine du c??sium-133 atomes et l'utiliser comme un point de r??f??rence. La premi??re horloge au c??sium pr??cis a ??t?? construit par Louis Essen en 1955 ?? la National Physical Laboratory au Royaume-Uni. Depuis, ils ont ??t?? am??lior??es de fa??on r??p??t??e au cours du demi-si??cle, et forment la base de normes conformes mesures de temps et de fr??quence. Ces horloges fr??quence de mesure avec une erreur de 2 ?? 3 parties en 10 14, ce qui correspondrait ?? une pr??cision de mesure de temps de 2 nanosecondes par jour, ou une seconde en 1,4 millions ann??es. Les derni??res versions sont exacts ?? mieux que 1 partie en 10 15, ce qui signifie qu'ils seraient hors d'environ 2 secondes depuis la extinction des dinosaures il ya 65 millions d'ann??es, et a ??t?? consid??r?? comme ??la r??alisation la plus pr??cise d'une unit?? que l'humanit?? a encore atteint."
horloges de c??sium sont ??galement utilis??s dans les r??seaux qui supervisent le moment de transmission de t??l??phone cellulaire et le flux de l'information sur l'Internet.
??nergie ??lectrique et de l'??lectronique
la vapeur de c??sium g??n??rateurs thermo sont des appareils de faible puissance qui convertissent l'??nergie thermique en ??nergie ??lectrique. Dans les deux ??lectrodes Convertisseur de tube ?? vide, on neutralise la charge d'espace qui se accumule ?? proximit?? de la cathode, et, ce faisant, il am??liore la circulation du courant.
Le c??sium est ??galement important pour son propri??t??s photo??missives par lequel l'??nergie lumineuse est convertie en flux d'??lectrons. Il est utilis?? dans cellules photo??lectriques parce que cathodes ?? base de c??sium, tels que le compos?? interm??tallique K 2 RRFP ont une faible tension de seuil pour l'??mission d' ??lectrons . La gamme de dispositifs de photo??missives utilisant le c??sium comprend dispositifs optiques de reconnaissance de caract??res, tubes photomultiplicateurs, et tubes de cam??ra vid??o. N??anmoins, le germanium , le rubidium, le s??l??nium, le silicium, le tellure, et plusieurs autres ??l??ments peuvent remplacer le c??sium dans des mat??riaux photosensibles.
L'iodure de c??sium (Csl), bromure (CsBr) et le fluorure de c??sium (CSF) cristaux sont utilis??s pour dans scintillateurs compteurs ?? scintillation largement utilis??s dans l'exploration min??rale et de la recherche en physique des particules, car ils sont bien adapt??s pour la d??tection de gamma et Rayonnement de rayons X. C??sium, ??tant un ??l??ment lourd, offre une bonne puissance de freinage, contribuant ?? une meilleure d??tectivit??. compos??s de c??sium peuvent aussi fournir une r??ponse plus rapide (LCR) et ??tre moins hygroscopique (CSI).
la vapeur de c??sium est utilis?? dans de nombreux commune magn??tom??tres. L'??l??ment est ??galement utilis?? en tant que ??talon interne dans spectrophotom??trie. Comme d'autres m??taux alcalins , le c??sium a une grande affinit?? pour l'oxyg??ne et il est utilis?? en tant que " getter "dans les tubes ?? vide. D'autres utilisations du m??tal ?? haute ??nergie comprennent des lasers , lampes de pr??chauffage vapeur, et de la vapeur redresseurs.
les fluides de centrifugation
En raison de leur forte densit??, des solutions de chlorure de c??sium, le sulfate de c??sium, le c??sium et trifluoroac??tate (Cs (O 2 CCF 3)) sont couramment utilis??s en biologie mol??culaire ?? gradient de densit?? ultracentrifugation. Cette technologie est essentiellement appliqu?? ?? l'isolement de particules virales , subcellulaire organites et fractions, et des acides nucl??iques ?? partir d'??chantillons biologiques.
Chimique et l'utilisation m??dicale

Relativement peu d'applications chimiques existent pour le c??sium. Le dopage avec des compos??s de c??sium est utilis?? pour am??liorer l'efficacit?? de plusieurs catalyseurs d'ions m??talliques utilis??s dans la production de produits chimiques, tels que acide acrylique, anthraquinone, l'oxyde d'??thyl??ne, du m??thanol , l'anhydride phtalique, le styr??ne, les monom??res de m??thacrylate de m??thyle, et diverses ol??fines . Il est ??galement utilis?? dans la conversion catalytique de le dioxyde de soufre en le trioxyde de soufre dans la production d' acide sulfurique .
fluorure de c??sium b??n??ficie utilisation de niche dans la chimie organique comme un base, ou en tant que la source anhydre de ion fluorure. sels de c??sium remplacent parfois des sels de potassium ou de sodium dans la synth??se organique, telle que cyclisation, est??rification, et polym??risation.
applications nucl??aires et isotopiques
Le c??sium-137 est un tr??s commun radio-isotope utilis?? en tant que gamma-??metteur dans les applications industrielles. Ses avantages sont une demi-vie d'environ 30 ans sa disponibilit?? ?? partir de la cycle du combustible nucl??aire, et comportant 137 Ba comme produit final stable. La solubilit?? dans l'eau est un inconv??nient qui la rend incompatible avec de grandes irradiateurs de piscine pour la nourriture et de fournitures m??dicales. Il a ??t?? utilis?? dans l'agriculture, le traitement du cancer, et la st??rilisation des aliments, les boues d'??puration et du mat??riel chirurgical. Radioactif isotopes de c??sium dans appareils ?? rayonnement ont ??t?? utilis??s dans le domaine m??dical pour traiter certains types de cancer, mais ??mergence de meilleures alternatives et l'utilisation de chlorure de c??sium soluble dans l'eau dans les sources, ce qui pourrait cr??er une large contamination, mis progressivement certaines de ces sources de c??sium sur utiliser. Le c??sium-137 a ??t?? utilis?? dans une vari??t?? de jauges de mesure industriels, y compris l'humidit??, la densit??, le nivellement, et des jauges d'??paisseur. Il a ??galement ??t?? utilis?? dans dispositifs de diagraphie pour mesurer la densit?? ??lectronique des formations rocheuses, qui est analogue ?? la densit?? apparente des formations.
Isotope 137 a ??galement ??t?? utilis?? dans hydrologiques des ??tudes analogues ?? celles utilisant tritium. Ce est un produit de filiation de r??actions de fission nucl??aire. Avec le d??but des essais nucl??aires vers 1945, et jusqu'au milieu des ann??es 1980, le c??sium 137 a ??t?? lib??r?? dans l'atmosph??re, o?? il est facilement absorb?? dans la solution. Connu variation d'ann??e en ann??e dans ce d??lai permet corr??lation avec le sol et les s??diments couches. Le c??sium-134, et dans une moindre mesure le c??sium-135, ont ??galement ??t?? utilis??s en hydrologie comme une mesure de la production de c??sium par l'industrie de l'??nergie nucl??aire. Alors qu'ils sont moins fr??quents que soit le c??sium-133 ou le c??sium-137, ces isotopes ont l'avantage d'??tre produite uniquement ?? partir de sources anthropiques.
D'autres utilisations

C??sium et le mercure ont ??t?? utilis??s comme propulseur au d??but moteurs ioniques con??us pour la propulsion spatiaux sur de tr??s longues missions interplan??taires ou extraplanetary. Le proc??d?? d'ionisation est de d??pouiller l'??lectron externe du propulseur lors du contact avec un tungst??ne ??lectrode qui avait tension appliqu??e. Les préoccupations concernant l'action corrosive du césium sur des composants de l'engin spatial développement ont poussé dans le sens de l'utilisation de gaz propulseurs de gaz inertes tels que le xénon ; Cela est plus facile à manipuler dans des essais au sol et a moins de potentiel pour interférer avec le vaisseau spatial. Finalement, le xénon a été utilisé dans le vaisseau spatial expérimental Deep Space 1 lancée en 1998. Néanmoins, à émission de champ des propulseurs électriques qui utilisent un système simple d'accélérer des ions métalliques liquides tels que du césium pour créer la poussée ont été construits.
nitrate de césium est utilisé comme oxydant et un colorant pyrotechnique à brûler silicium dans l'infrarouge , tels que des fusées éclairantes LUU la fusée-19, car il émet une grande partie de sa lumière dans le spectre proche infrarouge. Le césium a été utilisé pour réduire la signature radar de panaches d'échappement dans le Blackbird SR-71 des avions militaires. Césium, avec le rubidium, a été ajouté comme le carbonate de verre, car il réduit la conductivité électrique et améliore la stabilité et la durabilité de la fibre optique et des dispositifs de vision de nuit. fluorure de césium ou de fluorure de césium d'aluminium sont utilisés dans les flux formulées pour le brasage d' aluminium alliages qui contiennent du magnésium .
Prognostications
(MHD) des systèmes de production d'énergie MHD ont été étudiés, mais n'a pas réussi à gagner l'acceptation répandue. Césium métal a également été considéré comme le fluide de travail dans à haute température des générateurs de turboelectric de cycle de Rankine. sels de césium ont été évalués comme réactifs antichoc à être utilisés après l'administration de médicaments arsenic. En raison de leur effet sur ??????le rythme cardiaque, cependant, ils sont moins susceptibles d'être utilisées de sels de potassium ou de rubidium. Ils ont également été utilisés pour traiter l'épilepsie .
Risques pour la santé et la sécurité

composés de césium sont rarement rencontrés par la plupart des gens, mais la plupart sont légèrement toxique à cause de la similarité chimique de césium potassium . L'exposition à de grandes quantités de composés de césium peut provoquer hyperirritabilité et spasmes, mais que ces montants ne seraient pas normalement être rencontrés dans les sources naturelles, le césium est pas un grand polluant de l'environnement chimique. Le dose létale (DL médian 50 ) valeur pour le chlorure de césium chez la souris est de 2,3 g par kg, ce qui est comparable aux LD 50 valeurs de chlorure de potassium et chlorure de sodium .
| NFPA 704 |
|---|
 3 4 3 |
| Le diamant feu signe de danger pour le c??sium m??tallique |
Césium métal est l'un des éléments les plus réactifs et est hautement explosive quand il entre en contact avec l'eau. Le gaz hydrogène produit par la réaction est chauffée par l'énergie thermique libérée en même temps, et allumage provoquant une violente explosion. Cela peut se produire avec d'autres métaux alcalins, mais le césium est si puissant que cette réaction explosive peut même être déclenché par l'eau froide. Le température d'auto-inflammation du césium est également -116 o C, il est donc très pyrophore, et enflamme explosive dans l'air pour former l'hydroxyde de césium et divers oxydes. Césium hydroxyde est une très forte base et va rapidement se corroder verre.
Les isotopes 134 et 137 sont présents dans la biosphère en petites quantités par les activités humaines et représentent un fardeau de la radioactivité qui varie selon l'endroit. Radiocaesium ne accumule pas dans le corps de manière aussi efficace que de nombreux autres produits de fission (tels que l'iode radioactif et radiostrontium). Environ 10% des lavages de césium radioactif absorbées hors du corps relativement rapidement dans la sueur et l'urine. Les 90% restants a une demi-vie comprise entre 50 et 150 jours. Radiocaesium suit potassium et tend à s'accumuler dans les tissus végétaux, y compris les fruits et légumes. Il est également bien documenté que les champignons de forêts contaminées par le césium radioactif accumulent (césium 137) dans leurs fongiques sporocarpes. L'accumulation de césium 137 dans les lacs a été une grande préoccupation après la catastrophe de Tchernobyl . Des expériences avec des chiens ont montré qu'une dose unique de 3,8 millicuries (140 MBq, 4.1 ug du césium-137) par kilogramme est mortelle dans les trois semaines; de plus petites quantités peuvent causer l'infertilité et le cancer. Le Agence internationale de l'énergie atomique et d'autres sources ont averti que des matières radioactives, tels que le césium-137, pourraient être utilisés dans des dispositifs de dispersion radiologique ou « bombes sales ».
