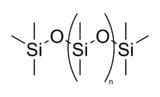Silicium
Renseignements g??n??raux
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Silicium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
14 Si | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||
cristallin, r??fl??chissant avec des visages bleut??s teint??  Raies spectrales de Silicon | |||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||
| Nom, symbole, nombre | silicium, Si, 14 | ||||||||||||||||||||||||||||||
| Prononciation | / s ɪ l ɨ k ən / -Je viendrai si je SIL ou / s ɪ l ɨ k ɒ n / -Kon de SIL | ||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tallo??de | ||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 14, 3, p | ||||||||||||||||||||||||||||||
| Poids atomique standard | 28,085 (1) | ||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ne ] 3s 2 3p 2 2, 8, 4 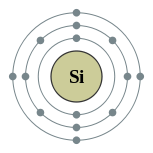 | ||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||
| Pr??diction | Antoine Lavoisier (1787) | ||||||||||||||||||||||||||||||
| D??couverte | J??ns Jacob Berzelius (1823) | ||||||||||||||||||||||||||||||
| Premier isolement | J??ns Jacob Berzelius (1823) | ||||||||||||||||||||||||||||||
| Nomm?? par | Thomas Thomson (1817) | ||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 2,3290 g ?? cm -3 | ||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 2,57 g ?? cm -3 | ||||||||||||||||||||||||||||||
| Point de fusion | 1687 K , 1414 ?? C, 2577 ?? F | ||||||||||||||||||||||||||||||
| Point d'??bullition | 3538 K, 3265 ?? C, 5909 ?? F | ||||||||||||||||||||||||||||||
| La chaleur de fusion | 50,21 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 359 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 19,789 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 3, 2, 1 -1, -2, -3, -4 ( l'oxyde amphot??re) | ||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,90 (??chelle de Pauling) | ||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 786,5 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| 2??me: 1577,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||
| 3??me: 3231,6 kJ ?? mol -1 | |||||||||||||||||||||||||||||||
| Rayon atomique | 111 h | ||||||||||||||||||||||||||||||
| Rayon covalente | 111 h | ||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 210 h | ||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||
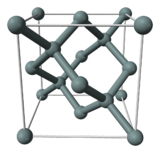
| Crystal structure | Diamant | ||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 10 3 Ω ?? m | ||||||||||||||||||||||||||||||
| Conductivit?? thermique | 149 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) de 2,6 um ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 8,433 m ?? s -1 | ||||||||||||||||||||||||||||||
| Le module d'Young | 130-188 GPa | ||||||||||||||||||||||||||||||
| Module de cisaillement | 51-80 GPa | ||||||||||||||||||||||||||||||
| Module Bulk | 97,6 GPa | ||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,064 ?? 0,28 | ||||||||||||||||||||||||||||||
| Duret?? Mohs | 7 | ||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-21-3 | ||||||||||||||||||||||||||||||
| ??nergie de bande interdite ?? 300 K | 1,12 eV | ||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de silicium | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Le silicium, un t??travalent m??tallo??des, est un ??l??ment chimique avec le symbole Si et de num??ro atomique 14. Il est moins r??actif que son analogue chimique du carbone , la non m??tallique directement au-dessus de la table p??riodique , mais plus r??actif que le germanium , le m??tallo??de directement en dessous de la table. La controverse sur les dates de caract??res de silicium ?? sa d??couverte; il a ??t?? d'abord pr??par?? et caract??ris?? en forme pure en 1823. En 1808, il a ??t?? donn?? le nom de silicium (du latin : Silicis, silex), avec un de sugg??rer un m??tal se terminant mot, un nom -ium laquelle l'??l??ment conserve dans plusieurs langues autres que l'anglais. Cependant, sa derni??re nom anglais, d'abord propos?? en 1817, refl??te la plus semblable physiquement ??l??ments carbone et de bore.
Silicon est le huiti??me plus ??l??ment commun dans l'univers en masse, mais tr??s rarement se produit comme ??l??ment libre pur dans la nature. Il est le plus largement distribu?? dans poussi??res, sables , plan??to??des et plan??tes que diverses formes de dioxyde de silicium (silice) ou silicates. Plus de 90% de la cro??te terrestre est compos??e de silicates, ce qui rend l'silicium deuxi??me ??l??ment le plus abondant dans la cro??te de la Terre (environ 28% en masse) apr??s l'oxyg??ne .
La plupart silicium est utilis?? commercialement sans ??tre s??par??s, et m??me souvent avec peu de transformation de compos??s de la nature. Il se agit notamment renforcement utilisation industrielle directe des argiles, le sable de silice et de pierre. Silice est utilis??e dans la brique en c??ramique. Silicate en va Ciment Portland pour mortier et stuc, et lorsqu'il est combin?? avec du sable de silice et gravier, de faire b??ton. Silicates sont ??galement en fa??ence des c??ramiques telles que porcelaine, et traditionnelle quartz ?? base de verre sodo-calcique. Plus de compos??s du silicium tels que modernes silicium abrasifs de forme de carbure et de la c??ramique ?? haute r??sistance. Le silicium est la base des polym??res ?? base de silicium synth??tique appel?? ubiquitaires silicones.
Le silicium ??l??mentaire a ??galement un grand impact sur l'??conomie mondiale moderne. Bien que la plupart du silicium libre est utilis?? dans l'affinage de l'acier, de l'aluminium sous pression, et les industries de chimie fine (souvent ?? faire la silice pyrog??n??e), la partie relativement petite de silicium tr??s hautement purifi?? qui est utilis?? dans l'??lectronique ?? semi-conducteur (<10%) est peut-??tre encore plus critique. Parce que d'une large utilisation de silicium dans les circuits int??gr??s , la base de la plupart des ordinateurs, une grande partie de la technologie moderne en d??pend.
Le silicium est un ??l??ment essentiel de la biologie, mais seulement minuscules traces semblent ??tre requis par les animaux. Cependant, divers ??ponges de mer ainsi que des micro-organismes comme diatom??es besoin silicium afin d'avoir la structure. Il est beaucoup plus important pour le m??tabolisme des plantes, en particulier de nombreuses gramin??es.
Caract??ristiques
Physique
Le silicium est un solide ?? temp??rature ambiante, avec relativement ??lev??e points de fusion et d'environ 1 400 d'??bullition et de 2800 degr??s Celsius respectivement. Fait int??ressant, le silicium a une plus grande densit?? ?? l'??tat liquide ?? l'??tat solide. Il ne se contracte pas quand il g??le comme la plupart des substances, mais ??largit, semblable ?? la fa??on dont la glace est moins dense que l'eau et a moins de masse par unit?? de volume que l'eau liquide. Avec un niveau relativement ??lev?? conductivit?? thermique de 149 W ?? m -1 ?? K -1, le silicium conduit bien la chaleur et en cons??quence ne est pas souvent utilis??e pour isoler des objets chauds.
Dans son cristallin forme, silicium pur a une couleur gris et un ??clat m??tallique. Comme le germanium , le silicium est assez forte, tr??s fragiles et sujettes ?? l'??caillage. Silicon, comme le carbone et le germanium, cristallise dans un Diamant la structure cristalline, avec un espacement de r??seau de 0.5430710 nm (5.430710 ??).
L'ext??rieur ??lectron orbital de silicium, comme celui de carbone, a quatre ??lectrons de valence. Les 1 s, 2 s, 2 p et 3 s sous-couches sont compl??tement remplis tandis que les 3 p sous-couche contient deux ??lectrons sur une possibilit?? de six.
Le silicium est un semi-conducteur . Il a un coefficient de temp??rature n??gatif de r??sistance , ??tant donn?? que le nombre de porteurs de charge libres augmente avec la temp??rature. La r??sistance ??lectrique de silicium monocristallin change de mani??re significative sous l'application d'une contrainte m??canique due ?? la effet pi??zor??sistif.
Chimique
Le silicium est un m??tallo??de, soit facilement don ou le partage ses quatre ??lectrons externes, permettant de nombreuses formes de liaison chimique. Comme le carbone, il forme g??n??ralement quatre liaisons. Contrairement carbone, il peut accepter des ??lectrons suppl??mentaires et former cinq ou six liaisons dans un parfois plus labile sous forme de silicate. Tetra-valent silicium est relativement inerte, mais r??agit toujours avec les halog??nes et dilu??e alcalis, mais la plupart des acides (sauf pour certaines combinaisons hyper-r??actif de l'acide nitrique et l'acide fluorhydrique) ne ont pas d'effet connu sur elle. Cependant, ayant quatre ??lectrons de liaison lui donne, comme le carbone, de nombreuses possibilit??s de combiner avec d'autres ??l??ments ou compos??s dans les bonnes circonstances.
Isotopes
Naturellement silicium se produisant est compos?? de trois stables isotopes du silicium, 28, 29 de silicium et le silicium-30, avec du silicium 28 ??tant le plus abondant (92% du abondance naturelle). Parmi ceux-ci, seul le silicium-29 est d'usage dans RMN et Spectroscopie EPR. Vingt des radio-isotopes ont ??t?? caract??ris??s, ?? ??tre plus stable le silicium-32 avec une demi-vie de 170 ans et du silicium 31 avec une demi-vie de 157,3 minutes. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de sept secondes, et la majorit?? d'entre eux ont des demi-vies qui sont inf??rieures ?? un dixi??me de seconde. Le silicium n'a pas connu isom??res nucl??aires.
Les isotopes de l'??ventail de silicium dans nombre de masse du 22 au 44. Le plus commun mode de six isotopes avec des nombres de masse inf??rieure ?? la isotope stable le plus abondant de d??croissance, le silicium-28, est β +, formant principalement isotopes d'aluminium (13) en tant protons produits de d??sint??gration. Le mode de d??croissance la plus courante (s) pour 16 isotopes avec des nombres de masse plus ??lev?? que le silicium-28 est β -, formant principalement des isotopes de phosphore (15 protons) que les produits de d??sint??gration.
Occurrence

Mesur?? en masse, le silicium repr??sente 27,7% de la cro??te terrestre et est le deuxi??me ??l??ment le plus abondant dans la cro??te, avec seulement de l'oxyg??ne ayant une plus grande abondance. Silicon se trouve g??n??ralement sous la forme de complexe silicates, et moins souvent que le dioxyde de silicium (silice, une composante majeure de sable commune). Cristaux de silicium purs sont tr??s rarement dans la nature.
Le min??raux divers-silicate min??raux contenant du silicium, de l'oxyg??ne et r??active m??taux compte pour 90% de la masse de la cro??te de la Terre. Cela est d?? au fait que les temp??ratures ??lev??es caract??ristiques de la formation du syst??me solaire interne, le silicium et l'oxyg??ne ont une grande affinit?? pour l'autre, formant des r??seaux de silicium et d'oxyg??ne dans les compos??s chimiques de tr??s faible volatilit??. Depuis oxyg??ne et le silicium sont les ??l??ments les plus communs non gazeuses et non m??talliques dans les d??bris de la supernova la poussi??re qui formaient la disque protoplan??taire dans le formation et l'??volution du syst??me solaire, ils ont form?? de nombreux silicates complexes qui Accumul??e en grande rocheuse plan??t??simaux qui formaient le plan??tes telluriques. Ici, la matrice min??rale silicate pi??g?? r??duit suffisamment les m??taux r??actifs ?? oxyder (en aluminium, de calcium, de sodium, de potassium et de magn??sium). Apr??s la perte de gaz volatils, ainsi que le carbone et le soufre par r??action avec l'hydrog??ne, ce m??lange silicate form?? d'??l??ments majeure partie de la cro??te terrestre. Ces silicates ??taient de densit?? relativement faible par rapport au fer, de nickel et d'autres m??taux non-r??actives ?? l'oxyg??ne et donc un r??sidu du fer non combin?? et le nickel ont coul?? au noyau de la plan??te, laissant un ??pais manteau compos?? principalement de silicates de magn??sium et de fer ci-dessus.
Des exemples de silicates dans la cro??te comprennent ceux dans le pyrox??ne, amphibole, mica et de feldspath groupes. Ces min??raux se produisent dans l'argile et divers types de roche tels que le granit et gr??s.
La silice se produit dans les min??raux comprenant du dioxyde de silicium tr??s pur sous diff??rentes formes cristallines, quartz , agate am??thyste, cristal de roche , calc??doine, silex, jaspe, et opale. Les cristaux ont la formule empirique de dioxyde de silicium, mais ne sont pas constitu??s de mol??cules de dioxyde de silicium distincts dans le temps de dioxyde de carbone solide. Au contraire, la silice est structurellement un r??seau solide constitu?? du silicium et de l'oxyg??ne dans les cristaux tridimensionnels, comme le diamant. Silice moins pure forme le verre naturel obsidienne. Silice biog??ne se produit dans la structure de diatom??es, radiolaires et ??ponges siliceuses.
Le silicium est ??galement un ??l??ment principal de nombreux m??t??orites, et est une composante de tectites, un min??ral de silicate d'origine ??ventuellement lunaire, ou (si Terre-d??riv??) qui a ??t?? soumis ?? des temp??ratures et des pressions inhabituelles, peut-??tre de gr??ve de la m??t??orite.
Production
Alliages
Ferrosilicium, un alliage de fer et de silicium qui contient des proportions variables de silicium ??l??mentaire et de fer, repr??sente environ 80% de la production mondiale de silicium ??l??mentaire, avec la Chine, le principal fournisseur de silicium ??l??mentaire, fournissant 4,6 millions tonnes (ou 2/3 de la production mondiale) de silicium, dont la plupart est sous la forme de ferrosilicium. Elle est suivie par la Russie (610 000 t), la Norv??ge (330 000 t), le Br??sil (240 000 t) et les ??tats-Unis (170 000 t). Ferrosilicium est principalement utilis?? par l'industrie sid??rurgique (voir ci-dessous).
Des alliages d'aluminium-silicium sont largement utilis??s dans l'industrie du moulage d'alliage d'aluminium, o?? le silicium est le seul additif le plus important de l'aluminium afin d'am??liorer ses propri??t??s de moulage. ??tant donn?? que la fonte d'aluminium est largement utilis?? dans l'industrie automobile, cette utilisation du silicium est donc la plus grande utilisation industrielle unique de "qualit?? m??tallurgique" silicium pur (comme ce silicium purifi?? est ajout?? ?? l'aluminium pur, alors que le ferrosilicium est jamais purifi?? avant d'??tre ajout?? ?? l'acier ).
Qualit?? m??tallurgique
Le silicium ??l??mentaire non alli?? avec d'importantes quantit??s d'autres ??l??ments, et le plus souvent> 95%, est souvent d??sign?? de fa??on l??che sous forme de m??tal de silicium. Il repr??sente environ 20% de la production mondiale totale de silicium ??l??mentaire, de moins de 1 ?? 2% de silicium ??l??mentaire totale (5-10% de silicium de qualit?? m??tallurgique) jamais purifi?? ?? teneurs plus ??lev??es pour leur utilisation en ??lectronique. Silicium de qualit?? m??tallurgique est commercialement pr??par?? par la r??action de haute puret?? de la silice avec du bois, du charbon de bois et le charbon dans un Four ?? arc ??lectrique ?? l'aide carbone ??lectrodes. A des temp??ratures plus de 1900 ?? C (3450 ?? F), l'atome de carbone dans les mat??riaux mentionn??s ci-dessus et le silicium subissent la r??action chimique SiO 2 + 2 C → CO 2 + Si. le silicium liquide se accumule dans le fond du four, qui est ensuite ??goutt?? et refroidi. Le silicium produite de cette mani??re est appel?? silicium de qualit?? m??tallurgique et est au moins pur ?? 98%. En utilisant cette m??thode, le carbure de silicium (SiC) peut ??galement se former ?? partir d'un exc??s de carbone dans une ou des deux mani??res suivantes:. SiO 2 + C → SiO + CO ou SiO + 2 C → SiC + CO Toutefois, ?? condition que la concentration de SiO 2 est maintenue ??lev??, le carbure de silicium peut ??tre ??limin?? par la r??action chimique SiC 2 + SiO 2 → 3 Si + 2 CO.
Comme indiqu?? plus haut, le silicium de qualit?? m??tallurgique "m??tal" a son utilisation principale dans l'industrie du moulage d'aluminium pour fabriquer des pi??ces en alliage d'aluminium-silicium. Le reste (environ 45%) est utilis?? par le industrie chimique, o?? il est principalement utilis??e pour faire la silice fum??e.
En Septembre 2008, m??tallurgiques co??ts de silicium de grade environ US $ 1,45 par livre ($ 3,20 / kg), en hausse de 0,77 $ la livre (1,70 $ / kg) en 2005.
Qualit?? ??lectronique
L'utilisation de silicium en semi-conducteur appareils exige une plus grande puret?? que donn?? par le silicium de qualit?? m??tallurgique. Silicium tr??s pur (> 99,9%) peut ??tre extraite directement ?? partir de la silice solide ou d'autres compos??s du silicium par ??lectrolyse de sel fondu. Cette m??thode, connue d??s 1854 (voir aussi FFC du processus Cambridge), a le potentiel de produire directement du silicium de qualit?? solaire sans dioxyde de carbone ??mission ?? la consommation d'??nergie beaucoup plus faible.
Silicium de qualit?? solaire ne peut pas ??tre utilis?? pour les semi-conducteurs, o?? la puret?? doit ??tre extr??me ?? contr??ler correctement le processus. Plaquettes de silicium en vrac utilis??s au d??but du processus de fabrication de circuit int??gr?? doivent d'abord ??tre affin??s pour "neuf nines?? puret?? (99.9999999%), un processus qui n??cessite des applications r??p??t??es de la technologie de raffinage.
La majorit?? des cristaux de silicium destin??es ?? la production de l'appareil est produit par la Proc??d?? de Czochralski (CZ-Si) puisque ce est la m??thode la plus ??conomique disponible et il est capable de produire de gros cristaux de taille. Cependant, les monocristaux cultiv??s par le proc??d?? de Czochralski parce que les impuret??s contiennent creuset contenant la masse fondue se dissout souvent. Historiquement, un certain nombre de m??thodes ont ??t?? utilis??es pour produire des ultra-haute puret?? silicium.
Techniques de purification de silicium d??but ??taient bas??es sur le fait que si le silicium est fondu et re-solidifi??, les derni??res parties de la masse pour solidifier contiennent la plupart des impuret??s. La premi??re m??thode de purification de silicium, d??crite pour la premi??re en 1919 et utilis?? sur une base limit??e pour faire radar composants lors de la Seconde Guerre mondiale , impliqu?? concassage silicium de qualit?? m??tallurgique, puis dissoudre partiellement la poudre de silicium dans un acide. Lorsque ??cras??, le silicium fissur?? sorte que les r??gions d'impuret??s riches en plus faibles ??taient ?? l'ext??rieur des grains de silicium r??sultant. En cons??quence, le silicium riche en impuret??s est le premier ?? ??tre dissous lors d'un traitement avec un acide, en laissant derri??re un produit plus pur.
En fusion de zone, ??galement appel??e zone de raffinage, le premier proc??d?? de purification de silicium pour ??tre largement utilis??s industriellement, les tiges de silicium de qualit?? m??tallurgique sont chauff??s ?? l'??tat fondu ?? une extr??mit??. Ensuite, l'??l??ment chauffant est d??plac?? lentement vers le bas la longueur de la tige, en gardant une petite longueur de la tige de fusion comme le silicium se refroidit et se resolidifie derri??re elle. Comme la plupart des impuret??s ont tendance ?? rester dans la r??gion fusion plut??t que resolidifier, lorsque le processus est termin??, la plupart des impuret??s dans la tige aura ??t?? d??plac?? dans la fin qui a ??t?? le dernier ?? ??tre fondu. Cette extr??mit?? est ensuite coup??e et jet??e, et le processus est r??p??t?? si une puret?? encore plus ??lev??e est souhait??e.
?? un moment donn??, DuPont a produit du silicium ultra pur par r??action avec du t??trachlorure de silicium de haute puret?? zinc vapeurs ?? 950 ?? C, production de silicium par SiCl 4 + 2 Zn → Si + 2 ZnCl 2. Cependant, cette technique a ??t?? en proie ?? des probl??mes pratiques (comme le chlorure de zinc sous-produit de solidification et les lignes de colmatage) et a finalement ??t?? abandonn?? en faveur du processus de Siemens . Dans le proc??d?? Siemens, tiges de silicium de haute puret?? sont expos??s ?? trichlorosilane ?? 1150 ?? C. Le gaz de trichlorosilane d??compose et d??p??ts silicium suppl??mentaire sur les tiges, les agrandissant, car deux HSiCl3 → Si + 2 HCl + SiCl 4. Silicon produite ?? partir de ce processus et similaires est appel?? silicium polycristallin. Le silicium polycristallin a g??n??ralement des niveaux de moins d'une partie par milliard d'impuret??s.
En 2006 REC a annonc?? la construction d'une usine sur la base lit fluidis?? (FB) en utilisant la technologie silane: 3 SiCl 4 + Si + 2 H 2 → 4 HSiCl 3, 4 HSiCl3 → 3 SiCl 4 + 4 SiH, SiH 4 → Si + 2 H 2. L'avantage de la technologie ?? lit fluidis?? est que les processus peuvent ??tre ex??cut??s en continu, ce qui donne des rendements plus ??lev??s que sur le processus Siemens, qui est un processus de traitement par lots.
Aujourd'hui, le silicium est purifi?? en le convertissant en un silicium compos?? qui peut ??tre plus facilement purifi?? par distillation que dans son ??tat initial, et ensuite la conversion de ce compos?? de silicium dos en silicium pur. Le trichlorosilane est le compos?? de silicium le plus couramment utilis?? en tant que produit interm??diaire, bien le t??trachlorure de silicium et silane sont ??galement utilis??s. Lorsque ces gaz sont souffl??s au-dessus de silicium ?? haute temp??rature, ils se d??composent en silicium de haute puret??.
En outre, il est le Processus Schumacher, qui utilise tribromosilane en place de trichlorosilane et de la technologie ?? lit fluidis??. Il n??cessite des temp??ratures de d??p??t inf??rieurs, des co??ts de capital inf??rieurs ?? construire des installations et ?? utiliser, pas de polym??res dangereux ni mati??re explosive, et ne produit aucun d??chet de poussi??re de silicium amorphe, qui sont tous des inconv??nients du proc??d?? Siemens. Cependant, il n'y a pas encore y avoir de grandes usines construites utilisant ce processus.
Compos??s
- Silicon forme des compos??s appel??s binaires siliciures avec de nombreux ??l??ments m??talliques dont les propri??t??s vont de compos??s r??actifs, par exemple siliciure de magn??sium, Mg 2 Si travers compos??s r??fractaires de fusion ??lev?? tels que disiliciure de molybd??ne, le MoSi 2.
- Le carbure de silicium, SiC (carborundum) est un disque, point de fusion ??lev?? et un solide bien connu abrasif. Il peut ??galement ??tre fritt??e en un type de c??ramique ?? haute r??sistance utilis?? dans l'armure.
- Silane, SiH 4, est un gaz pyrophorique avec une structure t??tra??drique similaire ?? m??thane , CH 4. Quand elle est pure, il ne r??agit pas avec de l'eau pure ou les acides dilu??s; Toutefois, m??me de petites quantit??s d'impuret??s alcalins du verre de laboratoire peuvent entra??ner une hydrolyse rapide. Il existe une gamme d'hydrures de silicium encha??n??s qui forment une s??rie homologue de compos??s, Si n H 2 n 2 o?? n = 2-8 (analogues aux alcanes ). Ce sont tous facilement hydrolyses et sont thermiquement instables, en particulier les membres les plus lourds.
- Disilenes contiennent une double liaison silicium-silicium (analogues aux alc??nes ) et sont g??n??ralement tr??s r??actifs n??cessitant de grands groupes substituants pour les stabiliser. Un Disilyne avec un silicium-silicium triple liaison a ??t?? isol?? pour la premi??re en 2004; bien que le compos?? ne est pas lin??aire, la liaison est diff??rente de celle dans alcynes.
- T??trahalog??nures, SiX 4, sont form??s avec tous les halog??nes. Le t??trachlorure de silicium, par exemple, r??agit avec l'eau, ?? la diff??rence de son analogue de carbone, le t??trachlorure de carbone . dihalog??nures de silicium sont form??s par la r??action ?? haute temp??rature et les t??trahalog??nures de silicium; avec une structure analogue ?? un carb??ne, ils sont des compos??s r??actifs. Difluorure de silicium se condense pour former un compos?? polym??re, (SiF 2) n.
- Le dioxyde de silicium est un solide ?? point de fusion ??lev?? un certain nombre de formes cristallines; le plus familier de ce qui est le min??ral quartz . Dans quartz chaque atome de silicium est entour?? par quatre atomes d'oxyg??ne qui relient ?? d'autres atomes de silicium pour former un r??seau tridimensionnel. La silice est soluble dans l'eau ?? des temp??ratures ??lev??es une gamme de compos??s appel??s acide monosilicique, Si (OH) 4.
- En vertu de l'acide monosilicique de bonnes conditions se polym??rise facilement pour former des acides siliciques plus complexes, allant de l'eau de condensation le plus simple, l'acide disilicic (H 6 Si 2 O 7) ?? lin??aire, rubans, couches et treillis structures qui forment la base des nombreux min??raux silicat??s et sont appel??s acides polysiliciques {Si de x (OH) 4-2x} n.
- Avec des oxydes d'autres ??l??ments de la r??action ?? haute temp??rature en dioxyde de silicium peut donner une large gamme de lunettes avec diff??rentes propri??t??s. Des exemples comprennent verre sodocalcique, verre borosilicate et verre cristal.
- Silicon sulfure, SiS 2, est un solide polym??re (contrairement ?? son analogique de carbone du liquide CS 2).
- Silicium forme un nitrure, Si 3 N 4, qui est une c??ramique. Silatranes, un groupe de compos??s tricycliques ?? cinq coordinants contenant du silicium, peuvent avoir des propri??t??s physiologiques.
- De nombreux complexes de m??taux de transition contenant une liaison m??tal-silicium sont maintenant connus, qui comprennent des complexes contenant SiH n X 3- n ligands, des ligands SiX 3, et Si (OR) 3 ligands.
- Les silicones sont grand groupe de compos??s polym??res d'un (Si-O-Si) squelette. Un exemple est le PDMS ?? l'huile de silicone (polydim??thylsiloxane). Ces polym??res peuvent ??tre r??ticul??s pour produire des r??sines et ??lastom??res.
- Beaucoup des compos??s organosilici??s sont connus qui contiennent une liaison simple carbone-silicium. Beaucoup d'entre elles sont bas??es sur un atome de silicium t??tra??drique central, et d'autres sont optiquement actif lorsque central chiralit?? existe. Les polym??res ?? longue cha??ne contenant un squelette de silicium sont connus, tels que polydimethysilylene (SiMe 2) n. Polycarbosilane, [(SiMe 2) 2 CH 2] n avec un squelette contenant une unit?? de r??p??tition -Si-Si-C, est un pr??curseur dans la production de fibres de carbure de silicium.
Histoire
L'attention a ??t?? attir??e sur la premi??re silice comme l'oxyde possible d'une fondamentale ??l??ment chimique par Antoine Lavoisier , en 1787. Apr??s une tentative d'isoler le silicium en 1808, Sir Humphry Davy a propos?? le nom de "silicium" pour le silicium, de la silice latine, pour Silicis silex, silex, et en ajoutant le "-ium" fin parce qu'il croyait que ce ??tait un m??tal. En 1811, Gay-Lussac et Th??nard sont pens?? pour avoir pr??par?? impure silicium amorphe, par le chauffage de r??cemment isol?? potassium m??tal avec t??trafluorure de silicium, mais ils ne ont pas de purifier et de caract??riser le produit, ni l'identifier comme un nouvel ??l??ment. Silicon a donn?? son nom actuel en 1817 par le chimiste ??cossais Thomas Thomson. Il a conserv?? une partie du nom de Davy, mais a ajout?? "-on" parce qu'il croyait que le silicium ??tait un non m??tallique semblable ?? de bore et de carbone . En 1823, Berzelius silicium amorphe pr??par?? en utilisant approximativement le m??me proc??d?? que Gay-Lussac (m??tal de potassium et le fluorosilicate de potassium), mais en purifiant le produit en une poudre brune en lavant ?? plusieurs reprises il. En cons??quence, il est g??n??ralement donn?? cr??dit pour la d??couverte de l'??l??ment.
Silicium dans sa forme cristalline plus fr??quente ??tait pas pr??par?? jusqu'?? 31 ans plus tard, par Deville. Par ??lectrolyse impur sodium - aluminium chlorure contenant environ 10% de silicium, il a r??ussi ?? obtenir un l??g??rement impur allotrope du silicium en 1854. Plus tard, plusieurs m??thodes rentables ont ??t?? d??velopp??s pour isoler silicium dans plusieurs allotrope formes, dont la plus r??cente silicene.
Parce que le silicium est un ??l??ment important dans les semi-conducteurs et appareils de haute technologie, de nombreux endroits dans le monde portent son nom. Par exemple, Silicon Valley en Californie , puisque ce est la base pour un certain nombre d'industries li??es ?? la technologie, porte le nom silicium. Autres zones g??ographiques ayant des liens avec l'industrie ont depuis ??t?? nomm?? d'apr??s le silicium ainsi. Des exemples comprennent Silicon Forest dans l'Oregon , Silicon Hills dans Austin, Texas, Silicon Saxony en Allemagne , la Silicon Valley en Inde , Silicon Border dans Mexicali, au Mexique, Silicon Fen dans Cambridge, en Angleterre , Silicon Roundabout ?? Londres , Silicon Glen en Ecosse , et Silicon Gorge Bristol, en Angleterre .
Applications
Compos??s
La plupart silicium est utilis?? industriellement sans ??tre s??par??s dans l'??l??ment, et en fait souvent avec relativement peu de traitement de pr??sence naturelle. Plus de 90% de la cro??te terrestre est compos??e de silicates. Beaucoup d'entre eux ont des utilisations commerciales directes, comme les argiles, le sable de silice et la plupart des types de pierre de construction. Ainsi, la grande majorit?? des utilisations de silicium sont les compos??s de structure, soit comme des silicates ou de la silice (dioxyde de silicium brut). Par exemple, la silice est une partie importante de briques de c??ramique. Silicates sont utilis??s dans la fabrication du ciment Portland qui est utilis?? dans le mortier de construction et de stuc, mais plus important combin?? avec du sable de silice, et de gravier (contenant g??n??ralement des silicates comme le granit), pour faire le b??ton qui est la base de la plupart des tr??s grand industrielle les projets de construction du monde moderne.
Silicates sont ??galement en c??ramique p??te blanche, une classe importante de produits contenant habituellement divers types de terre cuite (silicate d'aluminium naturel). Un exemple est la porcelaine qui est bas??e sur le silicate min??ral kaolinite. C??ramique comprennent des objets d'art, et, des produits industriels et de construction nationales. Verre sodo-calcique classique ?? base de quartz fonctionne ??galement dans un grand nombre des m??mes r??les.
Plus de compos??s de silicium modernes fonctionnent aussi comme abrasifs de haute technologie et de nouvelles c??ramiques ?? haute r??sistance sur la base de ( le carbure de silicium), et superalliages.
L'alternance des cha??nes silicium-oxyg??ne avec l'hydrog??ne li?? ?? du silicium liaisons restantes forment les mat??riaux polym??res ?? base de silicium connus sous le nom ubiquitaires silicones. Ces compos??s contenant du silicium-oxyg??ne et de temps en temps des liaisons silicium-carbone ont la capacit?? d'agir comme interm??diaires de liaison entre le verre et les compos??s organiques, et pour former des polym??res ayant des propri??t??s utiles, telles que l'imperm??abilit?? ?? l'eau, la souplesse et la r??sistance aux attaques chimiques. Les silicones sont souvent utilis??s dans les traitements d'??tanch??it??, Mati??res ?? mouler, au moulage agents de d??moulage, joints m??caniques, haute temp??rature graisses et cires, et compos??s de calfeutrage. Le silicone est ??galement parfois utilis?? dans les implants mammaires, lentilles de contact, explosifs et pyrotechnie. Silly Putty a ??t?? initialement faite en ajoutant acide borique huile de silicone.
Alliages
Le silicium ??l??mentaire est ajout?? au fondu fonte que ferrosilicium ou silicocalcium alliages pour am??liorer les performances dans coul??e sections minces et emp??chent la formation de c??mentite o?? expos?? ?? l'air ext??rieur. La pr??sence de silicium ??l??mentaire dans des actes de fer en fusion en tant que puits pour l'oxyg??ne, de sorte que la teneur en carbone de l'acier, qui doit ??tre maintenue dans des limites ??troites pour chaque type d'acier, peut ??tre plus ??troitement contr??l??e. Production et l'utilisation de ferrosilicium est un moniteur de l'industrie de l'acier, et bien que cette forme de silicium ??l??mentaire est impur, il repr??sente 80% de la consommation mondiale de silicium libre.
Les propri??t??s du silicium lui-m??me peut ??tre utilis?? pour modifier alliages. L'importance de silicium en fonte d'aluminium qui est une quantit?? nettement plus ??lev??e (12%) de silicium dans l'aluminium forme un m??lange eutectique qui se solidifie avec tr??s peu de contraction thermique. Cela r??duit consid??rablement la d??chirure et fissures form?? du stress que les alliages de coul??e refroidir ?? la solidit??. Silicon am??liore ??galement de mani??re significative la duret?? et la r??sistance ?? l'usure ainsi de l'aluminium. Le silicium est un constituant important de acier ??lectrique, modifiant son r??sistivit?? et des propri??t??s ferromagn??tiques.
Silicium de qualit?? m??tallurgique est le silicium de 95 ?? 99% de puret??. Environ 55% de la consommation mondiale de silicium de puret?? m??tallurgique va pour la production d'alliages aluminium-silicium pour une partie de l'aluminium pl??tres, principalement pour une utilisation dans le l'industrie automobile. La raison de l'utilisation ??lev??e en silicium dans ces alliages est not?? ci-dessus. Une grande partie du reste du silicium de qualit?? m??tallurgique est utilis?? par l'industrie chimique pour la production du produit industriel important la silice fum??e. Le reste est utilis?? dans la production d'autres produits chimiques fins tels que silanes et certains types de silicones.
??lectronique
Depuis silicium plus ??l??mentaire produit reste qu'un alliage de ferrosilicium, seule une quantit?? relativement faible (20%) du silicium ??l??mentaire produit est raffin?? ?? la puret?? m??tallurgique de qualit?? (un total de 1,3 ?? 1.500.000 tonnes / an). La fraction de silicium m??tallique, puis raffin??e ?? la puret?? de semi-conducteur est estim??e ?? seulement 15% de la production mondiale de silicium de qualit?? m??tallurgique. Cependant, l'importance ??conomique de cette petite fraction de tr??s haute puret?? (en particulier le ~ 5% qui est trait??e au silicium monocristallin pour une utilisation dans les circuits int??gr??s) est disproportionn??e.
Pur silicium monocristallin est utilis?? pour produire du silicium galettes utilis??es dans la l'industrie des semi-conducteurs, de l'??lectronique et dans certains-co??t ??lev?? et ?? haute efficacit?? applications photovolta??ques. En termes de frais conduction, silicium pur est un semi-conductrice intrins??que qui signifie que, contrairement ?? ce conduit m??taux trous d'??lectrons et des ??lectrons qui peuvent ??tre lib??r??s ?? partir d'atomes dans le cristal par la chaleur, et donc d'augmenter de silicium la conductivit?? ??lectrique ?? des temp??ratures plus ??lev??es. Silicium pur a une conductivit?? trop faible (ce est ?? dire, trop ??lev?? r??sistivit??) pour ??tre utilis?? comme un ??l??ment de circuit dans l'??lectronique. Dans la pratique, le silicium pur est dop?? avec de petites concentrations de certains autres ??l??ments, un processus qui accro??t consid??rablement sa conductivit?? et ajuste sa r??ponse ??lectrique en contr??lant le nombre et la charge ( positive ou n??gative ) des transporteurs activ??s. Un tel contr??le est n??cessaire pour transistors, cellules solaires, Les d??tecteurs ?? semi-conducteurs et autres dispositifs semi-conducteurs , qui sont utilis??s dans l'industrie des ordinateurs et d'autres applications techniques. Par exemple, dans la photonique sur silicium, le silicium peut ??tre utilis?? comme une onde continue Milieu laser Raman pour produire une lumi??re coh??rente, si elle est inefficace comme une source de lumi??re tous les jours.
En commun des circuits int??gr??s , une plaquette de silicium monocristallin sert de support m??canique pour les circuits, qui sont cr????es par dopage, et isol??s les uns des autres par des couches minces d' oxyde de silicium , un isolant qui est facilement produit en exposant l'??l??ment ?? l'oxyg??ne sous les conditions appropri??es. Silicon est devenu le mat??riau le plus populaire pour construire les deux semi-conducteurs de haute puissance et de circuits int??gr??s. La raison en est que le silicium est le semi-conducteur qui peut r??sister aux temp??ratures les plus ??lev??es et des puissances ??lectriques sans devenir dysfonctionnel en raison de claquage par avalanche (un proc??d?? dans lequel un avalanche d'??lectrons est cr???? par un proc??d?? de r??action en cha??ne de sorte que la chaleur produit des ??lectrons et des trous libres, qui ?? leur tour produisent plus de courant qui produit plus de chaleur). En outre, l'oxyde de silicium isolant ne est pas soluble dans l'eau, ce qui lui conf??re un avantage par rapport germanium (un ??l??ment ayant des propri??t??s similaires qui peuvent ??galement ??tre utilis??s dans des dispositifs ?? semi-conducteur) dans certains types de techniques de fabrication.
Silicium monocristallin est cher ?? produire, et ne est g??n??ralement justifi??e dans la production de circuits int??gr??s, o?? les petites imperfections de cristal peuvent interf??rer avec les chemins de circuits minuscules. Pour d'autres utilisations, d'autres types de silicium pur qui ne existent pas sous forme de cristaux uniques peuvent ??tre utilis??s. Il se agit notamment silicium amorphe hydrog??n?? et am??lior?? silicium de qualit?? m??tallurgique (UMG-Si) qui sont utilis??s dans la production de faible co??t, l'??lectronique de grande surface dans des applications telles que ??crans ?? cristaux liquides et de grande surface, ?? faible co??t, ?? couche mince cellules solaires. Ces qualit??s de semi-conducteurs de silicium qui sont soit l??g??rement moins pur que ceux utilis??s dans les circuits int??gr??s, ou qui sont produites dans polycristallin plut??t que sous forme monocristalline, constituent montant ?? peu pr??s similaire de silicium sont produits pour l'industrie des semi-conducteurs en silicium monocristallin, ou 75 000 ?? 150 000 tonnes m??triques par an. Cependant, la production de ces mat??riaux augmente plus rapidement que le silicium pour le march?? de circuit int??gr??. En 2013 la production de silicium polycristallin, principalement utilis?? dans les cellules solaires, devrait atteindre 200 000 tonnes m??triques par ann??e, tandis que la production de semi-conducteur silicium monocristallin (utilis?? dans les puces informatiques) reste en dessous de 50 000 tonnes / an.
R??le biologique
Bien que le silicium est facilement disponible sous la forme de silicates, tr??s peu d'organismes ont un emploi pour lui. Les diatom??es, radiolaires et ??ponges siliceuses utilisent silice biog??ne comme mat??riau de construction pour construire des squelettes. Dans les usines les plus avanc??es, la silice phytolithes (de phytolithes d'opale) sont des organismes microscopiques rigides qui se produisent dans la cellule; certaines plantes, par exemple le riz , le silicium ont besoin pour leur croissance. Bien que le silicium a ??t?? propos?? pour ??tre une trace nutriments ultra, sa fonction exacte dans la biologie des animaux est encore en discussion. Organismes sup??rieurs ne sont connus que de l'utiliser dans des occasions tr??s limit??es sous forme de l'acide silicique et silicates solubles.
Le silicium est connu pour ??tre n??cessaire pour la synth??se du ??lastine et collag??ne; la aorte contient la plus grande quantit?? d'??lastine et de silicium.
Le silicium est actuellement à l'étude pour l'élévation au statut de «planter substance bénéfique par l'Association des officiers de contrôle des aliments usine américaine (AAPFCO)." Silicon a été démontré dans des études universitaires et sur ??????le terrain pour améliorer la résistance de la paroi cellulaire des plantes et de l'intégrité structurelle, d'améliorer la résistance à la sécheresse et le gel, diminuer le potentiel de l'hébergement et de stimuler naturel des ravageurs et des maladies des systèmes de combat de la plante. Silicon a également été montré pour améliorer la vigueur de la plante et de la physiologie par l'amélioration de la masse racinaire et la densité, et l'augmentation de la biomasse végétale au-dessus du sol et le rendement des cultures.
Formes de vie à base de silicium hypothétiques sont l'objet de la biochimie de silicium, par analogie avec carbone à base de formes de vie. Silicon, étant en dessous de carbone dans le tableau périodique, est pensé pour avoir des propriétés assez semblables qui rendraient la vie à base de silicium possible, mais très différente de la vie comme nous la connaissons.