
Point de fusion
Renseignements g??n??raux
Cette s??lection de wikipedia a ??t?? choisi par des b??n??voles aidant les enfants SOS de Wikipedia pour cette s??lection Wikipedia pour les ??coles. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
Le point de fusion d'un solide cristallin est la plage de temp??rature ?? laquelle il change ??tat solide ?? liquide . Bien que l'expression sugg??re une temp??rature donn??e et est couramment et incorrectement utilis?? tel quel dans la plupart des manuels et la litt??rature, la plupart des compos??s cristallins fondent en fait sur une plage de quelques degr??s ou moins. Au point de fusion de la phase solide et liquide existe ?? l'??quilibre. Quand consid??r??e comme la temp??rature de la variation inverse de liquide ?? solide, il est d??sign?? sous le point de cong??lation. En raison de la capacit?? de certaines substances ?? supercool, le point de cong??lation ne est pas consid??r?? comme une propri??t?? caract??ristique d'une substance.
Fundamentals

Pour la plupart des substances, fusion et points de cong??lation sont essentiellement ??gaux. Par exemple, le point de fusion et le point de cong??lation de l' ??l??ment mercure est 234,32 kelvin (-38,83 ?? C ou -37,89 ?? F). Toutefois, certaines substances poss??dent des temp??ratures de transition solide-liquide diff??rents. Par exemple, agar fond ?? 85 ?? C (185 ?? F) et se solidifie ?? partir de 31 ?? C ?? 40 ?? C (89,6 ?? F ?? 104 ?? F); ce processus est connu sous le nom hyst??r??sis.
Certains mat??riaux, tels que le verre , peuvent durcir sans cristallisation; ceux-ci sont appel??s solides amorphes. Les mat??riaux amorphes ainsi que certains polym??res ne ont pas un v??ritable point de fusion, il n'y a pas de changement de phase abrupte ?? toute temp??rature sp??cifique. Au lieu de cela, il ya un changement progressif de leur propri??t??s visco??lastiques sur une plage de temp??ratures. Ces mat??riaux sont caract??ris??s par une temp??rature de transition vitreuse qui peut ??tre grossi??rement d??finie comme le ??genou?? point de la densit?? de la mati??re par rapport ?? la courbe de temp??rature.
Le point de fusion de l'eau ?? une atmosph??re de pression est tr??s proche de 0 ?? C (32 ?? F, 273,15 K), ce est ??galement connu comme le point de glace. En pr??sence de nucl??ation substances du point de cong??lation de l'eau est le m??me que le point de fusion, mais en l'absence d'eau peut nucl??ateurs supercool ?? -42 ?? C (-43,6 ?? F, 231 K) avant de les congeler.
Contrairement au point d'??bullition , le point de fusion est relativement insensible ?? la pression parce que la transition solide / liquide repr??sente seulement un petit changement dans le volume. Les points de fusion sont souvent utilis??es pour caract??riser les compos??s organiques et de v??rifier le puret??. Le point d'une substance pure de fusion est toujours plus ??lev??e et a une port??e plus petite que le point d'une substance impure de fusion. Le plus impuret?? est pr??sente, plus le point de fusion et la plus large de la gamme. Finalement, un point de fusion minimum sera atteint. Le rapport de m??lange qui entra??ne le point de fusion le plus bas possible est connu comme le le point eutectique.
L' ??l??ment chimique avec le point de fusion le plus ??lev?? est le tungst??ne , ?? 3695 K (3422 ?? C, 6192 ?? F) ce qui en fait un excellent pour une utilisation en tant que filaments dans les ampoules. Le souvent cit?? carbone ne fond pas ?? la pression ambiante mais sublime ?? environ 4000 K; une phase liquide ne existe que des pressions sup??rieures ?? 10 MPa et estim??e 4300-4700 K. Tantale carbure d'hafnium (HfC 4 5 Ta) est un compos?? r??fractaire avec un point de fusion tr??s ??lev?? de 4488 K (4215 ?? C, 7619 ?? F). ?? l'autre extr??mit?? de l'??chelle, l'h??lium ne g??le pas du tout ?? la pression normale, m??me ?? des temp??ratures infiniment proches de z??ro absolu ; pressions sup??rieures ?? 20 fois la pression atmosph??rique normale est n??cessaire.
Point de fusion mesures
Beaucoup Il existe des techniques de laboratoire pour la d??termination des points de fusion. Un banc Kofler est une bande m??tallique avec un (temp??rature ambiante de gamme ?? 300 ?? C) de gradient de temp??rature. Toute substance peut ??tre plac?? sur une section de la bande r??v??lant son comportement thermique ?? la temp??rature ?? ce point. Calorim??trie diff??rentielle ?? balayage donne des informations sur le point de fusion avec son Enthalpie de fusion.
Dispositif de point de fusion de base pour l'analyse des solides cristallins se compose d'un bain d'huile avec une fen??tre transparente (plus de conception de base: un Tube de Thiele) et une loupe simple. Les quelques grains d'un solide sont plac??s dans un tube de verre mince et partiellement immerg??es dans le bain d'huile. Le bain d'huile est chauff??e (et on l'agite) et ?? l'aide de la loupe fusion (et la source de lumi??re externe) des cristaux individuels ?? une certaine temp??rature peut ??tre observ??. Dans les dispositifs contemporains cette d??tection optique est automatis??.
Thermodynamique

Non seulement la chaleur n??cessaire pour ??lever la temp??rature de la mati??re solide ?? la temp??rature de fusion, mais la fusion lui-m??me a besoin de chaleur appel?? le chaleur de fusion.
D'un point de vue thermodynamique, au point de fusion le changement ??nergie libre de Gibbs (  ) De la mati??re est nul, car le enthalpie (
) De la mati??re est nul, car le enthalpie ( 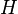 ) Et l' entropie (
) Et l' entropie (  ) Du mat??riau sont en augmentation (
) Du mat??riau sont en augmentation (  ). Point de fusion ph??nom??ne se produit lorsque l'??nergie libre de Gibbs du liquide devient inf??rieure ?? la mati??re solide de ce mat??riau. ?? diff??rentes pressions cela se produit ?? une temp??rature sp??cifique. Il peut ??galement ??tre d??montr?? que:
). Point de fusion ph??nom??ne se produit lorsque l'??nergie libre de Gibbs du liquide devient inf??rieure ?? la mati??re solide de ce mat??riau. ?? diff??rentes pressions cela se produit ?? une temp??rature sp??cifique. Il peut ??galement ??tre d??montr?? que:

Le " 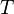 ","
"," 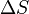 ", Et"
", Et"  "Dans ce qui pr??c??de sont respectivement la temp??rature au point de fusion, changement de l'entropie de fusion, et le changement d' enthalpie de fusion.
"Dans ce qui pr??c??de sont respectivement la temp??rature au point de fusion, changement de l'entropie de fusion, et le changement d' enthalpie de fusion.
R??gle de Carnelley
En chimie organique, la r??gle de Carnelley ??tablie en 1882 par Thomas Carnelley, stipule que haute sym??trie mol??culaire est associ??e ?? point de fusion ??lev??. Carnelley fond?? sa r??gle sur l'examen de 15 000 compos??s chimiques. Par exemple, pour trois isom??res structurels avec la formule mol??culaire C 5 H 12 les point de fusion augmente dans la s??rie isopentane -160 ?? C (113 K) n-pentane -129,8 ?? C (143 K) et n??opentane -18 ?? C (255 K). De m??me, en xyl??nes et aussi dichlorobenz??nes le point de fusion augmente dans l'ordre m??ta, ortho et para. Pyridine a une sym??trie inf??rieur benz??ne o?? son point de fusion inf??rieur, mais le point de fusion augmente ?? nouveau avec diazine et triazines. De nombreux compos??s de cage comme adamantane et cubane avec une haute sym??trie ont des points de fusion tr??s ??lev??s.
Un point de fusion ??lev?? r??sulte d'une haute chaleur de fusion ou d'une faible l'entropie de fusion ou une combinaison. Dans mol??cules hautement sym??triques la phase cristalline est dens??ment emball?? avec de nombreuses interactions intermol??culaires efficaces conduisant ?? un changement d'enthalpie plus ??lev??e lors de la fusion.

