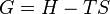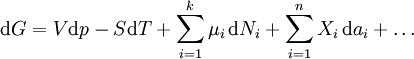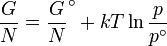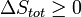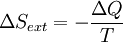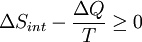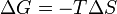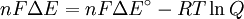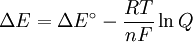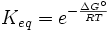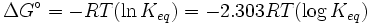??nergie libre de Gibbs
?? propos de ce ??coles s??lection Wikipedia
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . SOS Enfants a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| M??canique statistique |
|---|
 |
|
Statistiques de particules
|
Ensembles
|
|
Mod??les
|
Potentiels
|
Dans la thermodynamique , l'??nergie libre de Gibbs ( D??nomination de l'UICPA recommand??e: Gibbs l'??nergie ou la fonction de Gibbs) est un potentiel thermodynamique qui mesure le travail ??utile?? ou un processus initiant obtenue ?? partir d'un isotherme, isobare syst??me thermodynamique. Techniquement, l'??nergie libre de Gibbs est la quantit?? maximale de travail non-expansion qui peut ??tre extrait d'un syst??me ferm?? ou ce maximum peut ??tre atteint que dans un tout processus r??versible. Lorsqu'un syst??me passe d'un ??tat initial bien d??fini ?? un ??tat final bien d??fini, le Gibbs Ag de l'??nergie libre est ??gal au travail ??chang??e par le syst??me avec son environnement, moins le travail des forces de pression, lors d'une transformation r??versible du syst??me du m??me ??tat initial dans le m??me ??tat final.
??nergie de Gibbs est ??galement le potentiel chimique qui est minimis??e quand un syst??me atteint l'??quilibre ?? la pression et la temp??rature constante. En tant que tel, ce est un crit??re pratique de la spontan??it?? de processus ?? pression et temp??rature constante.
L'??nergie libre de Gibbs, appel?? ?? l'origine de l'??nergie disponible, a ??t?? d??velopp?? dans les ann??es 1870 par le physicien et math??maticien am??ricain Willard Gibbs . En 1873, dans une note, Gibbs d??fini ce qu'il a appel?? ??l'??nergie disponible" d'un corps en tant que telle:
| " | La plus grande quantit?? de travail m??canique qui peut ??tre obtenu ?? partir d'une quantit?? donn??e d'une certaine substance dans un ??tat initial donn??, sans augmenter son total de volumes ou de permettre ?? la chaleur de passer ou d'organismes ext??rieurs, sauf comme ?? la fin des processus sont gauche dans leur ??tat initial. | " |
L'??tat initial de l'organisme, selon Gibbs, est suppos??e ??tre telle que "le corps peut ??tre amen?? ?? passer de l?? ?? des ??tats de ??nergie dissip??e par processus r??versibles ". Dans son 1876 ??uvre ma??tresse Sur l'??quilibre des substances h??t??rog??nes, une analyse graphique des syst??mes chimiques multi-phases, il se est engag?? ses r??flexions sur l'??nergie libre chimique en plein.
D??finitions

L'??nergie libre de Gibbs est d??fini comme:
qui est la m??me que:
o??:
- U est la ??nergie interne ( Unit?? SI: joule)
- p est ??gal ?? pression (unit?? SI: Pascal)
- V est le volume (unit?? SI: m 3)
- T est la temp??rature (unit?? SI: kelvin )
- S est la entropie (unit?? SI: joule par kelvin)
- H est l' enthalpie (unit?? SI: joule)
L'expression de la variation r??versible infinit??simale dans l'??nergie libre de Gibbs, pour un syst??me ouvert, soumis ?? l'action des forces externes X i, qui provoquent des param??tres externes du syst??me a i ?? changer d'une valeur da i, est donn??e par:
 o??:
o??:
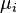 est le le potentiel chimique du i -i??me composant chimique. (Unit?? SI: joules par particule ou joules par mole)
est le le potentiel chimique du i -i??me composant chimique. (Unit?? SI: joules par particule ou joules par mole)  est le nombre de particules (ou nombre de moles) composant le composant chimique de la i.
est le nombre de particules (ou nombre de moles) composant le composant chimique de la i.
Ce est une forme de l'??quation fondamentale Gibbs. Dans l'expression infinit??simale, le terme impliquant les comptes potentiels chimiques des changements dans ??nergie libre de Gibbs r??sultant d'un afflux de particules ou de flux sortant. En d'autres termes, elle est valable pour un syst??me ouvert. Pour un syst??me ferm??, ce terme peut ??tre abandonn??e.
Ne importe quel nombre de termes suppl??mentaires peuvent ??tre ajout??es, selon le syst??me particulier consid??r??. Mis ?? part le travail m??canique , un syst??me peut en outre effectuer de nombreux autres types de travail. Par exemple, dans l'expression infinit??simale, l'??nergie de travail de contraction associ??e ?? un syst??me thermodynamique qui est une fibre contractile qui r??duit d'une quantit?? - dl sous une force f se traduirait par un FDL terme ??tant ajout??. Si une quantit?? de charge - de se acquiert par un syst??me ?? une Ψ potentiel ??lectrique, les travaux d'??lectricit?? associ??e ?? ce est de -Ψ, qui seraient inclus dans l'expression infinit??simale. Autres conditions de travail sont ajout??s selon les exigences du syst??me.
Chaque quantit?? dans les ??quations ci-dessus peut ??tre divis??e par la quantit?? de substance mesur??e dans taupes, pour former molaire ??nergie libre Gibbs. L'??nergie libre de Gibbs est l'une des fonctions thermodynamiques les plus importants pour la caract??risation d'un syst??me. Ce est un facteur d??terminant dans les r??sultats tels que la une tension de cellule ??lectrochimique, et la une constante d'??quilibre de r??action r??versible. Dans isotherme, syst??mes isobariques, ??nergie libre de Gibbs peut ??tre consid??r?? comme une quantit?? ??dynamique??, en ce qu'elle est une mesure repr??sentative des effets oppos??s des forces de enthalpiques et entropique conduite impliqu??s dans un processus thermodynamique.
La d??pendance en temp??rature de l'??nergie de Gibbs pour un gaz parfait est donn??e par la Gibbs-Helmholtz ??quation et sa pression d??pendance est donn?? par:
si le volume est connu plut??t que la pression il devient alors:
ou plus commod??ment que son potentiel chimique:
Dans les syst??mes non-id??ales, fugacit?? entre en jeu.
D??rivation
L'??nergie libre de Gibbs diff??rentielle totale en termes de variables naturelles peuvent ??tre obtenues via Legendre transforme du ??nergie interne. Pour un syst??me subissant un processus interne r??versible qui est autoris?? ?? ??changer affaire, la chaleur et le travail avec son environnement, le diff??rentiel de l'??nergie interne est donn??e de la premi??re loi de la thermodynamique que
 .
.
Parce que  ,
,  Et
Et 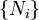 sont variables extensives, Fonction homog??ne th??or??me d'Euler permet une int??gration facile des
sont variables extensives, Fonction homog??ne th??or??me d'Euler permet une int??gration facile des 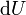 :
:
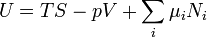 .
.
La d??finition de 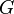 d'en haut est
d'en haut est
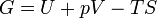 .
.
Prenant la diff??rentielle totale, nous avons
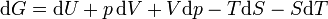 .
.
Remplacement 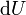 avec le r??sultat de la premi??re loi donne
avec le r??sultat de la premi??re loi donne
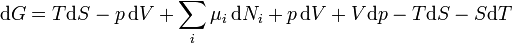
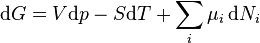 .
.
Les variables naturelles de 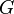 sont alors
sont alors 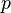 ,
, 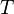 Et
Et 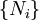 . Parce que certaines des variables naturelles sont intensifs,
. Parce que certaines des variables naturelles sont intensifs, 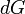 ne peuvent pas ??tre int??gr??s ?? l'aide d'Euler int??grales comme ce est le cas avec l'??nergie. Cependant, en rempla??ant simplement le r??sultat pour
ne peuvent pas ??tre int??gr??s ?? l'aide d'Euler int??grales comme ce est le cas avec l'??nergie. Cependant, en rempla??ant simplement le r??sultat pour 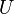 dans la d??finition de
dans la d??finition de 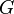 donne une expression standard pour G:
donne une expression standard pour G:
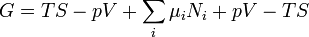
 .
.
Vue d'ensemble
De mani??re simple, en ce qui concerne STP syst??mes r??agir, un g??n??ral r??gle de base est:
| " | Chaque syst??me vise ?? atteindre un minimum d'??nergie libre. | " |
Par cons??quent, en dehors de cette tendance naturelle g??n??ral, une mesure quantitative de la fa??on dont pr??s ou de loin est une r??action potentielle de ce minimum est calcul?? lors de l'??nerg??tique du proc??d?? indiquent que le changement de Gibbs Ag ??nergie libre est n??gatif. Essentiellement, cela signifie que cette r??action est favoris??e et lib??rer de l'??nergie. L'??nergie lib??r??e est ??gale ?? la quantit?? maximale de travail qui peut ??tre effectu??e ?? la suite de la r??action chimique. Inversement, si les conditions indiqu?? une Ag positive, alors l'??nergie - sous la forme de travail - devrait ??tre ajout?? au syst??me de r??agir ?? rendre la r??action aller.
Histoire
La quantit?? appel??e "??nergie libre" est essentiellement un remplacement plus avanc??e et pr??cise pour le terme obsol??te " affinit?? ??, qui a ??t?? utilis?? par les chimistes dans les ann??es pr??c??dentes pour d??crire la?? force ??qui a provoqu?? des r??actions chimiques . Le terme d'affinit??, tel qu'il est utilis?? en relation chimique, remonte au moins au moment de Albertus Magnus en 1250.
De 1998 les manuels modernes Thermodynamique par le prix Nobel et professeur de g??nie chimique Ilya Prigogine nous trouvons:? "Comme motion a ??t?? expliqu?? par le concept newtonien de la force, les chimistes voulaient un concept similaire de?? force motrice ??pour changement chimique Pourquoi les r??actions chimiques se produisent, et pourquoi se arr??tent pas aux certains points chimistes appel?? le ' force ??qui a provoqu?? des r??actions chimiques affinit??, mais il lui manquait une d??finition claire".
Au cours du 18??me si??cle tout entier, l'opinion dominante en ce qui concerne la chaleur et de la lumi??re, ce est que mis en avant par Isaac Newton , appel?? ??l'hypoth??se de Newton", qui a d??clar?? que la lumi??re et la chaleur sont les formes de mati??re attir??s ou repouss??s par d'autres formes de la mati??re, avec analogues aux forces de gravitation ou affinit?? chimique.
Au 19??me si??cle, le chimiste fran??ais Marcellin Berthelot et le chimiste danois Julius Thomsen avait tent?? de quantifier affinit?? en utilisant chaleurs de r??action. En 1875, apr??s avoir quantifi?? les chaleurs de r??action pour un grand nombre de compos??s, Berthelot a propos?? la " principe du travail maximal "dans lequel tous les changements chimiques qui se produisent sans intervention de l'??nergie en dehors tendent vers la production de corps ou d'un syst??me de corps qui lib??rent la chaleur .
En plus de cela, en 1780 Antoine Lavoisier et Pierre-Simon Laplace ont jet?? les bases de thermochimie en montrant que la chaleur d??gag??e dans une r??action est ??gale ?? la chaleur absorb??e dans la r??action inverse. Ils ont ??galement ??tudi?? la chaleur sp??cifique et chaleur latente d'un certain nombre de substances, et les quantit??s de chaleur d??gag??e lors de la combustion. De m??me, en 1840 chimiste suisse Germain Hess formul?? le principe que le d??gagement de chaleur dans une r??action est le m??me que le proc??d?? est r??alis?? en une seule ??tape ou en plusieurs ??tapes. Ceci est connu comme La loi de Hess. Avec l'av??nement de la la th??orie m??canique de la chaleur au d??but du 19e si??cle, la loi de Hess est venu ?? ??tre consid??r?? comme une cons??quence de la loi de conservation de l'??nergie.
Sur la base de ces id??es, et d'autres Berthelot et Thomsen, ainsi que d'autres, examin?? la chaleur d??gag??e dans la formation d'un compos?? comme une mesure de l'affinit??, ou le travail effectu?? par les forces chimiques. Ce point de vue, cependant, ne ??tait pas tout ?? fait correcte. En 1847, le physicien anglais James Joule a montr?? qu'il pouvait ??lever la temp??rature de l'eau en tournant une roue ?? aubes en elle, montrant ainsi que la chaleur et le travail m??canique ??taient ??quivalentes ou proportionnelle ?? l'autre, soit environ,  . Cette d??claration est venu ?? ??tre connu sous le nom ??quivalent m??canique de la chaleur et ??tait une forme pr??curseur de la premi??re loi de la thermodynamique .
. Cette d??claration est venu ?? ??tre connu sous le nom ??quivalent m??canique de la chaleur et ??tait une forme pr??curseur de la premi??re loi de la thermodynamique .
En 1865, le physicien allemand Rudolf Clausius avait montr?? que ce principe d'??quivalence n??cessaire amendement. Autrement dit, on peut utiliser la chaleur provenant d'un r??action de combustion dans un four ?? charbon pour faire bouillir l'eau, et d'utiliser cette chaleur pour vaporiser la vapeur, puis utiliser l'??nergie ?? haute pression accrue de la vapeur vaporis?? pour pousser un piston. Ainsi, nous pourrions na??vement raison que l'on peut tout ?? convertir la chaleur de combustion initiale de la r??action chimique dans le travail de pousser le piston. Clausius a montr??, cependant, que nous devons prendre en compte le travail que les mol??cules de l'organe de travail, ?? savoir les mol??cules d'eau dans le cylindre, le faire sur l'autre lors de leur passage ou transformer d'une ??tape ou ??tat de la cycle du moteur ?? l'autre, par exemple ?? partir de (P1, V1) ?? (P2, V2). Clausius origine appel?? cela le ??contenu de transformation" du corps, et puis plus tard a chang?? le nom de l'entropie . Ainsi, la chaleur utilis??e pour transformer le corps de travail de mol??cules d'un ??tat ?? l'autre ne peut pas ??tre utilis?? pour faire un travail externe, par exemple pour pousser le piston. Clausius d??fini cette chaleur de transformation que dQ = TDS.
En 1873, Willard Gibbs publi?? une m??thode de repr??sentation g??om??trique des propri??t??s thermodynamiques des substances au moyen de surfaces dans laquelle il a pr??sent?? le plan pr??liminaire des principes de sa nouvelle ??quation permettant de pr??dire ou estimer les tendances de divers processus naturels de se ensuivre quand les corps ou les syst??mes sont mis en contact. En ??tudiant les interactions de substances homog??nes en contact, ce est ?? dire les corps, ??tant dans la composition partie solide, partie liquide, et une partie de la vapeur, et en utilisant un trois dimensions du volume - entropie - graphe int??rieur de l'??nergie, Gibbs ??tait en mesure de d??terminer trois ??tats d'??quilibre, ce est ?? dire ??n??cessairement stable??, ??neutre?? et ??instable??, et si oui ou non les changements se ensuivra. En 1876, Gibbs construit sur ce cadre en introduisant le concept de potentiel chimique afin de tenir compte des r??actions chimiques et des ??tats d'organes qui sont chimiquement diff??rents de l'autre. Dans ses propres mots, pour r??sumer ses r??sultats en 1873, Gibbs d??clare:
Dans cette description, tel qu'il est utilis?? par Gibbs, ε se r??f??re ?? la l'??nergie interne du corps, η se r??f??re ?? la entropie du corps, et ν est le le volume du corps.
Ainsi, en 1882, apr??s l'introduction de ces arguments par Clausius et Gibbs, le scientifique allemand Helmholtz a indiqu??, ?? l'encontre de l'hypoth??se de Berthelot et Thomas que l'affinit?? chimique est une mesure de la chaleur de r??action de la r??action chimique bas?? sur le principe du travail maximal, que l'affinit?? ne est pas la chaleur d??gag??e dans la formation d'un compos?? mais elle est la plus grande quantit?? de travail qui peut ??tre obtenu lorsque la r??action est r??alis??e de mani??re r??versible, par exemple le travail dans une cellule ??lectrique r??versible. Le travail maximale est donc consid??r??e comme la diminution de la libert??, ou disponible, l'??nergie du syst??me (??nergie libre de Gibbs G ?? T = constante, P = constante ou Helmholtz ??nergie libre F ?? T = constante, V = constante), tandis que le chaleur d??gag??e est habituellement une mesure de la diminution de l'??nergie totale du syst??me ( ??nergie interne). Ainsi, G ou F est la quantit?? d'??nergie ??gratuite?? pour les travaux dans les conditions donn??es.
Jusqu'?? ce point, l'avis g??n??ral a ??t?? telle que: "toutes les r??actions chimiques en voiture le syst??me ?? un ??tat d'??quilibre dans lequel les affinit??s des r??actions disparaissent". Au cours des 60 prochaines ann??es, l'affinit?? terme est venu pour ??tre remplac?? par l'??nergie libre terme. Selon l'historien de la chimie Henry Leicester, l'influent 1923 manuel Thermodynamique et l'??nergie libre de r??actions chimiques par Gilbert N. Lewis et Merle Randall a conduit au remplacement du terme ??affinit???? par le terme ????nergie libre?? dans une grande partie du monde anglo-saxon.
Que signifie le terme ??libre?? signifie?
Dans les 18e et 19e si??cles, le th??orie de la chaleur, ce est ?? dire que la chaleur est une forme d'??nergie ayant rapport ?? un mouvement vibratoire, commen??ait ?? supplanter la fois le th??orie calorique, ce est ?? dire que la chaleur est un fluide, et la quatre th??orie de l'??l??ment dans lequel la chaleur est le plus l??ger des quatre ??l??ments. Beaucoup de manuels scolaires et des articles d'enseignement au cours de ces si??cles pr??sent??s ces th??ories c??te ?? c??te. De m??me, au cours de ces ann??es, la chaleur commen??ait ?? se distinguer en diff??rentes cat??gories de classification, tels que, "production combin??e de chaleur" "la chaleur libre??, ??la chaleur rayonnante??, chaleur sp??cifique, la capacit?? de la chaleur, "la chaleur absolue", "calorique latent??, ??libre?? ou ??perceptible?? calorique (calorique sensible), entre autres.
En 1780, par exemple, Laplace et Lavoisier a d??clar??: ??En g??n??ral, on peut changer la premi??re hypoth??se dans la seconde en changeant les mots de la chaleur libre, production combin??e de chaleur et chaleur lib??r??e?? en ?? . vis viva, perte de force vive, et l'augmentation de la force vive ??De cette mani??re, la masse totale de calories dans un corps, appel?? la chaleur absolue, a ??t?? consid??r?? comme un m??lange de deux composants; le calorique libre ou perceptible pourrait affecter un thermom??tre tandis que l'autre composante, le calorique latent, ne pouvait pas. L'utilisation des mots "chaleur latente" impliquait une similitude ?? la chaleur latente dans le sens le plus courant; il a ??t?? consid??r?? comme li?? chimiquement aux mol??cules de l'organisme. Dans le adiabatique compression d'un gaz la chaleur absolue est rest??e constante par la hausse de la temp??rature observ??e, indiquant que certains calorique latente ??tait devenu ??libre?? ou perceptible.
Au d??but du 19??me si??cle, le concept de calorique perceptible ou libre a commenc?? ?? ??tre appel?? ??la chaleur libre?? ou chaleur d??gag??e. En 1824, par exemple, le physicien fran??ais Sadi Carnot, dans ses c??l??bres ??R??flexions sur la puissance motrice du feu", parle de quantit??s de chaleur 'absorb??e ou lib??r??s ??dans diff??rentes transformations. En 1882, le physicien et physiologiste allemand Hermann von Helmholtz a invent?? l'expression ????nergie libre?? pour l'expression E - TS, dans lequel le changement de F (ou G) d??termine la quantit?? d' ??nergie ??gratuite?? pour les travaux dans les conditions donn??es.
Ainsi, dans l'utilisation traditionnelle, le terme ??libre?? a ??t?? fix?? ?? ??nergie libre de Gibbs, ce est ?? dire pour les syst??mes ?? pression et temp??rature constante, ou Helmholtz ??nergie libre, ce est ?? dire pour les syst??mes ?? volume constant et la temp??rature, pour signifier ??disponibles sous la forme de un travail utile. ?? En r??f??rence ?? l'??nergie libre de Gibbs, nous ajoutons la qualification que ce est l'??nergie libre pour le travail non-volume.
Un nombre croissant de livres et articles de journaux ne incluent pas la pi??ce jointe "libre", se r??f??rant ?? G comme simplement de l'??nergie Gibbs (et de m??me pour le L'??nergie de Helmholtz). Ceci est le r??sultat d'un 1988 R??union UICPA pour r??gler terminologies unifi??es pour la communaut?? scientifique internationale, dans laquelle l'adjectif ??libre?? aurait ??t?? banni. Cette norme, toutefois, n'a pas encore ??t?? universellement adopt??, et de nombreux articles publi??s et les livres comprennent toujours le descriptif ??libre??.
??nergie libre de r??actions
Pour calculer l'??quation de l'??nergie libre de Gibbs pour une syst??me isol??, laissez S tot ??tre l'entropie totale de la syst??me isol??, ce est un syst??me qui ne peut pas ??changer de la chaleur ou de masse avec son environnement. Selon la seconde loi de la thermodynamique :
et si  alors le processus est r??versible. Le transfert de chaleur
alors le processus est r??versible. Le transfert de chaleur 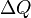 dispara??t pour un syst??me adiabatique. Tout processus adiabatique qui est ??galement r??versible est appel?? isentropique
dispara??t pour un syst??me adiabatique. Tout processus adiabatique qui est ??galement r??versible est appel?? isentropique  processus.
processus.
Consid??rons maintenant les syst??mes diabatiques, ayant interne entropie S int. Un tel syst??me est reli?? thermiquement ?? son environnement, qui ont entropie S ext. La forme d'entropie de la deuxi??me loi ne se applique pas directement au syst??me diabatique, elle se applique uniquement au syst??me ferm?? form?? par le syst??me et ses environs. Par cons??quent, un processus est possible si
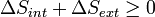 .
.
Nous allons essayer d'exprimer le c??t?? gauche de cette ??quation enti??rement en termes de fonctions de l'??tat ΔS poste est d??fini comme.:
La temp??rature T est la m??me pour deux syst??mes en ??quilibre thermique. Par le Principe z??ro de la thermodynamique, si un syst??me est en ??quilibre thermique avec un second et un troisi??me syst??me, ces deux derniers sont en ??quilibre aussi bien. Aussi, 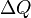 est la chaleur transf??r??e au syst??me, de sorte que
est la chaleur transf??r??e au syst??me, de sorte que 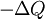 est la chaleur transf??r??e ?? l'environnement, et -ΔQ / T est acquise par entropie les environs. Nous avons maintenant:
est la chaleur transf??r??e ?? l'environnement, et -ΔQ / T est acquise par entropie les environs. Nous avons maintenant:
Multipliez les deux c??t??s par T:
AQ est la chaleur transf??r??e vers le syst??me; si le processus est maintenant suppos?? ??tre isobarique, puis AQ p = AH:
AH est la variation d'enthalpie de la r??action (pour une r??action chimique ?? pression constante et de la temp??rature). Puis
pour un processus possible. Laissez le changement Δ G ??nergie libre de Gibbs ??tre d??finie comme
 (Eq.1)
(Eq.1)
Notez qu'il ne est pas d??fini en termes de toutes les fonctions de l'??tat externes, tels que Δ S poste ou Δ S tot. Puis la seconde loi devient, qui nous parle aussi de la spontan??it?? de la r??action:
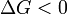 r??action favoris??e (spontan??e)
r??action favoris??e (spontan??e) 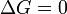 Ni l'avant ni la r??action inverse pr??vaut ( Equilibrium )
Ni l'avant ni la r??action inverse pr??vaut ( Equilibrium ) 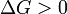 r??action d??favoris??e (Nonspontaneous)
r??action d??favoris??e (Nonspontaneous)
??nergie libre de Gibbs G se est d??fini comme
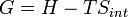 (Eq.2)
(Eq.2)
Mais remarquez que, pour obtenir l'??quation (2) de l'??quation (1) nous devons supposer que T est constante. Ainsi, ??nergie libre de Gibbs est tr??s utile pour des proc??d??s thermochimiques ?? temp??rature constante et la pression: les deux isothermes et isobares. Ces processus ne se d??placent pas sur un P - T diagramme, tels que le changement de phase d'un corps pur, qui se d??roule ?? la pression de saturation et la temp??rature. Les r??actions chimiques, cependant, ne subissent des changements dans le potentiel chimique, qui est une fonction d'??tat. Ainsi, les processus thermodynamiques ne se limitent pas aux deux dimensions P - V diagramme. Il existe une troisi??me dimension de n, la quantit?? de gaz. Naturellement pour l'??tude des produits chimiques explosifs, les proc??d??s ne sont pas n??cessairement isotherme et isobare. Pour ces ??tudes, ??nergie libre est utilis??.
Si un syst??me ferm?? (Δ Q = 0) est ?? pression constante (Δ Q = Δ H), puis
Par cons??quent, l'??nergie libre d'un syst??me ferm?? est:
et si 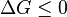 alors cela signifie que
alors cela signifie que  , ?? l'endroit o?? nous avons commenc?? la d??rivation de Δ G.
, ?? l'endroit o?? nous avons commenc?? la d??rivation de Δ G.
Identit??s utiles
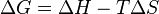 ?? temp??rature constante
?? temp??rature constante 
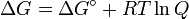
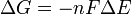
et r??arrangement donne
qui concerne le potentiel ??lectrique d'une r??action au coefficient d'??quilibre de cette r??action.
o??
Δ G = changement ??nergie libre de Gibbs, Δ H = changement dans enthalpie , T = absolue temp??rature , Δ S = changement de l'entropie , R = constante des gaz, ln = logarithme naturel , K = la constante d'??quilibre, Q = quotient de r??action, n = nombre d' ??lectrons par produit taupe, F = Constante de Faraday ( coulombs par mole), et Δ E = le potentiel ??lectrique de la r??action. En outre, nous avons aussi:
qui concerne l'??quilibre constant avec ??nergie libre de Gibbs.
Changement standard de formation
L'??nergie libre de Gibbs norme de formation d'un compos?? est le changement de l'??nergie libre de Gibbs qui accompagne la formation d'une mole de cette substance ?? partir de ses ??l??ments constitutifs, ?? leur ??tats standards (la forme la plus stable de l'??l??ment ?? 25 degr??s Celsius et 100 kilopascals). Son symbole est Δ G f O.
Tous les ??l??ments dans leurs ??tats standard ( oxyg??ne , gaz graphite, etc.) ont 0 changement d'??nergie norme Gibbs libre de formation, car il n'y a pas de changement en cause.
- Δ G = Δ G ˚ + RT ln Q
A l'??quilibre, Δ G = 0 et Q = K donc l'??quation devient Δ G ˚ = - RT ln K
Table des mati??res s??lectionn??s
| Substance | ??tat | Δ G ˚ ( cal / mol) |
|---|---|---|
| NH 3 | g | -3,976 |
| H 2 O | lq | -56,69 |
| H 2 O | g | -54,64 |
| CO 2 | g | -94,26 |
| CO | g | -32,81 |
| CH 4 | g | -12,14 |
| C 2 H 6 | g | -7,86 |
| C 3 H 8 | g | -5,614 |
| C 8 H 18 | g | 4.14 |
| C 10 H 22 | g | 8,23 |