
Thermodynamique
Saviez-vous ...
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. enfants SOS est le plus grand don de charit?? du monde enfants orphelins et abandonn??s la chance de la vie familiale.
Thermodynamique (du grec θερμη, therme, qui signifie ?? chaleur ??et δυναμις, dunamis, sens" pouvoir ") est une branche de la physique et est largement utilis?? dans la chimie . Thermodynamique ??tudie les effets des changements dans la temp??rature , la pression et le volume de syst??mes physiques ?? la ??chelle macroscopique en analysant le mouvement collectif de leurs particules en utilisant les statistiques . En gros, la chaleur signifie "??nergie en transit?? et la dynamique se rapporte ?? ??mouvement??; Ainsi, en thermodynamique essence ??tudie le mouvement de l'??nergie et comment l'??nergie insuffle mouvement. Historiquement, la thermodynamique d??velopp?? par n??cessit?? d'augmenter la l'efficacit?? des premiers moteurs ?? vapeur .
Le point de d??part de la plupart des consid??rations thermodynamiques sont les lois de la thermodynamique, qui postulent que l'??nergie peuvent ??tre ??chang??s entre les syst??mes physiques comme la chaleur ou le travail . Ils postulent ??galement l'existence d'une quantit?? appel??e entropie , qui peut ??tre d??finie pour chaque syst??me. En thermodynamique, les interactions entre les grands ensembles d'objets sont ??tudi??s et class??s. Au centre de ce sont les concepts de syst??me et environnement. Un syst??me est compos?? de particules, dont les mouvements moyenne d??finir ses propri??t??s, qui ?? leur tour sont li??s les uns aux autres par le biais ??quations d'??tat. Les propri??t??s peuvent ??tre combin??es pour exprimer l'??nergie et potentiels thermodynamiques, qui sont utiles pour la d??termination des conditions pour ??quilibre et processus spontan??s.
Avec ces outils, la thermodynamique d??crit comment les syst??mes r??pondent aux changements dans leur environnement. Ceci peut ??tre appliqu?? ?? une grande vari??t?? de sujets dans la science et l'ing??nierie , tels que moteurs, les transitions de phase, r??actions chimiques , ph??nom??nes de transport, et m??me des trous noirs . Les r??sultats de la thermodynamique sont indispensables pour d'autres domaines de la physique et la chimie , g??nie chimique, g??nie a??rospatial, g??nie m??canique , la biologie cellulaire, g??nie biom??dical, la science des mat??riaux , et de l'??conomie pour ne en nommer que quelques-uns.
Histoire

L'histoire de la thermodynamique comme une discipline scientifique commence g??n??ralement par Otto von Guericke, qui en 1650 a construit et con??u le premier au monde pompe ?? vide et cr???? premi??re au monde vide (connu sous le nom H??misph??res de Magdebourg). Guericke a ??t?? conduit ?? faire un vide afin de r??futer Aristote 'hypoth??se de longue date s que ??la nature a horreur du vide??. Peu de temps apr??s Guericke, le physicien irlandais et chimiste Robert Boyle avait appris des desseins de Guericke et en 1656, en coordination avec le scientifique anglais Robert Hooke, construit une pompe ?? air. L'utilisation de cette pompe, Boyle et Hooke not?? une corr??lation entre la pression, la temp??rature et le volume. ?? l'heure, La loi de Boyle a ??t?? formul??e, qui stipule que la pression et le volume sont inversement proportionnelles. Puis, en 1679, sur la base de ces concepts, un associ?? de Boyle nomm?? Denis Papin construit un digesteur osseuse, qui ??tait un r??cipient ferm?? avec un couvercle herm??tique qui limite la vapeur jusqu'?? une pression ??lev??e a ??t?? g??n??r??.
Conceptions plus tard mis en ??uvre une soupape de d??charge de vapeur qui a gard?? la machine d'exploser. En regardant la vanne rythmiquement monter et descendre, Papin con??u l'id??e d'un piston et un moteur de cylindre. Il n'a pas, cependant, suivre ?? travers avec son design. N??anmoins, en 1697, sur la base des mod??les de Papin, ing??nieur Thomas Savery a construit le premier moteur. Bien que ces premiers moteurs ??taient rudimentaires et inefficaces, ils ont attir?? l'attention des principaux scientifiques de l'??poque. Parmi ces scientifiques ??tait Sadi Carnot, le ??p??re de la thermodynamique", qui a publi?? en 1824 R??flexions sur la puissance motrice du feu, un discours sur la chaleur, la puissance et l'efficacit?? du moteur. Le document d??crit les relations ??nerg??tiques de base entre le Machine de Carnot, le Cycle de Carnot, et La force motrice. Cela marque le d??but de la thermodynamique comme une science moderne.
La thermodynamique terme a ??t?? invent?? par James Joule en 1858 pour d??signer la science des relations entre la chaleur et pouvoir. En 1849, "thermo-dynamique", comme un terme fonctionnel, a ??t?? utilis?? dans L'article de William Thomson Un compte de la th??orie de Carnot de la puissance motrice de la chaleur. Le premier manuel thermodynamique a ??t?? ??crit en 1859 par William Rankine, ?? l'origine une formation de physicien et professeur de g??nie civil et m??canique ?? la Universit?? de Glasgow.
Les lois de la thermodynamique
En thermodynamique, il ya quatre lois de validit?? tr??s g??n??rale, et comme tels, ils ne d??pendent pas sur les d??tails des interactions ou les syst??mes ??tudi??s. Par cons??quent, ils peuvent ??tre appliqu??s aux syst??mes dont on ne sait rien d'autre que le solde de l'??nergie et de la mati??re de transfert. Les exemples comprennent Einstein pr??diction de l 'de ??mission spontan??e autour de la fin du 20??me si??cle et les recherches actuelles sur la thermodynamique des trous noirs .
Les quatre lois sont:
- Principe z??ro de la thermodynamique, indiquant que ??quilibre thermodynamique est une relation d'??quivalence .
- Si deux syst??mes thermodynamiques sont s??par??ment en ??quilibre thermique avec un troisi??me, ils sont ??galement en ??quilibre thermique avec l'autre.
- Premi??re loi de la thermodynamique , de la conservation de l'??nergie
- Deuxi??me loi de la thermodynamique , ?? propos de l'entropie
- L'entropie totale de tout syst??me thermodynamique isol?? tend ?? augmenter au fil du temps, l'approche d'une valeur maximale.
- En tant que syst??me approche asymptotiquement de z??ro absolu de temp??rature cesse pratiquement tous les processus et l'entropie du syst??me se approche de mani??re asymptotique une valeur minimale; a ??galement d??clar?? que: "l'entropie de tous les syst??mes et de tous les Etats d'un syst??me est nulle au z??ro absolu?? ou ??quivalente "il est impossible d'atteindre le z??ro absolu de temp??rature par un nombre fini de processus".
- Relations r??ciproques Onsager (parfois appel?? la quatri??me loi de la thermodynamique)
- Exprimez l'??galit?? de certaines relations entre les flux et les forces de syst??mes thermodynamiques sur ??quilibre, mais o?? la notion de ??quilibre local existe.
- Voir aussi: Condensat de Bose-Einstein et temp??rature n??gative.
Potentiels thermodynamiques
Comme on peut le d??riv?? de l'??quation du bilan d'??nergie (ou de l'??quation Burks) sur un syst??me thermodynamique il existe des quantit??s ??nerg??tiques appel??s potentiels thermodynamiques, qui constitue la mesure quantitative de l'??nergie stock??e dans le syst??me. Les cinq potentiels les plus connus sont:
| L'??nergie interne | 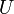 |
| ??nergie libre | 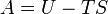 |
| Enthalpie | 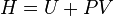 |
| ??nergie libre de Gibbs | 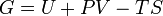 |
| Grand potentiel |  |
Autres potentiels thermodynamiques peuvent ??tre obtenus par Transformation de Legendre. Potentiels sont utilis??s pour mesurer les changements d'??nergie dans les syst??mes ?? mesure qu'ils ??voluent d'un ??tat initial ?? un ??tat final. Le potentiel utilis?? d??pend des contraintes du syst??me, comme la temp??rature ou la pression constante. L'??nergie est l'??nergie interne du syst??me, enthalpie est l'??nergie interne du syst??me plus l'??nergie li??s au travail pression-volume et Helmholtz et Gibbs l'??nergie sont les ??nergies disponibles dans un syst??me de faire un travail utile lorsque la temp??rature et le volume ou la pression et la temp??rature sont fix??es, respectivement.
Thermodynamique classique
La thermodynamique classique est l'original des ann??es 1800 au d??but variation de la thermodynamique avec les ??tats concern??s, et les propri??t??s thermodynamiques que l'??nergie, le travail et la chaleur, et avec les lois de la thermodynamique, tout manque une interpr??tation atomique. Dans la forme pr??curseur, la thermodynamique classique d??rive de chimiste Robert Boyle de 1662 postulat que la pression P d'une quantit?? donn??e de gaz varie en raison inverse de son volume V ?? temp??rature constante; ce est ?? dire sous forme d'??quation: PV = k, une constante. De l??, un semblant de thermo-science a commenc?? ?? se d??velopper avec la construction des premiers moteurs ?? vapeur atmosph??riques succ??s en Angleterre par Thomas Savery en 1697 et Thomas Newcomen en 1712. Les premi??re et deuxi??me lois de la thermodynamique ??merg?? simultan??ment dans les ann??es 1850, principalement ?? partir des travaux de William Rankine, Rudolf Clausius, et William Thomson (Lord Kelvin).
Thermodynamique statistique
Avec le d??veloppement des th??ories atomiques et mol??culaires ?? la fin des ann??es 1800 et au d??but des ann??es 1900, la thermodynamique a ??t?? donn?? une interpr??tation mol??culaire. Ce champ est appel?? thermodynamique statistique, qui peut ??tre consid??r?? comme un pont entre les propri??t??s macroscopiques et microscopiques des syst??mes. Essentiellement, la thermodynamique statistique est une approche de la thermodynamique situ??s sur la m??canique statistique , qui met l'accent sur la d??rivation des r??sultats macroscopiques de premiers principes. Il peut ??tre oppos?? ?? son pr??d??cesseur historique thermodynamique ph??nom??nologiques , qui donne des descriptions scientifiques de ph??nom??nes en ??vitant des d??tails microscopiques. L'approche statistique est de tirer toutes les propri??t??s macroscopiques (temp??rature, volume, la pression, l'??nergie, l'entropie, etc.) ?? partir des propri??t??s des particules en mouvement constitutifs et les interactions entre eux (y compris les ph??nom??nes quantiques). Il se est r??v??l?? ??tre tr??s efficace et, partant, est couramment utilis??.
Thermodynamique chimique
Thermodynamique chimique est l'??tude de l'interrelation de la chaleur avec des r??actions chimiques ou avec un changement physique de Etat dans les limites de la lois de la thermodynamique. Pendant les ann??es 1873 ?? 1876 de l'American physicien math??maticien Josiah Willard Gibbs a publi?? une s??rie de trois articles, le plus c??l??bre ??tant Sur l'??quilibre des substances h??t??rog??nes, dans lequel il a montr?? comment processus thermodynamiques pourraient ??tre analys??es graphiquement, par l'??tude de l' ??nergie , l'entropie , le volume , la temp??rature et pression de la syst??me thermodynamique, de mani??re ?? d??terminer si un processus se produire spontan??ment. Au d??but du 20e si??cle, les chimistes tels que Gilbert N. Lewis, Merle Randall, et EA Guggenheim a commenc?? ?? appliquer les m??thodes math??matiques de Gibbs ?? l'analyse des processus chimiques.
Syst??mes thermodynamiques

Un concept important en thermodynamique est le ??syst??me??. Tout dans l'univers ?? l'exception du syst??me est connu sous environnement. Un syst??me est la r??gion de l'univers ??tudi??. Un syst??me est s??par??e du reste de l'univers par un limite qui peut ??tre imaginaire ou pas, mais qui, par convention d??limite un volume fini. Les ??changes possibles de travail , la chaleur ou la mati??re entre le syst??me et l'environnement ont lieu dans cette limite. Les fronti??res sont de quatre types: fixe, mobile, r??els et imaginaires.
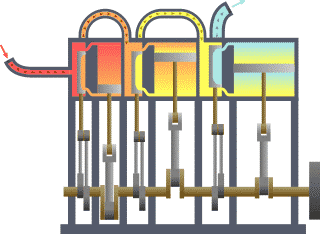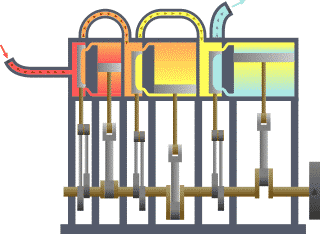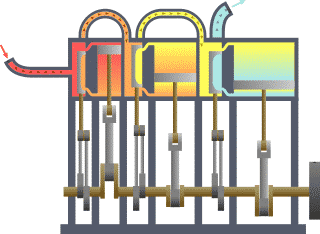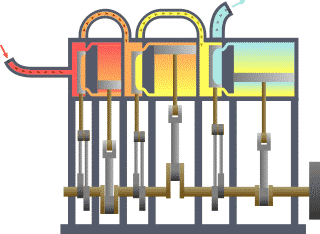
Fondamentalement, la ??fronti??re?? est tout simplement une ligne imaginaire trac??e en pointill??s autour d'un volume de quelque chose quand il va y avoir un changement dans la ??nergie interne de ce quelque chose. Tout ce qui passe ?? travers la fronti??re qui effectue un changement dans l'??nergie interne de la quelque chose doit ??tre pris en compte dans l'??quation de l'??quilibre ??nerg??tique. Ce quelque chose peut ??tre la r??gion volum??trique entourant un seul atome de r??sonance de l'??nergie, tels que Max Planck d??fini en 1900; il peut ??tre un corps de vapeur ou d'air dans un moteur ?? vapeur , tel que Sadi Carnot d??fini en 1824; il peut ??tre le corps d'un cyclone tropical , tel que Kerry Emanuel th??oris?? en 1986 dans le domaine de thermodynamique de l'atmosph??re; il peut aussi ??tre simplement une nucl??ide (ie un syst??me de quarks ) comme certains sont actuellement en th??orisant thermodynamique quantique.
Pour un moteur, une limite fixe moyen de piston est verrouill?? dans sa position; en tant que tel, un proc??d?? ?? volume constant se produit. Dans ce m??me moteur, une limite mobile permet au piston de se d??placer dans et hors. Pour les syst??mes ferm??s, les fronti??res sont r??els tandis que pour syst??me ouvert les fronti??res sont souvent imaginaires. Il existe cinq classes dominantes de syst??mes:
- Syst??mes isol??s - la mati??re et l'??nergie ne peut pas traverser la fronti??re
- Syst??mes adiabatique - la chaleur ne doivent pas traverser la fronti??re
- Syst??mes diathermiques - chaleur peut traverser limite
- Les syst??mes ferm??s - la mati??re ne peuvent pas traverser la fronti??re
- Open Systems - la chaleur, le travail, et la mati??re peuvent franchir la fronti??re (souvent appel?? contr??le du volume dans ce cas)
Comme le temps passe dans un syst??me isol??, les diff??rences internes dans le syst??me ont tendance ?? ??galiser et les pressions et les temp??ratures ont tendance ?? ??galiser, comme les diff??rences de densit??. Un syst??me dans lequel tous les processus d'??galisation ont disparu pratiquement ?? son terme, est consid??r?? comme ??tant dans un ??tat de l'??quilibre thermodynamique.
Dans l'??quilibre thermodynamique, les propri??t??s d'un syst??me sont, par d??finition, immuable dans le temps. Syst??mes en ??quilibre sont beaucoup plus simple et plus facile ?? comprendre que les syst??mes qui ne sont pas en ??quilibre. Souvent, lorsque l'analyse d'un processus thermodynamique, on peut supposer que chaque ??tat interm??diaire dans le processus est ?? l'??quilibre. Cela permettra ??galement de simplifier consid??rablement la situation. Processus thermodynamiques qui se d??veloppent assez lentement pour permettre ?? chaque ??tape interm??diaire pour ??tre un ??tat d'??quilibre sont dits processus r??versible.
Param??tres thermodynamiques
Le concept central de la thermodynamique est celui de l'??nergie , la capacit?? de faire le travail. Comme stipul?? par la premi??re loi , l'??nergie totale du syst??me et de ses environs est conserv??e. Il peut ??tre transf??r?? dans un corps par chauffage, compression, ou l'ajout de la mati??re, et extrait d'un corps soit par refroidissement, l'expansion ou l'extraction de la mati??re. A titre de comparaison, en m??canique, des r??sultats de transfert d'??nergie ?? partir d'une force qui provoque le d??placement, le produit des deux ??tant la quantit?? d'??nergie transf??r??e. De la m??me mani??re, les syst??mes thermodynamiques peuvent ??tre consid??r??s comme le transfert d'??nergie ?? la suite d'une force provoquant un d??placement g??n??ralis?? g??n??ralis??e, avec le produit des deux ??tant la quantit?? d'??nergie transf??r??e. Ces paires force d??placement thermodynamiques sont connus comme les variables conjugu??. Les variables thermodynamiques conjugu??es plus courants sont les pression-volume (param??tres m??caniques), la temp??rature-entropie (param??tres thermiques), et le nombre potentiel particules chimiques (param??tres mat??riels).
Instruments thermodynamiques
Il existe deux types d'instruments thermodynamiques, l'appareil de mesure et le r??servoir. Un compteur thermodynamique est tout dispositif qui mesure tous les param??tres d'un syst??me thermodynamique. Dans certains cas, le param??tre thermodynamique est en fait d??fini en termes d'un appareil de mesure id??alis??e. Par exemple, le droit z??ro indique que si deux corps sont en ??quilibre thermique avec un troisi??me corps, ils sont ??galement en ??quilibre thermique avec l'autre. Ce principe, comme l'a not?? James Maxwell en 1872, affirme qu'il est possible de mesurer la temp??rature. Un id??alis??e thermom??tre est un ??chantillon d'un gaz parfait ?? pression constante. Du loi des gaz parfaits PV = nRT, le volume d'un tel ??chantillon peut ??tre utilis?? comme un indicateur de temp??rature; de cette mani??re, il d??finit la temp??rature. Bien que la pression est d??finie m??caniquement, un dispositif de mesure de pression, appel??e barom??tre peut ??galement ??tre construit ?? partir d'un ??chantillon d'un gaz id??al maintenu ?? une temp??rature constante. Un calorim??tre est un appareil qui est utilis?? pour mesurer et d??finir l'??nergie interne d'un syst??me.
Un r??servoir thermodynamique est un syst??me qui est si grande qu'elle ne modifie pas sensiblement ses param??tres d'??tat lorsqu'il est mis en contact avec le syst??me de test. Il est utilis?? pour imposer une valeur particuli??re d'un param??tre d'??tat sur le syst??me. Par exemple, un accumulateur de pression est un syst??me ?? une pression particuli??re, ce qui impose que la pression sur un syst??me de test qui est reli?? m??caniquement. L'atmosph??re de la terre est souvent utilis?? comme un r??servoir de pression.
Il est important que ces deux types d'instruments sont distincts. Un compteur ne effectue pas sa t??che avec pr??cision se il se comporte comme un r??servoir de la variable d'??tat qu'il cherche ?? mesurer. Si, par exemple, d'un thermom??tre, d'agir comme un r??servoir de temp??rature cela modifie la temp??rature du syst??me ??tant mesur??e, et la lecture serait erron??e. Id??al m??tres ne ont aucun effet sur les variables d'??tat du syst??me qu'ils mesurent.
??tats thermodynamiques
Quand un syst??me est ?? l'??quilibre dans un ensemble donn?? de conditions, il est dit ??tre dans un ??tat d??fini. L'??tat du syst??me peut ??tre d??crit par un certain nombre de variables intensives et des variables extensives. Les propri??t??s du syst??me peut ??tre d??crit par un ??quation d'??tat qui sp??cifie la relation entre ces variables. ??tat peut ??tre consid??r?? comme la description quantitative instantan??e d'un syst??me avec un num??ro de s??rie de variables maintenu constant
Processus thermodynamiques
Proc??d?? thermodynamique peut ??tre d??finie comme l'??volution dynamique d'un syst??me thermodynamique passer d'un ??tat initial ?? un ??tat final. Typiquement, chaque processus thermodynamique se distingue des autres processus, ?? caract??re ??nergique, selon quels param??tres, comme la temp??rature, la pression ou le volume, etc., sont maintenues fixes. En outre, il est utile de regrouper ces processus en paires, dans lequel chaque variable maintenue constante est un membre d'une paire conjugu??. Les sept processus thermodynamiques plus courantes sont indiqu??es ci-dessous:
- Une processus isobarique se produit ?? une pression constante.
- Une processus isochore ou processus isom??trique / isovolum??trique, se produit ?? volume constant.
- Une Proc??d?? isotherme se effectue ?? une temp??rature constante.
- Une processus adiabatique se produit sans perte ou le gain de chaleur.
- Une processus isentropique (proc??d?? adiabatique r??versible) se produit ?? une entropie constante.
- Une isenthalpique processus se produit ?? une enthalpie constante.
- Un processus de l'??tat d'??quilibre se produit sans un changement dans l'??nergie interne d'un syst??me.

