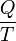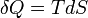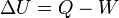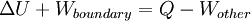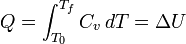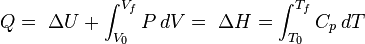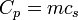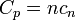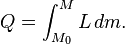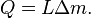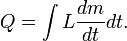Chaleur
Saviez-vous ...
Enfants SOS b??n??voles ont aid?? ?? choisir des articles et faites autre mat??riel de programme de parrainage d'enfants aide les enfants du monde en d??veloppement ?? apprendre aussi.
Dans la physique , de la chaleur, symbolis?? par Q, est l'??nergie transf??r??e d'un organisme ou syst??me ?? l'autre en raison d'une diff??rence de temp??rature . En thermodynamique , une quantit?? de TDS est utilis?? comme une mesure repr??sentative de la chaleur, qui est la temp??rature absolue d'un objet multipli?? par la quantit?? diff??rentielle d'un syst??me de l'entropie mesur??e ?? la limite de l'objet. La chaleur peut se ??couler spontan??ment ?? partir d'un objet avec une temp??rature ??lev??e pour un objet avec une temp??rature inf??rieure. Le transfert de chaleur d'un objet ?? un autre objet ?? une temp??rature ??gale ou sup??rieure peut se produire uniquement ?? l'aide d'un pompe ?? chaleur. Organismes de temp??rature ??lev??e, qui aboutissent souvent ?? des taux ??lev??s de transfert de chaleur, peut ??tre cr???? par des r??actions chimiques (tels que br??lure), r??actions nucl??aires (tels que la fusion qui a lieu ?? l'int??rieur du Soleil ), ??lectromagn??tique dissipation (comme dans cuisini??res ??lectriques), ou dissipation m??canique (tels que frottement). La chaleur peut ??tre transf??r??e entre des objets par rayonnement, conduction et convection. Temp??rature est utilis??e comme une mesure de l'??nergie interne ou enthalpie , ce est le niveau de mouvement primaire donnant lieu ?? un transfert de chaleur. La chaleur ne peut ??tre transf??r?? entre les objets, ou des zones dans un objet, avec des temp??ratures diff??rentes (comme indiqu?? par le Principe z??ro de la thermodynamique), puis, en l'absence de travaux, uniquement dans la direction du corps froid (selon la seconde loi de la thermodynamique ). La temp??rature et la phase d'une substance soumise ?? un transfert de chaleur sont d??termin??s par chaleur latente et la capacit?? calorifique. Un terme connexe est l'??nergie thermique, vaguement d??fini comme l'??nergie d'un corps qui augmente avec sa temp??rature .

Vue d'ensemble
La premi??re loi de la thermodynamique affirme que l'??nergie d'un syst??me ferm?? est conserv??. Par cons??quent, pour modifier l'??nergie d'un syst??me, de l'??nergie doit ??tre transf??r??e vers ou depuis le syst??me. La chaleur et le travail sont les deux seuls m??canismes par lesquels l'??nergie peut ??tre transf??r??e vers ou ?? partir d'une masse de commande. La chaleur est le transfert d'??nergie provoqu??e par la diff??rence de temp??rature. L'unit?? de la quantit?? d'??nergie transf??r??e par la chaleur en Syst??me international d'unit??s SI est le joule (J), si le British Thermal Unit et de la calories sont encore parfois utilis?? aux ??tats-Unis. L'unit?? de la vitesse de transfert de chaleur est la watt (W = J / s).

Le transfert de chaleur est un fonction de trajet ( quantit?? de processus), par opposition ?? un fonction de point ( grandeur d'??tat). Le flux de chaleur entre les syst??mes qui ne sont pas en ??quilibre thermique avec l'autre; il coule spontan??ment des zones de haute temp??rature dans des zones de basse temp??rature. Lorsque deux corps de temp??rature diff??rente entrent en contact thermique, ils vont ??changer de l'??nergie interne jusqu'?? ce que leurs temp??ratures sont ??galis??es; ce est, jusqu'?? ce qu'ils atteignent ??quilibre thermique. L'adjectif chaud est utilis?? comme un terme relatif pour comparer la temp??rature de l'objet ?? celle de l'environnement (ou celui de la personne utilisant le terme). La chaleur ?? long terme est utilis?? pour d??crire le flux d'??nergie. En l'absence d'interactions de travail, la chaleur qui est transf??r??e ?? un objet finit par se stock??es dans l'objet sous la forme d'??nergie interne.

La chaleur sp??cifique est d??finie comme la quantit?? d'??nergie qui doit ??tre transf??r?? vers ou depuis une unit?? de masse ou en moles d'une substance pour changer sa temp??rature par une degr??. La chaleur sp??cifique est une propri??t??, ce qui signifie que cela d??pend de la substance ?? l'??tude et son ??tat comme sp??cifi?? par ses propri??t??s. Combustibles, lorsqu'il est br??l??, lib??rent une grande partie de l'??nergie dans les liaisons chimiques de leurs mol??cules. Lors du passage d'une phase ?? l'autre, une substance rejets purs ou absorbe la chaleur sans son changement de temp??rature. La quantit?? de transfert de chaleur pendant un changement de phase est appel??e chaleur latente et d??pend principalement de la substance et de son ??tat.
Energie Thermique
L'??nergie thermique est un terme souvent confondu avec celui de la chaleur. Grosso modo, quand la chaleur est ajout??e ?? une syst??me thermodynamique ses augmentations d'??nergie thermique et lorsque la chaleur est retir??e de ses baisses d'??nergie thermique. Dans ce point de vue, les objets qui sont chauds sont d??sign??es comme ??tant en possession d'une grande quantit?? d'??nergie thermique, tandis que les objets froids poss??dent peu d'??nergie thermique. L'??nergie thermique est alors souvent ?? tort d??fini comme ??tant synonyme du mot chaleur. Ceci, cependant, ne est pas le cas: un objet ne peut pas poss??der la chaleur, mais seulement de l'??nergie. L'??nergie thermique terme lorsqu'il est utilis?? dans la conversation ne est pas souvent utilis?? dans un sens tout ?? fait correct, mais est plus susceptible d'??tre utilis?? comme un mot descriptif. En physique et de la thermodynamique, les mots "chaleur", " ??nergie "," travail "," enthalpie "(teneur en chaleur),?? entropie ??,?? externes forces ", etc., qui peut ??tre d??finie exactement, ce est ?? dire sans avoir recours ?? des motions et des vibrations atomiques internes, ont tendance ?? ??tre pr??f??r?? et utilis?? plus souvent que l'??nergie thermique ?? long terme, ce qui est difficile ?? d??finir.
Histoire
Dans l' histoire de la science , l'histoire de la chaleur retrace ses origines de la premi??re hominid??s de faire feu et de sp??culer sur son fonctionnement et un sens ?? jour modernes physiciens des particules qui ??tudient la nature sub-atomique de la chaleur. En bref, le ph??nom??ne de la chaleur et sa d??finition a ??volu?? ?? partir des th??ories mythologiques de feu , ?? la chaleur, ?? pinguis cuite, phlogistique, ?? air de feu, calorique, de la th??orie de la chaleur, de la ??quivalent m??canique de la chaleur, ?? la thermo-dynamique (parfois appel?? ??nerg??tique) ?? la thermodynamique . L'histoire de la chaleur, alors, est un pr??curseur de l'??volution et les th??ories de la l'histoire de la thermodynamique.
Notation
Le montant total de l'??nergie transf??r??e par transfert de chaleur est classiquement abr??g?? Q. La convention de signe conventionnel est que quand un corps lib??re de la chaleur dans son environnement, Q <0 (-); . quand un corps absorbe la chaleur de son environnement, Q> 0 (de +) Taux de transfert de chaleur, ou flux de chaleur par unit?? de temps, est d??sign?? par:
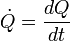 .
.
Elle est mesur??e en watts. flux de chaleur est d??finie comme le taux de transfert de chaleur par unit?? de surface de section transversale, et est not?? q, r??sultant en unit??s de watts par m??tre carr??, bien que l??g??rement diff??rentes conventions de notation peuvent ??tre utilis??s.
Entropy
En 1854, le physicien allemand Rudolf Clausius d??fini le deuxi??me th??or??me fondamental (la seconde loi de la thermodynamique ) dans la m??canique th??orie de la chaleur ( thermodynamique ): "si deux transformations qui, sans n??cessiter aucun autre changement permanent, peut remplacer mutuellement les uns les autres, ??tre appel??s ??quivalent, les g??n??rations de la quantit?? de chaleur Q du travail ?? la temp??rature T, a l'??quivalence un valeur: "
En 1865, il est venu de d??finir ce rapport que l'entropie symbolis??e par S, de telle sorte que, pour un syst??me fixe ferm??:
et ainsi, par r??duction, les quantit??s de chaleur AQ (e diff??rentielle inexacte) sont d??finis comme quantit??s de TDS (un diff??rentielle exacte):
En d'autres termes, la fonction d'entropie S facilite la quantification et la mesure des flux de chaleur ?? travers un limite thermodynamique.
D??finitions
En termes modernes, la chaleur est d??finie comme l'??nergie de mani??re concise en transit. Physicien ??cossais James Clerk Maxwell , dans son 1871 Th??orie classique de chaleur, a ??t?? l'un des premiers ?? ??noncer une d??finition moderne de la "chaleur". En bref, Maxwell a pr??sent?? quatre stipulations sur la d??finition de la chaleur. Premi??rement, il est ??quelque chose qui peut ??tre transf??r?? d'un corps ?? un autre", selon la seconde loi de la thermodynamique . Deux, il peut parler comme un ??quantit?? mesurable??, et ce trait?? math??matiquement comme les autres quantit??s mesurables. Troisi??mement, il "ne peut pas ??tre consid??r??e comme une substance"; car il peut ??tre transform?? en quelque chose qui ne est pas une substance, p.ex. travail m??canique . Enfin, il est "l'une des formes de l'??nergie ". Similaires tels moderne, d??finitions succinctes de chaleur sont les suivantes:
- Dans un sens thermodynamique, la chaleur ne est jamais consid??r?? comme ??tant stock?? dans un corps. Comme le travail, elle ne existe que sous forme d'??nergie en transit d'un corps ?? un autre; dans la terminologie thermodynamique, entre un syst??me et de ses environs. Lorsque l'??nergie sous forme de chaleur est ajout?? ?? un syst??me, il est stock?? sous forme de chaleur, mais pas sous forme d'??nergie cin??tique et potentielle des atomes et des mol??cules qui constituent le syst??me.
- La chaleur de nom ne est d??fini que pendant le processus de transfert d'??nergie par conduction ou rayonnement.
- La chaleur est d??fini comme tout ??coulement spontan?? de l'??nergie d'un objet ?? un autre, provoqu??e par une diff??rence de temp??rature entre deux objets.
- La chaleur peut ??tre d??finie comme l'??nergie en transit d'un objet ?? haute temp??rature ?? un objet de temp??rature inf??rieure.
- La chaleur est une interaction entre deux syst??mes ferm??s sans ??change de travail est une interaction thermique pur quand les deux syst??mes, d'abord isol??s et dans un ??quilibre stable, sont mises en contact. L'??nergie ??chang??e entre les deux syst??mes est ensuite appel??e chaleur.
- La chaleur est une forme d'??nergie que poss??de une substance en vertu du mouvement de vibration, ce est ?? dire l'??nergie cin??tique, des mol??cules ou des atomes.
- La chaleur est le transfert d'??nergie entre les substances ?? des temp??ratures diff??rentes.
Thermodynamique
L'??nergie interne
De la chaleur est li??e ?? la ??nergie interne 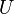 et le syst??me de travail
et le syst??me de travail  effectu??e par le syst??me par la premi??re loi de la thermodynamique :
effectu??e par le syst??me par la premi??re loi de la thermodynamique :
ce qui signifie que l'??nergie du syst??me peut modifier le travail ou soit par l'interm??diaire des flux de chaleur ?? travers la limite de la syst??me thermodynamique. De mani??re plus d??taill??e, L'??nergie est la somme de toutes les formes microscopiques d'??nergie d'un syst??me. Elle est li??e ?? la structure mol??culaire et le degr?? d'activit?? mol??culaire et peut ??tre consid??r??e comme la somme des ??nergies cin??tiques et potentielles des mol??cules; il comprend les types d'??nergies suivantes:
| Type | Composition de L'??nergie interne (U) |
|---|---|
| ??nergie sensible | la partie de la ??nergie interne d'un syst??me associ?? avec des ??nergies cin??tiques (traduction mol??culaire, la rotation et les vibrations, la traduction ??lectronique et de spin et spin nucl??aire) des mol??cules. |
| ??nergie latente | l'??nergie associ??e ?? l' ??tape d'un syst??me. |
| L'??nergie chimique | l'??nergie interne associ?? aux liaisons atomiques dans une mol??cule. |
| ??nergie nucl??aire | l'??norme quantit?? d'??nergie associ??e ?? la de fortes liaisons dans le noyau de l'atome lui-m??me. |
| interactions ??nerg??tiques | ces types d'??nergies ne sont pas stock??es dans le syst??me (par exemple, transfert de chaleur, transfert de masse, et travaux), mais qui sont comptabilis??s ?? la limites du syst??me comme ils le traversent, qui repr??sentent les gains ou les pertes par un syst??me au cours du processus. |
| Energie Thermique | la somme des formes sensibles et latentes de l'??nergie interne. |
Le transfert de la chaleur ?? un gaz parfait ?? pression constante augmente l'??nergie interne et effectue des travaux de d??limitation (c. permet un volume de contr??le de gaz ?? devenir plus ou moins), ?? condition que le volume ne est pas contraint. Revenant ?? la premi??re loi ??quation et la s??paration de la p??riode de travail en deux types, "travail de fronti??re?? et ??autres?? (par exemple travail de l'arbre r??alis??e par un ventilateur de compresseur), donne le r??sultat suivant:
Cette quantit?? combin??e  est l'enthalpie ,
est l'enthalpie , 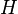 , L'un des potentiels thermodynamiques. Les deux enthalpie,
, L'un des potentiels thermodynamiques. Les deux enthalpie, 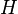 , Et de l'??nergie interne,
, Et de l'??nergie interne, 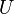 sont fonctions de l'??tat. fonctions ??tatiques reviennent ?? leur valeur initiale ?? la fin de chaque cycle dans des processus cycliques, tels que celui d'une moteur thermique. En revanche, ni
sont fonctions de l'??tat. fonctions ??tatiques reviennent ?? leur valeur initiale ?? la fin de chaque cycle dans des processus cycliques, tels que celui d'une moteur thermique. En revanche, ni 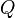 ni
ni  sont des propri??t??s d'un syst??me et ne sont pas n??cessairement somme soit ??gale ?? z??ro au cours des ??tapes d'un cycle. L'expression infinit??simale de chaleur,
sont des propri??t??s d'un syst??me et ne sont pas n??cessairement somme soit ??gale ?? z??ro au cours des ??tapes d'un cycle. L'expression infinit??simale de chaleur, 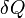 , Forme un diff??rentielle inexacte pour les processus impliquant un travail. Cependant, pour des proc??d??s impliquant pas de changement de volume, le champ magn??tique appliqu??, ou d'autres param??tres ext??rieurs,
, Forme un diff??rentielle inexacte pour les processus impliquant un travail. Cependant, pour des proc??d??s impliquant pas de changement de volume, le champ magn??tique appliqu??, ou d'autres param??tres ext??rieurs, 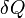 , Forme un diff??rentielle exacte. De m??me, pour les processus adiabatique (pas de transfert de chaleur), l'expression pour le travail fait diff??rentielle exacte, mais pour les processus impliquant le transfert de chaleur qu'il fait diff??rentielle inexacte.
, Forme un diff??rentielle exacte. De m??me, pour les processus adiabatique (pas de transfert de chaleur), l'expression pour le travail fait diff??rentielle exacte, mais pour les processus impliquant le transfert de chaleur qu'il fait diff??rentielle inexacte.
Capacit?? calorifique
Pour un syst??me compressible simple comme un gaz parfait ?? l'int??rieur un piston, les variations de l'enthalpie et l'??nergie interne peut ??tre li??e ?? la la capacit?? thermique ?? pression constante et le volume, respectivement. contraint ?? avoir un volume constant, la chaleur, 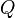 , N??cessaire pour changer sa temp??rature ?? partir d'une temp??rature initiale T 0, ?? une temp??rature finale, T f est donn??e par:
, N??cessaire pour changer sa temp??rature ?? partir d'une temp??rature initiale T 0, ?? une temp??rature finale, T f est donn??e par:
Retrait de la contrainte de volume et permettant au syst??me de dilater ou se contracter ?? pression constante:
Pour les substances incompressibles, comme solides et liquides , la distinction entre les deux types de capacit?? de chaleur dispara??t comme aucun travail ne est effectu??. la capacit?? de chaleur est un vaste quantit?? et en tant que telle est d??pendante du nombre de mol??cules dans le syst??me. Il peut ??tre repr??sent?? comme le produit de la masse, 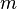 Et la capacit?? thermique sp??cifique,
Et la capacit?? thermique sp??cifique, 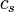 selon:
selon:
ou est d??pendante du nombre de moles et la capacit?? thermique molaire, 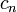 selon:
selon:
Les capacit??s calorifiques molaires et sp??cifiques d??pendent des degr??s de libert?? internes du syst??me et non sur les propri??t??s externes tels que le volume et le nombre de mol??cules.
Les chaleurs sp??cifiques des gaz monoatomiques (par exemple, h??lium) sont ?? peu pr??s constante avec la temp??rature. Gaz diatomiques telles que l'affichage d'hydrog??ne certaine d??pendance de temp??rature, et les gaz triatomiques (par exemple, dioxyde de carbone) plus encore.
Dans les liquides ?? des temp??ratures suffisamment basses, les effets quantiques deviennent significatifs. Un exemple est le comportement de bosons tels que l'h??lium-4. Pour de telles substances, le comportement de la capacit?? calorifique de la temp??rature est discontinue au Bose-Einstein point de condensation.
Le comportement quantique des solides est suffisamment caract??ris?? par le Mod??le Debye. A des temp??ratures bien inf??rieures ?? la temp??rature de Debye caract??ristique d'un r??seau solide, sa chaleur sp??cifique est proportionnelle au cube de la temp??rature absolue. Pour les m??taux ?? basse temp??rature, un deuxi??me terme est n??cessaire pour tenir compte du comportement des ??lectrons de conduction, un exemple de Statistique de Fermi-Dirac.
Changements de phase
Le point d'??bullition de l'eau , au niveau de la mer et de la pression atmosph??rique normale et la temp??rature, seront toujours ?? pr??s de 100 ?? C, peu importe combien de chaleur est ajout??. La chaleur suppl??mentaire modifie la phase de l'eau de l'??tat liquide dans la vapeur d'eau . La chaleur ajout??e pour modifier la phase d'une substance de cette fa??on est dite "cach??e", et par cons??quent il est appel?? chaleur latente (du latin sens latere "mentir cach????). La chaleur latente est la chaleur par unit?? de masse n??cessaire de changer l'??tat d'une substance donn??e, ou:
et
Notez que lorsque la pression augmente, la L augmente l??g??rement. Ici,  est la quantit?? de masse d'abord dans la nouvelle phase, et M est la quantit?? de masse qui finit dans la nouvelle phase. De plus, en g??n??ral L ne d??pend pas de la quantit?? de masse qui change de phase, de sorte que l'??quation peut ??tre ??crite normalement:
est la quantit?? de masse d'abord dans la nouvelle phase, et M est la quantit?? de masse qui finit dans la nouvelle phase. De plus, en g??n??ral L ne d??pend pas de la quantit?? de masse qui change de phase, de sorte que l'??quation peut ??tre ??crite normalement:
Parfois, L peut ??tre d??pendant du temps si la pression et le volume sont en train de changer avec le temps, de sorte que l'int??grale peut ??tre ??crite comme:
des m??canismes de transfert de chaleur
La chaleur tend ?? se d??placer ?? partir d'une r??gion de haute temp??rature ?? une r??gion de basse temp??rature. Ce transfert de chaleur peut se produire par les m??canismes de conduction et rayonnement. Dans l'ing??nierie , le terme transfert de chaleur par convection est utilis?? pour d??crire les effets combin??s de conduction et l'??coulement de fluide et est consid??r??e comme un troisi??me m??canisme de transfert de chaleur.
Conduction
La conduction est le moyen le plus importantes de transfert de chaleur dans un solide. Sur une ??chelle microscopique, la conduction se produit aussi chaud, se d??pla??ant rapidement ou vibration des atomes et des mol??cules d'interagir avec des atomes et des mol??cules voisines, transf??rer une partie de leur ??nergie (chaleur) ?? ces atomes voisins. En Isolateurs le flux de chaleur est r??alis?? presque enti??rement par vibrations des phonons.
Le "fluide d'??lectrons?? d'un m??talliques conductrice conduites solides quasi-totalit?? des flux de chaleur ?? travers le solide. Phonon flux est toujours pr??sent, mais comporte moins de 1% de l'??nergie. ??lectrons effectuent ??galement un courant ??lectrique ?? travers les solides conductrices, et la thermique et conductivit??s ??lectriques de la plupart des m??taux ont ?? peu pr??s le m??me rapport. Un bon conducteur ??lectrique, tels que le cuivre , conduit g??n??ralement aussi bien la chaleur. Le Effet Peltier-Seebeck pr??sente la propension des ??lectrons ?? conduire la chaleur ?? travers un solide conducteur ??lectriquement. Thermoelectricity est caus??e par la relation entre les ??lectrons, les flux de chaleur et des courants ??lectriques.
Convection
La convection est g??n??ralement la forme dominante de transfert de chaleur dans les liquides et les gaz. Ce est un terme utilis?? pour caract??riser les effets combin??s de la conduction et l'??coulement du fluide. En convection, enthalpie transfert se produit par le mouvement des parties chaudes ou froides du fluide en m??me temps que le transfert de chaleur par conduction. Par exemple, lorsque l'eau est chauff??e dans un four, l'eau chaude ?? partir du fond de la cuvette augmente, le chauffage de l'eau dans la partie sup??rieure de la cuve. Deux types de convection, on distingue g??n??ralement, convection libre, dans lequel les forces de gravit?? et de flottabilit?? en voiture le mouvement fluide et convection forc??e, o?? un ventilateur, d'un agitateur, ou d'autres moyens sont utilis??s pour d??placer le fluide. Le dynamisme convection est en raison des effets de la gravit??, et donc ne se produit pas dans conditions de microgravit??.
Radiation
Le rayonnement est la seule forme de transfert de chaleur qui peut se produire en l'absence de toute forme de support; il est donc le seul moyen de transfert de chaleur ?? travers un vide. Le rayonnement thermique est une cons??quence directe des mouvements des atomes et des mol??cules dans un mat??riau. ??tant donn?? que ces atomes et mol??cules sont compos??es de particules charg??es ( protons et ??lectrons ), leurs d??placements se traduisent par l'??mission d' un rayonnement ??lectromagn??tique , qui transporte de l'??nergie loin de la surface. Dans le m??me temps, la surface est constamment bombard?? par un rayonnement provenant de l'environnement, ce qui entra??ne le transfert d'??nergie ?? la surface. Depuis le montant des augmentations de rayonnement ??mis lorsque la temp??rature augmente, un transfert net d'??nergie ?? partir des temp??ratures plus ??lev??es ?? des r??sultats plus faibles temp??ratures
La puissance que corps noir ??met ?? diff??rentes fr??quences est d??crit par La loi de Planck. Il existe une fr??quence f max ?? laquelle la puissance ??mise est maximale. La loi de d??placement de Wien, et le fait que la fr??quence de la lumi??re est inversement proportionnelle ?? sa longueur d'onde dans le vide, signifient que la fr??quence maximale f max est proportionnelle ?? la temp??rature absolue T du corps noir. La photosph??re du Soleil, ?? une temp??rature d'environ 6000 K, ??met un rayonnement principalement dans la partie visible du spectre. L'atmosph??re de la terre est partiellement transparent ?? la lumi??re visible, et la lumi??re qui atteint la surface de la terre est absorb??e ou r??fl??chie. La surface de la terre ??met le rayonnement absorb??, approchant le comportement d'un corps noir ?? 300 K avec un pic spectrale ?? f max. A ces basses fr??quences, l'atmosph??re est en grande partie opaque et le rayonnement de la surface de la terre est absorb?? ou diffus?? par l'atmosph??re. Bien que certains rayonnement ??chappe dans l'espace, il est absorb?? puis r????mis par les gaz atmosph??riques. Ce est cette s??lectivit?? spectrale de l'atmosph??re qui est responsable de l'plan??taire effet de serre
Le m??nage commun ampoule a un spectre de corps noir chevauchant le spectre du soleil et de la terre. Une partie des photons ??mis par un filament de l'ampoule de lumi??re tungst??ne ?? 3000K sont dans le spectre visible. Cependant, la plupart de l'??nergie est associ?? ?? des photons de longueurs d'onde; ceux-ci ne seront pas aider une personne ?? voir, mais seront toujours transf??rer la chaleur ?? l'environnement, comme on peut le d??duire empiriquement en observant une ampoule ?? incandescence de m??nage. Chaque fois que le rayonnement ??lectromagn??tique ??mise puis absorb??e, la chaleur est transf??r??e. Ce principe est utilis?? dans fours ?? micro-ondes, d??coupage au laser, et ??pilation RF.
D'autres m??canismes de transfert de chaleur
- Chaleur latente: transfert de chaleur ?? travers un changement physique dans le milieu comme l'eau ?? la glace ou de l'eau-vapeur implique beaucoup d'??nergie et est exploit??e dans de nombreuses fa??ons: machine ?? vapeur , r??frig??rateur, etc. (voir chaleur latente de fusion)
- Les caloducs: utilisant la chaleur latente et l'action capillaire pour d??placer la chaleur, des caloducs peuvent transporter plusieurs fois autant de chaleur que une tige de cuivre de taille similaire. Invent?? ?? l'origine pour une utilisation dans satellites, ils commencent ?? avoir des applications dans les ordinateurs personnels .
La dissipation de chaleur
Dans les climats froids, maisons avec leurs syst??mes de chauffage forment des syst??mes dissipatives. En d??pit des efforts pour isoler ces maisons pour r??duire les pertes de chaleur ?? leurs ext??rieurs, une forte chaleur est perdue ou dissip??e, de leur part, ce qui peut rendre leurs int??rieurs inconfortablement frais ou froid. Pour le confort de ses habitants, ?? l'int??rieur d'une maison doit ??tre maintenu hors d'??quilibre thermique avec son environnement externe. En effet, les r??sidences domestiques sont des oasis de chaleur dans une mer de froid et le gradient thermique entre l'int??rieur et l'ext??rieur est souvent assez raide. Cela peut conduire ?? des probl??mes tels que condensation et de d??sagr??ables courants (de projets) qui, si rien ne est, peut causer des dommages structurels ?? la propri??t??. Ce est pourquoi des techniques d'isolation modernes sont n??cessaires pour r??duire la perte de chaleur.
Dans une telle maison, un thermostat est un dispositif apte ?? d??marrer le syst??me de chauffage lorsque l'int??rieur de la maison est inf??rieure ?? une temp??rature de consigne, et d'arr??ter cette m??me lorsqu'un autre syst??me (sup??rieur) temp??rature de consigne a ??t?? atteinte. Ainsi, le thermostat contr??le le flux d'??nergie dans la maison, que l'??nergie d'??tre finalement dissip??e ?? l'ext??rieur.