
Liaison chimique
?? propos de ce ??coles s??lection Wikipedia
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
Une liaison chimique est une attraction entre atomes qui permet la formation de des substances chimiques qui contiennent deux ou plusieurs atomes. La liaison est caus?? par la force ??lectrostatique d'attraction entre les charges oppos??es, soit entre les ??lectrons et les noyaux , ou comme le r??sultat d'une attraction dip??le. La force des liaisons chimiques varie consid??rablement; il existe des ??liens forts?? comme covalente ou liaisons ioniques et des liaisons faibles "" tels que interactions dip??le-dip??le, le Forces de London et une liaison hydrog??ne.
Depuis charges oppos??es se attirent via un simple force ??lectromagn??tique , les charg??s n??gativement ??lectrons qui sont en orbite autour du noyau et les charg??s positivement protons dans le noyau se attirent mutuellement. En outre, un ??lectron plac?? entre deux noyaux seront attir??s par les deux. Ainsi, la configuration la plus stable de noyaux et d'??lectrons est celui dans lequel les ??lectrons passent plus de temps entre les noyaux, que partout ailleurs dans l'espace. Ces ??lectrons provoquent les noyaux d'??tre attir??s les uns aux autres, et cette attraction r??sultats dans le lien. Toutefois, cette assembl??e ne peut se ??crouler ?? une taille dict??e par les volumes de ces particules individuelles. En raison de mati??re nature ondulatoire des ??lectrons et leur masse plus petite, ils occupent une plus grande quantit?? de volume par rapport aux noyaux, et ce volume occup?? par les ??lectrons maintient les noyaux atomiques relativement ??loign??s, par rapport ?? la taille des noyaux eux-m??mes.
En g??n??ral, une liaison chimique solide est associ?? ?? l'??change ou le transfert d'??lectrons entre les atomes participant. Les atomes dans les mol??cules , cristaux , m??taux et gases- diatomic effet plus de l'environnement physique autour US- sont maintenues ensemble par des liaisons chimiques qui dictent le la structure et les propri??t??s de la mati??re en vrac.

Aper??u des principaux types de liaisons chimiques
Une liaison chimique est une attraction entre atomes. Cette attraction peut ??tre consid??r??e comme le r??sultat d'un comportement diff??rent des ??lectrons les plus externes des atomes. Bien que tous ces comportements se fondre dans l'autre de fa??on transparente dans diverses situations de liaison de sorte qu'il n'y a pas de ligne claire doit ??tre ??tablie entre eux, n??anmoins comportements des atomes deviennent si qualitativement diff??rente que le caract??re de la liaison change quantitativement, qu'il demeure utile et coutumier faire la distinction entre les obligations qui causent ces diff??rentes propri??t??s de la mati??re condens??e .
Dans la vue la plus simple d'un soi-disant 'Covalente' liaison, un ou plusieurs ??lectrons (souvent une paire d'??lectrons) sont attir??s dans l'espace entre les deux noyaux atomiques. Ici, les ??lectrons charg??s n??gativement sont attir??es par les charges positives des deux noyaux, au lieu de leur propre. Ce surmonte la r??pulsion entre les deux noyaux charg??s positivement des deux atomes, et ainsi de cette attraction ??crasante d??tient les deux noyaux dans une configuration fixe de l'??quilibre, m??me se ils seront toujours vibrer ?? la position d'??quilibre. Ainsi, la liaison covalente implique le partage d'??lectrons dans laquelle les noyaux charg??s positivement de deux ou plusieurs atomes simultan??ment attirent les ??lectrons charg??s n??gativement qui sont partag??es entre eux. Ces obligations exister entre deux atomes identifiables particuliers, et ont une direction dans l'espace, leur permettant d'??tre repr??sent??es par des lignes de connexion simples entre les atomes dans les dessins, ou mod??lis??s comme des b??tons entre les sph??res dans les mod??les. Dans un liaison covalente polaire, un ou plusieurs ??lectrons sont in??galement r??parti entre deux noyaux. Les liaisons covalentes aboutissent souvent ?? la formation de petits ensembles d'atomes mieux connect??s appel??es mol??cules , dans lequel les solides et les liquides sont li??es ?? d'autres mol??cules par des forces qui sont souvent beaucoup plus faibles que les liaisons covalentes qui maintiennent les mol??cules ?? l'int??rieur ensemble. De telles liaisons intermol??culaires faibles donnent des substances mol??culaires organiques, tels que des cires et des huiles, leur caract??re souple en vrac, ainsi que leurs points de fusion bas (dans des liquides, les mol??cules doivent cesser contact le plus structur??e ou orient??e ?? l'autre). Lorsque des liaisons covalentes lien longues cha??nes d'atomes dans les grandes mol??cules, cependant (comme dans les polym??res tels que nylon), ou lorsque des liaisons covalentes se ??tendent dans des r??seaux solides qui ne sont pas compos??es de mol??cules discr??tes (telles que le diamant ou le quartz ou le silicates dans de nombreux types de roches), puis les structures qui en r??sultent peuvent ??tre ?? la fois fort et dur, au moins dans la direction orient??e correctement avec les r??seaux de liaisons covalentes. En outre, les points de fusion de ces polym??res et les r??seaux covalents augmentent consid??rablement.
Dans une vue simplifi??e d'un liaison ionique, l'??lectron de liaison ne est pas partag??e du tout, mais transf??r??. Dans ce type de liaison, l'externe orbitale atomique d'un atome a une vacance qui permet l'ajout d'un ou plusieurs ??lectrons. Ces ??lectrons nouvellement ajout??es occupent potentiellement un ??tat d'??nergie inf??rieur (en fait plus proche de la charge plus de nucl??aire) que qu'ils vivent dans un atome diff??rent. Ainsi, un noyau offre une position plus ??troitement li?? ?? ??lectrons que ne le fait un autre noyau, de sorte que l'on peut transf??rer un atome d'??lectrons ?? l'autre. Ce transfert provoque un atome d'assumer une charge nette positive, et l'autre d'assumer une charge nette n??gative. Le lien r??sulte alors de l'attraction ??lectrostatique entre les atomes, et les atomes deviennent positives ou charg??s n??gativement ions . Les liaisons ioniques peuvent ??tre consid??r??s comme des exemples extr??mes de polarisation dans des liaisons covalentes. Souvent, ces obligations ne ont pas d'orientation particuli??re dans l'espace, car ils r??sultent de l'attraction ??lectrostatique ??gale de chaque ion ?? tous les ions autour d'eux. Les liaisons ioniques sont fortes (et donc substances ioniques n??cessitent des temp??ratures ??lev??es pour faire fondre), mais aussi fragile, car les forces entre les ions sont ?? courte port??e, et ne comblent pas facilement les fissures et les fractures. Ce type de cautionnement donne un caract??re physique charactistic aux cristaux de sels min??raux classiques, tels que le sel de table.
Un type de liaison moins souvent mentionn?? est la lien m??tallique. Dans ce type de liaison, chaque atome de m??tal don une ou plusieurs ??lectrons ?? un "mer" d'??lectrons qui se trouvent entre plusieurs atomes de m??tal. Dans cette mer, chaque ??lectron est libre (du fait de sa nature d'onde) ?? ??tre associ?? ?? un grand nombre d'atomes ?? la fois. Le lien r??sultats parce que les atomes de m??tal deviennent peu charg?? positivement en raison de la perte de leurs ??lectrons, tandis que les ??lectrons restent attir??s par de nombreux atomes, sans faire partie de ne importe quel atome donn??. Liaison m??tallique peut ??tre consid??r??e comme un exemple extr??me de la d??localisation d'??lectrons sur un grand syst??me de liaisons covalentes, dans lequel chaque atome participe. Ce type de liaison est souvent tr??s forte (conduisant ?? la r??sistance ?? la traction de m??taux). Toutefois, les liaisons m??talliques sont plus de nature collective que les autres types, et ils permettent cristaux de m??tal de se d??former plus facilement, car ils sont compos??s d'atomes attir??s les uns aux autres, mais pas en aucune fa??on particuli??rement orient??es. Il en r??sulte la mall??abilit?? des m??taux. La mer d'??lectrons en obligations m??talliques provoque la caract??ristique bonne conductivit?? ??lectrique et thermique des m??taux, ainsi que leur r??flexion "brillant" de la plupart des fr??quences de lumi??re blanche.
Toutes les obligations peuvent ??tre expliqu??s par la th??orie quantique, mais, dans la pratique, les r??gles de simplification permettent chimistes pour pr??dire la force, la directivit?? et la polarit?? des obligations. Le r??gle de l'octet et Th??orie VSEPR sont deux exemples. Th??ories plus sophistiqu??es sont la th??orie de la valence de liaison qui comprend hybridation orbital et r??sonance, et la combinaison lin??aire des orbitales atomiques m??thode orbitale mol??culaire qui comprend ligand th??orie de champ. Electrostatics sont utilis??s pour d??crire polarit??s obligataires et les effets qu'ils ont sur les substances chimiques.
Histoire
D??but des sp??culations sur la nature de la liaison chimique, de d??s le 12??me si??cle, a suppos?? que certains types de les esp??ces chimiques ont ??t?? joints par un type de affinit?? chimique. En 1704, Isaac Newton a expos?? sa c??l??bre th??orie de la liaison atomique, dans "31 requ??te" de son Opticks, lequel atomes attachent les uns aux autres par une " vigueur ". Plus pr??cis??ment, apr??s avoir reconnu les diverses th??ories populaires en vogue ?? l'??poque, de la fa??on dont ont ??t?? motiv??es atomes d'attacher les uns aux autres, ce est ?? dire ??atomes crochus??, ??coll??s ensemble par le repos?? ou ??coll??es en conspirant mouvements", Newton affirme que il aurait plut??t d??duire de leur coh??sion, que ??particules attirent entre eux par certaines vigueur , qui, au contact imm??diat est extr??mement forte, ?? de petites distances effectue les op??rations chimiques, et atteint non loin des particules avec un effet sensible. "
En 1819, sur les talons de l'invention de la pile de Volta, J??ns Jakob Berzelius a d??velopp?? une th??orie de la combinaison chimique soulignant le caract??re ??lectron??gatif et ??lectropositive des atomes de combinaison. Vers le milieu du 19e si??cle, Edward Frankland, FA Kekul??, AS Couper, Alexander Butlerov, et Hermann Kolbe, se appuyant sur le th??orie des radicaux, a d??velopp?? la th??orie de valence , appel?? ?? l'origine "combinaison de puissance", dans lequel les compos??s ont ??t?? rejoints gr??ce ?? une attraction de p??les positifs et n??gatifs. En 1916, le chimiste Gilbert N. Lewis a d??velopp?? le concept de la liaison de paire d'??lectrons, dans lequel deux atomes d'hydrog??ne peuvent partager une ?? six ??lectrons, formant ainsi la liaison ?? un ??lectron , un liaison simple, un double liaison, ou d'un triple liaison; dans les propres mots de Lewis, "Un ??lectron peut former une partie de l'enveloppe de deux atomes diff??rents et ne peut ??tre dit appartenir ?? l'une exclusivement."
Cette m??me ann??e, Walther Kossel mis en avant une th??orie similaire ?? Lewis seulement son mod??le suppos?? transferts complets d'??lectrons entre les atomes, et ??tait donc un mod??le de des liaisons ioniques. Tant Lewis et Kossel structur??es leurs mod??les de liaison sur celle de Loi d'Abegg (1904).
En 1927, la premi??re description quantique math??matiquement compl??te d'une liaison chimique simple, ce est ?? dire celle produite par un seul ??lectron dans l'ion mol??culaire de l'hydrog??ne, H 2 +, a ??t?? obtenue par le physicien danois Oyvind Burrau. Ce travail a montr?? que l'approche quantique de liaisons chimiques pourrait ??tre fondamentale et quantitative correcte, mais les m??thodes math??matiques utilis??es ne saurait ??tre ??tendue ?? des mol??cules contenant plus d'un ??lectron. Un plus pratique, quoique moins quantitative, l'approche a ??t?? mise en avant dans la m??me ann??e par Walter et Heitler Fritz London. La m??thode Heitler-Londres constitue la base de ce qu'on appelle aujourd'hui la th??orie de la valence de liaison. En 1929, la combinaison lin??aire des orbitales atomiques m??thode orbitale mol??culaire (LCAO) rapprochement a ??t?? pr??sent?? par Sir John Lennard-Jones, qui a ??galement sugg??r?? des m??thodes pour calculer les structures ??lectroniques de mol??cules de F 2 ( fluor ) et O 2 ( oxyg??ne ) des mol??cules, de principes quantiques de base. Cette th??orie des orbitales mol??culaires repr??sente une liaison covalente comme une orbitale form?? en combinant la m??canique quantique Schr??dinger orbitales atomiques qui avaient ??t?? hypoth??tiques pour les ??lectrons dans les atomes simples. Les ??quations pour les ??lectrons dans les atomes de liaison multi-??lectrons ne peuvent ??tre r??solus ?? la perfection math??matique (ce est ?? dire, analytique), mais des approximations pour eux encore donn?? beaucoup de bonnes pr??visions qualitatives et les r??sultats. La plupart des calculs quantitatifs moderne chimie quantique utilisent soit liaison de valence ou th??orie des orbitales mol??culaires comme point de d??part, m??me si une troisi??me approche, Densit?? de la th??orie fonctionnelle, est devenu de plus en plus populaire ces derni??res ann??es.
En 1933, HH James et AS Coolidge effectue un calcul sur la mol??cule de dihydrog??ne que, contrairement ?? tout calcul pr??c??dent qui utilise des fonctions seulement de la distance de l'??lectron du noyau atomique, les fonctions qui ??galement ajout??s explicitement la distance entre les deux ??lectrons utilis??. Avec jusqu'?? 13 param??tres ajustables ont obtenu un r??sultat tr??s proche du r??sultat exp??rimental de l'??nergie de dissociation. Extensions ult??rieures ont utilis?? jusqu'?? 54 param??tres et donner un excellent accord avec l'exp??rience. Ce calcul a convaincu la communaut?? scientifique que la th??orie quantique pourrait donner accord avec l'exp??rience. Toutefois, cette approche n'a aucun des images physiques de la liaison de valence et th??ories orbitales mol??culaires et est difficile ?? ??tendre ?? des mol??cules plus grandes.
Th??orie de la liaison de valence
En 1927, la th??orie de la liaison de valence a ??t?? formul??e et il fait valoir que la formation d'une liaison chimique lorsque deux ??lectrons de valence, dans leur respective orbitales atomiques, ou la fonction de tenir deux noyaux ensemble, gr??ce aux effets de l'abaissement ??nergies du syst??me. Se appuyant sur cette th??orie, le chimiste Linus Pauling publi?? en 1931 ce que certains consid??rent l'un des documents les plus importants de l'histoire de la chimie: "Sur la nature de la liaison chimique". Dans cet article, l'??laboration sur les travaux de Lewis, et la th??orie de la liaison de valence (VB) de Heitler et Londres, et ses propres travaux ant??rieurs, Pauling a pr??sent?? six r??gles pour la liaison ??lectronique partag??, les trois premiers ont ??t?? d??j?? g??n??ralement connu:
- 1. La liaison de paire d'??lectrons formant gr??ce ?? l'interaction d'un ??lectron non appari?? sur chacun des deux atomes.
- 2. Les spins des ??lectrons doivent ??tre oppos??s.
- 3. Une fois jumel??s, les deux ??lectrons ne peuvent pas prendre part ?? des liaisons suppl??mentaires.
Ses trois derni??res r??gles ??taient nouveaux:
- 4. Les termes ??lectrons change pour le lien implique une seule fonction d'onde de chaque atome.
- 5. Les ??lectrons disponibles sur le niveau d'??nergie le plus bas forment des liaisons fortes.
- 6. De deux orbitales dans un atome, celui qui peut chevaucher le plus avec une orbitale d'un autre atome formera le lien le plus fort, et ce lien aura tendance ?? se allonger dans le sens de l'orbitale concentr??.
Se appuyant sur cet article, de Pauling 1939 manuel: Sur la nature de la liaison chimique deviendrait ce que certains ont appel?? la ??Bible?? de la chimie moderne. Ce livre a aid?? chimistes exp??rimentaux pour comprendre l'impact de la th??orie quantique de la chimie. Cependant, l'??dition tard en 1959 n'a pas r??ussi ?? r??pondre ad??quatement aux probl??mes qui semblaient ??tre mieux comprise par la th??orie des orbitales mol??culaires. L'impact de la th??orie de valence diminu?? au cours des ann??es 1960 et 1970 que la th??orie des orbitales mol??culaires a grandi dans utilit?? comme il a ??t?? mis en ??uvre dans les grandes informatiques num??riques programmes. Depuis les ann??es 1980, les probl??mes les plus difficiles de la mise en ??uvre de la th??orie liaison de valence dans les programmes informatiques ont ??t?? r??solus en grande partie, et la th??orie de liaison de valence a vu une r??surgence.
Comparaison des liaison de valence et th??orie des orbitales mol??culaires
A certains ??gards, la th??orie de la liaison de valence est sup??rieure ?? la th??orie des orbitales mol??culaires. Lorsqu'il est appliqu?? ?? la mol??cule simple ?? deux ??lectrons, H 2, la th??orie de la liaison de valence, m??me ?? la simple approche Heitler-Londres, donne une approximation beaucoup plus proche de la ??nergie de liaison, et il fournit une repr??sentation beaucoup plus pr??cise du comportement des ??lectrons comme les liaisons chimiques sont form??es et rompues. En revanche th??orie des orbitales mol??culaires simples pr??dit que la mol??cule d'hydrog??ne se dissocie en une superposition lin??aire d'atomes d'hydrog??ne et des ions hydrog??ne positifs et n??gatifs, un r??sultat tout ?? fait non physique. Cela explique en partie pourquoi la courbe de l'??nergie totale de la distance interatomique pour la m??thode de liaison de valence se situe en dessous de la courbe de la m??thode des orbitales mol??culaires ?? toutes les distances et le plus particuli??rement pour les grandes distances. Cette situation se produit pour toutes les mol??cules diatomiques homonucl??aires et est particuli??rement un probl??me pour F 2, o?? l'??nergie minimum de la courbe avec la th??orie des orbitales mol??culaires est encore plus ??lev?? en ??nergie que l'??nergie de deux atomes F.
Les concepts d'hybridation sont polyvalents, et la variabilit?? dans la liaison dans la plupart des compos??s organiques est si modeste, que la th??orie de liaison de valence demeure une partie int??grante du vocabulaire de la chimie organique. Cependant, le travail de Friedrich Hund, Robert Mulliken, et Gerhard Herzberg a montr?? que la th??orie des orbitales mol??culaires fourni une description plus appropri??e du spectroscopique, ionisation et propri??t??s magn??tiques des mol??cules. Les insuffisances de la th??orie de liaison de valence est devenu ??vident lorsque les mol??cules hypervalentes (par exemple PF 5) ont ??t?? expliqu??s sans l'utilisation d'orbitales d qui ??taient cruciales au r??gime liaison d'hybridation propos?? pour ces mol??cules par Pauling. Complexes m??talliques et compos??s d??ficients ??lectrons (par exemple, diborane) semble aussi ??tre bien d??crit par la th??orie des orbitales mol??culaires, bien que les descriptions de liaison de valence ont ??t?? faites.
Dans les ann??es 1930, les deux m??thodes, fortement concurrenc??e jusqu'?? ce qu'il soit rendu compte que ce sont deux approximations ?? une meilleure th??orie. Si nous prenons la structure de liaison de valence simple et m??langer dans toutes les structures covalentes et ioniques possibles d??coulant d'un ensemble particulier de orbitales atomiques, nous arrivons ?? ce qu'on appelle la fonction d'onde d'interaction de configuration compl??te. Si nous prenons la description des orbitales mol??culaires simples de l'??tat du sol et combinons cette fonction avec les fonctions d??crivant tous les ??tats excit??s possibles en utilisant orbitales inoccup??s d??coulant du m??me ensemble d'orbitales atomiques, nous atteignons aussi la pleine fonction d'onde d'interaction de configuration. Il peut ??tre alors vu que l'approche orbitale mol??culaire simple donne trop de poids aux structures ioniques, tandis que l'approche simple liaison de valence donne trop peu. Cela peut ??galement ??tre d??crit comme disant que l'approche orbitale mol??culaire est trop d??localis??e, alors que l'approche de liaison de valence est trop localis??e.
Les deux approches sont maintenant consid??r??es comme compl??mentaires, fournir ?? chaque ses propres id??es sur le probl??me de la liaison chimique. Calculs modernes dans la chimie quantique commencent g??n??ralement ?? partir (mais finalement vont bien au-del??) une orbitale mol??culaire plut??t qu'une approche de liaison de valence, non pas parce que de toute sup??riorit?? intrins??que dans l'ancien, mais plut??t parce que l'approche MO est plus facilement adapt??s aux calculs num??riques. Cependant, les programmes d'obligations mieux de valence sont maintenant disponibles.
Obligations dans les formules chimiques
Le fait que les atomes et les mol??cules sont en trois dimensions, il est difficile d'utiliser une seule technique pour indiquer orbitales et des obligations. Dans les formules mol??culaires des liaisons chimiques (orbitales de liaison entre les atomes) sont indiqu??es par diff??rentes m??thodes en fonction du type de discussion. Parfois, ils sont compl??tement n??glig??s. Par exemple, dans la chimie organique chimistes sont parfois concern??s que par la les groupes fonctionnels de la mol??cule. Ainsi, la formule mol??culaire de l'??thanol peut ??tre ??crit dans un article en conformationnelle tridimensionnelle, pleine ?? deux dimensions (indiquant tout lien avec l'absence de directives en trois dimensions), comprim?? ?? deux dimensions (CH 3 CH 2 OH), en s??parant le groupe fonctionnel d'une autre partie de la mol??cule (C 2 H 5 OH), ou par ses constituants atomiques (C 2 H 6 O), selon ce qui est discut??. Parfois, m??me les ??lectrons de valence shell non-liaison (avec les directions approximatives deux dimensions) sont marqu??s, ce est ?? dire pour le carbone ??l??mentaire. 'C'. Certains chimistes peuvent ??galement marquer les orbitales respectives, ?? savoir l'??thyl??ne hypoth??tique -4 anion (\ / C = C / \ -4) indiquant la possibilit?? de formation d'une liaison.
Liaisons chimiques fortes
| Typique longueurs de liaison dans h et obligataires ??nergies en kJ / mol. longueurs de liaison peuvent ??tre convertis en ?? par division par 100 (1 ?? = 100 h). Donn??es tir??es de . | ||
| Lien | Longueur (H) | ??nergie (KJ / mole) |
|---|---|---|
| H - Hydrog??ne | ||
| H-H | 74 | 436 |
| H-O | 96 | 366 |
| H-F | 92 | 568 |
| H-Cl | 127 | 432 |
| C - carbone | ||
| C-H | 109 | 413 |
| C-C | 154 | 348 |
| C-C = | 151 | |
| = C-C≡ | 147 | |
| = C-C = | 148 | |
| C = C | 134 | 614 |
| C≡C | 120 | 839 |
| C-N | 147 | 308 |
| C-O | 143 | 360 |
| C-F | 134 | 488 |
| C-Cl | 177 | 330 |
| N - Azote | ||
| N-H | 101 | 391 |
| N-N | 145 | 170 |
| N≡N | 110 | 945 |
| O - oxyg??ne | ||
| O-O | 148 | 145 |
| O = O | 121 | 498 |
| F, Cl, Br, I - Halog??nes | ||
| F-F | 142 | 158 |
| Cl-Cl | 199 | 243 |
| Br-H | 141 | 366 |
| Br-Br | 228 | 193 |
| I-H | 161 | 298 |
| JE JE | 267 | 151 |
Liaisons chimiques fortes sont les forces intramol??culaires qui d??tiennent atomes ensemble dans les mol??cules . Une liaison chimique forte est form?? ?? partir du transfert ou le partage d' ??lectrons entre les centres atomiques et se appuie sur l' attraction ??lectrostatique entre les protons dans les noyaux et les ??lectrons dans les orbitales. Bien que ces liaisons comportent g??n??ralement le transfert des nombres entiers d'??lectrons (ce qui est le ordre de liaison, ce qui repr??sente une transf??r?? ??lectrons ou deux ??lectrons partag??s), certains syst??mes peuvent avoir des chiffres interm??diaires d'obligations. Un exemple de ceci est la mol??cule organique benz??ne , o?? l'ordre de liaison est de 1,5 pour chaque atome de carbone, ce qui signifie qu'il poss??de des liaisons 1,5 (trois parts ??lectrons) avec chacun de ses deux voisins.
Les types de liaison forte sont diff??rentes en raison de la diff??rence de ??lectron??gativit?? des ??l??ments constitutifs. Une grande diff??rence d'??lectron??gativit?? conduit ?? plus polaire (ionique) caract??re dans le lien.
Une liaison covalente
La liaison covalente est un type commun de liaison, dans lequel la diff??rence d'??lectron??gativit?? entre les atomes li??s est faible ou inexistante. Obligations au sein de la plupart des compos??s organiques sont d??crits comme covalente. Voir liaisons sigma et liaisons pi pour LCAO-description de cette liaison.
Un liaison covalente polaire est une liaison covalente avec un caract??re ionique important. Cela signifie que les ??lectrons sont plus proches l'un des atomes que l'autre, cr??ant ainsi un d??s??quilibre de la charge. Ils se produisent comme une liaison entre deux atomes mod??r??ment ??lectron??gativit??s diff??rentes, et donnent lieu ?? interactions dip??le-dip??le. L'??lectron??gativit?? de ces obligations est de 0,3 ?? 1,7.
Un liaison covalente coordonn??e est une o?? les deux ??lectrons de liaison sont de l'un des atomes impliqu??s dans la liaison. Ces obligations donnent lieu ?? Des acides de Lewis et des bases. Les ??lectrons sont partag??s ?? peu pr??s ??galement entre les atomes contrairement ?? une liaison ionique. Une telle liaison se produit dans des mol??cules telles que la ion ammonium (NH 4 +) et sont indiqu??s par une fl??che pointant sur l'acide de Lewis. Aussi connu comme liaison covalente non polaire, l'??lectron??gativit?? de ces obligations vont de 0 ?? 0,3.
Mol??cules qui sont form??s principalement de liaisons covalentes non polaires sont souvent non miscible dans l'eau ou d'autres solvants polaires , mais beaucoup plus soluble dans des solvants non polaires tels que hexane.
Liaison ionique
La liaison ionique est un type d'interaction ??lectrostatique entre les atomes qui ont une grande diff??rence d'??lectron??gativit??. Il n'y a aucune valeur pr??cise qui distingue ionique de liaison covalente, mais une diff??rence de ??lectron??gativit?? de plus de 1,7 est susceptible d'??tre ionique, et une diff??rence de moins de 1,7 est susceptible d'??tre covalente. Liaison ionique conduit ?? s??parer positifs et n??gatifs ions . Charges ioniques sont g??n??ralement entre -3 e ?? 3 e. Une liaison ionique se produit g??n??ralement dans les sels m??talliques tels que le chlorure de sodium (sel de table). Une caract??ristique typique de liaisons ioniques est que les esp??ces forment en cristaux ioniques, dans lesquels aucun ion est sp??cifiquement jumel?? avec ne importe quel autre ion unique, une liaison directionnelle sp??cifique. Au contraire, chaque esp??ce d'ion est entour?? par des ions de charge oppos??e, et l'espacement entre celui-ci et chacun des ions de charges oppos??es proches, est le m??me pour tous les atomes voisins du m??me type. Il ne est donc plus possible d'associer un ion avec un autre atome ionis??e unique sp??cifique ?? proximit??. Ce est une situation semblable ?? celle dans les cristaux covalentes, o?? des liaisons covalentes entre les atomes sp??cifiques sont encore discernable ?? partir des distances plus courtes entre elles, tel que mesur?? par des techniques telles que Diffraction aux rayons X.
Cristaux ioniques peuvent contenir un m??lange d'esp??ces covalentes et ioniques, comme par exemple des sels d'acides complexes, tels que le cyanure de sodium, NaCN. De nombreux min??raux sont de ce type. Diffration des rayons X montre que dans NaCN, par exemple, les liaisons entre le sodium cations (Na +) et le cyanure anions (CN -) sont ionique, sans l'ion sodium associ?? ?? tout cyanure particulier. Toutefois, les liaisons entre C et N atomes dans cyanure sont du type covalente, faisant de chaque partie du carbone et de l'azote associ?? ?? un seul de son type oppos??, ?? laquelle elle est physiquement plus proche qu'elle ne l'est ?? d'autres atomes de carbone ou atomes d'azote dans un le cyanure de sodium cristalline.
Lorsque ces cristaux sont fondus dans des liquides, les liaisons ioniques sont bris??s premier, car ils sont non-directionnel et permettent aux esp??ces charg??es de se d??placer librement. De m??me, lorsque ces sels se dissolvent dans l'eau, les liaisons ioniques sont g??n??ralement cass??es par l'interaction avec de l'eau, mais les liaisons covalentes continuent ?? tenir. Par exemple, en solution, les ions cyanure, toujours li??s ensemble comme simples CN - ions, se d??placer ind??pendamment ?? travers la solution, comme le font les ions sodium, sous forme de Na +. Dans l'eau, des ions charg??s se ??cartent parce que chacun d'entre eux sont plus fortement attir??s par un certain nombre de mol??cules d'eau, que de l'autre. L'attraction entre les ions et les mol??cules d'eau dans de telles solutions est due ?? un type de faiblesse dip??le-dip??le obligataire type chimique. Dans les compos??s ioniques fondus, les ions continuent d'??tre attir?? ?? l'autre, mais pas d'une fa??on ordonn??e ou cristalline.
Obligations un et trois ??lectrons
Obligations avec une ou trois ??lectrons peuvent ??tre trouv??s dans esp??ces radicalaires qui ont un nombre impair d'??lectrons. L'exemple le plus simple d'une liaison 1-??lectrons se trouve dans la Dihydrog??ne, H 2 +. Obligations ?? un ??lectron ont souvent de moiti?? l'??nergie de liaison d'une liaison ?? 2 ??lectrons, et sont donc appel??s ??obligations de moiti??". Cependant, il existe des exceptions: dans le cas de dilithium, le lien est en r??alit?? plus forte pour l'??lectron 1 Li + 2 que pour le 2 ??lectrons Li 2. Cette exception se explique en termes de hybridation et int??rieur-shell effets.
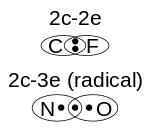
L'exemple le plus simple de liaison de trois ??lectrons se trouve sous le cation h??lium dim??re, Il 2 +, et peut ??galement ??tre consid??r??e comme une ??moiti?? liaison?? parce que, en termes d'orbitales mol??culaires, le troisi??me ??lectrons est dans un anti-collage orbital qui annule la moiti?? de la liaison form??e par les deux autres ??lectrons. Un autre exemple d'une mol??cule contenant une liaison 3-??lectrons, en plus de deux liaisons ?? 2 ??lectrons, est oxyde nitrique, NO. La mol??cule d'oxyg??ne, O 2 peut ??galement ??tre consid??r??e comme ayant deux liaisons 3-??lectrons et une liaison ?? 2 ??lectrons, ce qui explique son paramagn??tisme et son ordre de liaison officielle de deux. Le dioxyde de chlore et de ses analogues lourds dioxyde de brome et dioxyde d'iode contient ??galement trois liaisons ??lectrons.
Mol??cules avec des liaisons impair ??lectrons sont g??n??ralement tr??s r??actif. Ces types de liaisons ne sont stables entre les atomes avec ??lectron??gativit??s similaires.
Obligations Bent
Obligations Bent, ??galement connus comme les obligations de bananes, sont des obligations dans tendues ou autrement encombrement st??rique des mol??cules dont orbitales de liaison sont contraints ?? une forme de banane-comme. Bent obligations sont souvent plus sensibles aux r??actions que les obligations ordinaires.
3c-2e et 4e obligations 3c-
En obligations ?? deux ??lectrons de trois centres ("3c-2e") trois atomes part deux ??lectrons dans la liaison. Ce type de liaison se produit dans ??lectrons compos??s comme d??ficientes diborane. Chaque telle liaison (2 par mol??cule dans le diborane) contient une paire d'??lectrons qui relient les atomes de bore ?? l'autre en forme de banane, avec un proton (noyau d'un atome d'hydrog??ne) dans le milieu de la liaison, le partage des ??lectrons ?? la fois de bore atomes.
Obligations ?? trois centres de quatre ??lectrons ("3c-4E??) existent ??galement qui expliquent la liaison dans hypervalentes mol??cules. Dans certaines compos??s munitions, soi-disant obligations ?? deux ??lectrons de quatre centres ont ??galement ??t?? postul??e.
Dans certains conjugu?? π (pi) des syst??mes, tels que le benz??ne et d'autres les compos??s aromatiques (voir ci-dessous), et les solides de r??seau conjugu??s tels que graphite, les ??lectrons dans le syst??me conjugu?? de liaisons π-sont r??partis sur autant de centres nucl??aires qui existent dans la mol??cule, ou le r??seau.
Liaison aromatique
Dans la chimie organique , certaines configurations des ??lectrons et des orbitales d??duisent une stabilit?? suppl??mentaire ?? une mol??cule. Cela se produit lorsque orbitales π se chevauchent et se combinent avec d'autres sur diff??rents centres atomiques, formant une liaison longue port??e. Pour une mol??cule ?? aromatique, il doit ob??ir R??gle de H??ckel, o?? le nombre d'??lectrons π adapter la formule 4n + 2, o?? n est un entier. Les liaisons impliqu??es dans l'aromaticit?? sont tous plane.
Dans le benz??ne , le compos?? aromatique prototypique, 18 (n = 4) des ??lectrons de liaison se lient 6 atomes de carbone pour former une structure cyclique plane. Le lien ??ordre?? (nombre moyen d'obligations) entre les diff??rents atomes de carbone peut ??tre dit (18/6) /2=1.5, mais dans ce cas les obligations sont tous identiques du point de vue chimique. Ils peuvent parfois ??tre ??crites comme des liaisons simples alternant avec des doubles liaisons, mais la vue de toutes les obligations de l'anneau comme ??tant ??quivalente ?? environ 1,5 obligations en force, est beaucoup plus proche de la v??rit??.
Dans le cas de aromatiques h??t??rocycliques substitu??s et les benz??nes , les diff??rences d'??lectron??gativit?? entre les diff??rentes parties de l'anneau peuvent dominer le comportement chimique des obligations de noyaux aromatiques, qui sont par ailleurs ??quivalents.
Liaison m??tallique
Dans une liaison m??tallique, les ??lectrons de liaison sont d??localis??s sur un treillis d'atomes. En revanche, dans les compos??s ioniques, les emplacements de liaison des ??lectrons et leurs charges sont statiques. Le librement mobile ou d??localisation des ??lectrons de liaison conduit ?? des propri??t??s m??talliques classiques (telles que le lustre de r??flectivit?? de lumi??re de surface), ??lectrique et conductivit?? thermique, ductilit??, et de haute r??sistance ?? la traction.
Liaisons intermol??culaires
Il existe quatre types de base d'obligations qui peuvent ??tre form??s entre deux ou plusieurs (sinon non-associ??s) mol??cules, ions ou atomes. Provoquent des forces intermol??culaires des mol??cules ?? ??tre attir??s ou repouss??s par l'autre. Souvent, ceux-ci d??finissent une partie des caract??ristiques physiques (telles que le point de fusion ) d'une substance.
- Une grande diff??rence dans ??lectron??gativit?? entre deux atomes li??s entra??nera une s??paration permanente de charge, ou dip??le, dans une mol??cule ou ion. Deux ou plusieurs mol??cules ou d'ions avec des dip??les permanents peuvent interagir ?? l'int??rieur interactions dip??le-dip??le. Les ??lectrons de liaison ?? une mol??cule ou un ion seront, en moyenne, ??tre plus proche de l'atome plus ??lectron??gatif que le plus souvent une moins ??lectron??gatif, donnant lieu ?? charges partielles sur chaque atome, et causant des forces ??lectrostatiques entre les mol??cules ou des ions.
- Un liaison hydrog??ne est effectivement un bon exemple d'une interaction entre deux dip??les permanents. La grande diff??rence de ??lectron??gativit?? entre l'hydrog??ne et un de fluor , azote et oxyg??ne , coupl??s avec leurs paires d'??lectrons c??libataires risque de fortes forces ??lectrostatiques entre les mol??cules. Les liaisons hydrog??ne sont responsables des points d'??bullition ??lev??s de l'eau et de l'ammoniac par rapport ?? leurs analogues plus lourds.
- Le Forces de London se pose en raison de dip??les instantan??s dans les atomes voisins. Comme la charge n??gative de l' ??lectron ne est pas uniforme autour de l'atome entier, il ya toujours un d??s??quilibre de charge. Cette petite charge va induire un dip??le correspondant dans une mol??cule ?? proximit??; provoquant une attraction entre les deux. L'??lectron se d??place ensuite vers une autre partie de la nuage d'??lectrons et l'attraction est cass??.
- Un interaction cation-pi se produit entre un liaison pi et un cation.
R??sum??: ??lectrons dans des liaisons chimiques
Dans le (irr??aliste) limite de "pur" une liaison ionique, des ??lectrons sont parfaitement localis?? sur l'un des deux atomes dans la liaison. Ces obligations peuvent ??tre compris par la physique classique. Les forces entre les atomes sont caract??ris??s par continuum isotrope potentiels ??lectrostatiques. Leur ampleur est en proportion simple ?? la diff??rence de charge.
Les liaisons covalentes sont mieux comprises par la th??orie de la valence de liaison ou th??orie des orbitales mol??culaires. Les propri??t??s des atomes impliqu??s peuvent ??tre compris en utilisant des concepts tels que nombre d'oxydation. La densit?? d'??lectrons dans un liaison ne est pas affect??e ?? des atomes individuels, mais est plut??t d??localis??e entre les atomes. Dans la th??orie de liaison de valence, les deux ??lectrons sur les deux atomes sont coupl??s ensemble avec la force d'adh??rence en fonction du chevauchement entre eux. En th??orie des orbitales mol??culaires, la combinaison lin??aire d'orbitales atomiques (LCAO) permet de d??crire les structures orbitales mol??culaires d??localis??es et les ??nergies bas??es sur les orbitales atomiques des atomes dont ils sont issus. Contrairement aux obligations ioniques purs, des liaisons covalentes peuvent avoir dirig?? propri??t??s anisotropes.Ceux-ci peuvent avoir leurs propres noms, tels queliaison sigma et pi obligataire.
Dans le cas général, les atomes forment des liaisons qui sont intermédiaires entre ionique et covalente, selon le rapport électronégativité des atomes impliqués. Ce type de liaison est parfois appelée covalente polaire.
