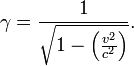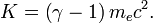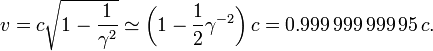??lectron
Contexte des ??coles Wikip??dia
Cette s??lection de wikipedia a ??t?? choisi par des b??n??voles aidant les enfants SOS de Wikipedia pour cette s??lection Wikipedia pour les ??coles. Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
 Estimations th??oriques de la densit?? ??lectronique pour les premi??res orbitales d'??lectrons d'atomes d'hydrog??ne repr??sent??s comme des sections transversales avec une densit?? de probabilit?? code couleur | |
| Composition | Particule ??l??mentaire |
|---|---|
| Statistiques | Fermion |
| G??n??ration | Premi??re |
| Interactions | Gravity , ??lectromagn??tique , Faible |
| Symbole | e -, β - |
| Antiparticule | Positron |
| Th??oris?? | G. Johnstone Stoney (1874) |
| D??couvert | JJ Thomson (1897) |
| Masse | 9,109 382 15 (45) ?? 10 -31 kg 5,485 799 09 (27) ?? 10 -4 u 1 / 1822,888 4843 (11) u |
| Charge ??lectrique | -1,602 176 487 (40) ?? 10 -19 C |
| Tourner | ?? |
L'??lectron est un fondamental particule subatomique qui porte un n??gatif charge ??lectrique . Ce est un spin ?? lepton qui participe ?? des interactions ??lectromagn??tiques , et sa masse est d'environ  de celle du proton . Avec les noyaux atomiques , qui sont constitu??s de protons et les neutrons , les ??lectrons repr??sentent des atomes. Leur interaction avec des noyaux adjacents est la principale cause de la liaison chimique .
de celle du proton . Avec les noyaux atomiques , qui sont constitu??s de protons et les neutrons , les ??lectrons repr??sentent des atomes. Leur interaction avec des noyaux adjacents est la principale cause de la liaison chimique .
Histoire
L'??lectron de nom vient du mot grec pour ambre , ήλεκτρον. Ce mat??riau a jou?? un r??le essentiel dans la d??couverte des ph??nom??nes ??lectriques. Les anciens Grecs savaient, par exemple, que le frottement d'un morceau d'ambre avec de la fourrure a laiss?? une charge ??lectrique sur sa surface, ce qui pourrait alors cr??er une ??tincelle lorsqu'il est amen?? ?? proximit?? d'un objet ?? la terre. Pour plus sur l'histoire de l'??lectricit?? ?? long terme, voir Histoire de l'??lectricit??.
L'??lectron comme une unit?? de charge en ??lectrochimie a ??t?? pos?? par G. Johnstone Stoney en 1874, qui a aussi invent?? l'??lectron terme en 1894.
Dans cet article, une estimation a ??t?? faite de la quantit?? r??elle de cette unit?? fondamentale la plus remarquable de l'??lectricit??, pour laquelle je ai depuis os?? sugg??rer l'??lectron de nom.- Stoney, George Johnstone (Octobre 1894). "De la" Electron ", ou Atom de l'??lectricit??". Philosophical Magazine 38 (5): 418-420. http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Stoney-1894.html.
?? la fin des ann??es 1890, un certain nombre de physiciens pos?? que l'??lectricit?? pourrait ??tre con??ue comme ??tant en unit??s distinctes, qui ont ??t?? donn??s une vari??t?? de noms, mais la r??alit?? de ces unit??s ne avait pas ??t?? confirm??e d'une mani??re convaincante.
La d??couverte que l'??lectron est un particule subatomique a ??t?? faite en 1897 par JJ Thomson ?? la Cavendish Laboratory de l'Universit?? de Cambridge , alors qu'il ??tudiait tubes ?? rayons cathodiques. Un tube ?? rayons cathodiques est un tube en verre scell??, dans lequel deux ??lectrodes sont s??par??es par un vide. Lorsqu'une tension est appliqu??e entre les ??lectrodes, les rayons cathodiques sont g??n??r??s, ce qui provoque le tube incandescent. Par l'exp??rimentation, Thomson a d??couvert que la charge n??gative ne peut pas ??tre s??par?? des rayons (par l'application de magn??tisme), et que les rayons peut ??tre d??vi?? par un champ ??lectrique. Il a conclu que ces rayons, plut??t que d'??tre vagues, ont ??t?? compos?? de particules charg??es n??gativement qu'il a appel?? "corpuscules". Il a mesur?? leur rapport masse-charge et trouv?? que ce ??tait plus de mille fois inf??rieure ?? celle d'un ion d'hydrog??ne, ce qui sugg??re qu'ils ??taient tr??s fortement charg??s ou tr??s petite masse. Des exp??riences ult??rieures par d'autres scientifiques ont confirm?? la derni??re conclusion. Leur rapport de masse sur charge est ??galement ind??pendante du choix du mat??riau de cathode et le gaz initialement dans le tube ?? vide. Cela a conduit Thomson ?? conclure qu'ils ??taient universelle entre tous les mat??riaux.
La charge de l'??lectron a ??t?? soigneusement mesur??e par RA Millikan dans son exp??rience de 1909 oil-drop.
La loi p??riodique indique que les propri??t??s chimiques des ??l??ments se r??p??tent largement p??riodiquement et est le fondement de la table p??riodique des ??l??ments. La loi elle-m??me a d'abord ??t?? expliqu?? par le masse atomique de l'??l??ment. Cependant, comme il y avait des anomalies dans le tableau p??riodique, des efforts ont ??t?? faits pour trouver une meilleure explication. En 1913, Henry Moseley a introduit le concept de la num??ro atomique et a expliqu?? la loi p??riodique en termes de nombre de protons chaque ??l??ment a. Dans la m??me ann??e, Niels Bohr a montr?? que les ??lectrons sont le fondement r??el de la table. En 1916, Gilbert Newton Lewis explique la liaison chimique des ??l??ments par des interactions ??lectroniques.
Classification
L'??lectron est dans la classe de particules subatomiques appel?? leptons, qui sont cens??es ??tre particules fondamentales.
Comme pour toutes les particules, les ??lectrons peuvent ??galement agir comme des ondes. Cela se appelle la dualit?? onde-particule , ??galement connu sous le terme compl??mentarit?? invent?? par Niels Bohr , et peut ??tre d??montr??e en utilisant la Fentes de Young.
L'antiparticule de l'??lectron est le positons, qui a charge positive plut??t que n??gative. Le d??couvreur du positron, Carl D. Anderson, a propos?? d'appeler standards n??gatons ??lectrons, et en utilisant des ??lectrons comme un terme g??n??rique pour d??crire les deux variantes charg??es positivement et n??gativement. Cet usage est parfois rencontr?? aujourd'hui.
Propri??t??s et le comportement
Les ??lectrons ont une charge ??lectrique de -1,6021765 ?? 10 -19 Coulomb, une masse de 9,11 ?? 10 -31 kg bas??e sur des mesures de charge / masse et un relativiste masse au repos d'environ 0,511 MeV / c ??. La masse de l'??lectron est d'environ 1/1836 de la masse du proton . Le symbole d'??lectrons commune est e -. Electron dur??e de vie moyenne est> 4.6x10 26 ann??es (voir d??sint??gration de particules).
Selon la m??canique quantique , les ??lectrons peuvent ??tre repr??sent??s par fonctions d'onde, ?? partir duquel un calcul??s probabiliste densit?? ??lectronique peut ??tre d??termin??e. Le orbital de chaque ??lectron dans un atome peut ??tre d??crit par une fonction d'onde. Sur la base de la Principe d'incertitude de Heisenberg, l'exacte dynamique et la position de l'??lectron r??elle ne peut ??tre d??termin??e simultan??ment. Ce est une limitation qui, dans ce cas, indique simplement que le plus de pr??cision, nous savons la position d'une particule, le moins de pr??cision que nous pouvons conna??tre son ??lan, et vice versa.
L'??lectron a de spin ?? et est un fermion (il se ensuit Fermi-Dirac statistiques). En plus de son moment angulaire intrins??que, un ??lectron a un intrins??que moment magn??tique le long de son axe de rotation.
Les ??lectrons dans un atome sont li??s ?? cet atome, tandis que les ??lectrons se d??placent librement dans le vide, l'espace ou certains m??dias sont des ??lectrons libres qui peuvent ??tre ax??s dans un faisceau d'??lectrons. Quand les ??lectrons libres se d??placent, il existe un flux net de frais, et ce flux est appel?? un courant ??lectrique. Le vitesse de d??rive des ??lectrons dans les fils m??talliques est de l'ordre de quelques millim??tres par seconde. Cependant, la vitesse ?? laquelle un courant ?? un moment donn?? dans un fil provoque un courant dans d'autres parties du fil, la vitesse de propagation, est g??n??ralement 75% de la vitesse de la lumi??re.
Dans certains supraconducteurs , paires d'??lectrons se d??placent comme Paires de Cooper dans lequel leur mouvement est coupl?? ?? la mati??re ?? proximit?? via vibrations du r??seau appel??s phonons. La distance de s??paration entre les paires de Cooper est d'environ 100 nm. (Rohlf, JW)
Un corps a une charge ??lectrique lorsque cette instance a plus ou moins d'??lectrons que sont n??cessaires pour ??quilibrer la charge positive des noyaux. Quand il ya un exc??s d'??lectrons, l'objet est dit ??tre charg?? n??gativement. Quand il ya moins d'??lectrons que des protons , l'objet est dit ??tre charg?? positivement. Lorsque le nombre d'??lectrons et le nombre de protons sont ??gaux, leurs charges se annulent mutuellement et l'objet est dit ??tre ??lectriquement neutre. Un corps macroscopique peut d??velopper une charge ??lectrique par frottement, par le ph??nom??ne de tribo??lectricit??.
Quand les ??lectrons et positrons entrent en collision, elles an??antir l'autre et produire des paires de haute ??nergie des photons ou d'autres particules. D'autre part, les photons de haute ??nergie peuvent se transformer en un ??lectron et un positon par un processus appel?? la production de paires, mais seulement en pr??sence d'une particule charg??e ?? proximit??, comme un noyau.
L'??lectron est d??crit comme un particule fondamentale ou primaire. Il n'a pas connue sous-structure. Ainsi, pour plus de commodit??, il est g??n??ralement d??fini ou suppos?? ??tre un point-like math??matique charge ponctuelle, sans extension spatiale. Cependant, quand une particule de test est forc?? de se approcher un ??lectron, nous mesurons les changements dans ses propri??t??s ( frais et de masse ). Cet effet est commun ?? toutes les particules ??l??mentaires. La th??orie actuelle sugg??re que cet effet est d?? ?? l'influence de les fluctuations du vide dans son espace local, de sorte que les propri??t??s mesur??es ?? partir d'une distance significative sont consid??r??es comme la somme des propri??t??s nues et les effets de vide (voir renormalisation ).
Le ??lectron est 2,8179 x 10 -15 m. Ce est le rayon qui est d??duite de la charge ??lectrique de l'??lectron, en utilisant le th??orie classique de seule l'??lectrodynamique, ignorant la m??canique quantique . Classique ??lectrodynamique ( Maxwell ??lectrodynamique s ') est l'ancien concept qui est largement utilis?? pour des applications pratiques de l'??lectricit??, g??nie ??lectrique, la physique des semi-conducteurs, et l'??lectromagn??tisme. ??lectrodynamique quantique, d'autre part, est utile pour des applications impliquant la physique des particules moderne et certains aspects de la optique, laser et la physique quantique.
Sur la base de la th??orie actuelle, la vitesse d'un ??lectron peut se approcher, mais jamais atteindre, c (la vitesse de la lumi??re dans le vide). Cette limitation est attribu?? ?? la th??orie d'Einstein de la relativit?? restreinte qui d??finit la vitesse de la lumi??re comme une constante dans tous les r??f??rentiels inertiels. Toutefois, lorsque relativiste des ??lectrons sont inject??s dans un milieu di??lectrique tel que l'eau, o?? la vitesse de la lumi??re locale est nettement inf??rieur ?? c, les ??lectrons (temporairement) voyagent vite que la lumi??re dans le milieu. Comme ils interagissent avec le milieu, ils g??n??rent une lumi??re bleut??e appel?? Rayonnement Tcherenkov.
Les effets de la relativit?? sont bas??es sur une quantit?? appel??e ou le γ Facteur de Lorentz. γ est une fonction de v, la vitesse de coordonn??es de la particule. Il est d??fini comme:
L'??nergie cin??tique n??cessaire pour acc??l??rer un ??lectron est:
Par exemple, le Lin??aire de Stanford acc??l??rateur peut acc??l??rer un ??lectron ?? environ 51 GeV . Cela donne un gamma de 100 000, car la masse d'un ??lectron est 0,51 MeV / c ?? (l'impulsion relativiste de cet ??lectron est 100.000 fois la dynamique classique d'un ??lectron ?? la m??me vitesse). R??solution de l'??quation ci-dessus pour la vitesse de l'??lectron (et en utilisant une approximation pour grand γ) donne:
Le longueur d'onde de Broglie d'une particule est λ = h / p o?? h est P constante et de Planck est dynamique. Aux ??nergies faibles (par exemple photo??lectrons) ce qui d??termine la taille des atomes, et au ??lev??es (par exemple au microscope ??lectronique) ??nergies ce qui rend le Pour des angles de Bragg diffraction d'??lectrons (co-d??couvert par JJ Thomson fils d ' GP Thomson) bien sous un degr??. Depuis ??lan est la masse multipli??e par bon-vitesse w = γv, nous avons
Pour l'??lectron GeV 51 ci-dessus, bon-vitesse est d'environ Yc, rendant la longueur d'onde de ces ??lectrons suffisamment petites pour explorer structures bien inf??rieure ?? la taille d'un noyau atomique.
Visualisation
Les premi??res images vid??o d'un ??lectron ont ??t?? captur??s par une ??quipe de l'Universit?? de Lund en Su??de en F??vrier 2008. Pour capturer cet ??v??nement, les scientifiques ont utilis?? extr??mement courts ??clairs de lumi??re. Pour produire cette lumi??re, technologie nouvellement d??velopp??e pour g??n??rer des impulsions courtes de la lumi??re laser intense, appel??es impulsions attosecondes, permis ?? l'??quipe de la Facult?? de g??nie de l'universit?? de capturer le mouvement de l'??lectron pour la premi??re fois.
"Il faut environ 150 attosecondes ?? un ??lectron pour encercler le noyau d'un atome. Une attoseconde est li??e ?? une seconde ce qu'une seconde est li??e ?? l'??ge de l'univers", a expliqu?? Johan Mauritsson, professeur assistant en physique atomique ?? la Facult?? de g??nie, Universit?? de Lund.
Vid??o est disponible ici:
En pratique
Dans l'univers
Les scientifiques croient que le nombre d'??lectrons dans la existantes connu univers est d'au moins 10 79. Ce nombre ??quivaut ?? une densit?? moyenne d'environ un ??lectron par m??tre cube d'espace. Les astronomes ont estim?? que 90% de la masse des atomes dans l'univers est un atome d'hydrog??ne , qui est constitu?? d'un ??lectron et un proton.
Dans l'industrie
Faisceaux d'??lectrons sont utilis??s dans le soudage , lithographie, microscopes ??lectroniques ?? balayage et microscopes ??lectroniques ?? transmission. LEED et RHEED sont des techniques d'imagerie de surface qui utilisent des ??lectrons.
Les ??lectrons sont ??galement au c??ur des les tubes ?? rayons cathodiques, qui sont largement utilis??s en tant que dispositifs d'affichage d'instruments de laboratoire, les ??crans d'ordinateur et t??l??viseurs. Dans un Tube photomultiplicateur, un photon frappe la photocathode, l'ouverture d'une avalanche d'??lectrons qui produit un courant d??tectable.
Au laboratoire
Le ratio exceptionnellement ??lev?? charge-masse des ??lectrons signifie qu'ils interagissent fortement avec des atomes, et sont faciles ?? acc??l??rer et concentrer avec des champs ??lectriques et magn??tiques. Ainsi certains des aujourd'hui transmission d'aberration corrig??e microscopes ??lectroniques utilisent les ??lectrons 300keV avec des vitesses sup??rieures ?? la vitesse de la lumi??re dans l'eau, deux longueurs d'onde inf??rieures picom??tres, transversales coh??rence largeurs plus d'un nanom??tre, et la coh??rence-largeurs longitudinales 100 fois que, ?? l'image de la diffusion de l'individu atomique noyaux ( HAADF) ainsi que les interf??rences de contraste solide sp??cimen sortie surface deBroglie-phase ( HRTEM) avec lat??ral ponctuelles r??solutions ?? 60 picom??tres. Grossissements approchant 100 millions sont n??cessaires pour faire le d??tail de l'image r??sultant confortablement visible ?? l'??il nu.
Les effets quantiques des ??lectrons sont ??galement utilis??s dans le microscope ?? effet tunnel, pour ??tudier les caract??ristiques sur des surfaces solides avec lat??ral r??solution ?? l'??chelle atomique (environ 200) et verticales picom??tres-r??solutions beaucoup mieux que cela. En plus de la forte d??pendance de tunnel quantique sur la s??paration pointe-??chantillon, la sensibilit?? verticale d??coule de la commande ??lectronique pr??cise de la s??paration possible avec une scanner pi??zo??lectrique.
En m??decine
En la radioth??rapie, des faisceaux d'??lectrons sont utilis??s pour le traitement de tumeurs superficielles.
En th??orie
Dans le mod??le de Dirac, un ??lectron est d??fini comme ??tant un point math??matique, une particule ponctuelle, charg??e "nu" entour?? d'une mer de paires d'interaction des virtuelle particules et antiparticules. Ceux-ci fournissent une correction d'un peu plus de 0,1% de la valeur pr??dite de l'??lectron de rapport gyromagn??tique d'exactement deux (comme pr??dit par le mod??le unique de particules de Dirac). L'accord d'une pr??cision extraordinaire de cette pr??diction avec la valeur d??termin??e exp??rimentalement est consid??r??e comme l'une des grandes r??alisations de la physique moderne.
Dans le mod??le standard de la physique des particules , l'??lectron est le Pr??nom g??n??ration charg??e lepton. Il forme un faible doublet de isospin avec le neutrino ??lectron; ces deux particules interagissent les uns avec les autres ?? la fois par le courant charg?? et neutre interaction faible. L'??lectron est tr??s semblable aux deux autres particules massives des g??n??rations plus ??lev??es, la muon et le tau lepton, qui sont identiques en charge, rotation, et l'interaction, mais une diff??rence de masse.
Le antimati??re homologue de l'??lectron est le positron. Le positron a la m??me quantit?? de charge ??lectrique de l'??lectron, sauf que la charge est positive. Il a la m??me masse et de spin de l'??lectron. Quand un ??lectron et un positron se rencontrent, ils peuvent annihiler l'un l'autre, donnant lieu ?? deux photons gamma ??mis ?? peu pr??s 180 ?? par rapport ?? l'autre. Si l'??lectron et positron avaient dynamique n??gligeable, chaque rayon gamma aura une ??nergie de 0,511 MeV. Voir ??galement ??re leptonique.
Les ??lectrons sont un ??l??ment cl?? de l'??lectromagn??tisme , une th??orie qui est pr??cis pour les syst??mes macroscopiques, et pour la mod??lisation classique de syst??mes microscopiques.
| |||||