
Tableau p??riodique
Contexte des ??coles Wikip??dia
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
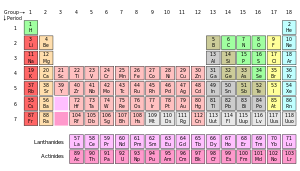
Le tableau p??riodique est un affichage tabulaire des ??l??ments chimiques , organis?? sur la base de leurs num??ros atomiques , configurations ??lectrons, et r??current propri??t??s chimiques. Les ??l??ments sont pr??sent??s en ordre croissant de num??ro atomique (nombre de protons). La forme standard de table comprend une grille 18 ?? 7 ou corps principal des ??l??ments, positionn?? au-dessus d'une double rang??e de petits ??l??ments. La table peut ??galement ??tre d??construit en quatre blocs rectangulaires: la s-bloc vers la gauche, la p-bloc vers la droite, la d-bloc dans le milieu, et la f-bloc dessous. Les lignes de la table sont appel??s p??riodes; les colonnes des S-, D-, et les p-blocs sont appel??s groupes, avec certains de ces noms ayant tels que les halog??nes ou les gaz rares . Puisque, par d??finition, un tableau p??riodique incorpore tendances r??currentes, un tel tableau peuvent ??tre utilis??es pour obtenir des relations entre les propri??t??s des ??l??ments et de pr??dire les propri??t??s de la nouvelle, encore ?? d??couvrir ou synth??tis??, ??l??ments. En cons??quence, une table, que ce soit p??riodique sous la forme standard ou une autre variante-fournit un cadre utile pour l'analyse du comportement chimique, et ces tables sont largement utilis??s dans la chimie et autres sciences.
Bien que pr??curseurs existent, Dmitri Mendele??ev est g??n??ralement cr??dit?? de la publication, en 1869, du premier tableau p??riodique largement reconnue. Il a d??velopp?? sa table pour illustrer les tendances p??riodiques dans les propri??t??s des ??l??ments alors connus. Mendele??ev pr??dit ??galement certaines propri??t??s de ??l??ments alors inconnus qui seraient attendus pour combler les lacunes dans ce tableau. La plupart de ses pr??dictions se av??rent exactes lorsque les ??l??ments en question ont ensuite ??t?? d??couverts. Tableau p??riodique de Mendele??ev a depuis ??t?? ??largi et affin?? avec la d??couverte ou la synth??se d'autres nouveaux ??l??ments et le d??veloppement de nouveaux mod??les th??oriques pour expliquer le comportement chimique.
Tous les ??l??ments de num??ros atomiques 1 ( d'hydrog??ne ) ?? 118 ( ununoctium ) ont ??t?? d??couverts ou synth??tis??. Parmi ceux-ci, tout jusqu'?? et y compris californium existe naturellement; le reste ne ont ??t?? synth??tis??s dans les laboratoires. Production d'??l??ments au-del?? ununoctium se poursuit, avec la question de la fa??on dont le tableau p??riodique peut ??tre n??cessaire de modifi?? pour accueillir de tels ajouts ??tant une question de d??bat. Nombreux synth??tique radionucl??ides d'??l??ments naturels ont ??galement ??t?? produits dans les laboratoires.
Disposition
| Tableau p??riodique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Groupe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||||||||||||||
| ↓ P??riode | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 1 H | 2 Il | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 3 Li | 4 ??tre | 5 B | 6 C | 7 N | 8 O | 9 Fa | 10 Ne | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K | 20 Californie | 21 Caroline du Sud | 22 Ti |
23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 G??orgie | 32 Ge | 33 Comme | 34 Se |
35 Br | 36 Kr | ||||||||||||||||||||||||||||||||||||||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd |
47 Ag | 48 CD | 49 En | 50 Sn | 51 Sb | 52 Te | 53 Je | 54 Xe | ||||||||||||||||||||||||||||||||||||||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta |
74 W | 75 R?? | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 ?? | 86 Rn |
||||||||||||||||||||||||||||||||||||||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo | ||||||||||||||||||||||||||||||||||||||
| * lanthanides | 57 La | 58 Ce | 59 Pr | 60 Dakota du Nord | 61 Pm | 62 Sm | 63 Ue | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 YB | 71 Lu | |||||||||||||||||||||||||||||||||||||||||
| ** actinides | 89 Un C | 90 Th | 91 Pennsylvanie | 92 U | 93 Np | 94 Pu | 95 Suis | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 Aucun |
103 Lr | |||||||||||||||||||||||||||||||||||||||||
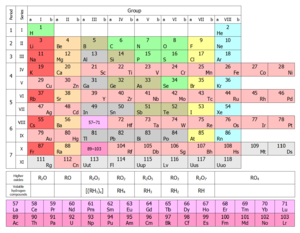
Ce est un 18-colonne tableau p??riodique pr??sentation, ce qui est venu ?? ??tre appel?? la forme commune ou de la norme, en raison de sa popularit??. Il est aussi parfois appel??e la forme longue, en comparaison ?? la forme courte ou Mendele??ev de style, qui omet les groupes 3-12 en pla??ant leurs ??l??ments dans les groupes principaux. Le grande table p??riodique int??gre les lanthanides et les actinides , plut??t que de les s??parer du corps principal de la table afin d'??conomiser de l'espace. Le tableau p??riodique ??tendu ajoute les p??riodes 8e et 9e, y compris le superactinides. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Toutes les versions de la table p??riodique des ??l??ments chimiques ne comprennent que, non les m??langes, les compos??s , ou particules subatomiques. Chaque ??l??ment chimique a un num??ro atomique unique repr??sentant le nombre de protons dans son noyau. La plupart des ??l??ments ont des nombres diff??rents de neutrons parmi des atomes diff??rents, avec ces variantes ??tant d??sign??es comme ??tant des isotopes . Par exemple, le carbone a trois isotopes naturels: l'ensemble de ses atomes poss??dent six protons et la plupart ont six neutrons aussi bien, mais environ un pour cent de sept neutrons, et une tr??s petite fraction avoir huit neutrons. Les isotopes ne sont jamais s??par??s dans le tableau p??riodique; ils sont toujours regroup??s dans un seul ??l??ment. ??l??ments sans isotopes stables ont les masses atomiques de leurs isotopes les plus stables, o?? ces masses sont repr??sent??s, figurant entre parenth??ses.
Dans le tableau p??riodique standard, les ??l??ments sont ??num??r??s en ordre croissant de num??ro atomique (nombre de protons dans le noyau d'un atome). Une nouvelle ligne ( p??riode) est commenc?? quand une nouvelle couche ??lectronique a son premier ??lectron. (Colonnes groupes) sont d??termin??es par la configuration d'??lectrons de l'atome; ??l??ments avec le m??me nombre d'??lectrons dans un sous-shell notamment tombent dans les m??mes colonnes (par exemple l'oxyg??ne et le s??l??nium sont dans la m??me colonne, car ils ont tous deux quatre ??lectrons dans le p-sous-shell ?? l'ext??rieur). Les ??l??ments ayant des propri??t??s chimiques semblables se retrouvent g??n??ralement dans le m??me groupe dans le tableau p??riodique, bien que dans le bloc f, et ?? certains ??gards ?? la d-bloc, les ??l??ments de la m??me p??riode ont tendance ?? avoir des propri??t??s similaires, aussi bien. Ainsi, il est relativement facile de pr??dire les propri??t??s chimiques d'un ??l??ment, si l'on conna??t les propri??t??s des ??l??ments qui l'entourent.
?? partir de 2012, le tableau p??riodique contient 118 ??l??ments chimiques confirm??s. Parmi ces ??l??ments, 114 ont ??t?? officiellement reconnu et nomm?? par le Union internationale de chimie pure et appliqu??e (UICPA). Un total de 98 de ces se produisent naturellement, dont 84 sont primordiale. Les 14 autres ??l??ments naturels se produisent seulement dans cha??nes d'??l??ments primordiaux de d??sint??gration. Tous les ??l??ments de einsteinium ?? copernicium , ainsi que Fl??rovium et Livermorium, tout en ne se trouve naturellement dans l'univers, ont ??t?? d??ment synth??tis?? et reconnue officiellement par l'IUPAC. ??l??ments 113 , 115 , 117 et 118 auraient ??t?? synth??tis?? en laboratoire, mais ces rapports ne ont pas encore ??t?? confirm??s. En tant que telle de ces ??l??ments sont actuellement connues que par leurs noms d'??l??ments syst??matiques, en fonction de leurs nombres atomiques. Aucun ??l??ment plus lourd que einsteinium (??l??ment 99) n'a jamais ??t?? observ?? dans des quantit??s macroscopiques dans sa forme pure. Aucun ??l??ment derni??res 118 ont ??t?? synth??tis??s ?? partir de 2012.
Regroupement m??thodes
Groupes
Un groupe ou de la famille est une colonne verticale dans le tableau p??riodique. Groupes ont g??n??ralement tendances p??riodiques plus importantes que les p??riodes et les blocs, expliqu??es ci-dessous. Modernes th??ories de m??canique quantique de la structure atomique expliquent les tendances de groupe en proposant que des ??l??ments au sein du m??me groupe ont g??n??ralement configurations d'??lectrons m??mes dans leur shell valence. Par cons??quent, les ??l??ments du m??me groupe ont tendance ?? avoir une chimie partag??e et pr??sentent une tendance claire dans les propri??t??s avec l'augmentation de nombre atomique. Cependant, dans certaines parties du tableau p??riodique, tels que le d-bloc et le bloc f, similitudes horizontales peuvent ??tre aussi importantes, sinon plus prononc?? que, similitudes verticales.
En vertu d'une convention de nommage internationale, les groupes sont num??rot??es num??riquement 1-18 de la colonne de gauche (les m??taux alcalins) ?? la colonne de droite (les gaz nobles). Auparavant, ils ??taient connus par les chiffres romains . En Am??rique, les chiffres romains ont ??t?? suivis soit par un ??A?? si le groupe ??tait dans le s- ou p-bloc, ou un "B" si le groupe a particip?? ?? la D-Block. Les chiffres romains utilis??s correspondent au dernier chiffre de la convention de nommage d'aujourd'hui (par exemple, le groupe 4 ??l??ments ??taient le groupe IVB, et de la groupe 14 ??l??ments ??tait groupe IVA). En Europe, le lettrage est similaire, sauf que ??A?? a ??t?? utilis?? si le groupe ??tait avant groupe 10, et ??B?? a ??t?? utilis?? pour les groupes, y compris et apr??s groupe 10. En outre, des groupes 8, 9 et 10 utilis??s pour ??tre trait??s comme un groupe triple de taille, connu collectivement dans les deux notations que groupe VIII. En 1988, le nouveau syst??me de nommage de l'UICPA a ??t?? mis en service, et les anciens noms de groupe ont ??t?? d??sapprouv??e.
| Groupe | Nom |
|---|---|
| 1 | les m??taux alcalins |
| 2 | m??taux alcalino-terreux |
| 11 | m??taux monnayage |
| 12 | m??taux volatils (rarement utilis??) |
| 13 | icosagens (rarement utilis??) |
| 14 | crystallogens (rarement utilis??) |
| 15 | pnictogens |
| 16 | chalcog??nes |
| 17 | halog??nes |
| 18 | gaz nobles (rarement aerogens ) |
Certains de ces groupes ont ??t?? donn??s triviales noms (non syst??matiques), comme on le voit dans le tableau ?? droite, m??me si certains sont rarement utilis??s. Groupes 3-10 ne ont pas de noms triviaux et sont appel??s simplement par leurs num??ros de groupe ou par le nom du premier membre de leur groupe (tels que 'le groupe de scandium ??pour Groupe 3), car ils affichent moins de similitudes et / ou les tendances verticales.
??l??ments du m??me groupe ont tendance ?? montrer des mod??les dans rayon atomique, ??nergie d'ionisation, et ??lectron??gativit??. De haut en bas dans un groupe, le rayon atomique des ??l??ments augmente. Comme il existe des niveaux d'??nergie plus remplis, les ??lectrons de valence se trouvent plus loin du noyau. Du sommet, chaque ??l??ment successif a une ??nergie d'ionisation inf??rieure, car il est plus facile de retirer un ??lectron depuis les atomes sont moins ??troitement li??s. De m??me, un groupe a un haut en bas d'??lectron??gativit?? diminution due ?? une augmentation de la distance entre les ??lectrons de valence et le noyau. Il ya des exceptions ?? ces tendances, cependant, un exemple de ce qui se produit dans groupe 11 o?? ??lectron??gativit?? augmente plus bas du groupe.
P??riodes
Une p??riode est une ligne horizontale dans le tableau p??riodique. Bien que les groupes ont g??n??ralement tendances p??riodiques les plus importants, il ya des r??gions o?? les tendances horizontales sont plus importants que les tendances de groupe verticaux, tels que le f-bloc, o?? les lanthanides et actinides forment deux s??ries horizontale important d'??l??ments.
??l??ments pour la m??me p??riode montrent les tendances dans le rayon atomique, ??nergie d'ionisation, affinit?? ??lectronique, et ??lectron??gativit??. Se d??pla??ant de gauche ?? droite sur une p??riode, rayon atomique diminue habituellement. Cela se produit parce que chaque ??l??ment successif a un proton et d'ajouter ??lectrons qui provoque l'??lectron ?? ??tre tir??e plus pr??s du noyau. Cette diminution de rayon atomique provoque ??galement l'??nergie d'ionisation ?? augmenter lorsque se d??pla??ant de gauche ?? droite sur une p??riode. L'un ??l??ment plus ??troitement li?? est, plus l'??nergie est n??cessaire pour enlever un ??lectron. ??lectron??gativit?? augmente de la m??me mani??re que l'??nergie d'ionisation en raison de la traction exerc??e sur les ??lectrons par le noyau. Affinit?? ??lectronique montre ??galement une l??g??re tendance sur une p??riode. Metals (c??t?? gauche d'une p??riode) ont g??n??ralement une plus faible affinit?? d'??lectrons de non-m??taux (c??t?? droit d'une p??riode), ?? l'exception des gaz nobles.
Blocs
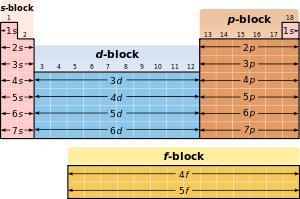
En raison de l'importance de la coque la plus externe d'??lectrons, les diff??rentes r??gions de la classification p??riodique sont parfois appel??es blocs, nomm??es en fonction de la sous-couche dans laquelle l'??lectron "dernier" r??side. Le s-bloc comprend les deux premiers groupes (m??taux alcalins et de m??taux alcalino-terreux), ainsi que l'hydrog??ne et l'h??lium. Le p-bloc comprend les six derniers groupes qui sont des groupes 13 ?? 18 de l'IUPAC (3A ?? 8A en Am??rique) et contient, entre autres ??l??ments, tous les m??tallo??des. Le d-bloc comprend des groupes 3 ?? 12 dans UICPA (2B ou 3B de num??rotation de groupe en am??ricain) et contient tous les m??taux de transition. Le bloc f, g??n??ralement compens??e en dessous du reste de la table p??riodique, comprend les lanthanides et les actinides.
D'autres conventions et variations
Dans les pr??sentations du tableau p??riodique, les lanthanides et les actinides sont habituellement pr??sent??s comme deux rang??es suppl??mentaires ci-dessous le corps principal de la table, avec des emplacements ou bien un seul ??l??ment s??lectionn?? de chaque s??rie (soit le lanthane ou le lut??tium, et soit l'actinium ou lawrencium , respectivement) pr??sent??e dans une seule cellule de la table principale, entre le baryum et le hafnium , et le radium et rutherfordium , respectivement. Cette convention est enti??rement une question d'esth??tique et praticit?? formatage; un rarement utilis?? tableau p??riodique grand format ins??re le lanthanides et des actinides ?? leur place, comme des parties de sixi??me et septi??me lignes du tableau (p??riodes).
 | 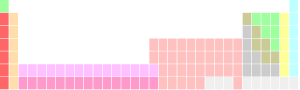 |
| Tableau p??riodique avec bloc f s??par??s (gauche) et en ligne (?? droite) | |
Certains tableaux p??riodiques comprennent un divisant la ligne, ou ??quivalent, entre les m??taux et non-m??taux. Diverses autres cat??gories d'??l??ments peuvent ??galement ??tre mis en ??vidence sur un tableau p??riodique, y compris, par exemple, des m??taux de transition , post-transition m??taux, ou m??tallo??des. Groupes sp??cialis??s comme le m??taux r??fractaires et la des m??taux nobles, qui sont des sous-ensembles (dans cet exemple) des m??taux de transition, sont ??galement connus et parfois d??sign??s.
Tendances p??riodiques
Configuration ??lectronique

La configuration ??lectronique ou l'organisation d'??lectrons en orbite autour atomes neutres montre un sch??ma r??current ou de la p??riodicit??. Les ??lectrons occupent une s??rie de coquilles d'??lectrons (coque num??rot??e 1, shell 2, et ainsi de suite). Chaque coquille est constitu??e d'un ou plusieurs sous-couches (s nomm??s, p, d, f et g). Comme num??ro atomique augmente, les ??lectrons remplissent progressivement ces coquilles et sous-couches plus ou moins en fonction de la Madelung r??gle ou d'??nergie r??gle de commande, comme indiqu?? dans le sch??ma de droite. La configuration d'??lectrons pour n??on , par exemple, est de 1 s 2 s 2 2 2p 6. Avec un num??ro atomique de dix, le n??on a deux ??lectrons dans la premi??re enveloppe, et huit ??lectrons dans la seconde coque-deux dans la sous-couche s et six dans le sous-shell p. Pour ce qui est de la table p??riodique, la premi??re fois qu'un ??lectron occupe une nouvelle coquille correspond au d??but de chaque nouvelle p??riode, ces positions ??tant occup??es par un atome d'hydrog??ne et les m??taux alcalins .
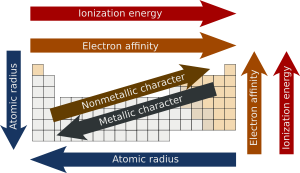
Depuis les propri??t??s d'un ??l??ment sont principalement d??termin??es par sa configuration ??lectronique, les propri??t??s des ??l??ments montrent ??galement des motifs ou comportement p??riodique, quelques exemples qui sont pr??sent??s dans le diagramme sur la gauche r??currents. Ce est cette p??riodicit?? des propri??t??s, manifestations dont ont ??t?? bien remarqu?? avant la th??orie sous-jacente a ??t?? d??velopp??e , qui a conduit ?? la mise en place de la loi p??riodique (les propri??t??s des ??l??ments reviennent ?? intervalles variables) et la formulation des premi??res tables p??riodiques.
Rayons atomiques

Rayons atomiques varient d'une mani??re pr??visible et explicable ?? travers la table p??riodique. Par exemple, les rayons diminuent en g??n??ral le long de chaque p??riode de la table, ?? partir de m??taux alcalins ?? des gaz nobles; et d'augmenter en bas de chaque groupe. Le rayon augmente fortement entre le gaz noble ?? la fin de chaque p??riode et le m??tal alcalin au d??but de la p??riode suivante. Ces tendances des rayons atomique (et de diverses autres propri??t??s physiques des ??l??ments chimiques et autres) peut ??tre expliqu?? par la th??orie de la coquille d'??lectrons de l'atome; ils ont fourni des preuves importantes pour le d??veloppement et la confirmation de la th??orie quantique .
Les ??lectrons dans le 4f-sous-shell, qui est progressivement rempli de c??rium (Z = 58) au lut??tium (Z = 71), ne sont pas particuli??rement efficaces pour prot??ger le charge nucl??aire croissante des sous-coquilles plus loin. Les ??l??ments qui suivent imm??diatement les lanthanides ont des rayons atomiques qui sont plus petites que celui qui serait pr??vu et qui sont pratiquement identiques aux rayons atomique des ??l??ments imm??diatement au-dessus. Ainsi hafnium a pratiquement le m??me rayon atomique (et de la chimie) et le zirconium , et du tantale a un rayon atomique proche de niobium , et ainsi de suite. Ceci est connu comme la contraction lanthanide. L'effet de la contraction des lanthanides est perceptible jusqu'?? platine (Z = 78), apr??s quoi il est masqu?? par un effet relativiste connu sous le nom inerte effet de paire. Le d-bloc contraction, ce qui est un effet similaire entre le d-bloc et p-bloc, est moins prononc??e que la contraction des lanthanides, mais d??coule d'une cause semblable.
l'??nergie d'ionisation

La premi??re ??nergie d'ionisation est l'??nergie qu'il faut pour retirer un ??lectron de l'atome, la seconde ??nergie d'ionisation est l'??nergie qu'il faut pour retirer un deuxi??me ??lectron de l'atome, et ainsi de suite. Pour un atome donn??, les ??nergies d'ionisation successives augmentent avec le degr?? d'ionisation. Pour magn??sium ?? titre d'exemple, la premi??re ??nergie d'ionisation est 738 kJ / mol, et la seconde est 1450 kJ / mol. Les ??lectrons dans les orbitales plus ??troits ??prouvent de plus grandes forces d'attraction ??lectrostatique; ainsi, leur retrait n??cessite de plus en plus d'??nergie. ??nergie d'ionisation devient plus grande en haut et ?? droite du tableau p??riodique.
Les grands sauts successifs dans les ??nergies d'ionisation molaires se produisent lors du retrait d'un ??lectron ?? partir d'une configuration de gaz noble (couche ??lectronique compl??te). Pour magn??sium de plus, les deux premi??res ??nergies molaires d'ionisation de magn??sium ci-dessus correspondent ?? l'??limination des deux 3 ??lectrons, et la troisi??me ??nergie d'ionisation est un nombre beaucoup plus 7,730 kJ / mol, pour l'??limination d'un ??lectron 2p de la tr??s stable n??on -like configuration de Mg 2+. Sauts similaires se produisent dans les ??nergies d'ionisation d'autres atomes de la troisi??me rang??e.
??lectron??gativit??

??lectron??gativit?? est la tendance d'un atome ?? attirer des ??lectrons . L'??lectron??gativit?? de l'atome est affect??e ?? la fois par son num??ro atomique et la distance entre le ??lectrons de valence et le noyau. Le plus son ??lectron??gativit??, plus un ??l??ment attire les ??lectrons. Il a d'abord ??t?? propos?? par Linus Pauling en 1932. En g??n??ral, ??lectron??gativit?? augmente en passant de gauche ?? droite le long d'une p??riode, et diminue en descendant un groupe. De ce fait, le fluor est le plus ??lectron??gatif des ??l??ments, tandis que le c??sium est le moins, au moins de ces ??l??ments pour lesquels des donn??es sont disponibles substantielle.
Il ya quelques exceptions ?? cette r??gle g??n??rale. Gallium et le germanium ont ??lectron??gativit??s plus ??lev??s que l'aluminium et le silicium respectivement en raison de la contraction d-bloc. ??l??ments de la quatri??me p??riode imm??diatement apr??s la premi??re ligne des m??taux de transition ont inhabituellement faible rayons atomiques parce que les ??lectrons 3d ne sont pas efficaces au blindage de la charge nucl??aire accrue et une plus petite taille atomique corr??lation avec ??lectron??gativit?? plus ??lev??e. L'??lectron??gativit?? anormalement ??lev??e de plomb, surtout en comparaison avec le thallium et le bismuth , semble ??tre un artefact de la s??lection de donn??es (et la disponibilit?? des donn??es) -m??thodes de calcul autre que la m??thode Pauling montrer les tendances p??riodiques normales pour ces ??l??ments.
Affinit?? ??lectronique
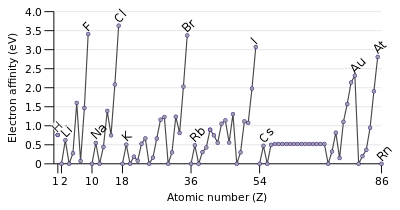
L'affinit?? d'??lectrons d'un atome est la quantit?? d'??nergie lib??r??e quand un ??lectron est ajout?? ?? un atome neutre pour former un ion n??gatif. Bien affinit?? ??lectronique varie grandement, certaines tendances se d??gagent. G??n??ralement, non-m??taux ont des valeurs d'affinit?? ??lectronique plus positifs que les m??taux . Chlore plus fortement attire un ??lectron suppl??mentaire. Les affinit??s ??lectroniques des gaz nobles ne ont pas ??t?? mesur??es de fa??on concluante, de sorte qu'ils peuvent ou non avoir des valeurs l??g??rement n??gatives.
Affinit?? ??lectronique augmente g??n??ralement sur une p??riode. Ceci est caus?? par le remplissage de la couche de valence de l'atome; un groupe 17 atome lib??re plus d'??nergie qu'un atome groupe 1 sur l'acquisition d'un ??lectron, car il obtient une couche de valence rempli et est donc plus stable.
Une tendance ?? la baisse affinit?? ??lectronique descendre groupes serait pr??vu. L'??lectron suppl??mentaire va entrer dans une orbitale plus loin du noyau. En tant que tel cet ??lectron serait moins attir?? vers le noyau et se lib??rer moins d'??nergie lorsqu'il est ajout??. Cependant, ?? descendre un groupe, environ un tiers d'??l??ments sont anormales, avec des ??l??ments plus lourds ayant des affinit??s d'??lectrons plus ??lev??s que leurs cong??n??res plus l??gers prochaines. Largement, cela est d?? ?? la mauvaise protection par des ??lectrons d et f. Une diminution uniforme dans affinit?? ??lectronique se applique uniquement aux groupes une atomes.
Caract??re m??tallique
Plus les valeurs d'??nergie d'ionisation, l'??lectron??gativit?? et l'affinit?? ??lectronique plus m??tallique de l'??l??ment pr??sente un caract??re. Caract??re non m??tallique inverse, augmente avec des valeurs plus ??lev??es de ces propri??t??s. Compte tenu des tendances p??riodiques de ces trois propri??t??s, caract??re m??tallique tend ?? diminuer traversant une p??riode et, avec quelques irr??gularit??s (principalement) en raison de la mauvaise s??lection du noyau par des ??lectrons d et f, et effets relativistes, tend ?? augmenter descendre un groupe. Ainsi, les ??l??ments les plus m??talliques (tels que le c??sium et le francium ) se trouvent en bas ?? gauche de tables p??riodiques traditionnelles et les ??l??ments les plus non m??talliques ( oxyg??ne , le fluor , chlore ) en haut ?? droite. La combinaison des tendances horizontales et verticales ?? caract??re m??tallique explique la forme escalier- ligne de division entre les m??taux et non-m??taux trouv??s sur certains tableaux p??riodiques, et la pratique de cat??goriser parfois plusieurs ??l??ments adjacents ?? cette ligne, ou des ??l??ments adjacents ?? ces ??l??ments, que m??tallo??des.
Histoire
Premi??res tentatives de syst??matisation
En 1789, Antoine Lavoisier a publi?? une liste de 33 ??l??ments chimiques , en les regroupant en gaz , m??taux , les non-m??taux, et terres; Chimistes ont pass?? le si??cle suivant recherchant un syst??me de classification plus pr??cis. En 1829, Johann Wolfgang D??bereiner a observ?? que plusieurs des ??l??ments pourraient ??tre group??s dans les triades en fonction de leurs propri??t??s chimiques. lithium , sodium et potassium , par exemple, ont ??t?? regroup??s dans une triade aussi doux, des m??taux r??actifs. D??bereiner a ??galement observ?? que, lorsqu'elle est dispos??e en poids atomique, le deuxi??me membre de chaque triade ??tait ?? peu pr??s la moyenne de la premi??re et la troisi??me; ce est devenu connu comme le Loi des triades. Chimiste allemand Leopold Gmelin a travaill?? avec ce syst??me, et d'ici 1843 il avait identifi?? dix triades, trois groupes de quatre, et un groupes de cinq. Jean-Baptiste Dumas travaux publi??s en 1857 d??crivant les relations entre les divers groupes de m??taux. Bien que les divers chimistes aient pu identifier des rapports entre de petits groupes d'??l??ments, ils ont eu ??tablir encore un plan qui les a entour??s tous.
En 1858, le chimiste allemand Ao??t Kekul?? observ?? que le carbone a souvent quatre autres atomes li??s ?? elle. Le m??thane , par exemple, a un atome de carbone et quatre atomes d'hydrog??ne. Ce concept est devenu connu comme valence ; diff??rents ??l??ments liaison avec des nombres diff??rents d'atomes.
En 1862, Alexandre-??mile B??guyer de Chancourtois, un g??ologue fran??ais, a publi?? une premi??re forme de tableau p??riodique, qu'il a appel?? l'h??lice tellurique ou une vis. Il ??tait la premi??re personne ?? remarquer la p??riodicit?? des ??l??ments. Avec les ??l??ments dispos??s en spirale sur un cylindre par ordre croissant de poids atomique, de Chancourtois a montr?? que des ??l??ments ayant des propri??t??s similaires ont sembl?? se produire ?? intervalles r??guliers. Son tableau comprenait certains ions et compos??s en plus des ??l??ments. Son journal a ??galement utilis?? g??ologiques plut??t que des termes chimiques et ne comprenait pas un sch??ma; en cons??quence, il a re??u peu d'attention jusqu'?? ce que le travail de Dmitri Mendele??ev .
En 1864, Julius Lothar Meyer, un chimiste allemand, a publi?? une table avec 44 ??l??ments dispos??s par la valence. Le tableau montre que les ??l??ments avec les propri??t??s semblables ont souvent partag?? la m??me valence. Parall??lement, William Odling (un chimiste anglais) a publi?? un arrangement de 57 ??l??ments, ordonn?? sur la base de leurs poids atomiques. Avec quelques irr??gularit??s et des lacunes, il a remarqu?? ce qui semblait ??tre une p??riodicit?? de poids atomiques entre les ??l??ments et que ceci se accordait avec 'leurs groupements g??n??ralement re??ues. " Odling fait allusion ?? l'id??e d'une loi p??riodique, mais n'a pas le poursuivre. Il a ensuite propos?? (en 1870) une classification fond??e valence des ??l??ments.

Le chimiste anglais John Newlands a produit une s??rie de documents de 1863 ?? 1866 notant que lorsque les ??l??ments ont ??t?? class??s par ordre de poids atomique croissant, les propri??t??s physiques et chimiques semblables se sont reproduites ?? intervalles de huit; comme il a compar?? ?? la p??riodicit?? octaves de la musique. Cette sorte appel?? Loi des octaves, cependant, a ??t?? ridiculis?? par les contemporains de Newlands, et de la Chemical Society a refus?? de publier son travail. Newlands ??tait n??anmoins capable de r??diger un tableau des ??l??ments et l'a utilis?? pour pr??dire l'existence d'??l??ments manquants, tels que le germanium . The Chemical Society seulement reconnu l'importance de ses d??couvertes cinq ans apr??s leur cr??dit??s Mendele??ev.
En 1867, Gustave Hinrichs, un chimiste universitaire danois n?? r??parties en Am??rique, publi?? un syst??me p??riodique spirale sur la base de spectres et le poids atomique, et les similitudes chimiques. Son travail a ??t?? consid??r?? comme idiosyncrasique, ostentatoire et labyrinthique et cela peut avoir milit?? contre la reconnaissance et l'acceptation.
La table de Mendele??ev


Professeur de chimie russe Dmitri Mendeleev et chimiste allemand Julius Lothar Meyer ind??pendamment ??dit?? leurs tables p??riodiques en 1869 et 1870, respectivement. La table de Mendele??ev ??tait sa premi??re version publi??e; celle de Meyer ??tait une version ??largie de sa table (Meyer) de 1864. Ils ont tous deux ont construit leurs tables en ??num??rant les ??l??ments en lignes ou en colonnes par ordre de poids atomique et en commen??ant une nouvelle rang??e ou colonne quand les caract??ristiques des ??l??ments ont commenc?? ?? r??p??ter .
La reconnaissance et l'acceptation b??n??ficient de la table de Mendeleev est venu de deux d??cisions qu'il a prises. Le premier ??tait de laisser des lacunes dans la table quand il a sembl?? que l'??l??ment correspondant ne avait pas encore ??t?? d??couvert. Mendeleev ne ??tait pas le premier chimiste ?? faire, mais il ??tait le premier ?? ??tre reconnu comme employant les tendances dans sa table p??riodique de pr??voir les propri??t??s de ceux ??l??ments manquants, tels que le gallium et le germanium. La deuxi??me d??cision ??tait de temps en temps d'ignorer l'ordre sugg??r?? par les poids atomiques et de commuter les ??l??ments adjacents, tels que le tellure et l'iode , pour les classifier mieux dans les familles chimiques. Avec le d??veloppement des th??ories de structure atomique, il est devenu ??vident que Mendeleev avait involontairement ??num??r?? les ??l??ments par ordre croissant de num??ro atomique ou une charge nucl??aire.
La signification des nombres atomiques ?? l'organisation de la table p??riodique n'a pas ??t?? appr??ci?? jusqu'?? ce que l'existence et les propri??t??s des protons et les neutrons se est compris. Tables p??riodiques de Mendele??ev utilis??s poids atomique au lieu de num??ro atomique d'organiser les ??l??ments, informations d??terminable ?? la pr??cision ??quitable dans son temps. Poids atomique fonctionnait assez bien dans la plupart des cas ?? (indication contraire) donne une pr??sentation qui ??tait capable de pr??dire les propri??t??s des ??l??ments manquants de fa??on plus pr??cise que toute autre m??thode alors connu. Remplacement des num??ros atomiques, une fois compris, a donn?? une s??quence d??finitive, entier non pour les ??l??ments, encore utilis?? aujourd'hui m??me si de nouveaux ??l??ments synth??tiques sont produites et ??tudi??es.
La poursuite du d??veloppement
En 1871, Mendele??ev a publi?? une mise ?? jour sous forme de tableau p??riodique (voir ?? gauche), ainsi que de donner des pr??visions d??taill??es pour les ??l??ments qu'il a pr??c??demment not?? manquaient, mais devrait exister. Ces lacunes ont ensuite ??t?? remplis que les chimistes d??couvraient des ??l??ments naturels suppl??mentaires. Il est souvent affirm?? que le dernier ??l??ment naturel ?? d??couvrir ??tait francium (d??sign?? par Mendeleev comme eka-c??sium) en 1939. Toutefois, le plutonium , produit synth??tiquement en 1940, a ??t?? identifi?? en quantit??s infimes comme un ??l??ment primordial naturel en 1971 et en 2011 il a ??t?? constat?? que tous les ??l??ments jusqu'?? californium peuvent se produire naturellement que des traces dans les minerais d'uranium par capture de neutrons et de la d??sint??gration b??ta.
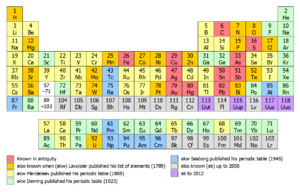
La disposition du tableau p??riodique populaire, aussi connu comme la forme commune ou de la norme (comme illustr?? ?? divers autres points dans cet article), est attribuable ?? Horace Groves Deming. En 1923, Deming, un chimiste am??ricain, publi?? courte ( Le style de Mendele??ev) et moyen ( 18-colonne) forment tableaux p??riodiques. Merck and Company pr??par?? un formulaire de document de 18 colonnes de la table de support de Deming, en 1928, qui a ??t?? largement diffus?? dans les ??coles am??ricaines. Dans les ann??es 1930 la table de Deming apparaissait dans les manuels et les encyclop??dies de la chimie. Il a ??galement ??t?? distribu?? pendant de nombreuses ann??es par le Sargent-Welch Scientific Company.
Avec le développement des modernes mécanique quantique théories de électrons dans les atomes configurations, il est devenu évident que chaque période (ligne) dans le tableau correspond au remplissage d'une coquille de quantum des électrons. Plus grands atomes ont plus de sous-coquilles d'électron, plus tard tables ont exigé progressivement de plus longues périodes.

En 1945, Glenn Seaborg, un scientifique américain, a suggéré que les éléments actinides , comme les lanthanides remplissaient un sous-niveau f. Avant cette époque, les actinides ont été pensés pour être la formation d'un quatrième bloc d rangée. Les collègues de Seaborg lui conseillent de ne pas publier une telle suggestion radicale qu'elle serait très probablement ruiner sa carrière. Comme Seaborg considéré qu'il n'a pas alors une carrière à déconsidérer, il a publié de toute façon. La suggestion de Seaborg a été jugée correcte et il est allé ensuite à remporter le prix Nobel 1951 de chimie pour ses travaux dans la synthèse des éléments d'actinides.
Bien que des quantit??s infimes de certains transuraniens se produisent naturellement, ils ont tous ??t?? d'abord d??couvert dans les laboratoires. Leur production a élargi le tableau périodique de manière significative, le premier d'entre eux étant le neptunium , synthétisé en 1939. Comme bon nombre des éléments transuraniens sont très instables et la pourriture rapidement, ils sont difficiles à détecter et caractériser lorsqu'elle est produite. Il y a eu controverses concernant l'acceptation de la découverte en compétition les réclamations pour certains éléments, exigeant un examen indépendant pour déterminer la partie qui a la priorité, et donc les droits de nommage. Les éléments les plus récemment reconnus et nommés sont flérovium (élément 114) et livermorium (élément 116), tous deux nommés le 31 mai 2012. En 2010, une collaboration russo-américain à Dubna, l'oblast de Moscou, en Russie, a affirmé avoir synthétisé six atomes de Ununseptium (élément 117), ce qui en fait la découverte la plus récemment affirmé.
Agencements alternatifs

Il ya beaucoup de tables périodiques avec les dispositions autres que celle de la forme commune ou de la norme. Dans les 100 ans de l'apparition de la table de Mendeleev en 1869 il a été estimé que près de 700 différentes versions périodiques de table ont été publiés. Ainsi que de nombreuses variations rectangulaires, d'autres formats de table périodiques ont inclus, par exemple, circulaire, cubique, cylindrique, edificial (bâtiment-like), hélicoïdale, lemniscate, prismatique octogonale, pyramidale, séparés, sphérique, en spirale, et des formes triangulaires. Ces alternatives sont souvent développés pour mettre en évidence ou accentuer des propriétés chimiques ou physiques des éléments qui ne sont pas aussi apparent dans les tableaux périodiques traditionnels.
Une mise en page alternative populaire est celle de Theodor Benfey (1960). Les éléments sont disposés en une spirale continue, avec de l'hydrogène au centre et les métaux de transition, les lanthanides, les actinides et les péninsules d'occupation.
La plupart des tables périodiques sont deux dimensions tables mais en trois dimensions sont connus pour aussi loin que au moins 1862 (pré-datant tableau à deux dimensions de Mendeleïev de 1869). Des exemples plus récents incluent périodique Classification des Courtines (1925), Système de Lamina Wringley (1949), périodique hélice de Giguère (1965) et Arbre périodique de Dufour (1996). Franchissant un mieux, tableau périodique de Physicien de Stowe (1989) a été décrit comme étant à quatre dimensions (trois ayant une dimension spatiale et de la couleur).
Les diverses formes de tableaux périodiques peuvent être considérés comme se trouvant dans un continuum de chimie-physique. Vers la fin de la chimie du continuum peut être trouvé, par exemple, «indisciplinés» Inorganic Droguerie Tableau périodique de Rayner-Canham (2002), qui met l'accent sur ??????les tendances et les schémas et les relations chimiques inhabituelles et propriétés. Vers la fin de la physique du continuum est Gauche-Step tableau périodique de Janet (1928). Cela a une structure qui montre un lien plus étroit avec l'ordre de remplissage électrons coquille et, par association, la mécanique quantique . Quelque part au milieu du continuum est la forme courante ou norme omniprésente du tableau périodique. Ceci est considéré comme exprimant mieux les tendances empiriques dans l'état physique, la conductivité électrique et thermique, et nombres d'oxydation, et d'autres propriétés facilement inférées à partir de techniques traditionnelles de laboratoire chimique.
| Janet gauche étape tableau périodique | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s | H | Il | ||||||||||||||||||||||||||||||
| 2s | Li | ??tre | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | Fa | Ne | N / A | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Californie | ||||||||||||||||||||||||
| 3d 4p 5s | Caroline du Sud | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | G??orgie | Ge | Comme | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | CD | En | Sn | Sb | Te | Je | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Dakota du Nord | Pm | Sm | Ue | Gd | Tb | Dy | Ho | Er | Tm | YB | Lu | Hf | Ta | W | R?? | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | ?? | Rn | Fr | Ra |
| 5f 6d 7p 8s | Un C | Th | Pennsylvanie | U | Np | Pu | Suis | Cm | Bk | Cf | Es | Fm | Md | Aucun | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | Uue | UBN |
| f-bloc | D-Block | p-bloc | s-bloc | |||||||||||||||||||||||||||||
| Cette forme de tableau périodique est plus en harmonie avec l'ordre dans lequel les coquilles d'électrons sont remplis, comme indiqué dans la séquence d'accompagnement dans la marge gauche (lire de haut en bas, de gauche à droite). Le placement de l'hélium (un gaz noble) au-dessus du béryllium (un métal alcalino-terreux) attire habituellement de fortes critiques de chimistes. | ||||||||||||||||||||||||||||||||
Questions et controverses ouvertes
Éléments ayant des propriétés chimiques inconnus
Bien que tous les éléments jusqu'à à ununoctium ont été découverts, seuls les éléments jusqu'à hassium (élément 108), avec copernicium (élément 112), ont connu des propriétés chimiques. Les autres éléments peuvent se comporter différemment de ce que devrait être prédite par extrapolation, en raison des effets relativistes; par exemple, flérovium a été prédit pour éventuellement présenter certaines propriétés comme noble gaz, même si elle est actuellement placé dans les groupe de carbone. expériences plus récentes ont suggéré, cependant, que flérovium comporte chimiquement comme le plomb, comme prévu à partir de sa position de la table périodique.
D'autres extensions de table périodiques
Il est difficile de savoir si de nouveaux éléments vont continuer le modèle de la table périodique actuelle comme période de 8, ou exiger d'autres adaptations ou aménagements. Seaborg attend la huitième période, qui comprend-bloc d'un à deux éléments pour les éléments 119 et 120, une nouvelle g -BLOC pour les 18 prochaines éléments, et 30 éléments supplémentaires poursuivies l'f- actuelle, d- et p-blocs. Plus récemment, des physiciens comme Pekka Pyykkö ont théorisé que ces éléments supplémentaires ne suivent pas la règle Madelung, qui prédit comment coquilles électrons sont remplis et affecte l'apparence de la présente table périodique ainsi.
Elément avec le numéro atomique le plus élevé possible
Le nombre d'éléments possibles est pas connue. Une suggestion très tôt réalisé par Elliot Adams en 1911, et sur ??????la base de la disposition des éléments dans chaque tableau périodique rangée horizontale, était que des éléments de poids atomique supérieur à 256 ± (ce qui équivaudrait à entre 99 et 100 éléments en termes modernes ) n'a pas existé. A-plus élevé récente estimation est que le tableau périodique peut se terminer peu après l' îlot de stabilité, qui devrait tourner autour élément 126, comme l'extension des tableaux périodiques et nucléides est limité par protons et de neutrons lignes d'égouttement. Autres prédictions de la fin de la table périodique comprennent au élément 128 par John Emsley, à l'élément 137 par Richard Feynman et à l'élément 155 par Albert Khazan.
- Mod??le de Bohr
Le Modèle de Bohr présente des difficultés pour les atomes de numéro atomique supérieur à 137, comme tout élément ayant un nombre atomique supérieur à 137 exigerait électrons 1s de voyager plus vite que c , la vitesse de la lumière . Ainsi le modèle Bohr non relativiste est inexact lorsqu'il est appliqué à un tel élément.
- Équation de Dirac relativiste
Le relativiste équation de Dirac a des problèmes pour les éléments avec plus de 137 protons. Pour ces éléments, la fonction d'onde de l'état fondamental de Dirac est oscillant plutôt que lié, et il n'y a pas d'écart entre les spectres d'énergie positive et négative, comme dans le paradoxe Klein. Des calculs plus précis en prenant en compte les effets de la taille finie du noyau indiquent que l'énergie de liaison supérieure à la première limite pour les éléments de plus de 173 protons. Pour les éléments les plus lourds, les plus à l'intérieur si orbitaux (1s) ne sont pas remplies, le champ électrique du noyau va tirer un électron à partir du vide, ce qui entraîne l' émission spontanée d'un positron; Toutefois, cela ne se produit pas si le plus à l'intérieur est rempli orbital, de sorte que l'élément 173 ne sont pas nécessairement à la fin de la table périodique.
Placement d'hydrogène et d'hélium
L'hydrogène et l'hélium sont souvent placés dans des endroits différents que leurs configurations électroniques indiqueraient; un atome d'hydrogène est généralement placé au-dessus de lithium, conformément à sa configuration d'électrons, mais il est parfois placé au-dessus de fluor , ou encore du carbone, il se comporte comme également quelque peu similaire à eux. L'hydrogène est également parfois placé dans son propre groupe, car il ne se comporte pas suffisamment similaire à un élément à être placé dans un groupe à un autre. L'hélium est presque toujours placé au-dessus du néon , car ils sont très semblables chimiquement, même si elle est parfois placé au-dessus de béryllium en raison d'avoir une configuration de couche électronique comparable (hélium: 1s 2 ; béryllium: [Il] 2s 2 ).
Groupes inclus dans les métaux de transition
La définition d'un métal de transition , comme indiqué par l'IUPAC, est un élément dont l'atome a une sous-couche d incomplète, ou qui peuvent donner lieu à des cations avec un sous-shell d incomplètes. Par cette définition, tous les éléments des groupes 3 à 11 sont des métaux de transition. La définition exclut par conséquent groupe IUPAC 12, comprenant du zinc, du cadmium et du mercure, à partir de la catégorie des métaux de transition.
R??cup??r?? ?? partir de " http://en.wikipedia.org/w/index.php?title=Periodic_table&oldid=545187902 "
