
Rutherfordium
Contexte des ??coles Wikip??dia
Cette s??lection ??coles a ??t?? choisi par SOS Enfants pour les ??coles dans le monde en d??veloppement ne ont pas acc??s ?? Internet. Il est disponible en t??l??chargement intranet. Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premier ?
| Rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
104 Rf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| inconnu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | rutherfordium, Rf, 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ r ʌ ?? ər fa ɔr r?? Je ə m / RUDH -ər- POUR -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 4, 7, r?? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | [267] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Rn ] 5f 14 6d deux 7s 2 2, 8, 18, 32, 32, 10, 2 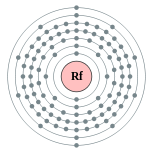 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Institut unifi?? de recherches nucl??aires (1964) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide (pr??vue) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 23 (estimation) g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2400 K , 2100 ?? C, 3800 (estimation) ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 5800 K, 5500 ?? C, 9900 (estimation) ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 3 (pr??vue) (??tats d'oxydation ne en gras sont connus exp??rimentalement) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 579,9 (estimation) kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1389,4 (estimation) kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2296,4 (estimation) kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 150 (estimation) h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 157 (estimation) h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 53850-36-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rutherfordium est un ??l??ment chimique avec le symbole Rf et de num??ro atomique 104, nomm?? en l'honneur de la Nouvelle-Z??lande-n?? physicien britannique Ernest Rutherford . C'est un ??l??ment synth??tique (un ??l??ment qui peut ??tre cr???? dans un laboratoire, mais ne se trouve pas dans la nature) et radioactifs; le connu plus stable isotope , 267 Rf, a une demi-vie d'environ 1,3 heures.
Dans le tableau p??riodique des ??l??ments, ce est un d-??l??ment et le premier bloc de la transactinide ??l??ments. Ce est un membre de la 7e p??riode et appartient ?? la groupe 4 ??l??ments. exp??riences de chimie ont confirm?? que rutherfordium se comporte comme le plus lourd homologue de l'hafnium dans le groupe 4. Les propri??t??s chimiques de rutherfordium se caract??risent en partie seulement. Ils comparent bien avec la chimie des autres ??l??ments du groupe 4, m??me si certains calculs avaient indiqu?? que l'??l??ment pourrait pr??senter des propri??t??s sensiblement diff??rentes en raison de effets relativistes.
Dans les ann??es 1960, de petites quantit??s de rutherfordium ont ??t?? produites dans les laboratoires de l'ex- Union sovi??tique et en Californie . La priorit?? de la d??couverte et donc la nommage de l'??l??ment a ??t?? contest??e entre les scientifiques sovi??tiques et am??ricains, et ce ne est qu'en 1997 que Union internationale de chimie pure et appliqu??e (UICPA) a ??tabli rutherfordium que le nom officiel de l'??l??ment.
Histoire
D??couverte
Rutherfordium aurait ??t?? d??tect?? pour la premi??re en 1964 ?? la Institut mixte de recherche nucl??aire de Dubna (puis dans l' Union sovi??tique ). Les chercheurs y bombard??s un plutonium -242 cible avec n??on -22 ions s??par??s et les produits de r??action par thermochromatography gradient apr??s conversion en chlorures par interaction avec ZrCl 4. L'??quipe a identifi?? activit?? de fission spontan??e contenue dans un chlorure volatile d??peignant propri??t??s de EKA-hafnium. Bien que la demi-vie n'a pas ??t?? d??termin??e avec pr??cision, des calculs ult??rieurs ont indiqu?? que le produit ??tait probablement rutherfordium-259 (en abr??g?? 259 Rf dans solf??ge ):
- 242
94 Pu + 22
10 Ne → 264- x
104 Rf → 264- x
104 Rf Cl 4
En 1969, des chercheurs de la Universit?? de Californie, Berkeley concluante synth??tis?? l'??l??ment en bombardant une californium -249 cible avec -ions carbone 12 et mesur?? la d??sint??gration alpha de 257 Rf, en corr??lation avec la d??sint??gration de fille de nob??lium -253:
- 249
98 Cf + 12
6 257 → C
104 Rf + 4 n
La synth??se am??ricaine a ??t?? confirm?? de fa??on ind??pendante en 1973 et a obtenu l'identification des rutherfordium comme parent par l'observation de K-alpha rayons X dans la signature ??l??mentaire du produit de d??sint??gration Rf 257, nob??lium-253.
Nommer la controverse
Les scientifiques russes ont propos?? le nom kurchatovium et les scientifiques am??ricains ont sugg??r?? le nom rutherfordium pour le nouvel ??l??ment. En 1992, le UICPA / Groupe de travail Transfermium UIPPA (GTT) a ??valu?? les demandes de d??couverte et conclu que les deux ??quipes ont fourni des preuves contemporaines ?? la synth??se de l'??l??ment 104 et que le cr??dit devraient ??tre partag??s entre les deux groupes.
Le groupe am??ricain a ??crit une r??ponse cinglante aux conclusions du groupe de travail technique, indiquant qu'ils avaient donn?? trop l'accent sur les r??sultats du groupe Dubna. En particulier, ils ont soulign?? que le groupe russe avait chang?? les d??tails de leurs demandes ?? plusieurs reprises sur une p??riode de 20 ann??es, un fait que l'??quipe russe ne nie pas. Ils ont ??galement soulign?? que le GTT avait donn?? trop de cr??dit aux exp??riences de chimie effectu??es par les Russes et a accus?? le GTT de ne pas avoir du personnel qualifi?? au sein du comit??. Le GTT a r??pondu en disant que ce ne ??tait pas le cas et apr??s avoir ??valu?? chaque point soulev?? par le groupe am??ricain a dit qu'ils ne ont trouv?? aucune raison de modifier leur conclusion concernant la priorit?? de la d??couverte. L'UICPA a finalement utilis?? le nom sugg??r?? par l'??quipe am??ricaine (de rutherfordium) qui peuvent en quelque sorte refl??ter un changement d'opinion.
En cons??quence de la d??couverte initiale de revendications, une comp??tition ??l??ment nommer controverse est n??e. Depuis les Sovi??tiques ont affirm?? avoir d??tect?? pour la premi??re le nouvel ??l??ment ils ont sugg??r?? le nom kurchatovium, Ku, en l'honneur de Igor Kourtchatov (1903-1960), ancien chef de Recherche nucl??aire sovi??tique. Ce nom avait ??t?? utilis?? dans les livres de la Bloc sovi??tique comme le nom officiel de l'??l??ment. Le rutherfordium Am??ricains, cependant, propos?? (Rf) pour le nouvel ??l??ment d'honorer Ernest Rutherford , qui est connu comme le ??p??re?? de la physique nucl??aire . L'Union internationale de chimie pure et appliqu??e ( UICPA) a adopt?? unnilquadium, Unq, comme temporaire, D??nomination syst??matique, provenant des noms latins pour les chiffres 1, 0 et 4. En 1994, l'UICPA a sugg??r?? le nom dubnium ??tre utilis?? depuis rutherfordium a ??t?? sugg??r?? pour l'??l??ment 106 et l'UICPA a estim?? que l'??quipe Dubna doit ??tre reconnu ?? juste titre pour leurs contributions . Cependant, il y avait encore un diff??rend sur les noms des ??l??ments 104-107. En 1997, les ??quipes impliqu??es ont r??solu le litige et a adopt?? le nom actuel rutherfordium. Le nom dubnium a ??t?? donn??e ?? l'??l??ment 105 en m??me temps.
Nucl??osynth??se
??l??ments super-lourds tels que rutherfordium sont produites en bombardant des ??l??ments plus l??gers dans acc??l??rateurs de particules qui induit les r??actions de fusion. Alors que la plupart des isotopes de rutherfordium peut ??tre synth??tis?? directement de cette fa??on, certains plus lourds ne ont ??t?? observ??s que les produits de d??sint??gration d'??l??ments plus ??lev??s avec des num??ros atomiques .
Selon les ??nergies mises en jeu, les premiers sont s??par??s en "chaud" et "froid". Dans les r??actions de fusion ?? chaud, tr??s l??gers, projectiles ?? haute ??nergie sont acc??l??r??s vers des objectifs tr??s lourds ( actinides ), donnant lieu ?? des noyaux compos??s ?? haute ??nergie d'excitation (~ 40-50 MeV) qui peut soit la fission ou se ??vaporer plusieurs (3-5) neutrons. Dans les r??actions de fusion ?? froid, les noyaux condens??s produits ont une ??nergie relativement faible d'excitation (~ 10 ?? 20 MeV), ce qui diminue la probabilit?? que ces produits vont subir des r??actions de fission. Comme les noyaux fusionn??s refroidir ?? la ??tat fondamental, ils ont besoin de l'??mission de seulement un ou deux neutrons, et donc, permet la g??n??ration de produits plus riches en neutrons. Cette derni??re est une notion distincte de celle de la fusion nucl??aire selon lequel ?? atteindre dans des conditions de temp??rature ambiante (voir la fusion ?? froid).
Des ??tudes de fusion ?? chaud
La synth??se de rutherfordium a ??t?? tent??e en 1964 par l'??quipe de Dubna en utilisant la r??action de fusion ?? chaud de n??on -22 projectiles avec le plutonium -242 objectifs:
- 242
94 Pu + 22
10 Ne → 264-x
104 Rf + 3 ou 5 n .
La premi??re ??tude a produit des preuves pour un fission spontan??e avec un 0,3 secondes demi-vie et une autre ?? 8 secondes. Alors que la premi??re observation a ??t?? finalement r??tract??, ce dernier est finalement devenu associ?? avec le Rf isotope 259. En 1966, l'??quipe sovi??tique r??p??t?? l'exp??rience en utilisant une ??tude chimique des produits de chlorure volatils. Ils ont identifi?? un chlorure volatile avec des propri??t??s de EKA-hafnium que cari??es rapide gr??ce ?? la fission spontan??e. On a obtenu des preuves solides pour la formation de RFCL 4, et bien que la demi-vie ne est pas mesur??e de fa??on pr??cise, la preuve sugg??re que plus tard, le produit ??tait tr??s probablement 259 Rf. L'??quipe a r??p??t?? l'exp??rience ?? plusieurs reprises au cours des prochaines ann??es, et en 1971, ils ont r??vis?? la fission spontan??e mi-temps pour l'isotope ?? 4,5 secondes.
En 1969, des chercheurs de la Universit?? de Californie dirig??e par Albert Ghiorso, a essay?? de confirmer les r??sultats originaux rapport??s ?? Dubna. Dans une r??action de curium -248 avec l'oxyg??ne-16, ils ont ??t?? incapables de confirmer le r??sultat de l'??quipe sovi??tique, mais a r??ussi ?? observer la fission spontan??e de 260 Rf avec une demi-vie tr??s courte de 10 ?? 30 ms:
- 248
96 cm + 16
8 O 260 →
104 Rf + 4 n .
En 1970, l'??quipe am??ricaine a ??galement ??tudi?? la m??me r??action avec l'oxyg??ne-18 et a identifi?? 261 Rf avec une demi-vie de 65 secondes (plus tard raffin?? ?? 75 secondes). Des exp??riences ult??rieures au Lawrence Berkeley National Laboratory en Californie a ??galement r??v??l?? la formation d'un isom??re de courte dur??e de 262 Rf (qui subit la fission spontan??e avec une demi-vie de 47 ms), et les activit??s de fission spontan??e avec de longues dur??es de vie provisoirement affect??s ?? 263 Rf.
La r??action du californium avec -249 carbone-13 a ??galement ??t?? ??tudi??e par l'??quipe Ghiorso, ce qui indique la formation de l'??ph??m??re 258 Rf (qui subit la fission spontan??e dans 11 ms):
- 249
98 Cf + 13
6 258 → C
104 Rf + 4 n .
En essayant de confirmer ces r??sultats en utilisant carbone-12 ?? la place, ils ont ??galement observ?? la premi??re alpha se d??sint??gre de 257 Rf.
La r??action des berkelium -249 avec l'azote a ??t?? ??tudi??e -14 premier ?? Dubna en 1977, et en 1985, les chercheurs il a confirm?? la formation de l'isotope 260 Rf qui subit rapidement fission spontan??e dans 28 ms:
- 249
97 Bk + 14
7 N → 260
104 Rf + 3 n .
En 1996, l'isotope 262 Rf a ??t?? observ??e dans LBNL de la fusion de plutonium-244 avec n??on-22:
- 244
94 Pu + 22
10 Ne → 266-x
104 Rf + 4 ou 5 n .
L'??quipe a d??termin?? une demi-vie de 2,1 secondes, contrairement aux rapports ant??rieurs de 47 ms et a sugg??r?? que les deux demi-vies pourraient ??tre dus ?? diff??rents ??tats isom??res de 262 Rf. Les ??tudes sur la m??me r??action par une ??quipe ?? Dubna, conduisent ?? l'observation en 2000 d'alpha se d??sint??gre de 261 Rf et fissions spontan??es de 261m Rf.
La r??action de fusion ?? chaud en utilisant une cible d'uranium a ??t?? signal??e ?? Dubna en 2000:
- 238
92 U + 26
12 Mg → 264-x
104 Rf + x n (x = 3, 4, 5, 6).
Ils ont observ?? d??sint??grations de 260 259 Rf et Rf, et plus tard pour 259 Rf. En 2006, dans le cadre de leur programme sur l'??tude de cibles d'uranium dans les r??actions de fusion ?? chaud, l'??quipe a ??galement observ?? LBNL 261 Rf.
??tudes de fusion froide
Les premi??res exp??riences de fusion froide ??l??ment impliquant 104 ont ??t?? r??alis??es en 1974 ?? Dubna, en utilisant la lumi??re titane 50 noyaux visant des cibles d'isotopes de plomb-208:
- 208
82 Pb + 50
Ti 22-x → 258
104 Rf + x n (x = 1, 2, ou 3).
La mesure d'une activit?? de fission spontan??e a ??t?? attribu?? ?? 256 Rf, alors que des ??tudes ult??rieures effectu??es au Gesellschaft f??r Schwerionenforschung Institute (GSI), ??galement mesur?? les propri??t??s de d??sint??gration des isotopes 257 Rf, et 255 Rf.
En 1974 des chercheurs de Dubna ??tudi?? la r??action de plomb-207 avec du titane-50 pour produire l'isotope 255 Rf. Dans une ??tude r??alis??e en 1994 chez GSI en utilisant l'isotope de plomb-206, 255 Rf ainsi que 254 Rf ont ??t?? d??tect??s. 253 Rf a de m??me ??t?? d??tect?? cette ann??e lorsque le plomb-204 a ??t?? utilis?? ?? la place.
??tudes de Decay
La plupart des isotopes avec un masse atomique ci-dessous 262 ont ??galement observ?? que les produits de d??sint??gration d'??l??ments avec une meilleure num??ro atomique , permettant pour le raffinement de leurs propri??t??s pr??c??demment mesur??es. Isotopes plus lourds de rutherfordium ne ont ??t?? observ??s que les produits de d??sint??gration. Par exemple, quelques ??v??nements de d??sint??gration alpha se terminant par 267 Rf ont ??t?? observ??s dans la cha??ne de d??sint??gration de darmstadtium -279 depuis 2004:
- 279
110 275 Ds →
108 Hs + α → 271
Sg 106 267 + α →
104 Rf + α.
Cette nouvelle a subi une fission spontan??e avec un mi-temps d'environ 1,3 h.
Enqu??tes sur la synth??se de la dubnium -263 isotopes en 1999 ?? la Universit?? de Berne a r??v??l?? ??v??nements compatibles avec capture d'??lectrons pour former 263 Rf. Une fraction de rutherfordium a ??t?? s??par??e, et plusieurs ??v??nements de fission spontan??e avec longue dur??e de vie d'environ 15 minutes ont ??t?? observ??s, ainsi que l'alpha et d??cro??t avec la dur??e de vie d'environ 10 minutes. Rapports sur la cha??ne de d??sint??gration de Fl??rovium -285 en 2010 ont montr?? cinq s??quentielle alpha se d??sint??gre qui se terminent dans 265 Rf, qui subit une nouvelle fission spontan??e avec une dur??e de vie de 152 secondes.
Certains ??l??ments de preuve exp??rimentale a ??t?? obtenu en 2004 pour un isotope encore plus lourd, 268 Rf, dans la cha??ne de d??sint??gration d'un isotope de ununpentium :
- 288
115 284 Uup →
113 Uut α → + 280
111 Rg + α → 276
109 Mt + α → 272
107 Bh + α → 268
105 Db + α? → 268
104 Rf + ν
e.
Toutefois, la derni??re ??tape de cette cha??ne ??tait incertain. Apr??s avoir observ?? les ??v??nements de d??sint??gration alpha cinq qui g??n??rent dubnium -268, les ??v??nements de fission spontan??es ont ??t?? observ??es avec une longue demi-heure. Il est difficile de savoir si ces ??v??nements ??taient dus ?? diriger fission spontan??e de 268 Db, ou 268 Db produit ??v??nements de capture d'??lectrons avec de longues demi-vies de 268 g??n??rent Rf. Si celui-ci est produit et se d??sint??gre avec une dur??e de vie courte, les deux possibilit??s peuvent pas ??tre distingu??s. ??tant donn?? que le capture d'??lectrons de 268 Db ne peut pas ??tre d??tect??, ces ??v??nements de fission spontan??e peut ??tre d?? ?? 268 Rf, auquel cas la demi-vie de cet isotope ne peut pas ??tre extraite.
Selon un rapport de 2007 sur la synth??se de ununtrium , l'isotope 282 113 a ??t?? observ??e ?? subir une d??croissance similaire ?? former 266 Db, qui subit la fission spontan??e avec une demi-vie de 22 minutes. ??tant donn?? que la capture d'??lectrons de 266 Db ne peut pas ??tre d??tect??, ces ??v??nements de fission spontan??e peut ??tre d?? ?? 266 Rf, auquel cas la demi-vie de cet isotope ne peut pas ??tre extraite.
Isotopes
| Isotope | Demi-vie | Pourriture mode | D??couverte ann??e | R??action |
|---|---|---|---|---|
| 253 Rf | 48 ps | α, SF | 1994 | 204 Pb (Ti 50, n) |
| 254 Rf | 23 ps | SF | 1994 | 206 Pb (Ti 50, 2n) |
| 255 Rf | 2,3 | ε ?, α, SF | 1974 | 207 Pb (Ti 50, 2n) |
| 256 Rf | 6,4 ms | α, SF | 1974 | 208 Pb (Ti 50, 2n) |
| 257 Rf | 4,7 | ε, α, SF | 1969 | 249 Cf (C 12, 4n) |
| 257m Rf | 4,1 | ε, α, SF | 1969 | 249 Cf (C 12, 4n) |
| 258 Rf | 14,7 ms | α, SF | 1969 | 249 Cf (C 13, 4n) |
| 259 Rf | 3,2 | α, SF | 1969 | 249 Cf (13 C, 3n) |
| 259m Rf | 2,5 | ε | 1969 | 249 Cf (13 C, 3n) |
| 260 Rf | 21 | α, SF | 1969 | 248 cm (16 O, 4n) |
| 261 Rf | 78 | α, SF | 1970 | 248 cm (18 O, 5n) |
| 261m Rf | 4 | ε, α, SF | 2001 | Pu 244 (22 Ne, 5n) |
| 262 Rf | 2,3 | α, SF | 1996 | Pu 244 (22 Ne, 4n) |
| 263 Rf | 15 min | α, SF | 1999 | 263 Db ( e - , ν e) |
| 263m Rf? | 8 | α, SF | 1999 | 263 Db ( e - , ν e) |
| 264 Rf | 1? h | α? | inconnu | - |
| 265 Rf | 2,5 min | SF | 2010 | 269 Sg (-, α) |
| 266 Rf | 10 h? | α, SF? | 2007? | 266 Db ( e - , ν e)? |
| 267 Rf | 1,3 h | SF | 2004 | 271 Sg (-, α) |
| 268 Rf | 6 h? | α, SF? | 2004? | 268 Db ( e - , ν e)? |
Rutherfordium n'a pas d'isotopes stables ou naturels. Plusieurs isotopes radioactifs ont ??t?? synth??tis??s dans le laboratoire, soit par fusion de deux atomes ou en observant la d??croissance des ??l??ments plus lourds. Quinze isotopes diff??rents ont ??t?? rapport??s avec les masses atomiques 253-268 (?? l'exception de 264). La plupart de ces Decay principalement par des voies de fission spontan??e.
Vie fois
Les isotopes les plus l??gers ont g??n??ralement plus courtes demi-vies; la demi-vie de moins de 50 ms pour 253 254 Rf et Rf ont ??t?? observ??s. 256 Rf, Rf 258, 260 Rf sont plus stables autour de 10 ms, 255 Rf, Rf 257, 259 Rf, et 262 Rf en direct entre 1 et 5 secondes et 261 Rf, Rf 265 et 263 Rf sont plus stables, aux alentours de 1, 1,5 et 10 min respectivement. Les isotopes lourds sont les plus stables, avec 267 Rf ayant une demi-vie mesur??e d'environ 1,3 h.
Les isotopes les plus l??gers ont ??t?? synth??tis??s par fusion directe entre deux noyaux plus l??gers et en tant que produits de d??sint??gration. L'isotope le plus lourd produit par fusion directe est 262 Rf; isotopes plus lourds ne ont ??t?? observ??s que les produits de d??sint??gration d'??l??ments ayant les num??ros atomiques plus grandes, dont seulement 267 Rf a ??t?? confirm??e. Isotopes 266 Rf et Rf 268 peuvent aussi avoir ??t?? observ?? que les produits de d??composition et sont consid??r??s comme ayant une longue demi-vie de 10 h et 6 h, respectivement, mais ceux-ci ont ??t?? mesur??es indirectement, ?? travers des ??tudes syst??matiques. Alors que l'isotope 264 Rf n'a pas encore ??t?? observ??, il est pr??vu d'avoir une longue demi-vie de 1 h. Avant cette d??couverte, 265 Rf est pr??vu d'avoir une plus longue demi-vie de 13 h m??me, mais il a une demi-vie de seulement 2,5 min.
En 1999, des scientifiques am??ricains de l'Universit?? de Californie, Berkeley, ont annonc?? qu'ils avaient r??ussi ?? synth??tiser trois atomes de 293 118. Ces noyaux m??res auraient successivement ??mis sept particules alpha pour former 265 noyaux Rf, mais leur demande a ??t?? r??tract??s en 2001.
Isom??rie nucl??aire
Plusieurs ??tudes ant??rieures sur la synth??se de 263 Rf ont indiqu?? que ce nucl??ide se d??sint??gre principalement par fission spontan??e avec une demi-vie de 10 ?? 20 minutes. Plus r??cemment, une ??tude de hassium isotopes a permis la synth??se d'atomes de 263 Rf d??composition avec une demi-vie plus courte de huit secondes. Ces deux modes de d??sint??gration diff??rents doivent ??tre associ??s ?? deux ??tats isom??res, mais des missions sp??cifiques sont difficiles en raison du faible nombre d'??v??nements observ??s.
Au cours de la recherche sur la synth??se des isotopes de rutherfordium utilisant le Pu 244 (22 Ne, 5n) 261 r??action Rf, le produit a ??t?? trouv?? ?? subir exclusive 8,28 MeV d??sint??gration alpha avec une demi-vie de 78 secondes. Des ??tudes ult??rieures ?? GSI sur la synth??se de copernicium et hassium isotopes produits donn??es contradictoires, que 261 Rf produite dans la cha??ne de d??sint??gration a ??t?? trouv?? ?? subir 8,52 MeV d??sint??gration alpha avec une demi-vie de 4 secondes. R??sultats plus tard indiqu?? une fission branche pr??dominante. Ces contradictions ont conduit ?? un certain doute sur la d??couverte de copernicium. Le premier isom??re est actuellement not??e 261a Rf (Rf ou simplement 261) tandis que le second est not??e 261b Rf (ou 261m Rf). Cependant, on pense que le premier noyau appartient ?? un ??tat fondamental haut-spin et le second ?? un ??tat m??tastable bas spin. La d??couverte et la confirmation de 261b Rf ont apport?? la preuve pour la d??couverte de copernicium en 1996.
Une ??tude d??taill??e spectroscopique de la production de 257 noyaux RF en utilisant la r??action 208 Pb (50 Ti, n) 257 Rf a permis l'identification d'un niveau d'isom??res dans 257 Rf. Le travail a confirm?? que 257g Rf a un spectre complexe avec 15 lignes alpha. Un diagramme de structure de niveau a ??t?? calcul?? pour les deux isom??res. Isom??res similaires ont ??t?? signal??s pour 256 Rf ??galement.
Propri??t??s pr??dites
Chimique
Rutherfordium est la premi??re Transactinide et le second ??l??ment de la s??rie 6d de m??taux de transition. Calculs sur son potentiels d'ionisation, rayon atomique, ainsi que des rayons, les ??nergies orbitales, et les niveaux de ses ??tats ionis??s au sol sont similaires ?? celles de l'hafnium et tr??s diff??rent de celui du plomb . Par cons??quent, il a ??t?? conclu que les propri??t??s de base de rutherfordium se apparentent ?? ceux de l'autre groupe 4, en dessous des ??l??ments titane , zirconium , et hafnium. Certains de ses propri??t??s ont ??t?? d??termin??es par des exp??riences en phase gazeuse et la chimie aqueuse. L'??tat d'oxydation 4 est le seul ??tat stable pour les deux derniers ??l??ments et donc rutherfordium devrait ??galement pr??senter un ??tat stable 4. En outre, est ??galement pr??vu rutherfordium pour pouvoir former un ??tat moins trois stable.
Les propri??t??s chimiques de rutherfordium ??taient fond??es sur le calcul qui a indiqu?? que les effets relativistes sur la coque d'??lectrons pourrait ??tre suffisant que la forte orbitales p ont un niveau d'??nergie inf??rieur ?? la orbitales d, lui donnant une configuration ??lectronique valence de 1 7s 6d 2 7p une ou m??me deux 7s 7p 2, rendant ainsi l'??l??ment se comporte plus comme chef de file de l'hafnium. Avec de meilleures m??thodes de calcul et des ??tudes sur les propri??t??s chimiques des compos??s rutherfordium on a pu montrer que rutherfordium se comporte selon le reste de la groupe 4 ??l??ments.
De mani??re analogue ?? zirconium et hafnium, rutherfordium devrait former un tr??s stable, point de fusion ??lev?? de l'oxyde de points, RFO 2. Il r??agit avec les halog??nes pour former des t??trahalog??nures, RFX 4, qui se hydrolysent au contact de l'eau pour former des oxyhalog??nures RfOX 2. Les t??trahalog??nures sont des solides volatils en tant que mol??cules t??tra??driques existants monom??res dans la phase vapeur.
Dans la phase aqueuse, l'ion 4+ Rf hydrolyse inf??rieur de titane (IV) et ?? un degr?? similaire ?? celui du zirconium et du hafnium, conduisant ainsi ?? l'ion 2+ RFO. Le traitement des halog??nures avec des ions halog??nure favorise la formation d'ions complexes. L'utilisation d'ions chlorure et bromure produit les complexes de hexahalog??nure RFCL 2-
6 et RFBR 2-
6. Pour les complexes de fluorure de zirconium et le hafnium ont tendance ?? hepta- et octa- former des complexes. Ainsi, pour la plus grande rutherfordium ions, les complexes RFF 2-
6, RFF 2-
7 et RFF 4-
8 sont possibles.
Physique atomique et
Rutherfordium devrait ??tre un solide dans des conditions normales. Il devrait ??tre un m??tal tr??s lourd avec une densit?? d'environ 23 g / cm 3; En comparaison, l'??l??ment le plus dense connue qui a eu sa densit?? mesur??e, l'osmium , a une masse volumique de 22,61 g / cm 3. Ceci r??sulte du poids atomique ??lev?? de rutherfordium, le lanthanides et des actinides contractions, et effets relativistes, bien que la production d'une quantit?? suffisante rutherfordium pour mesurer cette quantit?? ne serait pas pratique, et l'??chantillon serait rapidement se d??grader. Le rayon atomique pour rutherfordium devrait se situer autour de 150 h. En raison de la stabilisation relativiste des 7s orbitales et de d??stabilisation de l'orbitale 6d, les ions Rf + et Rf 2+ sont pr??vus pour donner des ??lectrons au lieu de 7s 6d ??lectrons, ce qui est le contraire du comportement de ses homologues plus l??gers.
Chimie exp??rimentale
| Formule | Noms |
|---|---|
| RFCL 4 | t??trachlorure rutherfordium, rutherfordium (IV) de chlorure |
| RFBR 4 | t??trabromure rutherfordium, rutherfordium (IV) de bromure |
| RfOCl 2 | oxychlorure rutherfordium, rutherfordyl (IV) de chlorure, rutherfordium (IV) oxyde de dichlorure |
| [RFCL 6] 2- | hexachlororutherfordate (IV) |
| [RFF 6] 2- | hexafluororutherfordate (IV) |
| K 2 [RFCL 6] | hexachlororutherfordate de potassium (IV) |
en phase gazeuse
Les premiers travaux sur l'??tude de la chimie des rutherfordium ax??e sur thermochromatography de gaz et la mesure des courbes d'adsorption de la temp??rature de d??p??t relative. Le travail initial a ??t?? effectu??e ?? Dubna dans une tentative de r??affirmer leur d??couverte de l'??l??ment. Des travaux r??cents est plus fiable en ce qui concerne l'identification des radio-isotopes parent de rutherfordium. L'isotope 261m Rf a ??t?? utilis?? pour ces ??tudes. Les exp??riences se appuyaient sur l'espoir que rutherfordium commencerait la nouvelle s??rie d'??l??ments 6d et devrait donc former un t??trachlorure volatile en raison de la nature t??tra??drique de la mol??cule. Rutherfordium (IV) de chlorure est plus volatile que son homologue l??gers hafnium (IV) de chlorure (HfCl4) parce que ses obligations sont plus covalente.
Une s??rie d'exp??riences a confirm?? que rutherfordium se comporte comme un ??l??ment typique du groupe 4, en formant un chlorure t??travalent (RFCL 4) et du bromure (RFBR 4) ainsi qu'un oxychlorure (RfOCl 2). Une diminution de la volatilit?? a ??t?? observ??e pour RFCL 4 lorsque le chlorure de potassium est fournie en tant que phase solide au lieu de gaz, tr??s repr??sentatif de la formation de K 2 RFCL 6 non volatile de sel mixte.
La phase aqueuse
Rutherfordium devrait avoir la configuration d'??lectrons [Rn] 5f 14 7s 6d 2 2 et donc se comporter comme l'homologue plus lourd de l'hafnium dans le groupe 4 du tableau p??riodique. Il convient donc de former facilement un Rf 4+ ions hydrat?? dans une solution d'acide fort et devrait facilement former des complexes dans l'acide chlorhydrique , bromhydrique ou Les solutions d'acide fluorhydrique.
Les plus probants des ??tudes de chimie aqueuses de rutherfordium ont ??t?? effectu??es par l'??quipe japonaise ?? Institut japonais de recherche de l'??nergie atomique en utilisant le radio-isotope 261m Rf. exp??riences d'extraction de solutions d'acide chlorhydrique utilisant des isotopes de rutherfordium, le hafnium, le zirconium et le thorium ont prouv?? un comportement non-actinides pour rutherfordium. Une comparaison avec ses homologues plus l??gers rutherfordium plac?? fermement dans le groupe 4 et a montr?? la formation d'un complexe de hexachlororutherfordate dans des solutions de chlorure, d'une mani??re similaire ?? l'hafnium et le zirconium.
- 261m Rf 4+ + 6 Cl - → [261m RFCL 6] 2-
Des r??sultats tr??s similaires ont ??t?? observ??s dans des solutions d'acide fluorhydrique. Les diff??rences dans les courbes d'extraction ont ??t?? interpr??t??es comme une affinit?? plus faible pour les ions fluorure et la formation de l'ion hexafluororutherfordate, alors que les ions hafnium et zirconium sept ou huit ions fluorure complexes aux concentrations utilis??es:
- 261m Rf 4+ + 6 F - → [261m RFF 6] 2-





