
Calcium
Contexte des ??coles Wikip??dia
Cette s??lection ??coles a ??t?? choisi par SOS Enfants pour les ??coles dans le monde en d??veloppement ne ont pas acc??s ?? Internet. Il est disponible en t??l??chargement intranet. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille pr??s de la charit??. Lire la suite ...
| Calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20 Ca | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris mat, argent  Raies spectrales de calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | calcium, Ca, 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / k ?? l s Je ə m / -Əm de KAL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??tal alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 2 (m??taux alcalino-terreux) , 4, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 40,078 (4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 4s 2 2, 8, 8, 2 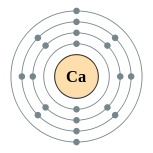 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 1,55 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 1,378 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1115 K , 842 ?? C, 1548 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 1757 K, 1484 ?? C, 2703 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 8,54 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 154,7 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,929 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 2, 1 (Fortement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,00 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 589,8 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1145,4 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 4912,4 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 197 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 176 ?? 22 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 231 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 33,6 nΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 201 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 22,3 um ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 3,810 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 7,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 1,75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 167 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le calcium est l' ??l??ment chimique avec le symbole de Ca et de num??ro atomique 20. Le calcium est un doux gris m??tal alcalino-terreux , et est le cinqui??me ??l??ment le plus abondante en masse dans la Terre de la cro??te . Le calcium est ??galement l'ion dissous cinqui??me plus abondant dans l'eau de mer ?? la fois par molarit?? et de masse, apr??s sodium , chlorure, magn??sium et sulfate .
Le calcium est essentiel pour la vie des organismes , en particulier dans la cellule physiologie, o?? le mouvement de l'ion calcium Ca2 + dans et hors de la cytoplasme fonctions en tant que signal pour de nombreux processus cellulaires. En tant que mat??riau principal utilis?? dans la min??ralisation des os, dents et coquilles, de calcium est le plus abondant m??tal en masse dans de nombreux animaux .
Caract??ristiques notables

En termes chimiques, de calcium r??actif et souple pour un m??tal (bien plus dur que le plomb, il peut ??tre coup?? avec un couteau avec difficult??). Ce est un ??l??ment m??tallique argent?? qui doit ??tre extrait par ??lectrolyse ?? partir d'un condens?? sel comme le chlorure de calcium . Une fois produit, il forme rapidement un gris-blanc oxyde et rev??tement nitrure lorsqu'il est expos?? ?? l'air. En vrac (g??n??ralement sous forme de copeaux ou ??tournures??), le m??tal est un peu difficile ?? enflammer, plus encore que copeaux de magn??sium; mais, lorsqu'il est allum??, le m??tal br??le dans l'air avec une haute intensit?? rouge-orange lumi??re brillante. Le calcium m??tal r??agit avec l'eau , en g??n??rant de l'hydrog??ne gazeux ?? une vitesse suffisamment rapide pour ??tre visible, mais pas assez vite ?? la temp??rature ambiante pour produire de chaleur, ce qui est utile pour produire de l'hydrog??ne. Sous forme de poudre, toutefois, la r??action avec l'eau est extr??mement rapide, comme l'augmentation de la surface de la poudre acc??l??re la r??action avec l'eau. Une partie de la lenteur de la r??action conduit calcium dans l'eau du m??tal ??tant partiellement prot??g??e par blanc insoluble l'hydroxyde de calcium. Dans des solutions aqueuses d'acides, o?? ce sel est soluble, le calcium r??agit vigoureusement.
Le calcium, avec une densit?? de 1,55 g / cm 3, est le plus l??ger des m??taux alcalino-terreux; magn??sium ( densit?? 1,74) et le b??ryllium (1,84) sont plus denses, bien plus l??ger en masse atomique. De strontium avant, les m??taux alcalino-terreux deviennent plus dense avec l'augmentation de masse atomique.
Il dispose de deux allotropes .
Le calcium a une r??sistivit?? ??lectrique plus ??lev??e que le cuivre ou l'aluminium , pour l'instant poids-poids, en raison de sa densit?? beaucoup plus faible, ce est un meilleur conducteur que plut??t navigateur. Cependant, son utilisation dans des applications terrestres est g??n??ralement limit??e par sa grande r??activit?? avec l'air.
Les sels de calcium sont incolores ?? partir de toute contribution du calcium, et les solutions ioniques de calcium (Ca 2+) sont incolores ainsi. Comme dans le cas du magn??sium et d'autres sels les sels de m??taux alcalino-terreux, les sels de calcium sont souvent tr??s soluble dans l'eau. Les exceptions notables incluent le hydroxyde, le sulfate (inhabituel pour les sels de sulfate), le carbonate et le phosphates. A l'exception du sulfate, m??me les insolubles ceux ??num??r??s ci sont en g??n??ral plus solubles que les m??taux de transition homologues. Lorsque en solution, l'ion calcium au go??t humaine varie remarquablement, ??tant signal?? que l??g??rement sal??, aigre, ??min??ral comme?? ou m??me ??apaisante??. Il est ??vident que de nombreux animaux peuvent go??ter, ou de d??velopper un go??t, pour le calcium, et d'utiliser ce sens pour d??tecter le min??ral blocs de sel ou d'autres sources. En nutrition humaine, les sels de calcium solubles peuvent ??tre ajout??s ?? tarte jus sans beaucoup d'effet au palais moyenne.
Le calcium est le cinqui??me ??l??ment le plus abondante en masse dans le corps humain, o?? il est un messager ionique cellulaire commun avec de nombreuses fonctions, et sert ??galement comme un ??l??ment structurel dans l'os. Ce est le calcium relativement haute num??ro atomique dans le squelette qui provoque os ?? ??tre radio-opaque. Des composants solides du corps humain apr??s le s??chage et le br??lage des mati??res organiques (comme par exemple, apr??s cr??mation), environ un tiers de la masse restante "min??rale" totale, est le d'environ un kilogramme de calcium qui compose le squelette moyenne (le reste ??tant surtout du phosphore et de l'oxyg??ne).
H et K lignes
Spectres visible de nombreuses stars, dont le Sun , pr??sentent une forte raies d'absorption du calcium ionis??. Au premier rang de ceux-ci sont l'H-ligne ?? 3968,5 ?? et la ligne K ?? 3933,7 ?? du calcium ionis??, ou Ca II. Pour le Soleil et les ??toiles avec des temp??ratures basses, l'importance des lignes H et K peut ??tre une indication de l'activit?? magn??tique intense dans le chromosph??re. Mesure des variations p??riodiques de ces r??gions actives peut ??galement ??tre utilis?? pour d??duire les p??riodes de ces ??toiles de rotation.
Compos??s
Calcium, combin?? avec phosphate pour former hydroxyapatite, est la partie min??rale des os et des dents humaines et animales. La partie min??rale de certains coraux peuvent ??galement ??tre transform??s en hydroxyapatite.
L'hydroxyde de calcium (chaux ??teinte) est utilis?? dans de nombreux proc??d??s de raffinage chimique et est effectu?? par chauffage calcaire ?? haute temp??rature (au-dessus de 825 ?? C), puis en ajoutant avec pr??caution de l'eau ?? elle. Lorsque la chaux est m??lang??e avec du sable, il durcit dans un mortier et est transform?? en pl??tre par du dioxyde de carbone absorption. M??lang?? avec d'autres compos??s, la chaux constitue une partie importante de Ciment Portland.
Le carbonate de calcium (de CaCO 3) est l'un des compos??s communs de calcium. Elle est chauff??e pour former de la chaux vive (CaO), qui est ensuite ajout?? ?? l'eau (H 2 O). Cela constitue un autre mat??riau connu sous le nom de chaux ??teinte (Ca (OH) 2), qui est un mat??riau de base peu co??teux utilis??s dans l'industrie chimique. Chalk, le marbre et le calcaire sont toutes les formes de carbonate de calcium.
Lorsque l'eau se infiltre dans calcaire ou d'autres solubles carbonate rochers, il se dissout partiellement le rock et provoque la formation de la grotte et caract??ristique stalactites et stalagmites et aussi des formes l'eau dure. D'autres compos??s de calcium sont importants le nitrate de calcium, sulfure de calcium, le chlorure de calcium , le carbure de calcium, la cyanamide calcique et l'hypochlorite de calcium.
Quelques compos??s de calcium dans l'??tat d'oxydation 1 ont ??galement ??t?? ??tudi??s r??cemment.
Isotopes
Le calcium a quatre stables isotopes (40 Ca, Ca 42, 43 et 44 Ca Ca), plus deux isotopes plus (46 Ca et Ca 48) qui ont une telle longue demi-vie, ?? toutes fins pratiques, ils peuvent aussi ??tre consid??r??e comme stable. La gamme de 20% en masse par rapport parmi les isotopes d'origine naturelle de calcium est sup??rieur ?? ne importe quel ??l??ment ?? l'exception de l'hydrog??ne et l'h??lium. Le calcium a ??galement un isotopes cosmog??niques, 41 Ca radioactif, qui a une demi-vie de 103.000 ann??es. Contrairement ?? isotopes cosmog??niques qui sont produites dans l' atmosph??re , 41 Ca est produit par neutrons activation de 40 Ca. La plupart de sa production est dans le premier m??tre ou deux de la colonne de sol, o?? le flux de neutrons cosmog??nique est encore suffisamment forte. 41 Ca a re??u beaucoup d'attention dans les ??tudes stellaires parce qu'il se d??sint??gre ?? 41 K, un indicateur essentiel des anomalies du syst??me solaire .
Quatre-vingt-sept pour cent du calcium naturel est sous la forme de 40 Ca. Ca 40 est l'un des produits de filiation de 40 K d??croissance, avec 40 Ar. Tandis que Datation K-Ar a ??t?? largement utilis?? dans les g??ologiques sciences, la pr??valence de 40 Ca dans la nature a emp??ch?? son utilisation dans les fr??quentations. Les techniques utilisant la spectrom??trie de masse et un double pic dilution des isotopes ont ??t?? utilis??es pour K -Ca datation.
L'isotope le plus abondant, 40 Ca, poss??de un noyau de 20 protons et 20 neutrons . Ce est le plus lourd isotope stable de tout ??l??ment qui a le m??me nombre de protons et de neutrons. Dans explosions de supernovae, de calcium est form?? ?? partir de la r??action du carbone avec divers nombres de particules alpha (noyaux d'h??lium), jusqu'?? ce que l'isotope de calcium les plus courantes (contenant 10 des noyaux d'h??lium) a ??t?? synth??tis??.
Fractionnement isotopique
Comme avec les isotopes d'autres ??l??ments, une vari??t?? de processus fractionner, ou de modifier l'abondance relative des isotopes de calcium. Le mieux ??tudi?? de ces processus est la masse d??pend fractionnement des isotopes de calcium qui accompagne la pr??cipitation de min??raux de calcium, telles que calcite , aragonite et apatite, de la solution. Isotopes de calcium lumi??re est pr??f??rentiellement incorpor?? dans les min??raux, laissant la solution ?? partir de laquelle le min??ral pr??cipit?? enrichi en calcium isotope lourd. A temp??rature ambiante l'ampleur de ce fractionnement est d'environ 0,25 ??? (0,025%) par unit?? de masse atomique (UMA). diff??rences de masse d??pendant de la composition isotopique de calcium conventionnelle sont exprim??s le rapport de deux isotopes (g??n??ralement 44 Ca / 40 Ca) dans un ??chantillon par rapport ?? la m??me ratio dans un mat??riau de r??f??rence standard. 44 Ca / 40 Ca varie d'environ 1% chez commune mat??riaux g??ologiques.
Calcium fractionnement isotopique lors de la formation min??rale a conduit ?? plusieurs applications des isotopes de calcium. En particulier, l'observation 1997 par Skulan et DePaolo que les min??raux de calcium sont isotope plus l??ger que les solutions ?? partir de laquelle les min??raux pr??cipitent est la base des demandes analogues en m??decine et dans pal??ooc??anographie. Chez les animaux avec des squelettes min??ralis??es en calcium de la composition isotopique de calcium des tissus mous par rapport refl??te le taux de formation et la dissolution du min??ral osseux. Chez l'??tre humain a ??t?? d??montr?? que des changements dans la composition isotopique de calcium de l'urine ?? ??tre li??e ?? des changements dans l'??quilibre min??ral de l'os. Lorsque le taux de formation osseuse est sup??rieur au taux de r??sorption osseuse, les tissus mous 44 Ca / Ca 40 augmente. Tissus mous 44 Ca / Ca 40 tombe lorsque la r??sorption osseuse d??passe la formation osseuse. En raison de cette relation, mesures isotopiques de calcium d'urine ou de sang peuvent ??tre utiles dans la d??tection pr??coce des maladies osseuses m??taboliques telles que l'ost??oporose.
Un syst??me similaire existe dans l'oc??an, o?? l'eau de mer 44 Ca / 40 Ca a tendance ?? augmenter lorsque le taux d'??limination de Ca 2+ de l'eau de mer par pr??cipitation min??rale d??passe l'entr??e de la nouvelle calcium dans l'oc??an, et ?? l'automne lorsque l'entr??e de calcium d??passe les pr??cipitations min??rale . Il se ensuit que la hausse de 44 Ca / 40 Ca correspond ?? la baisse de l'eau de mer concentration de Ca2 +, et de tomber 44 Ca / 40 Ca correspond ?? l'augmentation de l'eau de mer concentration de Ca2 +. En 1997 Skulan et DePaolo pr??sent?? la premi??re preuve de changement de l'eau de mer 44 Ca / 40 Ca cours des temps g??ologiques, avec une explication th??orique de ces changements. Des travaux plus r??cents ont confirm?? cette observation, ce qui d??montre que l'eau de mer Ca 2+ concentration ne est pas constante, et que l'oc??an probablement jamais est en ????tat stable?? par rapport ?? son entr??e et la sortie de calcium. Ceci a des implications importantes climatologiques, que le cycle de calcium marin est ??troitement li??e ?? la cycle du carbone (voir ci-dessous).
Cycle g??ochimique
Calcium fournit un lien important entre tectonique, climatique et de la cycle du carbone. En termes simples, le soul??vement des montagnes expose roches Ca portant ?? l'alt??ration chimique et lib??re Ca 2+ dans les eaux de surface. Cette Ca 2+ est finalement transport?? vers l'oc??an o?? il r??agit avec le CO 2 dissous pour former calcaire. Une partie de ce calcaire se d??pose au fond de la mer o?? il est incorpor?? dans de nouveaux roches. CO 2 dissous, avec du carbonate et des ions bicarbonate, sont appel??s carbone inorganique dissous (DIC).

La r??action proprement dite est plus complexe et fait intervenir l'ion bicarbonate (HCO 3 -) qui se forme lorsque le CO 2 r??agit avec l'eau ?? l'eau de mer pH:
- Ca2 + HCO 2 -
3 → CaCO 3 (calcaire) + CO 2 + H 2 O
Notez que le pH des oc??ans ?? la plupart du CO 2 produit dans cette r??action est imm??diatement reconverti en HCO -
3. Les r??sultats de la r??action dans un transport net d'une mol??cule de CO 2 de l'oc??an / atmosph??re dans le lithosph??re.
Le r??sultat est que chaque ion Ca2 + lib??r?? par l'alt??ration chimique supprime finalement une mol??cule de CO 2 du syst??me de surface (atmosph??re, les oc??ans, les sols et les organismes vivants), le stocker dans des roches carbonat??es o?? il est susceptible de rester pour des centaines de millions de ann??es. L'alt??ration du calcium ?? partir de roches ainsi gommages CO 2 de l'oc??an et l'atmosph??re, en exer??ant un fort effet ?? long terme sur le climat. Cycles analogues impliquant le magn??sium, et dans une moindre mesure le strontium et le baryum beaucoup plus petite, a le m??me effet.
Comme l'alt??ration de calcaire (CaCO3) lib??re des quantit??s ??quimolaires de Ca 2+ et de CO 2, il n'a aucun effet net sur la teneur en CO 2 de l'atmosph??re et l'oc??an. L'alt??ration des roches silicat??es comme le granit , d'autre part, est un filet puits de CO 2, car elle produit Ca 2+ abondante mais tr??s peu de CO 2.
Histoire
Lime comme mat??riau de construction a ??t?? utilis?? depuis les temps pr??historiques remontant aussi loin que 7000 ?? 14000 av. Le premier en date du Dates de four ?? chaux de retour ?? 2500 avant JC et a ??t?? trouv?? dans Khafadje M??sopotamie . Calcium (du latin chaux, calcis g??nitif, qui signifie ??chaux??) ??tait connu d??s le premier si??cle, quand les Romains pr??par?? chaux oxyde de calcium. Litt??rature datant de 975 notes d'annonce qui Pl??tre de Paris (sulfate de calcium), est utile pour r??gler les os bris??s. Il n'a pas ??t?? isol?? jusqu'en 1808 en Angleterre lorsque Sir Humphry Davy ??lectrolys??e un m??lange de chaux et de l'oxyde mercurique. Davy essayait d'isoler calcium; quand il apprit que chimiste su??dois J??ns Jakob Berzelius et Pontin pr??par??s amalgame de calcium par ??lectrolyse chaux dans le mercure, il a essay?? lui-m??me. Il a travaill?? avec l'??lectrolyse au long de sa vie et aussi d??couvert / isol??e de sodium , de potassium , de magn??sium , de bore et de baryum . Calcium-m??tal ne ??tait pas disponible ?? grande ??chelle jusqu'?? ce que le d??but du 20e si??cle.
Occurrence
Calcium ne est pas naturellement pr??sent dans l'??tat ??l??mentaire. Calcium se produit le plus souvent dans des roches s??dimentaires dans les min??raux de calcite , dolomite et de gypse . Il se produit ??galement dans ign??es et m??tamorphiques principalement dans le silicates: plagioclases, amphiboles, pyrox??nes et grenats.
Applications
Le calcium est utilis??
- comme un agent r??ducteur dans l'extraction d'autres m??taux, tels que l'uranium , le zirconium et le thorium .
- comme d??soxydant, de d??sulfuration, ou d??calaminant pour divers m??taux ferreux et non ferreux alliages.
- comme agent d'alliage utilis?? dans la production d' aluminium , de b??ryllium , de cuivre , de plomb et de magn??sium des alliages.
- dans la fabrication de ciments et mortiers ?? ??tre utilis??s dans construction.
- dans la fabrication du fromage , o?? calcium ions influencent l'activit?? de r??nine dans la r??alisation de la la coagulation du lait.
Les compos??s de calcium
- Le carbonate de calcium (CaCO 3) est utilis?? dans la fabrication ciment et de mortier, citron vert, calcaire (g??n??ralement utilis?? dans l'industrie de l'acier) et aide ?? la production dans l'industrie du verre. Il a ??galement des utilisations chimiques et optiques que les sp??cimens de min??raux dans dentifrices, par exemple.
- une solution d'hydroxyde de calcium (Ca (OH) 2) (??galement connu sous le nom eau de chaux) est utilis?? pour d??tecter la pr??sence de dioxyde de carbone par barbotage dans une solution. Il devient trouble o?? le CO 2 est pr??sent.
- l'ars??niate de calcium (Ca 3 (AsO 4) 2) est utilis?? en insecticides.
- Le carbure de calcium (CaC 2) est utilis?? pour faire de l'ac??tyl??ne gaz (pour une utilisation dans l'ac??tyl??ne torches de soudage ) et dans la fabrication de mati??res plastiques .
- Le chlorure de calcium (CaCl 2) est utilis?? dans la glace et l'??limination contr??le de la poussi??re sur les routes de terre, dans le conditionneur pour b??ton, en tant qu'additif dans conserve les tomates, et de fournir des corps pour l'automobile pneus.
- Calcium cyclamate (Ca (C 6 H 11 NHSO 3) 2) a ??t?? utilis?? comme agent ??dulcorant, mais ne est plus autoris??e pour une utilisation en raison des propri??t??s pr??sum??s canc??rig??nes.
- Le gluconate de calcium (Ca (C 6 H 11 O 7) 2) est utilis?? en tant que additif alimentaire et vitamines pilules.
- L'hypochlorite de calcium (Ca (OCl) 2) est utilis?? en tant que piscine d??sinfectant, en tant que Agent de blanchiment, en tant qu'ingr??dient dans d??odorant, et algicide et fongicide.
- permanganate de calcium (Ca (MnO 4) 2) est utilis?? en propergol liquide, textile production, comme un agent de st??rilisation de l'eau et dans des interventions dentaires.
- Le phosphate de calcium (Ca 3 (PO 4 2)) est utilis?? en tant que suppl??ment pour animaux aliments pour animaux, des engrais , dans la production commerciale de p??te et la levure des produits, dans la fabrication de verre , et dans les produits de soins dentaires.
- Phosphure de calcium (Ca 3 P 2) est utilis?? dans feux d'artifice, rodenticide, torpilles et fus??es.
- le st??arate de calcium (Ca (C 18 H 35 O 2) 2) est utilis?? dans la fabrication de cire crayons, ciments, certains types de plastiques et cosm??tiques, en tant que Additif alimentaire pour la production de mat??riaux r??sistant ?? l'eau et ?? la production de les peintures.
- Le sulfate de calcium (CaSO 4 ?? 2H 2 O) est utilis?? comme craie commune, ainsi que, dans sa forme h??mihydrate mieux connu sous le pl??tre de Paris.
- Tungstate de calcium (CaWO 4) est utilis?? dans lumineux peintures, lampes fluorescentes et ??tudes aux rayons X.
- L'hydroxyapatite (Ca 5 (PO 4) 3 (OH), mais est habituellement ??crit Ca 10 (PO 4) 6 (OH) 2) repr??sente soixante dix pour cent de osseuse. Aussi gaz??ifi??e-calcium hydroxyapatite d??ficiente est le principal min??ral dont l'??mail dentaire et dentine sont constitu??s.
Nutrition
| ??ge | Calcium (mg / jour) |
|---|---|
| 0-6 mois | 200 |
| 7-12 mois | 260 |
| 13 ans | 700 |
| 4-8 ans | 1000 |
| 9-18 ans | 1300 |
| 19-50 ans | 1000 |
| 51-70 ans (m??le) | 1000 |
| 51-70 ans (femelle) | 1200 |
| 71+ ann??es | 1200 |
Le calcium est un ??l??ment important d'une alimentation saine et un min??raux n??cessaires ?? la vie. Le National Osteoporosis Foundation dit: ??Le calcium joue un r??le important dans la construction de forts, des os plus denses t??t dans la vie et de garder des os solides et en bonne sant?? plus tard dans la vie." Environ 99 pour cent du calcium de l'organisme est stock?? dans les os et les dents. Le reste du calcium dans l'organisme a d'autres utilisations importantes, telles que certaines exocytose, en particulier la lib??ration de neurotransmetteurs , et la contraction musculaire. Dans le syst??me de conduction ??lectrique du coeur, le calcium remplace sodium comme le min??ral qui d??polarise la cellule, la prolif??ration du potentiel d'action. Dans le muscle cardiaque, l'influx de sodium commence un potentiel d'action, mais au cours de l'efflux de potassium, le myocyte cardiaque subit l'influx de calcium, de prolonger le potentiel d'action et la cr??ation d'une phase de plateau d'??quilibre dynamique. Long terme carence en calcium peut conduire au rachitisme et une mauvaise coagulation du sang et en cas d'une femme m??nopaus??e, elle peut conduire ?? l'ost??oporose, dans laquelle l'os se d??t??riore et il existe un risque accru de fractures. Alors que le d??ficit continue peut affecter formation des os et des dents, trop peut causer la r??tention hypercalc??mie (taux de calcium ??lev?? dans le sang), une insuffisance r??nale et une diminution de l'absorption d'autres min??raux. Plusieurs sources sugg??rent une corr??lation entre l'apport ??lev?? en calcium (2000 mg par jour, ou deux fois les Etats-Unis recommand?? indemnit?? journali??re, l'??quivalent de six ou plusieurs verres de lait par jour) et cancer de la prostate. Apport ??lev?? de calcium ou absorption ??lev??e de calcium ??taient auparavant consid??r??s comme contribuant au d??veloppement de calculs r??naux. Cependant, un apport ??lev?? de calcium a ??t?? associ??e ?? un risque plus faible pour des calculs r??naux dans la recherche plus r??cente. La vitamine D est n??cessaire pour absorber le calcium.
Les produits laitiers tels que le lait et le fromage, sont une source bien connue de calcium. Certaines personnes sont allergiques aux produits laitiers et m??me plus de gens, en particulier ceux d'origine non indo-europ??enne, sont intol??rants au lactose, qui les emp??che de consommer des produits laitiers non ferment??s dans des quantit??s sup??rieures ?? environ un demi-litre par portion. D'autres, comme v??g??taliens, ??viter les produits laitiers pour des raisons ??thiques et de sant??.
Beaucoup de bonnes sources v??g??tales de calcium existent, y compris les algues telles que varech, wakame et hijiki; noix et les graines comme les amandes , noisettes, s??same , pistache; Blackstrap m??lasse; haricots (en particulier les haricots de soja ); figues; quinoa; gombo; rutabaga; ; le brocoli pissenlit feuilles; le chou fris??. En outre, pour certaines boissons (comme lait de soja ou de jus d'orange), il est typique pour enrichi de calcium.
De nombreux l??gumes, notamment ??pinards, blettes et la rhubarbe ont une teneur ??lev??e en calcium, mais ils peuvent ??galement contenir des quantit??s variables de l'acide oxalique qui se lie calcium et r??duit son absorption. Le m??me probl??me peut affecter un degr?? de l'absorption du calcium ?? partir de amarante, chou vert, greens de chicor??e. Ce proc??d?? peut ??galement ??tre li??e ?? la production de oxalate de calcium.
Une source n??glig??e de calcium est la coquille, qui peut ??tre broy?? en une poudre et m??lang?? ?? de la nourriture ou un verre d'eau.
La teneur en calcium de la plupart des aliments peut ??tre trouv??e dans la base de donn??es de l'USDA National des ??l??ments nutritifs.
Suppl??ments de calcium alimentaire

Les suppl??ments de calcium sont utilis??s pour pr??venir et traiter les carences en calcium. La plupart des experts recommandent que les suppl??ments ??tre prises avec de la nourriture et que pas plus de 600 mg devraient ??tre prises ?? la fois parce que le pour cent de calcium absorb??e diminue ?? mesure que la quantit?? de calcium dans les suppl??ments augmente. Il est recommand?? d'??taler doses tout au long de la journ??e. L'apport quotidien recommand?? en calcium pour les adultes varie de 1000 ?? 1500 mg. Il est recommand?? de prendre des suppl??ments avec de la nourriture pour aider ?? l'absorption.
La vitamine D est ajout?? ?? des suppl??ments de calcium. Une bonne statut de la vitamine D est importante parce que la vitamine D est convertie en une hormone dans l'organisme, ce qui induit alors la synth??se des prot??ines responsables de l'absorption intestinale de calcium.
- L'absorption du calcium de la plupart des aliments et des suppl??ments alimentaires couramment utilis??s est tr??s similaire. Ceci est contraire ?? ce que beaucoup de fabricants de suppl??ments de calcium affirment dans leur mat??riel promotionnel.
- Lait est une excellente source de calcium alimentaire pour ceux dont les corps tol??rer parce qu'il a une forte concentration de calcium et de calcium dans le lait est tr??s bien absorb??e.
- Lait de soja et autres laits v??g??taux sont habituellement vendus avec le calcium ajout??e de sorte que la concentration de calcium est aussi ??lev?? que dans le lait.
- Aussi diff??rents types de jus dop?? avec du calcium sont largement disponibles.
- Le carbonate de calcium est le suppl??ment de calcium la plus courante et la moins co??teuse. Il doit ??tre pris avec de la nourriture. Cela d??pend de faibles niveaux de pH pour une bonne absorption dans l'intestin. Certaines ??tudes sugg??rent que l'absorption du calcium ?? partir de carbonate de calcium est similaire ?? l'absorption du calcium de lait. Alors que la plupart des gens dig??rent le carbonate de calcium tr??s bien, certains pourraient d??velopper des malaises gastro-intestinaux ou de gaz. Prenant magn??sium avec elle peut aider ?? ??viter la constipation. Le carbonate de calcium est de 40% de calcium ??l??mentaire. 1000 mg fournira 400 mg de calcium. Cependant, les ??tiquettes des suppl??ments seront g??n??ralement indiquent la quantit?? de calcium est pr??sent dans chaque portion, pas combien de carbonate de calcium est pr??sent.
- Les antiacides contiennent souvent du carbonate de calcium, et sont, d'un suppl??ment de calcium peu co??teux couramment utilis??.
- Le calcium de corail est un sel de calcium provenant de r??cifs coralliens fossilis??s. Le calcium de corail est compos?? de carbonate de calcium et des oligo-??l??ments.
- Le citrate de calcium peut ??tre prise sans nourriture et est le suppl??ment de choix pour les personnes atteintes d'achlorhydrie ou qui prennent histamine-2 bloquants ou les inhibiteurs de la pompe ?? protons. Le citrate de calcium est d'environ 21% de calcium ??l??mentaire. 1000 mg fournira 210 mg de calcium. Il est plus cher que le carbonate de calcium et de plus il doit ??tre pris pour obtenir la m??me quantit?? de calcium.
- Le phosphate de calcium est plus co??teux que le carbonate de calcium, mais inf??rieure citrate de calcium. Hydroxyapatite microcristalline (MH) est une de plusieurs formes de phosphate de calcium utilis?? en tant que compl??ment alimentaire. L'hydroxyapatite est d'environ 40% de calcium.
- Le lactate de calcium pr??sente une absorption similaire ?? celle du carbonate de calcium, mais il est plus co??teux. le lactate de calcium et le gluconate de calcium sont des formes moins concentr??es de calcium et des suppl??ments oraux ne sont pas pratiques.
- Calcium sont des compos??s ch??lates de calcium synth??tiques, avec le calcium li?? ?? une mol??cule organique, tel que le malate, un aspartate, un ou fumarate. Ces formes de calcium peuvent ??tre mieux absorb??s sur un estomac vide. Cependant, en g??n??ral, ils sont absorb??s de mani??re similaire ?? du carbonate de calcium et d'autres suppl??ments de calcium commun lorsqu'il est pris avec de la nourriture. Les imite "ch??late" l'action qui effectue d'aliments naturels en gardant soluble dans l'intestin de calcium. Ainsi, sur un estomac vide, chez certains individus, ch??lates pourraient, en th??orie, ??tre absorb??s mieux.
Une ??tude portant sur les effets de l'utilisation de suppl??ments de calcium personnelle sur le risque cardiovasculaire dans Initiative sur la sant?? de calcium des femmes / vitamine D ??tude suppl??mentation (WHI ??tude CAO) a trouv?? un risque l??g??rement accru d'??v??nements cardiovasculaires, notamment l'infarctus du myocarde chez les femmes m??nopaus??es. Un large recommandation du calcium / vitamine D suppl??ments ne est donc pas justifi??e.
Pr??vention des fractures dues ?? l'ost??oporose
Ces ??tudes ne sont souvent pas tester calcium seul, mais plut??t une combinaison de calcium et de vitamine D. Des essais contr??l??s randomis??s ont trouv?? des effets ?? la fois positifs et n??gatifs. Les diff??rents r??sultats peuvent se expliquer par des doses de calcium et des taux sous-jacents de la suppl??mentation en calcium dans les groupes de contr??le. Toutefois, il est clair que l'augmentation de l'apport en calcium favorise le d??p??t de calcium dans les os, o?? il est plus b??n??fique dans la pr??vention des fractures de compression r??sultant de l'amincissement de la ost??oporotique Web dendritique des corps des vert??bres, que ce est ?? la pr??vention de la plus grave fractures osseuses corticales qui se produisent ?? la hanche et du poignet.
La pr??vention du cancer possible
Un m??ta-analyse par l'international Cochrane Collaboration de deux essais contr??l??s randomis??s ont trouv?? que le calcium "pourrait contribuer ?? un degr?? mod??r?? ?? la pr??vention des ad??nomateuse polypes du c??lon ??.
Des ??tudes plus r??centes ont ??t?? contradictoires, et qui a ??t?? positif pour l'effet (Lappe, et al.) A fait commande d'un possible effet anti-canc??rog??ne de la vitamine D , qui se est av??r?? ??tre une influence positive ind??pendante de calcium seul sur le risque de cancer ( voir deuxi??me ??tude ci-dessous).
- Un essai contr??l?? randomis?? constat?? que 1 000 mg de calcium ??l??mentaire et 400 UI de vitamine D 3 ont eu aucun effet sur le cancer colorectal.
- Un essai contr??l?? randomis?? a constat?? que 1400-1500 mg de calcium suppl??mentaire et 1100 UI de vitamine D 3 r??duits cancers agr??g??es avec un risque relatif de 0,402.
- Une observation cohorte trouv?? qu'un apport ??lev?? en calcium et en vitamine D a ??t?? associ??e ?? ??faible risque de d??velopper un cancer du sein avant la m??nopause."
Risques et de la toxicit??
En comparaison avec d'autres m??taux, l'ion calcium et la plupart des compos??s de calcium pr??sentent une faible toxicit??. Ce ne est pas surprenant ??tant donn?? l'abondance naturelle tr??s ??lev??e de compos??s de calcium dans l'environnement et dans les organismes. Calcium pose peu de probl??mes environnementaux graves, ?? des calculs r??naux effet secondaire le plus commun dans les ??tudes cliniques. Intoxication aigu?? de calcium est rare et difficile ?? r??aliser ?? moins que les compos??s de calcium sont administr??s par voie intraveineuse. Par exemple, la voie orale dose l??tale moyenne (DL 50) chez le rat pour le carbonate de calcium et le chlorure de calcium sont 6,45 et 1,4 g / kg, respectivement.
Calcium m??tal est dangereux en raison de ses r??actions parfois violentes avec de l'eau et les acides. Calcium m??tal est pr??sent dans certains produits de d??bouchage, o?? elle fonctionne ?? g??n??rer de la chaleur et l'hydroxyde de calcium que saponifie les graisses et liqu??fie les prot??ines (par exemple, les cheveux) qui bloquent les drains. Lorsque le m??tal d'ingestion de calcium a le m??me effet sur la bouche, de l'??sophage et de l'estomac, et peut ??tre mortelle.
Une consommation excessive de carbonate de calcium antiacides / compl??ments alimentaires (tels que Tums) sur une p??riode de plusieurs semaines ou mois peut causer lait-alcali syndrome, avec des sympt??mes allant de hypercalc??mie peuvent ??tre potentiellement mortelles insuffisance r??nale. Ce qui constitue la consommation ??excessive?? ne est pas bien connu et, il est pr??sum??, varie beaucoup d'une personne ??. Personnes consommant plus de 10 grammes / jour de CaCO 3 (= 4 g Ca) sont ?? risque de d??velopper un syndrome de lait-alcali, mais l'??tat a ??t?? signal??e dans au moins une personne qui consomme seulement 2,5 grammes / jour de CaCO 3 (= 1 g Ca), un montant g??n??ralement consid??r?? comme mod??r?? et s??r.
Des suppl??ments de calcium diminuent l'absorption orale de thyroxine lorsqu'elle est utilis??e dans quatre ?? six heures de l'autre. Ainsi, les personnes qui prennent la fois du calcium et de la thyroxine courent le risque d'insuffisance de remplacement de l'hormone thyro??dienne et de l?? hypothyro??die se ils prennent simultan??ment ou quasi-simultan??ment.
