
Mercury (??l??ment)
Saviez-vous ...
SOS Enfants a fait cette s??lection Wikipedia aux c??t??s d'autres ??coles des ressources . Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Mercure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
80 Hg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
argent??  Raies spectrales de mercure (UV ne voit pas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | mercure, Hg, 80 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / m ɜr k j ər Je / MER -kyə-ree; / k w ɪ k s ɪ l v ər /; / h aɪ r?? r ɑr dʒ ɨ r ə m / hy- Drar -ji-rəm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 12, 6, r?? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 200,59 (2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 14 5d 10 6s 2 2, 8, 18, 32, 18, 2 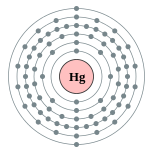 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Ancient Chinese et les Indiens (avant 2000 BC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | liquide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 13,534 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 234.3210 K , -38,8290 ?? C, -37,8922 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 629,88 K, 356,73 ?? C, 674,11 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | 234.3156 K (-39 ?? C), 1,65 ?? 10 -7 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 1750 K, 172,00 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 2,29 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 59,11 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 27,983 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 2 (mercure), 1 (mercureux) (L??g??rement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,00 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 1007,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1810 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 3300 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 151 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 132 ?? 17 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 155 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhombo??drique  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (25 ?? C) ?? m 961nΩ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 8,30 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 60,4 um ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | (Liquide, 20 ?? C) 1451,4 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7439-97-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de mercure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le mercure est un ??l??ment chimique avec le symbole Hg et de num??ro atomique 80. Il est commun??ment connu comme le mercure et ??tait autrefois nomm?? hydrargyrum (du grec " "eau et" hydr- argyros "argent). Une lourde, argent??e ??l??ment du bloc d, du mercure est le seul m??tal qui est liquide ?? conditions normales de temp??rature et de pression; le seul autre ??l??ment qui est liquide dans ces conditions est le brome , bien que des m??taux tels que le c??sium , le gallium , et le rubidium fondre juste au-dessus de la temp??rature ambiante. Avec un point de cong??lation de -38,83 ?? C et le point d'??bullition de 356,73 ?? C, le mercure a une des gammes les plus ??troites de son ??tat liquide de ne importe quel m??tal.
Le mercure se trouve dans les d??p??ts dans le monde entier principalement en cinabre ( sulfure de mercure). Le pigment rouge vermillon, une forme de sulfure de mercure pur, est le plus souvent obtenu par r??action de mercure (produit par r??duction de cinabre) avec du soufre. Cinabre est tr??s toxique par ingestion ou l'inhalation de la poussi??re. L'empoisonnement au mercure peut ??galement r??sulter d'une exposition ?? des formes de mercure soluble dans l'eau (tels que le chlorure mercurique ou m??thylmercure), l'inhalation de vapeurs de mercure, de manger ou de fruits de mer contamin??e par du mercure.
Le mercure est utilis?? dans thermom??tres, barom??tres, manom??tres, tensiom??tres, flotter vannes, interrupteurs ?? mercure, lampes fluorescentes et d'autres dispositifs si les pr??occupations au sujet de la toxicit?? de l'??l??ment ont conduit ?? des thermom??tres au mercure et les tensiom??tres ??tant largement ??limin??s dans des environnements cliniques en faveur de l'alcool -filled, Galinstan rempli, num??rique, ou instruments fond??s thermistance. Il reste en cours d'utilisation dans des applications de recherche scientifique et mat??riau d'amalgame restauration dentaire. Il est utilis?? dans l'??clairage: l'??lectricit?? travers?? vapeur de mercure dans une lampe fluorescente produit ?? ondes courtes de la lumi??re ultraviolette qui provoque alors le phosphore dans le tube pour fluorescence, faisant la lumi??re visible.
Propri??t??s
Propri??t??s physiques

Le mercure est un m??tal blanc argent?? lourd. Par rapport ?? d'autres m??taux, ce est un mauvais conducteur de chaleur, mais un bon conducteur d'??lectricit??. Le mercure a un niveau exceptionnellement bas point de fusion et de temp??ratures d'??bullition pour un m??tal d-bloc. Une explication compl??te de ce plonge profond??ment dans le domaine de la physique quantique , mais elle peut ??tre r??sum??e comme suit: le mercure a une configuration ??lectronique unique o?? les ??lectrons remplissent tous les disponibles 1s, 2s, 2p, 3s, 3p, 3D, 4s, 4p , 4d, 4f, 5s, 5p, 5d et 6s sous-couches. Comme telle configuration r??siste fermement l'enl??vement d'un ??lectron, le mercure se comporte de fa??on similaire ?? gaz nobles ??l??ments, qui forment des liaisons faibles et solides ainsi fonte facilement. La stabilit?? de la coque 6s est due ?? la pr??sence d'une couche 4f rempli. Une coquille de f ??crans mal la charge nucl??aire qui augmente la attractive interaction de Coulomb de la coquille 6s et le noyau (voir contraction lanthanide). L'absence d'une coquille interne rempli de f est la raison de la temp??rature de fusion quelque peu plus ??lev??e de cadmium et de zinc , bien que ces deux m??taux encore fondre facilement et, en outre, ont des points d'??bullition anormalement bas. D'autre part, l'or , qui est un espace vers la gauche de mercure dans le tableau p??riodique, a des atomes avec une moins 6s ??lectrons de mercure. Ces ??lectrons sont plus facilement enlev??s et sont partag??s entre les atomes d'or formant relativement forte liaisons m??talliques.
Propri??t??s chimiques
Le mercure ne r??agit pas avec la plupart des acides dilu??s, comme l'acide sulfurique , bien que acides oxydants tels que le concentr?? de l'acide sulfurique et l'acide nitrique ou l'eau r??gale dissoudre pour donner sulfate, nitrate, et des sels de chlorure. Comme l'argent, le mercure r??agit avec l'atmosph??re sulfure d'hydrog??ne. Mercure r??agit encore avec des flocons de soufre solide, qui sont utilis??s dans des kits de d??versement mercure pour absorber les vapeurs de mercure (trousses de nettoyage utilisent ??galement charbon actif en poudre et de zinc).
Amalgames

Le mercure se dissout bien d'autres m??taux tels que l'or et l'argent pour former amalgames. Le fer est une exception et flacons de fer ont ??t?? traditionnellement utilis?? pour le commerce du mercure. Plusieurs autres m??taux de premi??re transition de la ligne ?? l'exception de mangan??se , le cuivre et le zinc sont r??ticents ?? former des amalgames. D'autres ??l??ments qui ne font pas facilement amalgames au mercure comprennent le platine et quelques autres m??taux. amalgame de sodium est un agent r??ducteur en commun synth??se organique, et est ??galement utilis?? dans lampes au sodium ?? haute pression.
Le mercure se combine facilement avec l' aluminium pour former un mercure-amalgame d'aluminium lorsque les deux m??taux purs entrent en contact. Depuis l'amalgame d??truit l' oxyde d'aluminium couche qui prot??ge de l'oxydation de l'aluminium m??tallique en profondeur (comme dans le fer rouille), m??me de petites quantit??s de mercure peut s??rieusement corroder l'aluminium. Pour cette raison, le mercure ne est pas autoris?? ?? bord d'un a??ronef dans la plupart des cas en raison du risque de formation d'un amalgame d'aluminium avec des parties expos??es de l'avion.
Isotopes
Il ya sept stables isotopes du mercure ?? 202 Hg ??tant le plus abondant (29,86%). La plus longue dur??e des radio-isotopes 194 de mercure sont avec une demi-vie de 444 ans et 203 Hg avec une demi-vie de 46,612 jours. La plupart des radio-isotopes restants ont des demi-vies qui sont moins d'une journ??e. 199 Hg et 201 Hg sont le plus souvent ??tudi??s Noyaux actifs en RMN, ayant respectivement de spins 1/2 et 3/2.
Histoire
Mercury a ??t?? trouv?? dans ??gyptiens tombes qui datent de 1500 av.
Dans la Chine et le Tibet , l'utilisation du mercure a ??t?? pens?? pour prolonger la vie, de gu??rir des fractures, et de maintenir une bonne sant?? g??n??rale, mais il est maintenant connu que l'exposition au mercure entra??ne des effets n??fastes pour la sant??. Le premier empereur de Chine, Q??n shǐ Huangdi - aurait enterr?? dans une tombe qui contenait rivi??res se ??coulant de mercure sur un mod??le de la terre qu'il a jug??, repr??sentant des rivi??res de la Chine - a ??t?? tu?? par boire un mercure et poudre m??lange de jade formul??e par Qin alchimistes (causant insuffisance h??patique, l'empoisonnement au mercure, et la mort c??r??brale) qui avaient l'intention de lui donner la vie ??ternelle.
Les anciens Grecs Mercury dans les pommades; la les anciens Egyptiens et les Romains utilisaient dans cosm??tiques qui, parfois, a d??form?? le visage. En Lamanai, une fois une ville importante de la civilisation maya , un bassin de mercure a ??t?? trouv?? sous un marqueur dans un Ballcourt m??so-am??ricain. En 500 avant JC le mercure a ??t?? utilis?? pour faire amalgames (amalgama latin m??di??val, "alliage de mercure") avec d'autres m??taux.
Alchimistes pensaient de mercure que le Mati??re Premi??re ?? partir de laquelle tous les m??taux ont ??t?? form??es. Ils croyaient que les diff??rents m??taux pourraient ??tre produites en faisant varier la qualit?? et la quantit?? de soufre contenue dans le mercure. Le plus pur d'entre eux ??tait l'or, et le mercure a ??t?? appel?? dans les tentatives de la transmutation de base (ou impurs) les m??taux en or, ce qui ??tait l'objectif de nombreux alchimistes.
Hg est la moderne symbole chimique pour le mercure. Il vient de hydrargyrum, un latinis??e forme du grec mot Ύδραργυρος (hydrargyros), qui est un mot compos?? qui signifie ??eau-argent" (eau = hydr-, argyros = argent) - car il est liquide comme de l'eau et brillant comme l'argent. L'??l??ment a ??t?? nomm?? d'apr??s le dieu romain Mercury, connu pour la vitesse et la mobilit??. Il est associ?? ?? la plan??te Mercure ; le symbole astrologique de la plan??te est aussi l'un des symboles alchimiques pour le m??tal; le mot sanscrit pour l'alchimie est Rasavātam qui signifie ??la voie de mercure??. Le mercure est le seul m??tal dont le nom est devenu plan??taire alchimique le nom commun.
Les mines Almad??n (Espagne), Monte Amiata (Italie), et Idrija (maintenant la Slov??nie) a domin?? la production de mercure ?? partir de l'ouverture de la mine d'Almad??n il ya 2500 ans, jusqu'?? ce que de nouveaux gisements ont ??t?? trouv??s ?? la fin du 19??me si??cle.
Occurrence

Le mercure est un ??l??ment extr??mement rare dans de la Terre la cro??te , ayant une abondance de la cro??te moyenne en masse de seulement 0,08 parties par million (ppm). Cependant, parce qu'il ne se m??lange pas g??ochimique avec ces ??l??ments qui constituent la majorit?? de la masse de la cro??te, minerais de mercure peuvent ??tre extr??mement concentr??s compte tenu de l'abondance de l'??l??ment dans la roche ordinaire. Les plus riches minerais de mercure contiennent jusqu'?? 2,5% de mercure en masse, et m??me les maigres d??p??ts concentr??s sont au moins 0,1% de mercure (12 000 fois la moyenne de l'abondance de la cro??te). Il se trouve soit sous forme de m??tal natif (rare) ou en cinabre, cord??ro??te, livingstonite et d'autres min??raux , de cinabre (HgS) ??tant le minerai le plus commun. minerais de mercure se produisent habituellement dans tr??s jeune ceintures orog??niques o?? la roche de haute densit?? sont contraints ?? la cro??te de la terre, souvent dans des sources chaudes ou d'autres volcaniques r??gions.
A partir de 1558, avec l'invention de la processus de patio pour extraire du minerai d'argent en utilisant le mercure, est devenu une ressource essentielle dans l'??conomie de l'Espagne et ses colonies am??ricaines. Mercury a ??t?? utilis?? pour extraire l'argent des mines lucratives Nouvelle Espagne et le P??rou . Initialement, les mines de la Couronne espagnole ?? Almaden dans le sud de l'Espagne fournis tout le mercure pour les colonies. d??p??ts de mercure ont ??t?? d??couverts dans le Nouveau Monde, et plus de 100 000 tonnes de mercure ont ??t?? extraites de la r??gion de Huancavelica, au P??rou, au cours de trois si??cles apr??s la d??couverte de gisements il en 1563. Le processus de patio et plus tard processus de fusion pan continu?? ?? cr??er une grande demande de mercure pour traiter des minerais d'argent jusqu'?? la fin du 19??me si??cle.

Anciennes mines Italie , le Royaume-Unis et le Mexique qui a produit une fois une grande partie de l'approvisionnement mondial ont ??t?? compl??tement exploit?? sur ou, dans le cas de la Slov??nie ( Idrija) et en Espagne ( Almad??n), ferm?? en raison de la chute du prix du mercure. Nevada McDermitt mine, la derni??re mine de mercure aux ??tats-Unis, a ferm?? en 1992. Le prix du mercure a ??t?? tr??s volatile au cours des ans et en 2006 ??tait de 650 $ par 76 livres (34,46 kg) flacon.
Le mercure est extraite par chauffage de cinabre dans un courant d'air et de condensation de la vapeur. L'??quation de cette extraction est
- HgS + O 2 → Hg + SO 2
En 2005, la Chine ??tait le premier producteur de mercure pr??s des deux-tiers part globale suivie par le Kirghizistan . Plusieurs autres pays sont soup??onn??s d'avoir la production non enregistr??e de mercure ?? partir de cuivre ??lectrolytique processus et par la r??cup??ration des effluents.
En raison de la forte toxicit?? du mercure, ?? la fois l'exploitation de cinabre et de raffinage pour le mercure sont des causes dangereuses et historiques de l'empoisonnement au mercure. En Chine, le travail p??nitentiaire a ??t?? utilis?? par une compagnie mini??re priv??e aussi r??cemment que les ann??es 1950 pour cr??er de nouvelles mines de mercure du cinabre. Des milliers de prisonniers ont ??t?? utilis??s par la soci??t?? mini??re Luo Xi ?? ??tablir de nouveaux tunnels. En outre, la sant?? des travailleurs dans le fonctionnement des mines est ?? haut risque.
L' Union europ??enne directive demandant compacte les ampoules fluorescentes ?? ??tre rendues obligatoires d'ici 2012 a encourag?? la Chine de rouvrir les mines de cinabre mortelles pour obtenir le mercure n??cessaire pour la fabrication de CFL ampoule. En cons??quence, les dangers environnementaux ont ??t?? une pr??occupation, en particulier dans les villes du sud de Foshan et Guangzhou , et dans le Province de Guizhou dans le sud-ouest.
Mine de mercure sites de traitement abandonn??s contiennent souvent des tas de d??chets tr??s dangereux de cinabre r??ti calcine. Les eaux de ruissellement de ces sites est une source reconnue de dommages ??cologiques. Anciennes mines de mercure peuvent ??tre adapt??s ?? la r??utilisation constructive. Par exemple, en 1976, Comt?? de Santa Clara, en Californie, a achet?? l'historique Almaden Quicksilver mine et a cr???? un parc du comt?? sur le site, apr??s avoir proc??d?? ?? une vaste analyse de l'environnement et de la s??curit?? de la propri??t??.
Chimie
Le mercure existe sous deux principaux ??tats d'oxydation, I et II. ??tats d'oxydation sup??rieurs ne sont pas importantes, mais ont ??t?? d??tect??s, par exemple, mercure (IV) fluorure (HGF 4) mais seulement dans des conditions extraordinaires.
Les compos??s de mercure (I)
Diff??rente de ses voisins plus l??gers, le cadmium et le zinc, des formes de mercure des compos??s stables simples avec des liaisons m??tal-m??tal. Les mercure (I) sont des compos??s diamagn??tique et disposent cation dim??re, Hg 2+
2. D??riv??s stables comprennent le chlorure et le nitrate. Traitement de Hg (I) les compos??s complexation avec des ligands puissants tels que le sulfure, le cyanure, etc. induit dismutation de Hg 2+ et de mercure ??l??mentaire. Mercury (I) le chlorure, un solide incolore aussi connu comme calomel, ce est vraiment le compos?? de formule Hg 2 Cl 2, avec la connectivit?? Cl-Hg-Hg-Cl. Ce est une norme en ??lectrochimie. Il r??agit avec le chlore pour donner le chlorure mercurique, qui r??siste ?? une nouvelle oxydation.
Indicatif de sa tendance ?? se lier ?? lui-m??me, les formes de mercure polycations de mercure, qui se composent de cha??nes lin??aires de centres de mercure, plafonn??s avec une charge positive. Un exemple est Hg 2+
3 (ASF -
6)
2.
Les compos??s de mercure (II)
Le mercure (II) est l'??tat d'oxydation le plus courant et est la principale dans une nature aussi. Tous les quatre halog??nures mercuriques sont connus. Les formulaires complexes t??tra??driques avec d'autres ligands mais les halog??nures adoptent g??om??trie de coordination lin??aire, un peu comme Ag + fait. Mieux connu est de mercure (II) chlorure, un facilement sublimant solide blanc. HgCl 2 formes des complexes de coordination qui sont typiquement t??tra??dre, par exemple HgCl 2-
4.
Le mercure (II) oxyde, le principal l'oxyde de mercure, se pose lorsque le m??tal est expos?? ?? l'air pendant de longues p??riodes ?? des temp??ratures ??lev??es. Il revient aux ??l??ments lors du chauffage pr??s de 400 ?? C, comme cela a ??t?? d??montr?? par des pr??tres dans une synth??se pr??coce de pur oxyg??ne . Hydroxydes de mercure sont mal caract??ris??es, car ils sont pour ses voisins or et d'argent.
??tre un m??tal mou, d??riv??s formes de mercure tr??s stables avec les chalcog??nes lourds. Pr????minent est de mercure (II) sulfure, HgS, qui se produit dans la nature comme l'cinabre de minerai et est le pigment brillant vermillon. Comme ZnS, HgS cristallise en deux formes, la forme cubique rouge et le noir zinc blende forme. Le mercure (II) s??l??niure (HgSe) et de mercure (II) tellurure (HgTe) sont aussi connus, ainsi que les divers d??riv??s, par exemple, tellurure de cadmium et le mercure tellurure de mercure de zinc ??tant semi-conducteurs utiles comme mat??riaux de d??tecteurs infrarouges.
Les sels de mercure (II) forment une vari??t?? de d??riv??s complexes avec l'ammoniac . Il se agit notamment de la base de nitrate mercurique (Hg 2 + N), le polym??re ?? une dimension (+ sels de HgNH
2)
n), et "pr??cipit?? blanc fusible" ou [Hg (NH 3) 2] Cl 2. Connu comme Le r??actif de Nessler, t??traiodomercurate de potassium (II) (HGI 2-
4) est encore parfois utilis?? pour tester pour l'ammoniac en raison de sa tendance ?? former le sel iodure de couleur fonc??e de la base de Millon.
Fulminate de mercure est un d??tonateur largement utilis?? dans explosifs.
Des ??tats d'oxydation plus ??lev??s
??tats d'oxydation ci-dessus 2 chez une esp??ce non charg??s sont extr??mement rares, m??me si un mercurinium cyclique (IV) cation, avec trois substituants, peut ??tre un interm??diaire dans oxymercuration r??actions. En 2007, un rapport de synth??se d'un mercure (IV), mercure (IV) de fluorure, a ??t?? publi??. Dans les ann??es 1970, il y avait une cr??ance sur la synth??se d'un compos?? de mercure (III), mais il est maintenant consid??r??e comme fausse.
Compos??s organomercuriels
Mercure organiques compos??s sont historiquement important, mais ont peu de valeur industrielle dans le monde occidental. Les sels de mercure (II) sont un rare simples exemples de complexes de m??taux qui r??agissent directement avec des cycles aromatiques. compos??s organomercuriels sont toujours divalent et g??n??ralement deux coordonnent et la g??om??trie lin??aire. Contrairement aux compos??s organocadmium et organozinciques, les compos??s organomercuriels ne r??agissent pas avec l'eau. Ils ont g??n??ralement la formule HgR 2, qui sont souvent instables, ou HgRX, qui sont souvent des solides, o?? R est un groupe aryle ou un groupe alkyle et X est habituellement un halog??nure ou ac??tate. Le m??thylmercure, un terme g??n??rique pour les compos??s avec la formule CH 3 HgX, est une famille de compos??s dangereux qui sont souvent trouv??s dans pollu?? l'eau. Ils surviennent par un proc??d?? connu sous le nom biom??thylation.
Applications

Le mercure est utilis?? principalement pour la fabrication de produits chimiques industriels ou pour des applications ??lectriques et ??lectroniques. Il est utilis?? dans certains thermom??tres, en particulier ceux qui sont utilis??s pour mesurer des temp??ratures ??lev??es. Une quantit?? augmente encore est utilis?? comme le mercure gazeux dans lampes fluorescentes, tandis que la plupart des autres applications sont lentement ??limin??s progressivement en raison des r??glements de sant?? et de s??curit?? et est dans certaines applications remplac??s par moins toxique, mais consid??rablement plus cher Galinstan alliage.
M??decine

Le mercure et ses compos??s ont ??t?? utilis??s dans la m??decine, m??me se ils sont beaucoup moins fr??quents aujourd'hui qu'ils ne l'??taient une fois, maintenant que les effets toxiques du mercure et ses compos??s sont plus largement compris. Le mercure est un ??l??ment ingr??dient amalgames dentaires. Thiomersal (appel?? thim??rosal aux Etats-Unis) est un compos?? organique utilis?? en tant que agent de conservation dans vaccins, si cette utilisation est en d??clin. Un autre compos?? du mercure Merbromin (mercurochrome) est un antiseptique topique utilis?? pour des coupures et ??raflures mineures est encore en usage dans certains pays.
Depuis les ann??es 1930 un certain vaccins contenaient l'agent de conservation thiomersal, qui est m??tabolis?? ou d??grad?? ?? ??thylmercure. Bien qu'il soit largement sp??cul?? que ce conservateur ?? base de mercure peut provoquer ou d??clencher l'autisme chez les enfants, des ??tudes scientifiques ont montr?? aucune preuve soutenant un tel lien. N??anmoins thiomersal a ??t?? supprim??es ou r??duites ?? l'??tat de traces dans tous les vaccins recommand??s pour les enfants am??ricains de 6 ans et moins, ?? l'exception du vaccin antigrippal inactiv??.
Mercury sous la forme d'un de ses minerais communs, cinabre, est utilis?? dans divers m??dicaments traditionnels, notamment dans la m??decine traditionnelle chinoise. Examen de sa s??curit?? a trouv?? cinabre peut conduire ?? une intoxication importante de mercure lorsqu'il est chauff??, consomm??e dans surdosage ou pris ?? long terme, et peut avoir des effets ind??sirables ?? des doses th??rapeutiques, si ce ne est g??n??ralement r??versibles ?? des doses th??rapeutiques. Bien que cette forme de mercure semble moins toxiques que d'autres, son utilisation dans la m??decine traditionnelle chinoise n'a pas encore ??t?? justifi??e comme base th??rapeutique pour l'utilisation de cinabre ne est pas clair.
Aujourd'hui, l'utilisation du mercure dans la m??decine a consid??rablement diminu?? ?? tous les ??gards, en particulier dans les pays d??velopp??s. Thermom??tres et sphygmomanom??tres contenant du mercure ont ??t?? invent??s au d??but des 18e et 19e si??cles en retard, respectivement. Dans le d??but du 21e si??cle, leur utilisation est en d??clin et a ??t?? interdit dans certains pays, les Etats et les institutions m??dicales. En 2002, le S??nat am??ricain a adopt?? une loi pour ??liminer la vente de non-prescription des thermom??tres au mercure. En 2003, Washington et Maine est devenu les premiers Etats ?? interdire les appareils de la pression sanguine de mercure. Les compos??s du mercure se trouvent dans une certaine over-the-m??dicaments en vente libre, y compris d'actualit?? antiseptiques, laxatifs stimulants, couche-??ruption pommade, collyre, et pulv??risations nasales. Le FDA a "donn??es insuffisantes pour ??tablir la reconnaissance g??n??rale de la s??curit?? et de l'efficacit????, des ingr??dients de mercure dans ces produits. Le mercure est encore utilis?? dans certains diur??tiques, bien que des substituts existent maintenant pour la plupart des utilisations th??rapeutiques.
Production de chlore et de soude caustique
Le chlore est produit ?? partir de chlorure de sodium (sel commun, NaCl) en utilisant l'??lectrolyse pour s??parer le m??tal sodium ?? partir du gaz de chlore. Habituellement, le sel est dissous dans l'eau pour produire une saumure. Les sous-produits d'une telle proc??d?? chlore-alcali sont l'hydrog??ne (H 2) et de l'hydroxyde de sodium (NaOH), qui est commun??ment appel?? soude caustique ou la lessive. De loin la plus grande utilisation du mercure dans la fin du 20e si??cle, ??tait en train de cellules ?? mercure (aussi appel?? le Proc??d?? Castner-Kellner), o?? le sodium m??tallique est form?? en tant que l'amalgame ?? une cathode ?? base de mercure; cette sodium est ensuite mis ?? r??agir avec l'eau pour produire de l'hydroxyde de sodium. Beaucoup des rejets de mercure industrielles du 20e si??cle provenaient de ce processus, bien que les usines modernes ont pr??tendu ??tre en s??curit?? dans ce domaine. Apr??s environ 1985, toutes les nouvelles installations de production de chlore-alcali qui ont ??t?? construits aux ??tats-Unis utilis??s soit cellule ?? membrane ou des technologies cellulaires diaphragme pour produire du chlore.
utilisations de laboratoire
Certains thermom??tres m??dicaux, en particulier ceux pour les hautes temp??ratures, sont remplis de mercure; cependant, ils sont en train de dispara??tre progressivement. Aux ??tats-Unis, non-prescription vente de mercure des thermom??tres m??dicaux est interdite depuis 2003.
Le mercure est ??galement pr??sent dans t??lescopes ?? miroir liquide.
Certains t??lescopes de transit utilisent un bassin de mercure pour former un miroir plat et absolument horizontale, utile dans la d??termination d'une r??f??rence verticale ou perpendiculaire absolue. Miroirs paraboliques horizontales concaves peuvent ??tre form??es en faisant tourner le mercure liquide sur un disque, la forme parabolique du liquide ainsi form?? r??fl??chir et faire converger la lumi??re incidente. Ces t??lescopes sont moins chers que les grandes classiques t??lescopes ?? miroir par jusqu'?? un facteur 100, mais le miroir ne peuvent ??tre inclin??s et pointe toujours vers le haut.
Mercure liquide est une partie de r??f??rence secondaire populaire ??lectrode (appel?? le ??lectrode au calomel) dans ??lectrochimie comme une alternative ?? la ??lectrode normale ?? hydrog??ne. L'??lectrode au calomel est utilis?? pour travailler sur le potentiel de l'??lectrode de demi-cellules. Derni??re, mais non le moindre, le point triple de mercure, -38,8344 ?? C, est un point fixe utilis?? comme une norme de temp??rature pour l'??chelle internationale de temp??rature ( ITS-90).
usages de niche


Mercure gazeux est utilis?? dans lampes ?? vapeur de mercure et certains " enseigne au n??on "signes de type de publicit?? et de lampes fluorescentes. Ces lampes ?? basse pression ??mettent tr??s spectrale lignes ??troites, qui sont traditionnellement utilis??es dans la spectroscopie optique pour l'??talonnage de la position spectrale. Lampes d'??talonnage commerciaux sont vendus ?? cet effet; Cependant tout simplement refl??tant une partie de la lampe fluorescente-plafonnier dans un spectrom??tre est une pratique commune d'??talonnage. Mercure gazeux est ??galement constat?? dans certains tubes ??lectroniques, y compris ignitrons, thyratrons, et redresseurs ?? vapeur de mercure. Il est ??galement utilis?? dans les lampes de soins m??dicaux sp??cialis??s pour le bronzage de la peau et de d??sinfection (voir photos). Mercure gazeux est ajout?? ?? cathode froide argon -filled lampes pour augmenter la ionisation et conductivit?? ??lectrique. Une lampe remplie d'argon sans mercure avoir des taches ternes et ne parviendra pas ?? allumer correctement. ??clairage contenant du mercure peut ??tre bombard?? / four pomp?? qu'une seule fois. Lorsqu'il est ajout?? ?? n??on tubes remplis la lumi??re produite sera taches rouges / bleus incompatibles jusqu'?? ce que le processus de gravure en initiale termin??e; elle finira par allumer une couleur uniforme terne hors-bleu.
Produits de beaut??
Le mercure, comme thiomersal, est largement utilis?? dans la fabrication de mascara. En 2008, le Minnesota est devenu le premier ??tat am??ricain ?? interdire le mercure ajout?? intentionnellement dans les produits cosm??tiques, en lui donnant une norme plus difficile que le gouvernement f??d??ral.
Une ??tude de la concentration g??om??trique moyenne de mercure urinaire identifi?? une source m??connue d'exposition (des produits de soins de la peau) au mercure inorganique chez les ville de New York r??sidents. Biosurveillance bas??e sur la population a ??galement montr?? que les niveaux de concentration de mercure sont plus ??lev??s chez les consommateurs de fruits de mer et poissons plats.
Utilisations historiques


De nombreuses applications historiques ont fait usage des propri??t??s physiques particuli??res de mercure, surtout sous forme de liquide dense et un m??tal liquide:
- Les quantit??s de mercure liquide allant de 90 ?? 600 grammes (3,2 ?? 21 oz) ont ??t?? r??cup??r??s dans l'??lite Maya tombes ou caches rituelles sur six sites. Ce mercure peut avoir ??t?? utilis?? que dans des bols des miroirs pour fins divinatoires. Cinq d'entre elles datent de la p??riode classique de la civilisation maya (c. 250-900), mais un exemple pr??existaient ?? cela.
- En Espagne islamique, il a ??t?? utilis?? pour le remplissage des piscines d??coratifs. Plus tard, l'artiste am??ricain Alexander Calder construit une fontaine de mercure pour le pavillon espagnol de la 1937 Exposition universelle de Paris. La fontaine est maintenant expos??e ?? la Fundaci?? Joan Mir?? ?? Barcelone .
- Le mercure a ??t?? utilis?? ?? l'int??rieur leurres wobbler. Sa forme liquide lourd a utile car les leurres en un mouvement irr??gulier attrayante lorsque le mercure d??plac?? ?? l'int??rieur du bouchon. Cette utilisation a ??t?? arr??t?? en raison de pr??occupations environnementales, mais la pr??paration ill??gale de bouchons de p??che modernes se est produite.
- Le lentilles de Fresnel de la vieille phares utilis??s pour flotter et tourner dans un bain de mercure qui a agi comme un palier.
- Mercure tensiom??tres (sang de compteurs de pression), barom??tres, des pompes ?? diffusion, coulom??tres et de nombreux autres instruments de laboratoire. En tant que liquide opaque avec une densit?? ??lev??e et une dilatation thermique presque lin??aire, il est id??al pour ce r??le.
- Comme liquide ??lectriquement conducteur, il a ??t?? utilis?? dans interrupteurs ?? mercure (y compris commutateurs maison mercure de lumi??re install??s avant 1970), interrupteurs ?? bascule utilis??s dans les vieux d??tecteurs d'incendie, et les commutateurs d'inclinaison dans certains thermostats de la maison.
- En raison de ses propri??t??s acoustiques, le mercure a ??t?? utilis?? comme milieu de propagation dans dispositifs de m??moire de ligne ?? retard utilis??es dans les ordinateurs num??riques d??but de la mi-20e si??cle.
- Exp??rimental turbines ?? vapeur de mercure ont ??t?? install??s pour accro??tre l'efficacit?? des centrales ??lectriques ?? combustibles fossiles. La centrale South Meadow ?? Hartford, CT employ?? mercure comme sa fluide de travail, dans une configuration binaire avec un circuit d'eau secondaire, pour un certain nombre d'ann??es ?? partir de la fin des ann??es 1920 dans un lecteur pour am??liorer l'efficacit?? de l'usine. Plusieurs autres usines ont ??t?? construites, y compris la station de Schiller ?? Portsmouth, NH, mis en ligne en 1950. L'id??e n'a pas pris sur l'ensemble du secteur en raison du poids et de la toxicit?? du mercure, ainsi que l'av??nement de centrales ?? vapeur supercritiques dans les ann??es ult??rieures.
- De m??me, le mercure liquide a ??t?? utilis?? comme liquide de refroidissement pendant un certain r??acteurs nucl??aires; Cependant, le sodium est propos?? pour les r??acteurs refroidis avec du m??tal liquide, parce que la haute densit?? de mercure n??cessite beaucoup plus d'??nergie ?? circuler comme liquide de refroidissement.
- Mercury ??tait un propulseur pour le d??but moteurs ioniques dans syst??mes de propulsion spatiale ??lectrique. Avantages ??taient de poids mol??culaire ??lev?? de mercure, ?? faible ??nergie d'ionisation, faible consommation d'??nergie double ionisation, haute densit?? liquide et aptitude au stockage liquide ?? la temp??rature ambiante. Inconv??nients des pr??occupations concernant l'impact environnemental associ?? ?? des tests et les pr??occupations concernant le refroidissement et la condensation ??ventuelle d'une partie du propulseur sur le vaisseau spatial dans les op??rations de longue dur??e sol. Le premier vol spatial ?? utiliser la propulsion ??lectrique a ??t?? un ion propulseur de mercure aliment?? d??velopp?? par NASA Lewis et vol?? sur le Test de Rocket Electric Space " SERT-1 "engin spatial lanc?? par la NASA ?? sa Wallops Flight Facility en 1964. Le SERT-1 vol a ??t?? suivi par le SERT-2 vol en 1970. Le mercure et le c??sium ont ??t?? pr??f??r??es propulseurs pour moteurs ioniques jusqu'?? Laboratoire de recherche Hughes a effectu?? des ??tudes de trouver x??non gaz soit un remplacement convenable. X??non est maintenant le propulseur pr??f??r?? pour moteurs ioniques comme il a un poids mol??culaire ??lev??, peu ou pas de r??activit?? en raison de sa noble gaz naturel, et a une densit?? de liquide sous haute stockage cryog??nique doux.
Autres applications ont utilis?? les propri??t??s chimiques de mercure:
- Le Batterie de mercure est un non-rechargeable Batterie ??lectrochimique, un cellule primaire, qui ??tait courante dans le milieu du 20e si??cle. Il a ??t?? utilis?? dans une grande vari??t?? d'applications et est disponible en diff??rentes tailles, en particulier la taille des boutons. Sa sortie de tension constante et une longue dur??e de vie, il a donn?? une utilisation de niche pour les compteurs de lumi??re de la cam??ra et appareils auditifs. La cellule de mercure a ??t?? effectivement interdit dans la plupart des pays dans les ann??es 1990 en raison de pr??occupations au sujet des d??charges mercure contaminants.
- Mercury a ??t?? utilis?? pour la pr??servation du bois, le d??veloppement daguerr??otypes, argenture miroirs, peintures antisalissure (abandonn??es en 1990), (herbicides abandonn??es en 1995), jeux de labyrinthe de poche, le nettoyage, et des dispositifs de mise ?? niveau de la route dans les voitures. Les compos??s du mercure ont ??t?? utilis??s dans antiseptiques, les laxatifs, antid??presseurs, et en antisyphilitics.
- Il aurait ??t?? utilis?? par espions alli??s de saboter des avions de la Luftwaffe: une p??te de mercure a ??t?? appliqu??e ?? nu l'aluminium , ce qui provoque le m??tal rapidement corroder ; ce serait provoquer des d??faillances structurelles.
- Proc??d?? chlore-alcali: La plus grande utilisation industrielle de mercure au cours du 20e si??cle a ??t?? dans l'??lectrolyse pour s??parer le chlore et le sodium de la saumure; le mercure ??tant anode de la Processus Castner-Kellner. Le chlore a ??t?? utilis?? pour le papier (d'o?? le emplacement de la plupart de ces plantes des papeteries pr??s) alors que le sodium a ??t?? utilis?? pour faire l'hydroxyde de sodium pour les savons et autres produits de nettoyage blanchiment. Cet usage a ??t?? largement abandonn??, remplac?? par d'autres technologies qui utilisent les cellules de la membrane.
- Comme ??lectrodes dans certains types d' ??lectrolyse , (batteries cellules ?? mercure), hydroxyde de sodium et de chlore production, jeux de poche, des catalyseurs , insecticides.
- Mercury ??tait autrefois utilis?? comme un canon de fusil portait propre.
- ?? partir du milieu du 18e si??cle ?? la mi-19e si??cles, un processus appel?? " carottage "a ??t?? utilis?? dans la fabrication de chapeaux de feutre. Les peaux d'animaux ont ??t?? rinc??es dans une solution orange (le terme ??carottage?? est n??e de cette couleur) du compos?? de mercure nitrate mercurique, Hg (NO 3) 2 ?? 2H 2 O. Ce processus a s??par?? la fourrure de la fourrure et emm??l??s ensemble. Cette solution et on les vapeurs produites ??taient hautement toxique. Le ??tats-Unis Service de sant?? publique a interdit l'utilisation du mercure dans l'industrie du feutre en D??cembre 1941. Les sympt??mes psychologiques associ??s ?? l'empoisonnement au mercure inspir?? la phrase " fou comme un chapelier ". Lewis Carroll " Mad Hatter "dans son livre Alice au pays des merveilles est un jeu de mots bas?? sur l'expression plus, mais le personnage lui-m??me ne pr??sente pas de sympt??mes d'empoisonnement au mercure.
- Mines d'or et d'argent. Historiquement, le mercure a ??t?? largement utilis?? dans les mines d'or hydraulique afin d'aider l'or ?? couler ?? travers le m??lange eau-de gravier qui coule. Particules de mercure minces peuvent former des amalgames au mercure-or et donc d'augmenter les taux de r??cup??ration de l'or. L'utilisation ?? grande ??chelle de mercure arr??t?? dans les ann??es 1960. Cependant, le mercure est toujours utilis?? dans petite ??chelle, souvent clandestines, prospection d'or. On estime que 45 000 tonnes de mercure utilis??s en Californie pour l'exploitation des placers ne ont pas ??t?? r??cup??r??s. Mercury a ??galement ??t?? utilis?? dans les mines d'argent.
Utilisations m??dicinales historiques
Mercury (I) chlorure (aussi connu comme le calomel ou chlorure mercureux) a été utilisé dans la médecine traditionnelle comme un diurétique, actualité désinfectant et laxatif. de mercure (II) chlorure (aussi connu comme le chlorure de mercure ou sublimé) était autrefois utilisé pour traiter la syphilis ( ainsi que d'autres composés du mercure), mais il est tellement toxique que, parfois, les symptômes de sa toxicité ont été confondus avec ceux de la syphilis on croyait à traiter. Il est également utilisé comme désinfectant. masse Bleu, une pilule ou de sirop dans lequel le mercure est l'ingrédient principal, a été prescrit au long du 19ème siècle, pour de nombreuses conditions, y compris la constipation, la dépression, de procréer et les maux de dents. Au début du 20e siècle, le mercure a été administré à des enfants chaque année comme un laxatif et vermifuge, et il a été utilisé dans les poudres pour nourrissons de dentition. Le organohalogénure contenant du mercure merbromine (parfois vendu comme mercurochrome) est encore largement utilisé, mais a été interdit dans certains pays tels que les Etats-Unis
Toxicité et sécurité
Mercure et la plupart de ses composés sont extrêmement toxiques et doit être manipulé avec précaution; en cas de déversements de mercure (tels que de certains thermomètres ou des ampoules fluorescentes), des procédures de nettoyage spécifiques sont utilisés pour éviter l'exposition et contenir le déversement. Protocoles prévoient de fusionner physiquement plus petites gouttelettes sur les surfaces dures, de les combiner en une seule grande piscine pour l'enlèvement plus facile avec une pipette, ou pour pousser délicatement le déversement dans un contenant jetable. Aspirateurs balais et provoquent une plus grande dispersion du mercure et ne doivent pas être utilisés. Ensuite, bien soufre , zinc , ou une autre poudre qui forme facilement un amalgame (alliage) avec le mercure à la température ordinaire est saupoudré sur la zone avant de se étant récupérés et éliminés adéquatement de. Nettoyage des surfaces poreuses et les vêtements ne sont pas efficaces pour éliminer toute trace de mercure et il est donc conseillé de jeter ces types d'éléments devraient-ils être exposés à un déversement de mercure.
Le mercure peut ??tre absorb?? par la peau et les muqueuses et les vapeurs de mercure peut ??tre inhal??e, afin conteneurs de mercure sont bien scell??s pour ??viter les d??versements et l'??vaporation. Chauffage de mercure ou de composés de mercure qui peut se décomposer lorsqu'elle est chauffée, est toujours effectué avec une ventilation adéquate afin d'éviter l'exposition aux vapeurs de mercure. Les formes les plus toxiques de mercure sont les composés organiques , tels que le diméthylmercure et le méthylmercure. Composés inorganiques, tels que le cinabre sont également très toxique par ingestion ou inhalation. Le mercure peut provoquer à la fois une intoxication chronique et aiguë.
Les rejets dans l'environnement
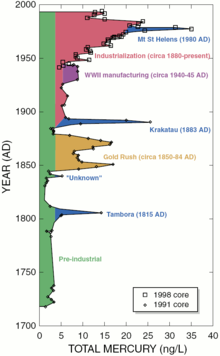
Les taux de dépôt préindustriels de mercure de l'atmosphère peuvent être d'environ 4 ng / (1 ??????L de dépôt de glace). Bien que cela peut être considéré comme un niveau naturel de l'exposition, les sources régionales ou mondiales ont des effets significatifs. Les éruptions volcaniques peuvent augmenter la source atmosphérique par 4-6 fois.
Les sources naturelles, comme les volcans , sont responsables d'environ la moitié des émissions atmosphériques de mercure. La moitié humain généré peut être divisé en les pourcentages estimés suivants:
- 65% de la combustion stationnaire, dont les centrales au charbon sont la plus grande source d'agrégats (40% des émissions de mercure des États-Unis en 1999). Cela comprend les centrales électriques fonctionnant au gaz où le mercure n'a pas été enlevé. Les émissions provenant de la combustion du charbon sont entre un et deux ordres de grandeur plus élevés que les émissions provenant de la combustion du pétrole, selon les pays.
- 11% de la production d'or. Les trois plus importantes sources ponctuelles d'émissions de mercure dans les États-Unis sont les trois plus grandes mines d'or. Libération hydrogeochimique de mercure provenant des résidus de mine d'or a été comptabilisée comme une source importante de mercure atmosphérique dans l'est du Canada.
- 6,8% dela production de métaux non ferreux, généralementfonderies.
- 6,4% dela production de ciment.
- 3,0% par rapport ?? l'??limination des d??chets , y compris municipal et d??chets dangereux, crématoires, etdes boues d'épuration.
- 3,0% dela soude caustiqueproduction.
- 1,4% dela fonte et del'acierproduction.
- 1,1% de la production de mercure, surtout pour les batteries.
- 2,0% d'autres sources.
Les pourcentages ci-dessus sont des estimations des émissions mondiales de mercure d'origine humaine en 2000, à l'exclusion combustion de la biomasse, une source importante dans certaines régions.
Contamination par le mercure atmosphérique récente dans l'air urbain en plein air a été mesurée à 0,01-0,02 pg / m 3 . A 2001 étude a mesuré les niveaux de mercure dans 12 sites intérieurs choisis pour représenter une section de types de bâtiments, les lieux et les âges dans la région de New York. Cette étude a révélé des concentrations de mercure significativement élevés sur les concentrations extérieures, à une gamme de 0,0065 au 0,523 ug / m 3 . La moyenne était de 0,069 ug / m 3 .
Le mercure pénètre aussi dans l'environnement par l'élimination inadéquate (par exemple, la mise en décharge, incinération) de certains produits. Les produits contenant du mercure comprennent: pièces automobiles, batteries, ampoules fluorescentes, les produits médicaux, les thermomètres et les thermostats. En raison de problèmes de santé (voir ci-dessous), utilisation de substances toxiques réduction des efforts sont réduisant ou en éliminant le mercure dans ces produits. Par exemple, la quantité de mercure dans les thermostats vendus aux États-Unis a diminué, passant de 14,5 tonnes en 2004 à 3,9 tonnes en 2007. La plupart des thermomètres utilisent maintenant pigmentée alcool à la place du mercure et des thermomètres en alliage Galinstan sont également une option. Les thermomètres à mercure sont encore parfois utilisées dans le domaine médical, car ils sont plus précis que les thermomètres à alcool, même si les deux sont souvent remplacés par des thermomètres électroniques et, moins fréquemment par des thermomètres Galinstan. Les thermomètres à mercure sont encore largement utilisés pour certaines applications scientifiques en raison de leur plus grande précision et la plage de travail.
Historiquement, l'un des plus importants rejets de l'usine était Colex, une usine de séparation des isotopes du lithium à Oak Ridge, Tennessee. L'usine a fonctionné dans les années 1950 et 1960. Les dossiers sont incomplets et peu clairs, mais les commissions gouvernementales ont estimé que près de deux millions de livres de mercure sont portées disparues.
Un grave catastrophe industrielle était le dumping des composés du mercure dans la baie de Minamata, au Japon. On estime que plus de 3.000 personnes ont subi diverses malformations graves, les symptômes de l'empoisonnement au mercure ou la mort de ce qui est devenu connu comme la maladie de Minamata.
L'exposition professionnelle
En raison des effets sur la santé de l'exposition au mercure, les utilisations industrielles et commerciales sont réglementés dans de nombreux pays. L' Organisation mondiale de la Santé , l'OSHA et NIOSH traitent tous du mercure comme un risque professionnel, et ont établi des limites spécifiques d'exposition professionnelle. Presse et l'élimination du mercure sur l'environnement sont réglementés aux États-Unis principalement par la Environmental Protection Agency des ??tats-Unis.
études de contrôle de cas ont montré des effets tels que les tremblements, douteux aptitudes cognitives et les troubles du sommeil chez les travailleurs avec une exposition chronique aux vapeurs de mercure, même à de faibles concentrations dans la gamme de 0,7 à 42 pg / m 3 . Une étude a montré que l'exposition aiguë (4 - 8 heures) à des niveaux de mercure élémentaire calculée de 1,1 à 44 mg / m 3 abouti à une douleur thoracique, dyspnée, toux, hémoptysie, altération de la fonction pulmonaire, et la preuve de interstitielle pneumonie. L'exposition aiguë aux vapeurs de mercure a été montré pour causer des effets profonds du système nerveux central, y compris des réactions psychotiques caractérisés par le délire, les hallucinations et tendance suicidaire. L'exposition professionnelle a abouti à un large éventail de troubles fonctionnels, y compris éréthisme, l'irritabilité, l'excitabilité, la timidité excessive, et l'insomnie. Avec l'exposition permanente, un léger tremblement développe et peut dégénérer en spasmes musculaires violents. Tremor implique d'abord les mains et se propage à paupières, des lèvres et de la langue plus tard. À long terme, l'exposition de bas niveau a été associée à des symptômes plus subtils de l'éréthisme, y compris la fatigue, l'irritabilité, perte de mémoire, des rêves et de la dépression.
Traitement
La recherche sur le traitement de l'empoisonnement au mercure est limitée. Les médicaments actuellement disponibles pour l'empoisonnement mercuriel aiguë comprennent des chélateurs N-acétyl-D, L- pénicillamine (NAP), British Anti-Lewisite (BAL), l'acide 2,3-dimercapto-1 propane sulfonique (DMPS), et l'acide dimercaptosuccinique (ADMS) . Dans une petite étude dont 11 travailleurs de la construction exposés au mercure élémentaire, les patients ont été traités avec DMSA et NAP. thérapie de chélation avec les deux médicaments entraîné la mobilisation d'une petite fraction du mercure total estimé de corps. DMSA a réussi à augmenter l'excrétion de mercure à une plus grande mesure que NAP.
Poisson
Poissons et crustacés ont une tendance naturelle à se concentrer du mercure dans leur corps, souvent sous la forme de méthylmercure, un composé organique hautement toxique du mercure. Espèces de poissons qui sont élevés sur la chaîne alimentaire, comme le requin , l'espadon, thazard, le thon rouge, le thon germon et le tile contiennent des concentrations élevées de mercure que d'autres. Comme le mercure et le méthylmercure sont liposolubles, elles accumulent principalement dans la viscères, même si elles se retrouvent également dans l'ensemble du tissu musculaire. Lorsque ce poisson est consommé par un prédateur, le niveau de mercure est accumulé. Comme les poissons sont moins efficaces au dépuration que d'accumuler du méthylmercure, les concentrations de poisson tissus augmentent au fil du temps. Ainsi espèces qui sont élevés sur la chaîne alimentaire amassent des charges corporelles de mercure qui peut être dix fois plus élevé que les espèces qu'ils consomment. Ce processus est appel?? bioamplification. L'empoisonnement au mercure est arrivé de cette façon dans Minamata, au Japon , maintenant appelée la maladie de Minamata.
Règlements
International
140 pays ont convenu de la Convention de Minamata par le Programme des Nations Unies pour l'environnement (PNUE) pour prévenir les émissions. Convention devrait être ouverte à la signature en Octobre 2013.
??tats Unis
Aux ??tats-Unis, la Agence de protection de l'environnement est chargé de réglementer et gérer la contamination au mercure. Plusieurs lois donnent l'EPA cette autorité, y compris le Clean Air Act, la Loi sur l'assainissement de l'eau, la conservation des ressources et la Loi sur le recouvrement et le Loi sur l'eau potable salubre. En outre, le contenant du mercure et Loi sur la gestion de la batterie rechargeable, adoptée en 1996, phases sur l'utilisation de mercure dans les piles, et prévoit l'élimination efficace et rentable de nombreux types de piles usagées. Amérique du Nord a contribué pour environ 11% du total des émissions de mercure anthropiques mondiales en 1995.
Les ??tats Unis Clean Air Act, adoptée en 1990, le mercure mis sur une liste de polluants toxiques qui doivent être contrôlés dans la mesure du possible. Ainsi, les industries qui libèrent des concentrations élevées de mercure dans l'environnement ont convenu d'installer des technologies de Maximum Achievable Control (MACT). En Mars 2005, l'EPA a promulgué un règlement qui ajoute centrales à la liste des sources qui devraient être contrôlés et institué un ressortissant système de plafonnement et d'échange. Unis ont jusqu'au Novembre 2006 à imposer des contrôles plus stricts, mais après une contestation judiciaire de plusieurs Etats, les règlements ont été frappés par une cour d'appel fédérale le 8 Février 2008. La règle n'a pas été jugée suffisante pour protéger la santé des personnes vivant à proximité les centrales au charbon, compte tenu des effets négatifs documentés dans le rapport d'étude de l'EPA au Congrès de 1998.
L'EPA a annoncé de nouvelles règles pour les centrales électriques au charbon le 22 Décembre 2011. Les fours à ciment qui brûlent des déchets dangereux sont tenus à une norme plus souple que sont standardsdéchets dangereuxincinérateurs aux États-Unis, et par conséquent sont une source disproportionné de mercure pollution.
Union Europ??enne
Dans l' Union européenne , la directive relative à la limitation de l'utilisation de certaines substances dangereuses dans les équipements électriques et électroniques (voir RoHS) interdit le mercure de certains produits électriques et électroniques, et limite la quantité de mercure dans d'autres produits à moins de 1000 ppm. Il ya restrictions pour la concentration de mercure dans l'emballage (la limite est de 100 ppm pour la somme de mercure, le plomb , le chrome hexavalent et le cadmium ) et les piles (la limite est de 5 ppm). En Juillet 2007, l'Union européenne a également interdit le mercure dans les dispositifs de mesure non électriques, tels que les thermomètres et les baromètres. L'interdiction concerne les nouveaux dispositifs seulement, et contient des exemptions pour le secteur des soins de santé et une période de grâce de deux ans pour les fabricants de baromètres.
Norv??ge
La Norvège a promulgué une interdiction totale de l'utilisation du mercure dans la fabrication et l'importation / exportation de produits contenant du mercure, à compter du 1er Janvier 2008. En 2002, plusieurs lacs en Norvège ont été trouvés à avoir un mauvais état ??????de la pollution au mercure, avec un excès de 1 pg / g de mercure dans leur sédiments. En 2008, le ministre norvégien du Développement Environnement Erik Solheim a déclaré: «Le mercure est parmi les toxines environnementales les plus dangereuses. Des alternatives satisfaisantes à Hg dans les produits sont disponibles, et il convient donc d'induire une interdiction ".
Su??de
Mercury a été interdit en Suède en 2009.
Danemark
En 2008, le Danemark a également interdit l'amalgame dentaire au mercure.
