
Corrosion
Contexte des ??coles Wikip??dia
Cette s??lection ??coles a ??t?? choisi par SOS Enfants pour les ??coles dans le monde en d??veloppement ne ont pas acc??s ?? Internet. Il est disponible en t??l??chargement intranet. Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premier ?
| |||||
La corrosion est la destruction progressive du mat??riau, habituellement des m??taux, par r??action chimique avec son environnement. Dans l'utilisation la plus courante du mot, cela signifie ??lectrochimique oxydation des m??taux dans la r??action avec un oxydant tel que l'oxyg??ne . La rouille, la formation de fer oxydes, est un exemple bien connu de corrosion ??lectrochimique. Ce type de d??g??t produit typiquement oxyde (s) ou sel (s) du m??tal d'origine. La corrosion peut ??galement se produire dans des mat??riaux autres que des m??taux, tels que c??ramique ou polym??res, bien que dans ce contexte, le terme d??gradation est plus fr??quente. La corrosion se d??grade les propri??t??s utiles des mat??riaux et des structures dont la force, l'allure et la perm??abilit?? aux liquides et aux gaz.
Beaucoup structurelle alliages corrodent simplement d'exposition ?? l'humidit?? dans l'air, mais le processus peut ??tre fortement affect??s par l'exposition ?? certaines substances. La corrosion peut ??tre concentr??e sur place pour former un puits ou le crack, ou il peut se ??tendre sur une vaste zone corrosion plus ou moins uniform??ment la surface. ??tant donn?? que la corrosion est un processus de diffusion contr??l??, il se produit sur les surfaces expos??es. En cons??quence, des proc??d??s pour r??duire l'activit?? de la surface expos??e, telle que passivation et conversion de chromate, peut augmenter la r??sistance ?? la corrosion d'un mat??riau. Toutefois, certains m??canismes de corrosion sont moins visibles et moins pr??visibles.



La corrosion galvanique

La corrosion galvanique se produit lorsque deux m??taux diff??rents sont en contact physique ou ??lectrique avec l'autre et sont immerg??es dans une commune ??lectrolyte, ou lorsque le m??me m??tal est expos?? ?? l'??lectrolyte avec des concentrations diff??rentes. Dans un couple galvanique, le m??tal plus actif (l'anode) se corrode ?? une vitesse acc??l??r??e et plus m??tal noble (la cathode) corrode ?? un taux retard??e. Lorsqu'elle a ??t?? immerg??e s??par??ment, chaque m??tal corrode ?? son propre rythme. Quel type de m??tal (s) ?? utiliser est d??termin??e facilement par la suite de la s??rie galvanique. Par exemple, le zinc est souvent utilis??e comme une anode sacrificielle pour structures en acier. La corrosion galvanique est d'un int??r??t majeur pour l'industrie maritime et ??galement partout l'eau (sels) contenant contacts tuyaux ou des structures m??talliques.
Des facteurs tels que la taille relative de anode, le type de m??tal, et des conditions de fonctionnement ( temp??rature , l'humidit??, salinit??, etc.) affecte la corrosion galvanique. Le rapport d'aire de surface de l'anode et cathode affecte directement les taux de corrosion des mat??riaux. La corrosion galvanique est souvent utilis?? dans anodes sacrificielles.
S??rie galvanique
Dans un environnement donn?? (une moyenne standard est a??r??e, ?? temp??rature ambiante d'eau de mer ), un m??tal est soit plus noble ou plus actifs que d'autres, en fonction de la force avec ses ions sont li??s ?? la surface. Deux m??taux de parts de contact ??lectrique les m??mes ??lectrons, de sorte que le "bras-de-guerre?? ?? chaque surface est analogue ?? la concurrence pour les ??lectrons libres entre les deux mat??riaux. Utilisation de l'??lectrolyte comme h??te pour le flux d'ions dans le m??me sens, le m??tal actif se ??lectrons de l'une noble. Le flux de masse r??sultante ou courant ??lectrique peuvent ??tre mesur??s pour ??tablir une hi??rarchie des mat??riaux dans le milieu d'int??r??t. Cette hi??rarchie est appel?? une s??rie galvanique et est utile pour pr??dire et comprendre la corrosion.
Suppression de la corrosion
Souvent, il est possible d'enlever chimiquement les produits de corrosion. Par exemple l'acide phosphorique sous forme de gel??e navale est souvent appliqu?? ?? des outils ou surfaces ferreuses pour enlever la rouille. Suppression de la corrosion ne doit pas ??tre confondue avec ??lectrolytique, qui supprime certaines couches de m??tal sous-jacent de faire une surface lisse. Par exemple, l'acide phosphorique peut ??galement ??tre utilis?? pour le polissage ??lectrolytique de cuivre, mais il le fait en enlevant le cuivre, et non les produits de corrosion du cuivre.
R??sistance ?? la corrosion
Certains m??taux sont intrins??quement plus r??sistant ?? la corrosion que les autres (pour des exemples, voir la s??rie galvanique). Il ya diff??rentes fa??ons de prot??ger les m??taux contre la corrosion y compris la peinture, galvanisation par immersion ?? chaud, et des combinaisons de ceux-ci.
La chimie intrins??que

Les mat??riaux les plus r??sistants ?? la corrosion sont ceux pour lesquels la corrosion est thermodynamiquement d??favorable. Les produits de corrosion de l'or ou le platine ont tendance ?? se d??composer spontan??ment en m??tal pur, ce est pourquoi ces ??l??ments peuvent ??tre trouv??s sous forme m??tallique sur Terre et ont ??t?? longtemps la valeur. Plus "base" commune m??taux ne peut ??tre prot??g??e par des moyens plus temporaires.
Certains m??taux ont naturellement lente cin??tique de la r??action, m??me si leur corrosion est thermodynamiquement favorable. Ceux-ci comprennent des m??taux tels que le zinc , le magn??sium et le cadmium . Bien que la corrosion de ces m??taux est continue et permanente, il arrive ?? un taux acceptable lente. Un exemple extr??me est graphite, ce qui lib??re de grandes quantit??s d'??nergie sur oxydation, mais a une cin??tique lente tels que ce est effectivement l'abri de la corrosion ??lectrochimique dans des conditions normales.
Passivation
La passivation se r??f??re ?? la formation spontan??e d'un film ultra-mince de produits de corrosion connus comme film passif sur la surface du m??tal qui agissent comme une barri??re ?? l'oxydation. La composition chimique et la microstructure d'un film passif est diff??rent du m??tal sous-jacent. ??paisseur du film passive typique sur aluminium, aciers inoxydables et alliages est ?? 10 nanom??tres. Le film passif est diff??rent de couches d'oxyde qui se forment lors du chauffage et qui sont dans la gamme d'??paisseur microm??trique - le film passif se retrouve retir??e ou endommag??e alors que la couche d'oxyde ne est pas. Passivation dans des environnements naturels tels que l'air, l'eau et le sol ?? mod??r??e pH se voit dans des mat??riaux tels que l'aluminium , acier inoxydable, titane et silicium .
Passivation est principalement d??termin??e par des facteurs m??tallurgiques et environnementaux. L'effet du pH est r??sum??e ?? l'aide Pourbaix diagrammes, mais de nombreux autres facteurs sont influents. Certaines conditions qui inhibent la passivation comprennent un pH ??lev?? pour l'aluminium et le zinc, ?? faible pH ou la pr??sence de des ions chlorure pour l'acier inoxydable, de titane ?? haute temp??rature (dans ce cas, l'oxyde se dissout dans le m??tal, au lieu de l'??lectrolyte) et ions fluorure pour le silicium. D'autre part, les conditions inhabituelles peuvent entra??ner une passivation de mat??riaux qui sont normalement non prot??g??, que l'environnement alcalin de b??ton fait pour l'acier barres d'armature. L'exposition ?? un m??tal liquide tel que du mercure ou ?? chaud soudure peut souvent contourner les m??canismes de passivation.
Corrosion des mat??riaux passives
Passivation est extr??mement utile dans l'att??nuation des dommages de corrosion, mais m??me un alli?? de haute qualit?? sera corrode si sa capacit?? ?? former un film de passivation est entrav??e. Une s??lection ad??quate de la bonne classe de mat??riel pour l'environnement sp??cifique est important pour la performance durable de ce groupe de mat??riaux. Si panne survient dans le film passif en raison de facteurs chimiques ou m??caniques, les principaux modes de corrosion pourraient inclure la corrosion par piq??res, la corrosion et crevasse corrosion sous contrainte.
La corrosion par piq??res

Certaines conditions, telles que de faibles concentrations d'oxyg??ne ou de fortes concentrations d'esp??ces telles que le chlorure qui compl??te comme anions , peuvent interf??rer avec la capacit?? d'un alliage donn?? de re-former un film de passivation. Dans le pire des cas, la quasi-totalit?? de la surface restera prot??g??, mais minuscules fluctuations locales seront d??grader le film d'oxyde en quelques points critiques. Corrosion ?? ces points sera grandement amplifi??, et peut causer des piq??res de corrosion de plusieurs types, en fonction des conditions. Alors que les piq??res de corrosion seulement nucl??ation dans des circonstances assez extr??mes, ils peuvent continuer ?? cro??tre m??me lorsque les conditions reviennent ?? la normale, depuis l'int??rieur d'une fosse est naturellement priv?? d'oxyg??ne et localement le pH diminue ?? des valeurs tr??s faibles et le taux de corrosion augmente en raison d'un processus autocatalytique. Dans les cas extr??mes, les pointes ac??r??es de piq??res de corrosion tr??s longues et ??troites peuvent causer concentration de contraintes au point que les alliages autrement difficiles peuvent ??clater; un film mince transperc?? par une invisible petit trou peut cacher une fosse taille du pouce de la vue. Ces probl??mes sont particuli??rement dangereuses car elles sont difficiles ?? d??tecter avant une partie ou de la structure ??choue. Piq??res reste parmi les formes les plus courantes et les plus dommageables de la corrosion dans les alliages passives, mais elle peut ??tre pr??venue par le contr??le de l'environnement de l'alliage.
Carie soudure et knifeline attaque


L'acier inoxydable peut poser des probl??mes de corrosion sp??ciaux, puisque son comportement de passivation repose sur la pr??sence d'un ??l??ment d'alliage majeure ( chrome , au moins 11,5%). En raison des temp??ratures ??lev??es de soudage et de traitement thermique, de chrome peuvent former des carbures dans le joints de grains des alliages inoxydables. Cette r??action chimique enl??ve le mat??riau de chrome dans la zone proche de la limite de grain, ce qui rend ces r??gions beaucoup moins r??sistant ?? la corrosion. Cela cr??e un couple galvanique avec l'alliage bien prot??g?? ?? proximit??, ce qui conduit ?? souder d??croissance (corrosion des joints de grains dans les zones affect??es par la chaleur) dans des environnements hautement corrosifs.
Un acier inoxydable est dit ??tre sensibilis??es si carbures de chrome sont form??s dans la microstructure. Une microstructure typique d'un acier inoxydable de type 304 normalis??e montre aucun signe de sensibilisation pendant un acier fortement sensibilis??es montre la pr??sence de pr??cipit??s aux joints de grains. Les lignes fonc??es dans la microstructure sensibilis??s sont des r??seaux de carbures de chrome form??s le long des joints de grains.
Alliages sp??ciaux, soit ?? faible teneur en carbone ou avec du carbone ajout?? " getters ", tels que le titane et le niobium (dans les 321 et 347, respectivement), peut emp??cher cet effet, mais celle-ci n??cessitent un traitement thermique sp??cial apr??s le soudage pour ??viter le ph??nom??ne similaire de knifeline attaque. Comme son nom l'indique, la corrosion est limit??e ?? un zone tr??s ??troite adjacente ?? la soudure, souvent seulement quelques microm??tres de diam??tre, ce qui en fait encore moins perceptible.
Corrosion

Corrosion caverneuse est une forme localis??e de la corrosion se produisant dans des espaces confin??s (de crevasses), dont l'acc??s du fluide de travail de l'environnement est limit??. La formation d'une cellule d'a??ration diff??rentiel conduit ?? la corrosion ?? l'int??rieur des fentes. Des exemples de crevasses sont les lacunes et les zones de contact entre les parties, sous les joints ou les joints, les fissures et les coutures ?? l'int??rieur, les espaces remplis de d??p??ts et sous des tas de boue.
Corrosion caverneuse est influenc??e par le type de crevasse (m??tal-m??tal, m??tal non m??tallique), la g??om??trie de la crevasse (taille, ??tat de surface), et les facteurs m??tallurgiques et environnementaux. La sensibilit?? ?? la corrosion caverneuse peut ??tre ??valu??e ?? l'aide des proc??dures standard ASTM. A la temp??rature critique de corrosion fissurante est couramment utilis?? pour classer la r??sistance d'un mat??riau ?? la corrosion caverneuse.
Corrosion microbienne
Corrosion microbienne, ou commun??ment connu sous le nom biocorrosion (MIC), est une corrosion provoqu??e ou promu par les micro-organismes, habituellement chimiotrophes. Elle peut se appliquer ?? la fois des mat??riaux m??talliques et non m??talliques, en pr??sence ou en absence d'oxyg??ne. les bact??ries sulfato-r??ductrices sont actifs en l'absence d'oxyg??ne (ana??robie); ils produisent sulfure d'hydrog??ne, ce qui provoque sulfure de fissuration sous contrainte. En pr??sence d'oxyg??ne (a??robie), certaines bact??ries peuvent oxyder directement fer en oxydes et hydroxydes de fer, d'autres bact??ries oxyder le soufre et produisent de l'acide sulfurique causant corrosion biog??ne de sulfure. Cellules de concentration peuvent se former dans les d??p??ts de produits de corrosion, ce qui conduit ?? la corrosion localis??e.
Corrosion acc??l??r??e de basse mer (ALWC) est une forme particuli??rement agressive de MIC qui affecte pieux d'acier en eau de mer pr??s de la laisse de basse mer de l'eau. Elle est caract??ris??e par une boue orange, qui sent de sulfure d'hydrog??ne lorsqu'il est trait?? avec de l'acide. Les taux de corrosion peuvent ??tre tr??s ??lev??s et les indemnit??s conception de corrosion pourront bient??t ??tre d??pass?? conduisant ?? une d??faillance pr??matur??e de la pile de l'acier. Piles qui ont ??t?? rev??tement et de protection cathodique install?? au moment de la construction ne sont pas sensibles ?? ALWC. Pour les pieux non prot??g??s, anodes sacrificielles peuvent ??tre install??s locale dans les zones touch??es pour inhiber la corrosion ou d'un syst??me d'anode sacrificielle modernis?? compl??te peut ??tre install??. Les zones affect??es peuvent ??galement ??tre trait??s par voie ??lectrochimique en utilisant une ??lectrode ?? la premi??re chlore produits pour tuer les bact??ries, puis produit un d??p??t calcaire, ce qui aidera ?? prot??ger le m??tal contre de nouvelles attaques.
Corrosion ?? haute temp??rature
La corrosion ?? haute temp??rature est une d??t??rioration chimique d'un mat??riau (en g??n??ral un m??tal) ?? la suite de chauffage. Cette forme non galvanique de corrosion peut se produire lorsque le m??tal est soumis ?? une atmosph??re chaude contenant de l'oxyg??ne, de soufre ou d'autres compos??s capables d'oxydation (ou d'aider l'oxydation des) mat??riau consid??r??. Par exemple, les mat??riaux utilis??s dans l'a??rospatiale, la production d'??lectricit?? et m??me des moteurs de voiture doivent r??sister ?? des p??riodes prolong??es ?? haute temp??rature dans laquelle ils peuvent ??tre expos??s ?? une atmosph??re contenant des produits potentiellement hautement corrosifs de combustion.
Les produits de corrosion ?? haute temp??rature peuvent potentiellement ??tre tourn?? ?? l'avantage de l'ing??nieur. La formation d'oxydes sur les aciers inoxydables, par exemple, peut fournir une couche protectrice pr??venir d'autres agressions atmosph??riques, permettant pour un mat??riau ?? utiliser pour des p??riodes prolong??es ?? la fois chambre et des temp??ratures ??lev??es dans des conditions hostiles. De tels produits de corrosion ?? haute temp??rature, sous la forme de compact??s gla??ures couche d'oxyde, d'emp??cher ou de r??duire l'usure ?? haute temp??rature pendant le contact de la surface m??tallique (ou m??tallique et c??ramique) coulissant.
D??poussi??rage de M??tal
poudrage m??tallique est une forme catastrophique corrosion qui se produit lorsque des mat??riaux sensibles sont expos??s ?? des environnements avec des activit??s de carbone ??lev??s, tels que le gaz de synth??se et d'autres environnements ?? haut CO. La corrosion se manifeste comme une rupture du m??tal massif ?? la poudre de m??tal. Le m??canisme est soup??onn?? d'abord le d??p??t d'une couche de graphite sur la surface du m??tal, g??n??ralement de monoxyde de carbone (CO) dans la phase vapeur. Cette couche de graphite est ensuite suppos?? former des esp??ces m??tastables M 3 C (o?? M est le m??tal), qui migrent loin de la surface m??tallique. Toutefois, dans certains r??gimes est observ?? aucune esp??ce M 3 C indiquant un transfert direct d'atomes de m??tal dans la couche de graphite.
Protection contre la corrosion
Les traitements de surface
Rev??tements appliqu??s

Placage, la peinture, et l'application de ??mail sont les plus communs les traitements anti-corrosion. Ils agissent en fournissant une barri??re de mat??riau r??sistant ?? la corrosion entre l'environnement et endommager le mat??riau de structure. Mis ?? part les probl??mes esth??tiques et de la fabrication, il ya des compromis ?? souplesse m??canique par rapport r??sistance ?? l'abrasion et ?? haute temp??rature. Placages ??chouent habituellement seulement en petites sections, et si le placage est plus noble que le substrat (par exemple, le chrome sur l'acier), un couple galvanique causeront une zone expos??e aux corrode beaucoup plus rapidement que ne le ferait une surface non plaqu??. Pour cette raison, il est souvent judicieux de la plaque de m??tal actif tel que le zinc ou le cadmium. Peinture soit par rouleau ou au pinceau est plus souhaitable pour les espaces restreints; vaporisez serait mieux pour les zones de rev??tement plus grandes telles que les ponts en acier et des applications de front de mer. Rev??tements souples de polyur??thane, comme Durabak-M26 par exemple, peuvent fournir un joint anti-corrosive avec une membrane antid??rapante tr??s durable. Rev??tements peints sont relativement faciles ?? appliquer et ?? avoir des temps de s??chage rapide, bien que la temp??rature et l'humidit?? peuvent causer des temps de s??chage varient ??.
Rev??tements r??actifs
Si l'environnement est contr??l??e (en particulier dans les syst??mes ?? recirculation), des inhibiteurs de corrosion peuvent souvent ??tre ajout??s. Ceux-ci forment un rev??tement ??lectriquement isolant imperm??able ou chimiquement sur les surfaces m??talliques expos??es, de supprimer les r??actions ??lectrochimiques. Ces m??thodes font ??videmment le syst??me moins sensible aux rayures ou des d??fauts dans le rev??tement, puisque les inhibiteurs suppl??mentaires peuvent ??tre mis ?? la disposition o?? le m??tal est expos??. Les produits chimiques qui inhibent la corrosion comprennent une partie des sels de l'eau dure (syst??mes d'eau romaine sont c??l??bres pour leurs gisements min??raux ), les chromates, des phosphates, polyaniline, autre polym??res conducteurs et un large ??ventail de produits chimiques sp??cialement con??us qui ressemblent des agents tensioactifs (par exemple ?? longue cha??ne de mol??cules organiques avec des groupes terminaux ioniques).
Anodisation

Les alliages d'aluminium sont souvent soumis ?? un traitement de surface. Conditions ??lectrochimiques dans le bain sont soigneusement ajust??s de sorte que plusieurs uniforme pores nanom??tres de large apparaissent dans le film d'oxyde de m??tal. Ces pores permettent l'oxyde de cro??tre beaucoup plus ??pais que les conditions de passivation permettraient. A la fin du traitement, les pores sont autoris??s ?? saisir, en formant une couche de surface plus dure que d'habitude. Si ce rev??tement est ray??, processus de passivation normales prennent le relais pour prot??ger la zone endommag??e.
L'anodisation est tr??s r??sistant aux intemp??ries et ?? la corrosion, il est couramment utilis?? pour les fa??ades de b??timents et d'autres domaines que la surface sera en contact r??gulier avec les ??l??ments. Tout en ??tant souple, il doit ??tre nettoy?? fr??quemment. Si laiss?? sans nettoyage, bord du panneau coloration va naturellement se produire.
rev??tements de biofilms
Une nouvelle forme de protection a ??t?? mis au point par l'application de certaines esp??ces bact??riennes de films ?? la surface des m??taux dans des environnements hautement corrosifs. Ce processus augmente la r??sistance ?? la corrosion sensiblement. Alternativement, antimicrobien producteurs biofilms peuvent ??tre utilis??s pour inhiber la corrosion de l'acier doux de bact??ries sulfato-r??ductrices.
Coffrage de perm??abilit?? contr??l??e,
Coffrage de perm??abilit?? contr??l??e (CPF) est une m??thode de pr??vention de la corrosion de renfort en am??liorant la durabilit?? naturelle du couvrir lors de la pose de b??ton. CPF a ??t?? utilis?? dans des environnements ?? combattre les effets de carbonatation, chlorures, le gel et ?? l'abrasion.
La protection cathodique
La protection cathodique (CP) est une technique pour contr??ler la corrosion d'une surface m??tallique en faisant que la surface d'une cathode Cellule ??lectrochimique. Syst??mes de protection cathodique sont les plus couramment utilis??s pour prot??ger l'acier, de l'eau et du carburant pipelines et des r??servoirs; quai de l'acier piles, des navires et en mer plates-formes p??troli??res.
La protection de l'anode sacrificielle

Pour CP efficace, le potentiel de la surface en acier est polaris?? (pouss??) plus n??gatif jusqu'?? ce que la surface de m??tal a un potentiel uniforme. Avec un potentiel uniforme, la force motrice de la r??action de corrosion est stopp??e. Pour les syst??mes de PC galvanique, le mat??riau d'anode se corrode sous l'influence de l'acier, et, ??ventuellement, il doit ??tre remplac??. Le polarisation est provoqu??e par le flux de courant de l'anode ?? la cathode, gr??ce ?? la diff??rence de potentiel ??lectrochimique entre l'anode et la cathode.
Protection cathodique ?? courant impos??
Pour de plus grandes structures, anodes galvaniques ne peuvent pas livrer ??conomiquement assez de courant pour fournir une protection compl??te. Protection cathodique ?? courant impos?? (ICCP) syst??mes utilisent des anodes connect??es ?? un Source de courant continu (comme un Redresseur de protection cathodique). Anodes pour syst??mes ICCP sont des formes de tiges tubulaires et solides de divers mat??riaux sp??cialis??s. Elles incluent une forte silicium la fonte, le graphite, l'oxyde de m??tal mixte ou en platine recouvert de titane ou le niobium et le fil rev??tu de la tige.
La protection anodique
Protection anodique impressionne courant anodique sur la structure ?? prot??ger (oppos??e ?? la protection cathodique). Il convient pour les m??taux qui pr??sentent la passivit?? (par exemple, l'acier inoxydable) et convenablement petit courant passive sur une large gamme de potentiels. Il est utilis?? dans des environnements agressifs, par exemple, des solutions d'acide sulfurique.
Taux de corrosion
Un simple test pour la mesure de la corrosion est la m??thode de perte de poids. Le proc??d?? consiste ?? exposer une pi??ce propre pes?? du m??tal ou de l'alliage de l'environnement corrosif pendant une dur??e sp??cifi??e suivi d'un nettoyage pour ??liminer les produits de corrosion et d'un poids de la pi??ce pour d??terminer la perte de poids. La vitesse de corrosion (R) est calcul?? comme
- R = kW / (ρAt)
o?? k est une constante, W est la perte de poids du m??tal dans le temps t, A est l'aire de surface du m??tal expos??, et ρ est la densit?? du m??tal (en g / cm??).
Impact ??conomique

En 2002, les ??tats-Unis Federal Highway Administration a publi?? une ??tude intitul??e co??ts de la corrosion et les strat??gies de pr??vention aux ??tats-Unis sur les co??ts directs associ??s ?? la corrosion m??tallique dans l'industrie am??ricaine. En 1998, le co??t direct annuel total de la corrosion dans les ??tats-Unis ??tait d'environ $ 276 000 000 000 (environ 3,2% des ??tats-Unis produit int??rieur brut ).
Rust est l'une des causes les plus fr??quentes d'accidents de pont. Comme la rouille a un volume beaucoup plus ??lev?? que la masse originaire de fer, de son accumulation peut ??galement provoquer une insuffisance en for??ant dehors parties adjacentes. Ce ??tait la cause de l'effondrement de la Mianus pont de la rivi??re en 1983, lorsque les paliers rouill??s interne et pouss?? un coin de la dalle de route de son support. Trois pilotes sur la chauss??e au moment morts que la dalle est tomb?? dans la rivi??re en contrebas. Ce qui suit Enqu??te du NTSB a montr?? que un drain dans la route avait ??t?? bloqu??e pour la route re-surfa??age, et ne avait pas ??t?? d??bloqu??; par cons??quent, les eaux de ruissellement p??n??tr?? les crochets de support. Rust ??tait ??galement un facteur important dans la Silver Bridge d??sastre de 1967 ?? West Virginia , lorsqu'un acier pont suspendu se est effondr?? dans une minute, tuant 46 conducteurs et passagers sur le pont ?? l'??poque.
De m??me, la corrosion de l'acier de b??ton couverte et fer peut provoquer le b??ton ??caillage, cr??ant de graves probl??mes structurels. Ce est un des modes de d??faillance les plus courantes de b??ton arm?? ponts . Instruments de mesure bas?? sur la potentiel de demi-cellule est capable de d??tecter les points de corrosion potentiels avant d??faillance totale de la structure en b??ton est atteinte.
Jusqu'?? il ya 20 ?? 30 ans; tuyaux en acier galvanis?? a ??t?? largement utilis?? dans les syst??mes d'eau potable pour les r??sidents mono et multi-familiales ainsi que la construction commerciale et publique. Aujourd'hui, ces syst??mes ont consomm?? la longue zinc et de protection sont corrosion r??sultant des d??faillances ?? l'int??rieur de mauvaise qualit?? de l'eau et de tuyaux. L'impact ??conomique sur les propri??taires, les habitants des condos, et de l'infrastructure publique est estim?? ?? 22 milliards de dollars que les accolades de l'industrie de l'assurance d'une vague de revendications en raison de d??faillances de tuyaux.
Corrosion dans les non-m??taux
Plus mat??riaux c??ramiques sont presque enti??rement ?? l'abri de la corrosion. Les fortes liaisons chimiques qui les d??tiennent ensemble laissent tr??s peu d'??nergie chimique libre dans la structure; ils peuvent ??tre consid??r??s comme d??j?? corrod??. Lorsque la corrosion se produit, il est presque toujours un simple dissolution de la r??action du mat??riel ou chimique, plut??t que d'un processus ??lectrochimique. Un exemple commun de protection contre la corrosion dans la c??ramique est le chaux ajout??e ?? la soude et de chaux verre pour r??duire sa solubilit?? dans l'eau; si elle ne est pas aussi soluble que pur silicate de sodium, le verre normal ne former d??fauts sous-microscopiques lorsqu'ils sont expos??s ?? l'humidit??. En raison de sa fragilit??, ces d??fauts provoquent une r??duction spectaculaire de la force d'un objet en verre au cours de ses premi??res heures ?? la temp??rature ambiante.
La corrosion des polym??res

d??gradation du polym??re implique plusieurs processus physico-chimiques complexes et souvent mal comprises. Ce sont ??tonnamment diff??rent des autres processus est question ici, et ainsi le terme "corrosion" est appliqu??e seulement ?? eux dans un sens large du mot. En raison de leur poids mol??culaire ??lev??, tr??s peu d' entropie peut ??tre obtenue par m??lange d'une masse donn??e de polym??re avec une autre substance, ce qui les rend g??n??ralement tr??s difficiles ?? dissoudre. Alors que la dissolution est un probl??me dans certaines applications de polym??res, il est relativement simple de concevoir contre. Un probl??me plus g??n??ral et relatives est un gonflement, o?? de petites mol??cules infiltrer la structure, r??duisant la force et de la rigidit?? et de provoquer un changement de volume. Inversement, de nombreux polym??res (notamment souple vinyle) sont intentionnellement gonfl?? avec des plastifiants, qui peuvent ??tre lessiv??s de la structure, ce qui provoque une fragilit?? ou d'autres changements ind??sirables. La forme la plus courante de d??gradation est toutefois une diminution de la longueur de la cha??ne polym??re. M??canismes qui brisent les cha??nes polym??res sont familiers aux biologistes en raison de leur effet sur l'ADN : les rayonnements ionisants (le plus souvent ultraviolet lumi??re), radicaux libres, et les oxydants tels que l'oxyg??ne, l'ozone et chlore . craquage d'ozone est un probl??me bien connu qui affecte caoutchouc naturel par exemple. Additifs peuvent ralentir ce processus tr??s efficace, et peut ??tre aussi simple qu'un absorbant les UV pigment (c.-??- le dioxyde de titane ou noir de carbone). Les sacs en plastique, souvent, ne comprennent pas ces additifs afin qu'ils se d??composent plus facilement que la liti??re .
La corrosion des verres

Verre maladie est la corrosion des verres de silicate ?? des solutions aqueuses. Elle est r??gie par deux m??canismes: lixiviation (??change d'ions) contr??l??e par la diffusion et la dissolution du r??seau hydrolytique du verre. Les deux m??canismes d??pendent fortement du pH de la solution en contact: le taux d'??change d'ions diminue avec pH 10 -0.5pH alors que le taux de dissolution d'hydrolyse augmente avec le pH de 10 0,5 pH.
Math??matiquement, les taux de lunettes de corrosion sont caract??ris??s par des taux de corrosion normalis??s des ??l??ments N ?? I (g / cm 2 ?? d) qui sont d??termin??s comme ??tant le rapport de la quantit?? totale des esp??ces rejet??es dans l'eau M i (g) de la surface de contact avec l'eau aire S (cm 2), temps de contact t (jours) et la fraction de poids de l'??l??ment contenu dans le verre f i:
 .
.
Le taux de corrosion globale est une somme de contributions des deux m??canismes (lessivage + dissolution) NR i = i + Nrx NRH. Diffusion contr??l??e lixiviation (??change d'ions) est caract??ristique de la phase initiale de corrosion et implique le remplacement d'ions alcalins dans le verre par un hydronium (H 3 O +) ionique de la solution. Il provoque une diminution s??lective d'ions de couches de verres proches de la surface et donne une fonction de racine carr??e inverse de la vitesse de corrosion en fonction du temps d'exposition. Le taux de lixiviation normalis?? contr??l??e par diffusion de cations de lunettes (g / cm 2 ?? d) est donn??e par:
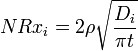 ,
,
o?? t est le temps, D i est le cation coefficient i-i??me efficace de diffusion (cm2 / d), qui d??pend du pH de l'eau en contact comme D i = D i0 ?? 10 -pH, et ρ est la densit?? du verre ( g / cm 3).
dissolution du r??seau de verre est caract??ristique des phases ult??rieures de la corrosion et provoque un d??gagement d'ions conforme ?? la solution d'eau ?? une vitesse ind??pendante du temps dans des solutions dilu??es (g / cm 2 ?? d):
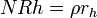 ,
,
o?? R h est ?? l'arr??t hydrolyse (la dissolution) Taux du verre (cm / j). Dans les syst??mes ferm??s de la consommation de protons ?? partir de la phase aqueuse augmente le pH et provoque une transition rapide ?? l'hydrolyse. Cependant, une autre solution de saturation de la silice emp??che l'hydrolyse et provoque le verre pour revenir ?? un ??change d'ions, par exemple r??gime de diffusion contr??l??e de corrosion.
Dans les conditions naturelles typiques taux de corrosion normalis??es de verres de silicates sont tr??s faibles et sont de l'ordre de 10 -7 -10 -5 g / (cm 2 ?? d). La durabilit?? tr??s ??lev?? de verres de silicate dans l'eau les rend appropri??s pour l'immobilisation de d??chets dangereux et nucl??aires.
Essais de corrosion en verre

Il existe de nombreuses proc??dures normalis??es pour la mesure de la corrosion (??galement appel??e r??sistance chimique) des verres dans des environnements neutres, basiques et acides, dans des conditions d'environnement simul??es, dans un fluide corporel simul??, ?? haute temp??rature et de pression, et dans d'autres conditions.
La proc??dure standard ISO 719 d??crit un test de l'extraction de compos??s basiques solubles dans l'eau dans des conditions neutres: 2 g de verre, la taille de particule de 300 ?? 500 um, est maintenue pendant 60 min dans 50 ml d'eau d??sionis??e de grade 2 ?? 98 ?? C; 25 ml de la solution obtenue est titr?? ?? 0,01 mol / l HCl solution. Le volume de HCl n??cessaire pour la neutralisation est class?? selon le tableau ci-dessous.
| Montant de HCl 0,01 M n??cessaire pour neutraliser les oxydes de base extraites, ml | Extrait Na 2 O ??quivalent, ug | Hydrolyse classe |
|---|---|---|
| <0,1 | <31 | 1 |
| 0,1-0,2 | 31-62 | 2 |
| 0,2 ?? 0,85 | 62-264 | 3 |
| 0,85 ?? 2,0 | 264-620 | 4 |
| 2,0 ?? 3,5 | 620-1085 | 5 |
| > 3,5 | > 1085 | > 5 |

