
Titane
Saviez-vous ...
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. enfants SOS a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Titane | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
22 Ti | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||
gris-blanc argent?? m??tallique  | ||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | titane, Ti, 22 | |||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / t aɪ t eɪ n Je ə m / TY- TAY -neE-əm | |||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 4, 4, r?? | |||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 47,867 (1) | |||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 3d 2 4s 2 2, 8, 10, 2 | |||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | William Gregor (1791) | |||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | J??ns Jakob Berzelius (1825) | |||||||||||||||||||||||||||||||||||||||||||||
| Nomm?? par | Martin Heinrich Klaproth (1795) | |||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 4,506 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 4,11 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1941 K , 1668 ?? C, 3034 ?? F | |||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3560 K, 3287 ?? C, 5949 ?? F | |||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 14,15 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 425 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,060 J ?? mol -1 .K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 3, 2, 1 ( l'oxyde amphot??re) | |||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,54 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 658,8 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1309,8 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2652,5 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 147 h | |||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 160 ?? 20 heures | |||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 420 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 21,9 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) de 8,6 um ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) 5090 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 116 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 110 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,32 | |||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 970 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 716 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-32-6 | |||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de titane | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
Le titane est un ??l??ment chimique avec le symbole de Ti et de num??ro atomique 22. Il a une faible densit?? et une forte, brillante, la corrosion , r??sistante (y compris l'eau de mer , l'eau r??gale et le chlore ) m??tal de transition avec une couleur d'argent.
Le titane a ??t?? d??couvert en Cornwall, Grande-Bretagne , par William Gregor en 1791 et nomm??e par Martin Heinrich Klaproth pour le Titans de la mythologie grecque . L'??l??ment se produit dans un certain nombre de gisements min??raux, principalement rutile et ilm??nite, qui sont largement distribu?? dans la cro??te terrestre et lithosph??re, et il se trouve des choses qui vivent dans la quasi-totalit??, les rochers, plans d'eau et les sols. Le m??tal est extrait de ses principaux minerais via le Proc??d?? Kroll ou Processus Hunter. Son compos?? le plus commun, dioxyde de titane, est un populaire photocatalyseur et est utilis?? dans la fabrication de pigments blancs. D'autres compos??s comprennent le t??trachlorure de titane (TiCl 4), un composant de fumer ??crans et catalyseurs ; et le trichlorure de titane (TiCl 3), qui est utilis?? en tant que catalyseur dans la production de polypropylene.
Titanium peut ??tre alli?? avec le fer , l'aluminium , le vanadium , le molybd??ne , entre autres ??l??ments, pour produire de fortes alliages l??gers pour l'a??ronautique ( moteurs ?? r??action , missiles, et engins spatiaux), les militaires, processus industriel (produits chimiques et p??trochimiques, usines de dessalement, de la p??te et du papier), l'automobile, l'agro-alimentaire, m??dicale Proth??ses orthop??diques implants, instruments dentaires et endodontiques et des fichiers, implants dentaires, articles de sport, bijoux, t??l??phones mobiles et autres applications.
Les deux propri??t??s les plus utiles de la forme de m??tal sont la r??sistance ?? la corrosion et le plus haut rapport r??sistance-poids de ne importe quel m??tal. Dans son ??tat non alli??, le titane est aussi forte que certains aciers , mais 45% plus l??ger. Il existe deux allotropiques et cinq formes d'origine naturelle des isotopes de cet ??l??ment, ?? travers 50 46 Ti Ti, Ti avec 48 ??tant le plus abondante (73,8%). Les propri??t??s de titane sont physiquement et chimiquement semblable ?? du zirconium , parce que les deux ont le m??me nombre de ??lectrons de valence et sont dans la m??me groupe dans le tableau p??riodique .
Caract??ristiques
Propri??t??s physiques
Un m??tallique ??l??ment , le titane est reconnu pour son rapport r??sistance-poids. Ce est un m??tal solide avec une faible densit?? qui est assez ductile (surtout dans un oxyg??ne environnement exempt), brillant et m??tallique blanc en couleur . Le point de fusion relativement ??lev?? (plus de 1650 ?? C ou 3000 ?? F) rend utile comme m??tal r??fractaire. C'est paramagn??tique et il a assez faible ??lectrique et conductivit?? thermique.
Commercial (99,2% de puret??) grades de titane ont la r??sistance ?? la traction d'environ 63 000 psi (434 MPa), ??gale ?? celle de, ?? faible teneur commun alliages d'acier, mais sont 45% plus l??ger. Le titane est 60% plus dense que l'aluminium, mais deux fois plus forte que 6061-T6 alliage d'aluminium le plus couramment utilis??. Certains alliages de titane (par exemple, Beta C) atteindre r??sistance ?? la traction de plus de 200 000 psi (1 400 MPa). Cependant, le titane perd de sa r??sistance lorsque la temp??rature d??passe 430 ?? C (806 ?? F).
Le titane est assez difficile (mais pas aussi dur que certaines nuances d'acier trait?? thermiquement), non-magn??tiques et un mauvais conducteur de chaleur et d'??lectricit??. Usinage n??cessite des pr??cautions, comme mat??riau se ramollit et v??sicule si les outils tranchants et les m??thodes de refroidissement appropri??es ne sont pas utilis??s. Comme ceux fabriqu??s ?? partir d'acier, de titane structures ont un limite de fatigue qui garantit la long??vit?? dans certaines applications. Les alliages de titane ont raideurs sp??cifique plus faible que dans de nombreux autres mat??riaux structuraux tels que les alliages d'aluminium et fibre de carbone.
Le m??tal est un dimorphisme allotrope dont la forme alpha hexagonale change dans un cube (treillis) centr??e sur le corps β forme ?? 882 ?? C (1620 ?? F). Le chaleur sp??cifique de la forme alpha augmente consid??rablement car il est chauff?? ?? cette temp??rature de transition mais tombe et reste assez constant pour la forme de β ind??pendamment de la temp??rature. Similaire ?? zirconium et hafnium, une phase om??ga suppl??mentaire existe, qui est thermodynamiquement stable ?? des pressions ??lev??es, mais est m??tastable ?? des pressions ambiantes. Cette phase est g??n??ralement hexagonale (id??al) ou trigonale (d??form??e) et peut ??tre consid??r??e comme ??tant due ?? une acoustique longitudinale douce phonon de la phase β provoquant l'effondrement de (111) plans d'atomes.
Propri??t??s chimiques

Comme l'aluminium et le magn??sium m??tal des surfaces m??talliques et des surfaces de titane d'alliage oxyder imm??diatement quand ils sont expos??s ?? l'air. Titane r??agit facilement avec l'oxyg??ne ?? 1200 ?? C (2190 ?? F) dans l'air, et ?? 610 ?? C (1130 ?? F) dans de l'oxyg??ne pur, formant dioxyde de titane. Cependant, il est lent ?? r??agir avec de l'eau et de l'air, car il forme un rev??tement d'oxyde et passive de protection qui la prot??ge contre une r??action ult??rieure. Quand il premi??res formes, cette couche de protection est seulement 1-2 nm d'??paisseur, mais continue de cro??tre lentement; atteindre une ??paisseur de 25 nm ?? quatre ans.
Lorsqu'il est expos?? ?? l'azote propre titane m??tallique est recouverte d'un couche de nitrure de titane. La mince dioxyde de titane et de nitrure de couches sur des surfaces de titane sont tr??s dur et inerte.
La propri??t?? produit chimique le plus not?? de titane est son excellente r??sistance ?? la corrosion; il est presque aussi r??sistants que le platine , capable de r??sister ?? l'attaque par dilu??e d'acide sulfurique et l'acide chlorhydrique ainsi que du chlore gazeux, des solutions de chlorure, et la plupart des acides organiques. Cependant, il est soluble dans les acides concentr??s. Le Diagramme de Pourbaix dans l'image montre que le titane est en fait thermodynamique un m??tal tr??s r??actif.
Le m??tal ne peut ??tre fondu ?? l'air libre car il br??le avant le point de fusion est atteinte. Point de fusion ne est possible que dans une atmosph??re inerte ou sous vide. A 550 ?? C (1022 ?? F), il se combine avec le chlore. Il r??agit ??galement avec les autres halog??nes et absorbe de l'hydrog??ne.
Le titane est l'un des rares ??l??ments qui br??le dans de l'azote gazeux pur, on fait r??agir ?? 800 ?? C (1470 ?? F) pour former le nitrure de titane, ce qui provoque une fragilisation. poudre de titane peut former un suspension explosif avec l'air.
Parce propre titane m??tallique est hautement r??actif et le titane se lie fortement ?? de l'oxyg??ne, de l'azote et d'autres gaz, filaments de titane sont appliqu??es en Pompes sublimation de titane. Pompes titane de sublimation sont des dispositifs peu co??teux et fiables qui sont appliqu??es comme la derni??re ??tape pour cr??er des pressions extr??mement basses dans syst??mes d'ultra-vide.
Des exp??riences ont montr?? que le titane devient radioactif naturel apr??s avoir ??t?? bombard?? avec deut??rons, ??mettant principalement positrons et dur les rayons gamma.
Compos??s

Le 4 ??tat d'oxydation domine la chimie de titane, mais compos??s de la 3 ??tat d'oxydation sont ??galement fr??quents. En raison de cet ??tat d'oxydation ??lev??, de nombreux compos??s de titane ont un degr?? ??lev?? de liaison covalente.
Star et saphirs rubis obtiennent leur asterism des impuret??s de dioxyde de titane pr??sent dans les. Des titanates sont des compos??s ?? base de dioxyde de titane. Le titanate de baryum a propri??t??s pi??zo-??lectriques, ce qui permet de l'utiliser comme un transducteur dans l'interconversion d' un son et de l'??lectricit?? . Esters de titane sont form??es par la r??action d' alcools et de t??trachlorure de titane et d'??tanch??it?? sont utilis??s pour des tissus .
Le nitrure de titane (TiN), ayant une duret?? ??quivalente ?? saphir et carborundum (9,0 sur l' ??chelle de Mohs ), est souvent utilis?? pour des outils de coupe de la robe, comme forets. Il trouve ??galement utiliser comme une finition d??corative de couleur or, et comme barri??re en m??tal fabrication de semi-conducteur.
Du t??trachlorure de titane (titane (IV) chlorure, TiCl 4) est un liquide incolore qui est utilis?? comme interm??diaire dans la fabrication de dioxyde de titane pour la peinture. Il est largement utilis?? en chimie organique en tant que Acide de Lewis, par exemple dans le La condensation de Mukaiyama. Le titane forme ??galement un chlorure inf??rieur, titane (III) chlorure (TiCl 3), qui est utilis?? en tant que agent r??ducteur.
Dichlorure de titanoc??ne est un important catalyseur pour la formation de liaison carbone-carbone. Isopropoxyde de titane est utilis?? pour ??poxydation Sharpless. D'autres compos??s comprennent bromure de titane (utilis?? dans la m??tallurgie, superalliages, et ?? haute temp??rature c??blage ??lectrique et des rev??tements) et carbure de titane (qui se trouve dans les outils et les rev??tements coupe-haute temp??rature).
Occurrence
| Pays | mille tonnes | % Du total |
|---|---|---|
| Australie | 1300 | 19,4 |
| Afrique Du Sud | 1160 | 17,3 |
| Canada | 700 | 10,4 |
| Inde | 574 | 8.6 |
| Mozambique | 516 | 7,7 |
| Chine | 500 | 7,5 |
| Vi??t-Nam | 490 | 7.3 |
| Ukraine | 357 | 5.3 |
| Monde | 6700 | 100 |
Le titane est toujours li?? ?? d'autres ??l??ments dans la nature. Ce est la neuvi??me plus ??l??ment abondant dans la terre cro??te (0,63% en masse ) et la septi??me plus abondant m??tal. Il est pr??sent dans la plupart des roches ign??es et les s??diments qui en d??coulent (ainsi que dans les ??tres vivants et les plans d'eau naturels). Sur les 801 types de roches ign??es analys??s par le United States Geological Survey, 784 contenait titane. Sa proportion dans le sol est d'environ 0,5 ?? 1,5%.
Il est largement distribu?? et se produit principalement dans les min??raux anatase, brookite, ilm??nite, p??rovskite, rutile et titanite (sph??ne). Parmi ces min??raux, ne rutile et d'ilm??nite ont une importance ??conomique, mais m??me ils sont difficiles ?? trouver dans des concentrations ??lev??es. Environ 6,0 et 0,7 millions de tonnes de ces min??raux ont ??t?? extraits en 2011, respectivement. D??p??ts d'ilm??nite importantes titane portant existent dans l'ouest de l'Australie , le Canada , la Chine , l'Inde , le Mozambique , la Nouvelle-Z??lande , la Norv??ge , l'Ukraine et l'Afrique du Sud . Environ 186 000 tonnes d'??ponge de titane m??tallique ont ??t?? produites en 2011, principalement en Chine (60 000 t), le Japon (56 000 t), la Russie (40 000 t), ??tats-Unis (32 000 t) et le Kazakhstan (20 700 t). R??serves totales de titane sont estim??es ?? plus de 600 millions de tonnes.
Titanium est contenue dans m??t??orites et a ??t?? d??tect?? dans le soleil et dans de type M ??toiles ; le type le plus cool de l'??toile avec une temp??rature de surface de 3200 ?? C (5790 ?? F). Rocks ramen?? du Lune au cours de la Mission Apollo 17 sont compos??es de 12,1% de TiO 2. Il se trouve aussi dans le charbon cendres, plantes , et m??me l' humain corps.
Isotopes
Naturellement titane se produisant est compos?? de cinq stables isotopes : 46 Ti, 47 Ti, 48 Ti, 49 Ti, Ti et 50, avec 48 Ti ??tant la plus abondante (73,8% de la abondance naturelle). Onze des radio-isotopes ont ??t?? caract??ris??s, avec le plus stable ??tant 44 Ti avec une demi-vie de 63 ans, 45 Ti avec une demi-vie de 184,8 minutes, 51 Ti avec une demi-vie de 5,76 minutes, et 52 Ti avec un demi vie de 1,7 minutes. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 33 secondes et la majorit?? d'entre eux ont des demi-vies qui sont moins d'une demi-seconde.
Les isotopes de gamme de titane poids atomique de 39,99 u (40 Ti) ?? 57,966 u (58 Ti). Le primaire mode de d??sint??gration avant l'isotope stable le plus abondant, 48 Ti, est capture d'??lectrons et le mode primaire apr??s est- ??missions beta. Le primaire produits de d??sint??gration avant 48 Ti sont des ??l??ments 21 ( scandium ) isotopes et les produits primaires apr??s 23 ??l??ments (sont vanadium ) isotopes.
Histoire

Le titane est d??couvert inclus dans un min??ral en Cornwall, Grande-Bretagne , en 1791 par le eccl??siastique et g??ologue amateur William Gregor, alors vicaire de Paroisse Creed. Il a reconnu la pr??sence d'un nouvel ??l??ment dans l'ilm??nite quand il a trouv?? sable noir par un ruisseau dans la proximit?? paroisse de Manaccan et a remarqu?? le sable a ??t?? attir?? par un aimant . L'analyse du sable d??termin?? la pr??sence de deux oxydes m??talliques; oxyde de fer (expliquant l'attraction de l'aimant) et 45,25% d'un oxyde m??tallique blanche, il n'a pas pu identifier. Gregor, r??alisant ce que l'oxyde non identifi??e contenait un m??tal qui ne correspondait pas les propri??t??s d'un ??l??ment connu, fait part de ses conclusions ?? la Soci??t?? royale de g??ologie de Cornwall et dans la revue scientifique allemand Annalen de Crell.
Vers la m??me ??poque, Franz-Joseph M??ller von Reichenstein produit une substance similaire, mais n'a pas pu l'identifier. L'oxyde a ??t?? red??couvert ind??pendamment en 1795 par Chimiste prussien Martin Heinrich Klaproth en rutile de la Hongrie . Klaproth a d??couvert qu'il contenait un nouvel ??l??ment et l'a nomm?? pour le Titans de la mythologie grecque . Apr??s avoir entendu parler d??couverte ant??rieure de Gregor, il a obtenu un ??chantillon de manaccanite et a confirm?? qu'il contenait titane.
Les processus n??cessaires ?? l'extraction de titanium de ses divers minerais sont laborieux et co??teux; il ne est pas possible de r??duire de la mani??re habituelle, par chauffage en pr??sence de carbone , car ce produit le carbure de titane. Le titane pur m??tallique (99,9%) a ??t?? pr??par?? d'abord en 1910 par Matthew A. Hunter au Rensselaer Polytechnic Institute TiCl 4 par chauffage ?? sodium ?? 700-800 ?? C dans la Processus Hunter. Titane m??tal n'a pas ??t?? utilis?? en dehors du laboratoire jusqu'en 1932 lorsque William Justin Kroll prouv?? qu'il pouvait ??tre produit en r??duisant du t??trachlorure de titane (TiCl 4) avec le calcium . Huit ans plus tard il a affin?? ce processus en utilisant du magn??sium et m??me sodium dans ce qui devint connu sous le nom Proc??d?? Kroll. Bien que la recherche continue dans les processus plus efficaces et moins chers (par exemple, FFC Cambridge), le processus Kroll est encore utilis?? pour la production commerciale.

Titane de puret?? tr??s ??lev??e a ??t?? faite en petites quantit??s lorsque Eduard van Arkel et Jan Hendrik de Boer a d??couvert l'iodure, ou barre de cristal, le processus en 1925, par r??action avec de l'iode et ?? d??composer les vapeurs form??es sur un filament chaud au m??tal pur.
Dans les ann??es 1950 et 1960, la Union sovi??tique pionnier de l'utilisation du titane dans les applications militaires et sous-marines ( Alfa classe et Mike classe) dans le cadre de programmes li??s ?? la guerre froide. Depuis le d??but des ann??es 1950, le titane a commenc?? ?? ??tre largement utilis?? ?? des fins militaires de l'aviation, en particulier dans les jets ?? haute performance, ?? commencer par des avions comme le F100 de Super Sabre et Lockheed A-12.
Aux Etats-Unis, la Minist??re de la D??fense a r??alis?? l'importance strat??gique du m??tal et soutenu les premiers efforts de commercialisation. Tout au long de la p??riode de la guerre froide , le titane a ??t?? consid??r?? comme un mat??riau strat??gique par le gouvernement am??ricain, et un important stock d'??ponge de titane a ??t?? maintenue par le D??fense Centre national des stocks, qui a finalement ??t?? ??puis?? dans les ann??es 2000. , Repose-russe le plus grand producteur du monde, Aujourd'hui VSMPO-Avisma, est estim?? ?? repr??senter environ 29% de la part du march?? mondial.
En 2006, l'Agence am??ricaine de d??fense attribu?? $ 5,7 millions ?? un consortium de deux entreprises de d??velopper un nouveau proc??d?? de fabrication de m??tal de titane poudre. Sous la chaleur et la pression, la poudre peut ??tre utilis?? pour cr??er des objets solides, l??gers allant de blindage de composants pour les industries a??rospatiale, du transport et de la transformation chimique.
La production et la fabrication

Le traitement de titane m??tallique se fait en 4 ??tapes principales: la r??duction du minerai de titane dans ????ponge??, une forme poreuse; fusion de l'??ponge, ou d'une ??ponge plus un alliage m??re pour former un lingot; fabrication primaire, o?? un lingot est convertie en produits de l'usine g??n??raux tels que billettes, barres, plaques, feuilles, rubans, et le tube; et la fabrication secondaire de formes de produits finis de l'usine.
??tant donn?? que le m??tal r??agit avec l'oxyg??ne ?? des temp??ratures ??lev??es, il ne peut pas ??tre g??n??r?? automatiquement par le r??duction de son anhydride. Titane m??tal est donc produit commercialement par la Proc??d?? Kroll, un complexe et co??teux proc??d?? discontinu. (La valeur de titane de march?? relativement ??lev??e est principalement due ?? son traitement, qui sacrifie un autre m??tal cher, magn??sium.) Dans le processus Kroll, l'oxyde est d'abord converti en chlorure travers carbochloration, o?? le chlore gaz est pass?? au-dessus rutile rouge ou ilm??nite en pr??sence de carbone ?? faire TiCl 4. Ce est condens?? et purifi?? par distillation fractionn??e et ensuite r??duit ?? 800 ?? C en fusion magn??sium dans une atmosph??re d'argon atmosph??re.
Une m??thode plus r??cemment d??velopp??e, la FFC processus Cambridge, peut ??ventuellement remplacer le processus Kroll. Cette m??thode utilise une poudre de dioxyde de titane (qui est une forme raffin??e de rutile) comme mati??re premi??re pour fabriquer le produit final qui est soit une poudre ou une ??ponge. Si poudres d'oxydes mixtes sont utilis??s, le produit est un alliage fabriqu?? ?? un co??t beaucoup plus faible que le proc??d?? classique de fusion en plusieurs ??tapes. Le processus FFC Cambridge peut rendre titane un mat??riau moins rare et cher pour la l'industrie de l'a??rospatiale et le march?? des biens de luxe, et pourraient ??tre vu dans de nombreux produits actuellement fabriqu??s en utilisant l'aluminium et les qualit??s d'acier sp??cialis??s.
Titane commune alliages sont fabriqu??s par r??duction. Par exemple, cuprotitanium (rutile avec le cuivre ajout?? est r??duite), ferrocarbon titane (ilm??nite r??duit avec coke dans un four ??lectrique), et manganotitanium (rutile avec des oxydes de mangan??se ou de mangan??se) sont r??duites.
- 2 FeTiO 3 + 7 + 6 Cl 2 → C 2 TiCl 4 + 2 FeCl 3 + 6 CO (900 ?? C)
- TiCl 4 + 2 → Mg 2 + MgCl 2 Ti (1100 ?? C)
Environ 50 grades de titane et alliages de titane sont d??sign??s et actuellement utilis??s, bien que seulement quelques dizaines sont facilement disponibles dans le commerce. Le ASTM International reconna??t 31 grades de m??taux et d'alliages de titane, dont les ann??es 1 ?? 4 sont commercialement pur (non alli??). Ces quatre se distinguent par leurs degr??s variables de r??sistance ?? la traction, en fonction de l'oxyg??ne contenu, avec une cat??gorie ??tant les plus ductile (la plus basse r??sistance ?? la traction avec une teneur en oxyg??ne de 0,18%) et le moins (la plus haute r??sistance ?? la traction avec un grade 4 teneur en oxyg??ne de 0,40%). Les cat??gories restantes sont des alliages, chacun ??tant con??u ?? des fins sp??cifiques, que ce soit la ductilit??, la r??sistance, la duret??, la r??sistivit?? ??lectrique, r??sistance au fluage, la r??sistance ?? la corrosion de m??dias sp??cifiques, ou une combinaison de ceux-ci.
Le grades couverts par ASTM et d'autres alliages sont ??galement produites pour r??pondre a??rospatiale et les sp??cifications militaires (SAE-AMS, MIL-T), les normes ISO, et les sp??cifications propres ?? chaque pays, ainsi que les sp??cifications exclusive de l'utilisateur final pour l'a??ronautique, militaire, m??dical, et les applications industrielles.
En termes de fabrication, tout soudage de titane doit ??tre effectu??e dans une atmosph??re inerte d' argon ou d'h??lium , afin de le prot??ger de la contamination par des gaz atmosph??riques tels que l'oxyg??ne, l'azote , ou un atome d'hydrog??ne . La contamination provoque une vari??t?? de conditions, telles que fragilisation, ce qui r??duira l'int??grit?? des soudures d'assemblage et de conduire ?? une d??faillance du joint. Produit plat commercialement pur (feuille, plaque) peut ??tre form?? facilement, mais le traitement doit prendre en compte le fait que le m??tal a une ??m??moire?? et tend ?? rebondir. Cela est particuli??rement vrai de certains alliages ?? haute r??sistance. Titanium ne peut pas ??tre soud?? sans d'abord pr??- placage en un m??tal qui est soudable. Le m??tal peut ??tre usin?? en utilisant le m??me ??quipement et par les m??mes proc??d??s que acier inoxydable.
Applications

Le titane est utilis?? en acier comme un ??l??ment d'alliage ( ferro-titane) pour r??duire la taille de grain et comme d??soxydant, et en acier inoxydable afin de r??duire la teneur en carbone. Le titane est souvent alli?? avec l'aluminium (pour affiner la taille des grains), vanadium , cuivre (durcir), le fer , le mangan??se , le molybd??ne , et avec d'autres m??taux. Applications pour les produits de l'usine de titane (feuilles, t??les, barres, fils, pi??ces forg??es, pi??ces moul??es) peuvent ??tre trouv??s dans l'industrie, de l'a??rospatiale, de loisirs, et les march??s ??mergents. Titane en poudre est utilis?? dans pyrotechniques comme une source de particules lumineuses combustion.
Pigments, les additifs et les rev??tements

Environ 95% du minerai de titane extrait de la Terre est destin??e pour le raffinement dans dioxyde de titane (Ti O 2), un blanc intense permanent pigment utilis?? dans peintures, papier, dentifrice, et les mati??res plastiques . Il est ??galement utilis?? dans ciment, en pierres pr??cieuses, comme un opacifiant optique papier, et un agent de renforcement dans les cannes ?? p??che graphite composites et les clubs de golf.
Poudre de TiO 2 est chimiquement inerte, r??siste ?? la d??coloration au soleil, et est tr??s opaque: ce qui lui permet de conf??rer une couleur blanc pur et brillant aux produits chimiques brun ou gris qui forment la majorit?? des plastiques m??nagers. Dans la nature, ce compos?? se trouve dans les minerais anatase, brookite et le rutile. Peinture faite avec du dioxyde de titane fait bien dans des temp??ratures s??v??res, et r??siste ?? des environnements marins. Le dioxyde de titane pur a un niveau tr??s ??lev?? indice de r??fraction et une dispersion optique sup??rieure ?? diamant . En plus d'??tre un pigment tr??s important, le dioxyde de titane est ??galement utilis?? dans des ??crans solaires en raison de sa capacit?? ?? prot??ger la peau en lui-m??me. R??cemment, l'oxyde de titane a ??t?? utilis??e dans des purificateurs d'air (comme un rev??tement de filtre), ou dans le film utilis?? pour les fen??tres de rev??tement sur des b??timents de telle sorte que lorsque de l'oxyde de titane est expos??e ?? la lumi??re UV (soit solaire ou artificielle) et de l'humidit?? dans l'air, esp??ce redox tels que des radicaux hydroxyles r??actifs sont produits de sorte qu'ils peuvent purifier l'air ou de garder propres les surfaces des fen??tres.
A??rospatiale et maritime
Gr??ce ?? leur haute r??sistance ?? la traction au rapport de la densit??, la r??sistance ?? la corrosion, r??sistance ?? la fatigue, une r??sistance ??lev??e ?? la fissuration, et la capacit?? de r??sister ?? des temp??ratures mod??r??ment ??lev??es sans rampante, le titane alliages sont utilis??s dans les a??ronefs , blindage, navires de guerre, vaisseau spatial, et missiles. Pour ces applications, titane alli?? avec de l'aluminium, du vanadium, et d'autres ??l??ments est utilis?? pour une vari??t?? de composants y compris les parties critiques de la structure, des murs coupe-feu, train d'atterrissage, les conduits d'??chappement (h??licopt??res), et des syst??mes hydrauliques. En fait, environ les deux tiers de tous les m??taux de titane produit est utilis?? dans les moteurs d'avions et des cadres. Le SR-71 "Blackbird" a ??t?? l'un des premiers avions ?? faire un large usage de titane dans sa structure, ouvrant la voie ?? son utilisation dans militaire moderne et d'avions commerciaux. On estime ?? 59 tonnes (130 000 livres) sont utilis??s dans le Boeing 777 , 45 dans le Boeing 747 , 18 dans le Boeing 737, 32 dans le Airbus A340, 18 dans le Airbus A330, et 12 dans le Airbus A320. L' Airbus A380 peut utiliser 77 tonnes, dont environ 11 tonnes dans les moteurs. Dans les applications de moteurs, de titane est utilis?? pour rotors, des aubes de compresseur, composants du syst??me hydraulique, et nacelles. Le repr??sente alliage de titane 6AL-4V pr??s de 50% de tous les alliages utilis??s dans les applications a??ronautiques.
Gr??ce ?? sa r??sistance ??lev??e ?? la corrosion de l'eau de mer , le titane est utilis?? pour faire des arbres de transmission et le gr??ement et dans la ??changeurs de chaleur usines de dessalement; en chauffe-refroidisseurs pour l'eau sal??e aquariums , ligne de p??che et chef de file, et les couteaux de plong??e. Le titane est utilis?? pour la fabrication des bo??tiers et autres composants de surveillance des oc??ans d??ploy??e et dispositifs de surveillance ?? usage scientifique et militaire. L'ancien Union Sovi??tique a d??velopp?? des techniques pour la fabrication de sous-marins en grande partie hors du titane.
Industriel

Tubes soud??s de titane et du mat??riel de fabrication (??changeurs de chaleur, r??servoirs, cuves de traitement, vannes) sont utilis??s dans les industries chimiques et p??trochimiques principalement pour r??sistance ?? la corrosion. Alliages sp??cifiques sont utilis??s en fond de puits et de nickel hydrom??tallurgie applications en raison de leur haute r??sistance (par exemple: le titane Beta C alliage), r??sistance ?? la corrosion, ou une combinaison des deux. Le l'industrie papeti??re utilise titane dans du mat??riel de fabrication expos??e aux milieux corrosifs tels que l'hypochlorite de sodium ou du chlore gazeux humide (dans le bleachery). D'autres applications incluent: soudage par ultrasons, brasage ?? la vague, et cibles de pulv??risation.
Du t??trachlorure de titane (TiCl 4), un liquide incolore, est important comme interm??diaire dans le proc??d?? de fabrication de TiO 2 et est ??galement utilis?? pour produire le Catalyseur de Ziegler-Natta, et est utilis?? pour iridize verre et parce qu'il vapeurs d'air humide dans fortement, il est ??galement utilis?? pour fabriquer des ??crans de fum??e.
Consommateurs et architecturale
Titane m??tal est utilis?? dans les applications automobiles, en particulier dans l'automobile ou de la comp??tition moto, o?? la r??duction de poids est essentiel tout en conservant une haute r??sistance et rigidit??. Le m??tal est g??n??ralement trop co??teux pour le rendre commercialisable sur le march?? de consommation en g??n??ral, autres que les produits haut de gamme, en particulier pour le march?? racing / performances. Late model Corvettes ont ??t?? disponibles avec ??chappement en titane.
Le titane est utilis?? dans de nombreux articles de sport: raquettes de tennis, les clubs de golf, arbres crosse de b??ton; le cricket grilles, hockey, la crosse, et casques de football; et v??lo cadres et composants. Bien que pas un mat??riau ordinaire pour la production de v??los, v??los de titane ont ??t?? utilis??s par les ??quipes de course et cyclistes d'aventure. Les alliages de titane sont ??galement utilis??s dans les lunettes trames. Il en r??sulte un cadre durable plut??t chers, mais tr??s r??sistant et longue qui est l??ger et ne provoque pas d'allergies cutan??es. Beaucoup routards utilisent de l'??quipement de titane, y compris les ustensiles de cuisine, ustensiles de cuisine, des lanternes, et piquets de tente. Bien que l??g??rement plus cher que les alternatives en acier ou en aluminium traditionnels, ces produits de titane peuvent ??tre beaucoup plus l??ger sans compromettre la solidit??. Titanium est ??galement favoris??e pour l'utilisation par mar??chaux-ferrants, car il est plus l??ger et plus r??sistant que l'acier lorsqu'il est form?? en fers ?? cheval.
Titanium a parfois ??t?? utilis?? dans des applications architecturales: le m??morial 40 m (131 pieds) ?? Youri Gagarine , le premier homme ?? voyager dans l'espace, de Moscou , est fait de titane pour la couleur attrayante et d'association du m??tal avec les fus??es. Le Mus??e Guggenheim de Bilbao et de la Cerritos Biblioth??que du Mill??naire ont ??t?? les premiers b??timents en Europe et en Am??rique du Nord, respectivement, pour ??tre recouvert de panneaux de titane. D'autres utilisations de la construction de la gaine de titane comprennent l'Frederic C. Hamilton Building ?? Denver , Colorado et du 107 m (350 pieds) Monument des Conqu??rants de l'Espace ?? Moscou .
En raison de sa solidit?? et de l??g??ret?? par rapport aux autres m??taux traditionnellement utilis??s dans les armes ?? feu (acier, l'acier inoxydable et l'aluminium), et les progr??s dans les techniques de la m??tallurgie, l'utilisation du titane est devenu plus r??pandu dans la fabrication d'armes ?? feu. Principales utilisations comprennent cadres de pistolet et cylindres de revolver. Pour ces m??mes raisons, il est ??galement utilis?? dans le corps d'ordinateurs portables (par exemple, dans d'Apple PowerBook ligne s ').
Certaines cat??gories haut de gamme d'outils en pour ??tre l??ger et r??sistant ?? la corrosion, tels que des pelles et des lampes de poche, sont en titane ou en alliages de titane ainsi.
Bijoux
En raison de sa durabilit??, le titane est devenu plus populaire pour les bijoux de cr??ateur (en particulier, anneaux de titane). Son inertie en fait un bon choix pour ceux qui souffrent d'allergies ou qui va porter les bijoux dans des environnements tels que des piscines. Le titane est ??galement alli?? avec l'or pour produire un alliage qui peut ??tre commercialis?? comme Or 24 carats, que le 1% de Ti alli?? est insuffisante pour n??cessite une marque moins. L'alliage r??sultant est ?? peu pr??s la duret?? de 14 carats et est plus durable qu'un 24 carats d'or pur produit serait donc.
La durabilit?? de titane, poids l??ger, dent- et r??sistance ?? la corrosion rend utile dans la production de montres cas. Certains artistes travaillent avec du titane pour produire des ??uvres d'art telles que des sculptures, des objets d??coratifs et des meubles.
L'inertie et la capacit?? ?? ??tre joliment color?? rend titane un m??tal populaire pour utilisation dans per??age corporel. Le titane peut ??tre anodis?? pour produire diff??rentes couleurs, qui varie l'??paisseur de la couche d'oxyde et les causes surface franges d'interf??rence.
M??dical
Parce qu'il est biocompatible (non toxique et ne est pas rejet?? par le corps), le titane est utilis?? dans une gamme d'applications m??dicales, y compris les instruments et les implants chirurgicaux, tels que des balles de la hanche et prises ( remplacement articulaire) qui peuvent rester en place pendant jusqu'?? 20 ans. Le titane est souvent alli?? avec environ 4% d'aluminium ou 6% d'Al et 4% de vanadium.
Le titane a la propri??t?? inh??rente ?? ost??o-int??gration, permettant une utilisation dans implants dentaires qui peuvent rester en place pendant plus de 30 ans. Cette propri??t?? est ??galement utile pour applications d'implants orthop??diques. Ces b??n??ficier de plus faible module d'??lasticit?? de titane ( Module d'Young) pour correspondre davantage ?? celle de l'os que ces dispositifs sont destin??s ?? r??parer. Par cons??quent, les charges du squelette sont plus uniform??ment r??parties entre l'os et l'implant, ce qui conduit ?? une plus faible incidence de la d??gradation des os due au stress blindage et les fractures osseuses p??riproth??tiques qui se produisent aux limites des implants orthop??diques. Toutefois, la rigidit?? de alliages de titane est plus du double de celle de l'os afin os adjacent porte une charge fortement r??duite et peut se d??t??riorer.
Le titane est non ferromagn??tique, les patients avec des implants en titane peuvent ??tre examin??es en toute s??curit?? avec imagerie par r??sonance magn??tique (pratique pour les implants ?? long terme). Pr??paration de titane destin?? ?? ??tre implant?? dans le corps consiste ?? soumettre ?? une haute temp??rature de plasma d'arc qui ??limine les atomes de la surface, exposant titane frais qui est imm??diatement oxyd??.
Le titane est ??galement utilis?? pour la instruments chirurgicaux utilis??s dans la chirurgie guid??e par l'image, ainsi que des fauteuils roulants, des b??quilles, et tous les autres produits pour lesquels une r??sistance ??lev??e et un faible poids sont souhaitables.
Stockage des d??chets nucl??aires
En raison de sa r??sistance ?? la corrosion extr??me, conteneurs en titane ont ??t?? ??tudi??s pour le stockage ?? long terme des d??chets nucl??aires (conteneurs durables plus de 100.000 ans sont possibles dans des conditions de fabrication appropri??es pour r??duire les d??fauts dans le processus). Un titane ??goutte ?? goutte bouclier" pourrait ??galement ??tre plac?? sur d'autres types de conteneurs pour contenir encore les d??chets.
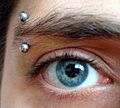
Un piercing de titane.

Caract??ristiques des cordons de soudure sur titane main cadre de la bicyclette.

Le Mus??e Guggenheim de Bilbao est recouvert de panneaux de titane.

Un anneau de titane.

Un titane Spork utile pour les routards. Environ 16 grammes, plus l??ger que d'un ustensile de l'acier, mais plus fort que la mise en ??uvre d'un plastique.
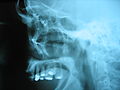
Une rupture de l' orbite de l'oeil a ??t?? r??par??e par la stabilisation des os fractur??s avec de petites plaques de titane et des vis.
Pr??cautions

Le titane est non toxique, m??me ?? fortes doses et ne joue aucun r??le naturel ?? l'int??rieur du corps humain. Une quantit?? d'environ 0,8 milligrammes de titane est ing??r?? par l'??tre humain chaque jour, mais la plupart traverse sans ??tre absorb??. Il, cependant, ont tendance ?? bio-accumuler dans les tissus contenant de la silice . Une ??tude indique un lien possible entre titane et Syndrome des ongles jaune. Un m??canisme inconnu dans les plantes peut utiliser titane pour stimuler la production d' hydrates de carbone et d'encourager la croissance. Cela peut expliquer pourquoi la plupart des plantes contiennent environ 1 partie par million (ppm) de titane, les plantes alimentaires ont environ 2 ppm, et pr??le et ortie contient jusqu'?? 80 ppm.
Sous forme de poudre ou sous la forme de copeaux de m??tal, le m??tal de titane pose un risque d'incendie important et, lorsqu'il est chauff?? dans l'air , un risque d'explosion. L'eau et le dioxyde de carbone ?? base de m??thodes pour ??teindre les incendies sont inefficaces sur titane en combustion; Classe D agents poudre s??che lutte contre l'incendie doivent ??tre utilis??s ?? la place.
Lorsqu'ils sont utilisés dans la production ou la manipulation du chlore , il faut prendre soin d'utiliser le titane que dans des endroits où il ne sera pas exposé à sécher chlore gazeux qui peut provoquer un incendie titane / chlore. Un risque d'incendie existe même lorsque le titane est utilisé dans le chlore humide en raison de possible séchage inattendue provoquée par des conditions météorologiques extrêmes.
Le titane peut prendre feu quand une surface fraîche, non oxydé entre en contact avec l'oxyg??ne liquide. ces surfaces peuvent apparaître lorsque la surface oxydée est frappé avec un objet dur, ou quand une contrainte mécanique provoque l'apparition d'une fissure. Cette limitation pose le possible pour son utilisation dans des systèmes d'oxygène liquide, tels que ceux qu'on trouve dans l'industrie aérospatiale.
