
Chrome
Saviez-vous ...
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . SOS enfants parrainage est cool!
| Chrome | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
24 Cr | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||
m??tallique argent??  | ||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | du chrome, du Cr, 24 | |||||||||||||||||||||||||||||||||||||||
| Prononciation | / k r oʊ m Je ə m / -Əm de KROH | |||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??tal de transition | |||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 6, 4, r?? | |||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 51,9961 (6) | |||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 3d 5 4s 1 2, 8, 13, 1 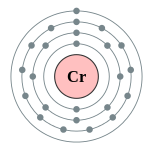 | |||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||
| D??couverte | Louis Nicolas Vauquelin (1797) | |||||||||||||||||||||||||||||||||||||||
| Premier isolement | Louis Nicolas Vauquelin (1798) | |||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 7,19 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 6,3 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2180 K , 1907 ?? C, 3465 ?? F | |||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 2944 K, 2671 ?? C, 4840 ?? F | |||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 21,0 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 339,5 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 23,35 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 6, 5, 4, 3, 2, 1, -1, -2 (Fortement acide oxyde) | |||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,66 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 652,9 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||
| 2??me: 1590,6 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||
| 3??me: 2987 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 128 h | |||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 139 ?? 17 heures | |||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centr??  | |||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | AFM (plut??t: SDW) | |||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 125 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 93,9 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) de 4,9 um ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 5,940 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 279 GPa | |||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 115 GPa | |||||||||||||||||||||||||||||||||||||||
| Module Bulk | 160 GPa | |||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,21 | |||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 8,5 | |||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 1060 MPa | |||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 1120 MPa | |||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-47-3 | |||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de chrome | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Le chrome est un ??l??ment chimique qui pr??sente le symbole Cr et de num??ro atomique 24. Ce est le premier ??l??ment en Groupe 6. Ce est un gris d'acier, lustr??e, disque m??tallique qui prend un beau poli et a un point de fusion ??lev??. Il est ??galement inodore, insipide, et mall??able. Le nom de l'??l??ment est d??riv?? du grec mot "Chroma" (χρώμα), ce qui signifie la couleur , parce que beaucoup de ses compos??s sont fortement color??e.
L'oxyde de chrome a ??t?? utilis?? par les Chinois dans la dynastie des Qin , il ya plus de 2000 ans aux armes manteau de m??tal trouv??s avec le Arm??e de terre cuite. Chrome a ??t?? d??couvert comme un ??l??ment apr??s son entr??e ?? l'attention du monde occidental dans le min??ral cristallin rouge croco??te ( plomb (II) chromate), d??couvert en 1761 et initialement utilis?? comme pigment . Louis Nicolas Vauquelin isol?? pour la premi??re chrome m??tallique de ce min??ral en 1797. Depuis la premi??re production de Vauquelin de chrome m??tallique, de petites quantit??s de maternelle (gratuit) chrome m??tallique ont ??t?? d??couverts en min??raux rares, mais ceux-ci ne sont pas utilis??s dans le commerce. Au lieu de cela, la quasi-totalit?? de chrome est commercialement extrait du minerai commercialement viable seule chromite, qui est l'oxyde de chrome fer (FeCr 2 O 4). Chromite est ??galement d??sormais la principale source de chrome pour les pigments de chrome.
Le chrome m??tal et alliage de ferrochrome sont produit commercialement ?? partir de chromite par silicothermique ou r??actions aluminothermiques, ou par torr??faction et processus de lixiviation. Chrome m??tallique se est av??r?? de grande valeur en raison de sa forte corrosion r??sistance et duret??. Un d??veloppement important a ??t?? la d??couverte que l'acier peut ??tre fait tr??s r??sistant ?? la corrosion et ?? la d??coloration par l'addition de chrome m??tallique pour former acier inoxydable. Cette application, avec chromage ( galvanoplastie avec du chrome) comprennent actuellement 85% de l'utilisation commerciale de l'??l??ment, avec des applications pour les compos??s de chrome formant le reste.
Trivalent de chrome (Cr (III)) ionique est ??ventuellement n??cessaire dans l'??tat de traces pour le sucre et de lipides m??tabolisme, bien que la question reste en d??bat. Dans les grandes quantit??s et sous diff??rentes formes, le chrome peut ??tre toxique et canc??rig??ne. L'exemple le plus frappant de chrome toxique est de chrome hexavalent (Cr (VI)). Chrome sites de production exigent souvent abandonn??s nettoyage de l'environnement.
Caract??ristiques
Physique
Le chrome est remarquable pour ses propri??t??s magn??tiques: ce est le seul solide ??l??mentaire qui spectacles ordre antiferromagn??tique ?? la temp??rature ambiante (et ci-dessous). Au-dessus de 38 ?? C, il se transforme en un ??tat paramagn??tique.
Passivation
Chrome m??tallique laiss?? au repos dans l'air est passiv??e par de l'oxyg??ne , en formant une couche de surface mince d'oxyde protectrice. Cette couche est une Structure seulement quelques atomes d'??paisseur de spinelle. Il est tr??s dense, et emp??che la diffusion de l'oxyg??ne dans le mat??riau sous-jacent. Cette barri??re est en contraste avec le fer ou aciers carbone brut, o?? l'oxyg??ne migre dans le mat??riau sous-jacent et les causes la rouille. La passivation peut ??tre am??lior??e par un court contact avec acides oxydants comme l'acide nitrique . Passivation au chrome est stable aux acides. L'effet inverse peut ??tre r??alis??e par traitement avec une forte agent qui d??truit la couche protectrice d'oxyde sur le m??tal r??ducteur. Le chrome m??tallique trait??e de cette fa??on se dissout facilement dans les acides faibles.
Le chrome, ?? la diff??rence des m??taux tels que le fer et le nickel, ne souffre pas de la fragilisation par l'hydrog??ne. Cependant, il souffre d'azote fragilisation, on fait r??agir avec de l'azote ?? partir d'air et formant des nitrures cassants ?? des temp??ratures ??lev??es n??cessaires pour travailler des pi??ces m??talliques.
Occurrence


Le chrome est la 24e plus ??l??ment abondant dans la cro??te de la Terre avec une concentration moyenne de 100 ppm. Les compos??s de chrome sont pr??sents dans l'environnement, en raison de l'??rosion des roches contenant du chrome et peuvent ??tre distribu??s par des ??ruptions volcaniques. Les concentrations varient dans le sol est compris entre 1 et 3000 mg / kg, dans l'eau de mer de 5 ?? 800 ug / litre, et dans les rivi??res et lacs 26 ug / litre ?? 5,2 mg / litre. Le chrome est exploit?? comme chromite (FeCr 2 O 4) minerai. Environ les deux-cinqui??mes des minerais et concentr??s de chromite dans le monde sont produits en Afrique du Sud , tandis que le Kazakhstan , l'Inde , la Russie et la Turquie sont ??galement des producteurs importants. D??p??ts de chromite inexploit??es sont nombreuses, mais g??ographiquement concentr??es au Kazakhstan et en Afrique australe.
Bien que rare, de d??p??ts chrome natif existe. Le Udachnaya tuyaux en Russie produit des ??chantillons de m??tal natif. Cette mine est un chemin??e de kimberlite, riche en diamants , et de la r??duire environnement a aid?? ?? produire ?? la fois de chrome ??l??mentaire et diamants .
Le rapport entre Cr (III) et Cr (VI) d??pend fortement pH et propri??t??s oxydatives de l'emplacement, mais dans la plupart des cas, le Cr (III) est l'esp??ce dominante, bien que dans certaines r??gions l'eau souterraine peut contenir jusqu'?? 39 g / litre de chrome total dont 30 ug / litre est pr??sent sous forme de Cr ( VI).
Isotopes
Naturellement chrome se produisant est compos?? de trois stables isotopes ; 52 Cr, 53 Cr et 54 Cr avec Cr 52 ??tant le plus abondant (83,789% abondance naturelle). 19 des radio-isotopes ont ??t?? caract??ris??s par le plus stable ??tant de 50 Cr avec une demi-vie de (plus de) 1,8 ?? 10 17 ans et 51 Cr avec une demi-vie de 27,7 jours. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 24 heures et la majorit?? d'entre eux ont des demi-vies qui sont moins de 1 minute. Cet ??l??ment a aussi 2 m??ta-Unis.
53 Cr est le produit de d??sint??gration radiog??nique de 53 Mn . Chrome isotopiques contenus sont g??n??ralement combin??s avec mangan??se teneurs isotopiques et ont trouv?? une application dans g??ologie isotopique. Mn des rapports isotopiques -cr renforcer les ??l??ments de preuve du 26 Al et 107 Pd pour l'histoire des d??buts du syst??me solaire . Les variations de 53 Cr / Cr et 52 rapports Mn / Cr de plusieurs m??t??orites indiquent une 53 Mn / Mn 55 rapport initial qui sugg??re Mn-Cr composition isotopique doit r??sulter de la d??composition in situ de 53 Mn dans les corps plan??taires diff??renci??es. Ainsi 53 Cr fournit une preuve suppl??mentaire de processus nucleosynthetic imm??diatement avant coalescence du syst??me solaire.
Les isotopes du chrome varient en masse atomique de 43 u (43 Cr) ?? u 67 (67 Cr). Le primaire mode de d??sint??gration avant l'isotope stable le plus abondant, 52 Cr, est capture d'??lectrons et le mode primaire apr??s est- la d??sint??gration b??ta. 53 Cr a ??t?? pos?? comme un proxy pour la concentration d'oxyg??ne atmosph??rique.
Compos??s
| Oxydation ??tats | |
|---|---|
| -2 | Na 2 [Cr (CO) 5] |
| -1 | Na 2 [Cr 2 (CO) 10] |
| 0 | Cr (C 6 H 6) 2 |
| 1 | K 3 [Cr (CN) 5 NO] |
| 2 | CrCl2 |
| 3 | CrCl3 |
| 4 | K 2 6 CrF |
| 5 | K 3 CrO 8 |
| 6 | K 2 CrO 4 |
Le chrome est un ??l??ment des m??taux de transition , en 6. groupe chrome (0) a une configuration ??lectronique de 4s 3d 1 5, en raison de l'??nergie inf??rieure de la configuration haut spin. Chrome pr??sente un large ??ventail de possibles ??tats d'oxydation , o?? l'Etat 3 est plus stable ??nerg??tiquement; les 3 et 6 Etats sont les plus couramment observ??es dans les compos??s de chrome, tandis que les 1, 4 et 5 ??tats sont rares.
Ce qui suit est la Diagramme de Pourbaix de chrome dans l'eau pure, l'acide perchlorique ou l'hydroxyde de sodium: 
Le chrome (III)


Un grand nombre de compos??s du chrome (III) sont connus. Le chrome (III) peut ??tre obtenu par dissolution de chrome ??l??mentaire en acides tels que l'acide chlorhydrique ou l'acide sulfurique . L'ion Cr 3+ a un rayon similaire (63 h) ?? l'ion Al 3+ (rayon 50 h), de sorte qu'ils peuvent remplacer l'un l'autre dans certains compos??s, tels que dans l'alun de chrome et alun. Quand une quantit?? trace de Cr 3+ ?? Al 3+ remplace corindon (oxyde d'aluminium, Al 2 O 3), la couleur rouge Ruby est form??.
Le chrome ions (III) ont tendance ?? former complexes octa??driques. Les couleurs de ces complexes est d??termin?? par les ligands fix??s au centre Cr. Le disponible dans le commerce chrome (III) chlorure hydrate est le complexe vert fonc?? [CrCl 2 (H 2 O) 4] Cl. Compos??s ??troitement apparent??s ont des couleurs diff??rentes: vert p??le [CrCl (H 2 O) 5] Cl 2 et la violette [Cr (H 2 O) 6] Cl 3. Si le vert sans eau chrome (III) chlorure est dissous dans l'eau, puis la solution verte vire au violet apr??s un certain temps, en raison de la substitution de l'eau par le chlorure dans la int??rieure sph??re de coordination. Ce type de r??action est ??galement observ??e avec des solutions de l'alun de chrome et d'autres sels de chrome soluble dans l'eau (III).
Le chrome (III) hydroxyde (Cr (OH) 3) est amphot??res, dissolution dans des solutions acides pour former [Cr (H 2 O) 6] 3+, et dans des solutions basiques pour former [Cr (OH) 6] 3-. Il est d??shydrat?? par chauffage pour former le vert chrome (III) oxyde (Cr 2 O 3), qui est l'oxyde stable avec une structure cristalline identique ?? celle du corindon .
Le chrome (VI)

Le chrome (VI) sont compos??s oxydants puissants ?? pH faible ou neutre. Les plus importants sont anion chromate (CrO 2-
4) et dichromate (Cr 2 O 7 2-) des anions, qui existent en ??quilibre:
- 2 [CrO 4] 2- + 2 H +
 [Cr 2 O 7] 2- + H 2 O
[Cr 2 O 7] 2- + H 2 O
Chrome (VI) halog??nures sont connus et comprennent ??galement la hexafluorure CrF 6 et le chlorure de chromyle (CrO 2 Cl 2).
chromate de sodium est produit industriellement par le grillage oxydante de minerai de chromite de calcium ou le carbonate de sodium. L'esp??ce dominante est donc, par le loi d'action de masse, d??termin??e par le pH de la solution. Le changement dans l'??quilibre est visible par un changement du jaune (chromate) ?? l'orange ( bichromate), tel que lorsqu'un acide est ajout?? ?? une solution neutre de chromate de potassium. A des valeurs de pH encore plus bas, outre la formation de condensation plus complexe oxyanions de chrome est possible.
Les deux Dichromate anions sont forts r??actifs oxydants ?? faible pH:

- Cr 2 O 2-
7 + 14 H 3 O + + 6 e - → 2 Cr 3+ + 21 H 2 O (ε 0 = 1,33 V)
Ils sont, cependant, que mod??r??ment oxydant ?? pH ??lev??:
- CrO 2-
4 + 4 H 2 O + 3 e - → Cr (OH) 3 + 5 OH - (ε 0 = -0,13 V)
Le chrome (VI) en solution peut ??tre d??tect??e par addition d'un acide de peroxyde d'hydrog??ne une solution. Le bleu fonc?? instable chrome (VI) peroxyde (CrO 5) est form??e, qui peut ??tre stabilis??e en tant que produit d'addition ??ther CrO 5 ?? OR 2.
Acide chromique a la formule hypoth??tique H 2 CrO 4. Ce est un produit chimique d??crit vaguement, malgr?? de nombreuses chromates et dichromates bien d??finies sont connus. Le rouge fonc?? chrome (VI) oxyde CrO 3, l'acide l'anhydride de l'acide chromique, est vendu industriellement en tant que "l'acide chromique". Il peut ??tre produit en m??langeant de l'acide sulfurique avec du bichromate, et est un agent oxydant fort.
Le chrome (V) et de chrome (IV)
L'??tat d'oxydation ne est r??alis??e 5 dans quelques compos??s sont des interm??diaires, mais dans de nombreuses r??actions impliquant des oxydations en chromate. Le seul compos?? binaire est le chrome volatile (V) de fluorure (CrF 5). Ce solide rouge a un point de 30 ?? C de fusion et un point de 117 ?? C d'??bullition. Il peut ??tre synth??tis?? par traitement de chrome m??tallique avec du fluor ?? 400 ?? C et une pression de 200 bar. Le peroxochromate (V) est un autre exemple de l'??tat d'oxydation +5. peroxochromate de potassium (K 3 [Cr (O 2) 4]) est r??alis??e par r??action de chromate de potassium avec du peroxyde d'hydrog??ne ?? basse temp??rature. Ce compos?? rouge brun est stable ?? temp??rature ambiante, mais se d??compose spontan??ment ?? 150-170 ?? C.
Les compos??s de chrome (IV) (dans l'??tat d'oxydation +4) sont l??g??rement plus fr??quentes que celles de chrome (V). Les t??trahalog??nures, CRF 4, CrCl 4, CRBR et 4, peuvent ??tre produits en traitant les trihalog??nures CRX (3) avec l'halog??ne correspondant ?? des temp??ratures ??lev??es. De tels compos??s sont sensibles ?? la dismutation des r??actions et ne sont pas stables dans l'eau.
Le chrome (II)
Beaucoup chrome compos??s (II) sont connus, y compris la stabilit?? ?? l'eau chrome (II) chlorure, CrCl 2, qui peut ??tre r??alis??e par r??duction du chrome (III) avec le chlorure de zinc. La solution bleu vif r??sultant ne est stable en position neutre pH. Beaucoup carboxylates chromeux sont ??galement connus, le plus c??l??bre, le rouge l'ac??tate chromeux (Cr 2 (O 2 CCH 3) 4), qui dispose d'une liaison quadruple.
Le chrome (I)
La plupart des compos??s Cr (I) sont obtenus par oxydation de riche en ??lectrons, octa??driques Cr (0) complexes. Autres Cr (I) complexes contiennent ligands cyclopentadi??nyle. Tel que v??rifi?? par Diffraction des rayons X, un Cr-Cr Liaison quintuple (longueur 183,51 (4) h) a ??galement ??t?? d??crite. Extr??mement ligands monodent??s encombrants stabiliser ce compos?? en prot??geant le lien quintuple partir d'autres r??actions.
Le chrome (0)
Beaucoup de chrome (0) compos??s sont connus. La plupart sont des d??riv??s de chrome ou hexacarbonyle bis (benz??ne) chrome.
Histoire
Armes trouv??es dans des fosses fun??raires datant de la fin du 3??me si??cle avant JC dynastie Qin de la Arm??e de terre cuite pr??s Xi'an, la Chine ont ??t?? analys??s par les arch??ologues. Bien enterr?? il ya plus de 2000 ans, l'ancienne conseils de bronze de carreaux d'arbal??te et ??p??es trouv??es sur le site ont montr?? de mani??re inattendue peu de corrosion, peut-??tre parce que le bronze a ??t?? d??lib??r??ment recouverte d'une fine couche d'oxyde de chrome. Cependant, cette couche d'oxyde m??tallique ou de chrome ??tait pas chromage comme nous le savons.
min??raux de chrome que les pigments sont venus ?? l'attention de l'Occident au 18??me si??cle. Le 26 Juillet 1761 Johann Gottlob Lehmann trouv?? un min??ral rouge-orange dans le Beryozovskoye mines dans le Oural qu'il nomme fil rouge de Sib??rie. Bien ?? tort comme un plomb compos?? avec s??l??nium et fer composants, le min??ral ??tait en fait croco??te ( chromate de plomb) avec une formule de PbCrO 4.
En 1770, Peter Simon Pallas a visit?? le m??me site que Lehmann et a trouv?? un min??ral de fil rouge qui avait des propri??t??s utiles en tant que pigment dans les peintures. L'utilisation du plomb rouge de Sib??rie, un pigment de peinture, puis se est d??velopp??e rapidement. Un lumineux pigment jaune ?? base de croco??te ??galement devenu ?? la mode.

En 1797, Louis Nicolas Vauquelin a re??u des ??chantillons de croco??te minerai. Il produit le trioxyde de chrome (CrO 3) en m??langeant croco??te avec de l'acide chlorhydrique . En 1798, Vauquelin d??couvrit qu'il pouvait isoler chrome m??tallique en chauffant l'oxyde dans un four ?? charbon de bois, faisant de lui le d??couvreur de l'??l??ment. Vauquelin ??tait ??galement capable de d??tecter des traces de chrome dans pr??cieuse pierres pr??cieuses, telles que rubis ou ??meraude.
Pendant les ann??es 1800, le chrome a ??t?? principalement utilis?? comme un composant des peintures et sels de tannage. Dans un premier temps, croco??te de la Russie ??tait la source principale, mais en 1827, un d??p??t de chromite plus grande a ??t?? d??couvert pr??s Baltimore, Etats-Unis . Cela a rendu les Etats-Unis le plus grand producteur de produits de chrome jusqu'?? 1848, lorsque d'importants gisements de chromite ont ??t?? trouv??s pr??s Bursa, Turquie .
Le chrome est ??galement connu pour son lustre lorsque poli. Il est utilis?? comme un rev??tement protecteur et d??coratif sur les pi??ces de voiture, accessoires de plomberie, pi??ces de meubles et de nombreux autres articles, g??n??ralement appliqu?? par ??lectrod??position. Chrome a ??t?? utilis?? pour la galvanoplastie d??s 1848, mais cette utilisation ne se est r??pandue avec le d??veloppement d'un proc??d?? am??lior?? en 1924.
alliages m??talliques repr??sentent d??sormais 85% de l'utilisation de chrome. Le reste est utilis?? dans le industrie chimique et r??fractaire et industries de fonderie.
Production


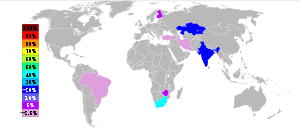
Environ 4,4 millions de tonnes de minerai de chromite commercialisables ont ??t?? produites en 2000, et convertis en ~ 3,3 millions de tonnes de ferro-chrome avec une valeur de march?? d'environ 2,5 milliards de dollars des ??tats-Unis . Les principaux producteurs de minerai de chrome ont ??t?? l'Afrique du Sud (44 de%) l'Inde (18%), le Kazakhstan (16%) du Zimbabwe (5%), la Finlande (4%) l'Iran (4%) et le Br??sil (2%) avec plusieurs autres pays producteurs le reste de moins de 10% de la production mondiale.
Les deux principaux produits de minerai de chrome sont le raffinage ferrochrome et chrome m??tallique. Pour ces produits, le processus de fonderie de minerai diff??re consid??rablement. Pour la production de ferrochrome, le minerai de chromite (FeCr 2 O 4) est r??duite ?? grande ??chelle dans Four ?? arc ??lectrique ou dans les petites fonderies avec soit l'aluminium ou le silicium dans un r??action aluminothermique.
Pour la production de chrome pur, le fer doit ??tre s??par?? du chrome dans un proc??d?? en deux ??tapes de grillage et lixiviation. Le minerai de chromite est chauff?? avec un m??lange de carbonate de calcium et carbonate de sodium en pr??sence d'air. Le chrome est oxyd?? en la forme hexavalent, le fer pendant qu'il fait l'??curie Fe 2 O 3. La lixiviation ult??rieure ?? des temp??ratures sup??rieures ??lev??es dissout le chromates et laisse l'oxyde de fer insoluble. Le chromate est converti par l'acide sulfurique dans le dichromate.
- 4 FeCr 2 O 4 + 8 Na 2 CO 3 + O 2 → 7 8 Na 2 CrO 4 2 + Fe 2 O 3 + 8 CO 2
- 2 Na 2 CrO 4 + H 2 SO 4 → Na 2 Cr 2 O 7 + Na 2 SO 4 + H 2 O
Le dichromate est converti en l'oxyde de chrome (III) par r??duction avec du carbone et ensuite r??duit dans une r??action aluminothermique de chrome.
- Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO
- Cr 2 O 3 + 2 Al → Al 2 O 3 + Cr 2
Applications
M??tallurgie

L'effet de renforcement de la formation des carbures m??talliques stables dans les joints de grains et de la forte augmentation de la r??sistance ?? la corrosion de chrome fait un mat??riau d'alliage important pour l'acier. Le aciers ?? outils ?? haute vitesse contiennent entre 3 et 5% de chrome. Acier inoxydable, la principale alliage m??tallique r??sistant ?? la corrosion, est form?? lorsque chrome est ajout?? ?? fer ?? des concentrations suffisantes, g??n??ralement au-dessus de 11%. Pour sa formation, ferrochrome est ajout?? au fer en fusion. Aussi augmenter les alliages ?? base de nickel de la r??sistance due ?? la formation de particules discr??tes, stables carbure de m??tal aux joints de grains. Par exemple, Inconel 718 contient 18,6% de chrome. En raison des excellentes propri??t??s ?? haute temp??rature de ces nickel superalliages, ils sont utilis??s dans les moteurs ?? r??action , et turbines ?? gaz au lieu des mat??riaux structurels communs.
La haute duret?? et r??sistance ?? la corrosion relative de chrome non alli?? en fait un bon rev??tement de surface, ??tant toujours le plus rev??tement m??tallique "populaire" avec une durabilit?? in??gal??e combin??e. Une fine couche de chrome est d??pos??e sur les surfaces m??talliques pr??trait??es par des techniques de galvanoplastie. Il existe deux m??thodes de d??p??t: Mince, ci-dessous 1 um d'??paisseur, les couches sont d??pos??es par chromage, et sont utilis??s pour les surfaces d??coratives. Si les surfaces r??sistantes ?? l'usure sont n??cessaires alors plus ??paisses couches de chrome sont d??pos??s. Les deux m??thodes utilisent normalement chromate acide ou solutions dichromate. Pour ??viter le changement consommant de l'??nergie dans l'??tat d'oxydation, l'utilisation de sulfate de chrome (III) est en cours de d??veloppement, mais pour la plupart des applications, le processus ??tabli est utilis??.
Dans le Proc??d?? de rev??tement par conversion de chromate, les propri??t??s fortement oxydantes de chromates sont utilis??s pour d??poser une couche protectrice d'oxyde sur des m??taux comme l'aluminium, le zinc et le cadmium. Cette passivation et les propri??t??s auto-cicatrisantes par le chromate stock?? dans le rev??tement de conversion au chromate, qui est capable de migrer vers d??fauts locaux, sont les avantages de cette m??thode de rev??tement. En raison de r??glementations environnementales et sanitaires sur les chromates, proc??d?? de rev??tement de remplacement sont en cours de d??veloppement.
L'anodisation de l'aluminium est un autre proc??d?? ??lectrochimique, ce qui ne entra??ne pas le d??p??t de chrome, mais utilisations l'acide chromique comme ??lectrolyte dans la solution. Au cours de l'anodisation, une couche d'oxyde est form??e sur l'aluminium. L'utilisation de l'acide chromique, ?? la place de l'acide sulfurique normalement utilis??, conduit ?? une l??g??re diff??rence de ces couches d'oxyde. La toxicit?? ??lev?? de Cr (VI), utilis?? dans le proc??d?? galvanique de chrome ??tablie, et le renforcement de la s??curit?? et r??glementations environnementales exigent une recherche de substituts pour chrome ou au moins un changement au chrome moins toxique (III) de compos??s.
Teintures et de pigments

Le min??ral croco??te ( chromate de plomb PbCrO 4) a ??t?? utilis?? comme pigment jaune peu de temps apr??s sa d??couverte. Apr??s un proc??d?? de synth??se est devenue disponible ?? partir de la chromite plus abondante, le jaune de chrome ??tait, avec le jaune de cadmium, un des pigments jaunes plus utilis??s. Le pigment ne pas photod??gradation, mais il a tendance ?? se assombrir en raison de la formation de chrome (III) de l'oxyde de. Il a une couleur forte, et a ??t?? utilis?? pour les autobus scolaires aux ??tats-Unis et pour le service postal (par exemple Deutsche Post) en Europe. L'utilisation de jaune de chrome diminu?? en raison de pr??occupations environnementales et de s??curit?? et a ??t?? remplac?? par des pigments organiques ou alternatives exempt de plomb et le chrome. D'autres pigments ?? base de chrome sont, par exemple, le pigment rouge vif rouge de chrome, qui est un chromate de plomb basique (PbCrO 4 ?? Pb (OH) 2). Un pigment de chromate tr??s important, qui a ??t?? largement utilis?? dans les formulations d'appr??t m??tallique est le chromate de zinc, maintenant remplac?? par du phosphate de zinc. Une amorce de lavage a ??t?? formul?? de mani??re ?? remplacer la pratique dangereuse pour le pr??traitement d'organes d'avions d'aluminium avec une solution d'acide phosphorique. Cette tetroxychromate de zinc utilis?? en dispersion dans une solution de polyvinylbutyral. Une solution ?? 8% d'acide phosphorique dans un solvant a ??t?? ajout?? juste avant l'application. Il a ??t?? constat?? que l'alcool facilement oxyd?? est un ingr??dient essentiel. Une mince couche d'environ 10 ?? 15 um a ??t?? appliqu??e, qui se est du jaune au vert fonc?? quand il a ??t?? gu??ri. Il ya encore une question sur le m??canisme exact. Vert Chrome est un m??lange de Bleu de Prusse et jaune de chrome, tandis que le vert d'oxyde de chrome est de chrome (III) de l'oxyde.
oxydes de chrome sont ??galement utilis??s en tant que couleur verte en verrerie et en tant que vernis en c??ramique. Vert d'oxyde de chrome est extr??mement stable ?? la lumi??re et ?? ce titre est utilis?? dans les rev??tements de gaine. Ce est aussi l'ingr??dient principal dans IR refl??tant peintures, utilis??s par les forces arm??es, ?? peindre des v??hicules, de leur donner la m??me r??flectance IR que les feuilles vertes.
Rubis synth??tique et le premier laser
Naturel rubis sont corindon (oxyde d'aluminium) de cristaux qui sont de couleur rouge (le type le plus rare) en raison des ions chrome (III) (autres couleurs de gemmes de corindon sont appel??es saphirs). Un rubis synth??tique de couleur rouge peut ??galement ??tre obtenue par dopage de chrome (III) en cristaux de corindon artificiel, ce qui rend une exigence de chrome pour la fabrication de rubis synth??tiques. Un tel cristal de rubis synth??tique ??tait la base pour la premi??re laser , produit en 1960, qui se appuyait sur l'??mission stimul??e de lumi??re ?? partir des atomes de chrome dans un tel cristal.
Conservateur bois
En raison de leur toxicit??, le chrome (VI) les sels sont utilis??s pour la protection du bois. Par exemple, ars??niate de cuivre chromat?? (ACC) est utilis?? dans le traitement du bois ?? prot??ger le bois contre les champignons pourriture, insectes de bois attaquer, y compris les termites et les xylophages marins. Les formulations contiennent du chrome sur la base de l'oxyde CrO 3 entre 35,3% et 65,5%. Aux ??tats-Unis, 65 300 tonnes m??triques de solution CCA ont ??t?? utilis??s en 1996.
Bronzage
Chrome (III), en particulier des sels l'alun de chrome et sulfate de chrome (III), sont utilis??s dans la tannage de cuir. Le chrome (III) stabilise le cuir par la r??ticulation les fibres de collag??ne. Le chrome cuir tann?? peut contenir entre 4 et 5% de chrome, qui est ??troitement li??e aux prot??ines. Bien que la forme de chrome utilis?? pour le bronzage ne est pas la vari??t?? hexavalent toxique, il reste int??r??t dans la gestion de chrome dans l'industrie du tannage comme la r??cup??ration et la r??utilisation, le recyclage direct / indirect, utilisation de moins de chrome ou "chrome-moins" bronzage sont pratiqu??es de mieux g??rer le chrome dans le tannage.
Mat??riau r??fractaire
La r??sistance ?? la chaleur ??lev??e et point de fusion ??lev?? marques chromite et de chrome (III) de l'oxyde d'un mat??riau pour des applications r??fractaires ?? haute temp??rature, comme les hauts fourneaux, du ciment fours, moules pour les tirs de briques et de sables de fonderie que pour le coul??e de m??taux. Dans ces applications, les mat??riaux r??fractaires sont fabriqu??s ?? partir des m??langes de la chromite et de la magn??site. L'utilisation diminue en raison de la r??glementation de l'environnement en raison de la possibilit?? de la formation de chrome (VI).
Catalyseurs
Plusieurs compos??s de chrome sont utilis??s comme catalyseurs pour le traitement des hydrocarbures. Par exemple, le Catalyseurs de Phillips pour la production de sont des m??langes de polyethylene chrome et de dioxyde de silicium ou des m??langes de chrome et titane et l'oxyde d'aluminium . Fe-Cr oxydes mixtes sont utilis??es comme catalyseurs ?? haute temp??rature pour la r??action de d??placement du gaz ?? l'eau. le chromite de cuivre est un utile hydrog??nation catalytique.
Autre utilisation
- Le chrome (IV) oxyde (CrO 2) est un magn??tique compos??. Sa forme id??ale anisotropie, qui conf??re haute coercivit?? et aimantation r??manente, ont fait un compos?? sup??rieure ?? la γ-Fe 2 O 3. Le chrome (IV) oxyde est utilis?? pour la fabrication bande magn??tique utilis?? dans la bande audio de haute performance et de la norme cassettes audio. Chromates peuvent emp??cher la corrosion de l'acier dans des conditions humides, et donc chromates sont ajout??s ?? boues de forage.
- Le chrome (III) oxyde est un vernis m??tallique connu comme rouge vert.
- L'acide chromique est un agent oxydant puissant et est un compos?? utile pour nettoyer la verrerie de laboratoire de toute trace de compos??s organiques. Il est pr??par?? in situ par dissolution le bichromate de potassium dans de l'acide sulfurique concentr??, qui est ensuite utilis?? pour laver l'appareil. le dichromate de sodium est parfois utilis?? en raison de sa solubilit?? plus ??lev??e (50 g / L par rapport ?? 200 g / L respectivement). Le dichromate de potassium est une substance chimique r??actif, utilis?? pour le nettoyage verrerie de laboratoire et comme agent de titrage. Il est ??galement utilis?? en tant que mordant (?? savoir un agent de fixation) dans le tissu pour les colorants.
R??le biologique
Le chrome trivalent (Cr (III) ou Cr 3+) se produit dans l'??tat de traces dans les aliments et les eaux, et semble ??tre b??nigne. En revanche, chrome hexavalent (Cr (VI) ou Cr 6+) est tr??s toxique et mutag??ne lorsqu'il est inhal??. Cr (VI) n'a pas ??t?? ??tablie comme canc??rog??ne lorsqu'il est en solution, m??me si elle peut provoquer allergique dermatite de contact (ACD).
la carence en chrome, impliquant un manque de Cr (III) dans le corps, ou peut-??tre un complexe de celui-ci, tel que facteur de tol??rance au glucose est controvers??e, ou est au moins extr??mement rare. Chrome a pas v??rifi?? r??le biologique et a ??t?? class?? par certains comme pas essentiel pour les mammif??res. Toutefois, d'autres critiques ont consid??r?? comme un oligo-??l??ment essentiel pour les humains.

carence en chrome a ??t?? attribu?? ?? seulement trois personnes sur le long terme la nutrition parent??rale, qui est quand un patient est aliment?? par une alimentation de liquide perfusions pendant de longues p??riodes de temps.
Bien qu'aucun r??le biologique pour le chrome n'a jamais ??t?? d??montr??e, compl??ments alimentaires pour le chrome comprennent Picolinate de chrome (III), chrome (III) polynicotinate, et des mati??res connexes. L'avantage de ces suppl??ments est interrog?? par certaines ??tudes. L'utilisation de compl??ments alimentaires contenant du chrome est controvers??e, en raison de l'absence de tout r??le v??rifi?? biologique, la charge de ces suppl??ments, et les effets complexes de leur utilisation. Le compl??ment alimentaire populaire complexe de picolinate de chrome g??n??re dommages chromosomiques dans des cellules de hamster (en raison du ligand picolinate). Aux ??tats-Unis les directives di??t??tiques pour l'absorption quotidienne de chrome ont ??t?? abaiss??s en 2001 de 50 ?? 200 pg pour un adulte de 35 ug (m??les adultes) et de 25 ug (femelle adulte).
Pr??cautions
Eau de chrome (III) insoluble et compos??s de chrome m??tal ne sont pas consid??r??s comme un danger pour la sant??, alors que la toxicit?? et les propri??t??s canc??rig??nes de chrome (VI) sont connus depuis longtemps. Parce que des m??canismes de transport sp??cifiques, que des quantit??s limit??es de chrome (III) p??n??trent dans les cellules. Plusieurs ??tudes in vitro ont indiqu?? que des concentrations ??lev??es de chrome (III) dans la cellule peuvent conduire ?? des dommages de l'ADN. Toxicit?? aigu?? par voie orale est comprise entre 1,5 et 3,3 mg / kg. Les effets b??n??fiques propos??es de chrome (III) et l'utilisation comme suppl??ments di??t??tiques ont donn?? des r??sultats controvers??s, mais les r??centes critiques sugg??rent que l'absorption mod??r??e de chrome (III) par des suppl??ments alimentaires ne pr??sente aucun risque.
Cr (VI)
Le aigu?? oral la toxicit?? pour le chrome (VI) est comprise entre 50 et 150 ug / kg. Dans le corps, le chrome (VI) est r??duit par plusieurs m??canismes de chrome (III) d??j?? dans le sang avant qu'il ne p??n??tre dans les cellules. Le chrome (III) est excr??t?? par le corps, tandis que l'ion chromate est transf??r?? dans la cellule par un m??canisme de transport, et par lequel le sulfate et des ions phosphates entrent dans la cellule. La toxicit?? aigu?? du chrome (VI) est due ?? son fort oxidational propri??t??s. Apr??s avoir atteint le flux sanguin, il endommage les reins, le foie et les cellules sanguines par des r??actions d'oxydation. H??molyse, r??nale et d'insuffisance h??patique sont les r??sultats de ces dommages. Dialyse agressif peut am??liorer la situation.
Le canc??rog??ne des poussi??res de chromate est connu depuis longtemps, et en 1890 la premi??re publication d??crit le risque de cancer ??lev?? de travailleurs dans une entreprise de teinture chromate. Trois m??canismes ont ??t?? propos??s pour d??crire la g??notoxicit?? de chrome (VI). Le premier m??canisme comprend fortement r??actif les radicaux hydroxyle et les autres radicaux r??actifs qui sont produits par de la r??duction du chrome (VI) en chrome (III). Le second proc??d?? comprend la liaison directe du chrome (V), obtenue par r??duction dans la cellule, et de chrome (IV) des compos??s de l' ADN . Le dernier m??canisme a attribu?? la g??notoxicit?? pour la liaison ?? l'ADN du produit de la (III) la r??duction du chrome final.
Les sels de chrome (chromates) sont aussi la cause de r??actions allergiques chez certaines personnes. Chromates sont souvent utilis??s pour fabriquer, entre autres, des produits en cuir, les peintures, le ciment, mortier et anti-corrosifs. Le contact avec des produits contenant des chromates peuvent conduire ?? des allergiques dermatite de contact et la dermatite irritante, r??sultant en une ulc??ration de la peau, parfois appel??s ??ulc??res chrome". Cette condition est souvent trouv?? chez les travailleurs qui ont ??t?? expos??s ?? des solutions de chromate fortes dans la galvanoplastie, de bronzage et les fabricants de chrome-production.
Probl??mes environnementaux
Comme compos??s de chrome ont ??t?? utilis??s dans colorants et peintures et le tannage de cuir, ces compos??s sont souvent trouv??s dans le sol et eaux souterraines sur les sites industriels abandonn??s, maintenant besoin nettoyage de l'environnement et assainissement pour le traitement de friches industrielles. Appr??t de peinture contenant du chrome hexavalent est encore largement utilis?? pour a??rospatiale et automobile finition applications.
En 2010, le Environmental Working Group a ??tudi?? l'eau potable dans 35 villes am??ricaines. L'??tude ??tait la premi??re analyse nationale mesurer la pr??sence de la substance chimique dans les syst??mes d'eau des ??tats-Unis. L'??tude a r??v??l?? mesurables chrome hexavalent dans l'eau du robinet de 31 des villes de l'??chantillon, avec Norman, Oklahoma, au sommet de la liste; 25 villes avaient des niveaux qui d??passent la limite propos??e de la Californie. Remarque: Les concentrations de Cr (VI) aux ??tats-Unis municipales d'approvisionnement en eau potable rapport??s par EWG sont dans, les niveaux de fond naturels probables pour les domaines test??s et ne pr??jugent pas de la pollution industrielle (CalEPA Fiche), comme l'affirme EWG. Ce facteur n'a pas ??t?? pris en consid??ration dans leur rapport.

