
??l??ment chimique
Contexte des ??coles Wikip??dia
SOS Enfants, un organisme de bienfaisance de l'??ducation , a organis?? cette s??lection. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
Un ??l??ment chimique, ou ??l??ment, est un type d' atome qui se distingue par son nombre atomique ; ce est, par le nombre de protons dans son noyau . Le terme est ??galement utilis?? pour faire r??f??rence ?? un produit chimique pur substance compos??e d'atomes ayant le m??me nombre de protons.
Des exemples courants d'??l??ments sont un atome d'hydrog??ne , carbone , azote et oxyg??ne . Au total, 117 ??l??ments ont ??t?? observ??s en 2007, dont 94 produisent naturellement sur Terre. Les ??l??ments ayant un num??ro atomique sup??rieur ?? 82 ( de bismuth et plus) sont intrins??quement instables et subissent d??sint??gration radioactive. Sur les 82 premiers ??l??ments, 80 ont stables isotopes . Elements 43 et 61 ( techn??tium et promethium ) ne ont pas les isotopes stables, et la pourriture. Les ??l??ments de 83 ?? num??ro atomique 94 qui ne ont pas noyaux stables, sont n??anmoins trouv??s dans la nature, soit survivre comme des vestiges de la nucl??osynth??se stellaire primordiale qui a produit les ??l??ments dans le syst??me solaire, ou encore comme produits comme fille-isotopes de courte dur??e nouveaux dans la d??croissance naturelle de l'uranium et du thorium .
Tous mati??re chimique est constitu??e de ces ??l??ments. Nouveaux ??l??ments de num??ro atomique sup??rieur sont d??couverts de temps ?? autre, comme des produits de artificielle r??actions nucl??aires.
Histoire
Le terme ????l??ments?? (stoicheia) a ??t?? d'abord utilis?? par le philosophe grec Platon dans environ 360 BCE, dans son dialogue Tim??e, qui comprend une analyse de la composition des organes inorganiques et organiques et est un trait?? rudimentaire sur la chimie. Platon suppose que la particule de minute de chaque ??l??ment correspond ?? l'un des poly??dres r??guliers: t??tra??dre (le feu), l'octa??dre (air), icosa??dre (eau), et cube (la terre).
 | 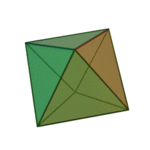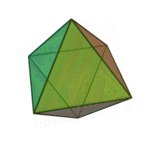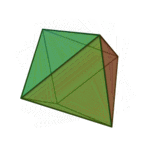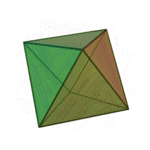 | 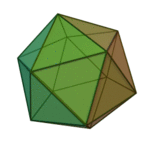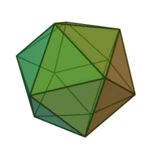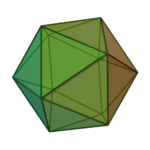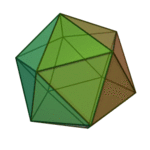 | 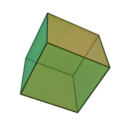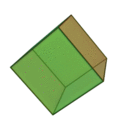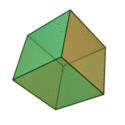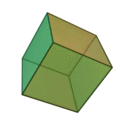 | |
| T??tra??dre (feu) | Octa??dre (air) | Icosa??dre (eau) | Cube (terre) |
Ajoutant ?? la quatre ??l??ments du philosophe grec Emp??docle, dans environ 350 avant JC, Aristote a ??galement utilis?? le terme ????l??ment?? et con??u cinqui??me ??l??ment appel?? " quintessence ", qui a form?? les cieux Aristote d??fini comme un ??l??ment.:
Element - un de ces organismes dans lesquels d'autres organismes peuvent ??tre d??compos??es et qui m??me ne est pas capable d'??tre divis?? en d'autres.
Se appuyant sur cette th??orie, en c. 790 chimiste Arabian Jabir ibn Hayyan-( Geber) postule que les m??taux ont ??t?? form??es ?? partir de deux ??l??ments: le soufre, "la pierre qui br??le??, qui caract??rise le principe de la combustibilit??, et le mercure, qui contenait le principe id??alis??e de propri??t??s m??talliques. Peu de temps apr??s, les choses ont ??volu?? dans le concept arabe des trois principes: le soufre donnant inflammabilit?? ou de la combustion, le mercure donnant la volatilit?? et de la stabilit??, et le sel donnant solidit??.
En 1524, le chimiste suisse Paracelse a adopt?? quatre Th??orie de l'??l??ment d'Aristote, mais a estim?? que ils sont apparus dans les organes que trois principes de Geber. Paracelse a vu ces principes aussi fondamentaux et les justifiait par le recours ?? la description de la fa??on dont le bois br??le dans le feu. Le mercure compris le principe coh??sif, de sorte que lorsqu'il a quitt?? la fum??e du bois se est effondr??. Tabac repr??sent?? la volatilit?? (le principe de mercure), les flammes ?? la chaleur donnant repr??sent??s inflammabilit?? (soufre), et la cendre reste repr??sent??s solidit?? (sel).
En 1669, le m??decin et chimiste allemand Johann Becher a publi?? son Physica Subterranea. Dans la modification sur les id??es de Paracelse, il a soutenu que les constituants du corps sont l'air, l'eau et trois types de terre: terre fluida, l'??l??ment mercurial, qui contribue fluidit?? et la volatilit??; terra lapida, l'??l??ment de solidification, qui produit la fusibilit?? ou la qualit?? de liaison; et terra pinguis, l'??l??ment gras, qui donne la substance mat??rielle de ses qualit??s huileux et combustibles. Ces trois terres correspondent aux trois principes de Geber. Un morceau de bois, par exemple, selon la Becher, est compos?? de cendres et terra pinguis; lorsque le bois est br??l??, le pinguis terra est lib??r??, laissant les cendres. En d'autres termes, dans la combustion de la terre gras br??le.
En 1661, Robert Boyle a montr?? qu'il y avait plus que quatre ??l??ments classiques que les anciens avaient suppos??. La premi??re liste moderne des ??l??ments chimiques a ??t?? donn?? dans Antoine Lavoisier de 1789 ??l??ments de chimie, qui contenait trente-trois ??l??ments, y compris la lumi??re et calorique. En 1818, J??ns Jakob Berzelius avait d??termin?? poids atomiques pendant quarante-cinq des ??l??ments accept??es quarante-neuf. Dmitri Mendele??ev avait soixante-six ??l??ments dans son tableau p??riodique de 1869, illustr?? ci-dessous.

De Boyle jusqu'au d??but du 20e si??cle, un ??l??ment a ??t?? d??fini comme un pur substance qui ne peut ??tre d??compos?? en une substance plus simple. Autrement dit, un ??l??ment chimique ne peut pas ??tre transform??e en d'autres ??l??ments chimiques par chimiques processus. En 1913, Henry Moseley a d??couvert que la base physique du num??ro atomique de l'atome ??tait sa charge nucl??aire, qui a finalement conduit ?? la d??finition actuelle. La d??finition actuelle permet ??galement d'??viter certaines ambigu??t??s dues aux isotopes et allotropes .
En 1919, il y avait soixante-douze ??l??ments connus. En 1955, l'??l??ment 101 a ??t?? d??couvert et nomm?? mendelevium en l'honneur de Mendele??ev, le premier ?? disposer les ??l??ments d'une mani??re p??riodique. En Octobre 2006, la synth??se de l'??l??ment 118 a ??t?? signal??; cependant, l'??l??ment 117 n'a pas encore ??t?? cr???? dans le laboratoire.
Description
Les ??l??ments les plus l??gers sont l'hydrog??ne et de l'h??lium , ?? la fois cr???? par Big Bang lors de la nucl??osynth??se 20 premi??res minutes de l'univers dans un rapport d'environ 3: 1 en poids (environ 12: 1 en nombre d'atomes). Presque tous les autres ??l??ments trouv??s dans la nature, y compris un certain laps hydrog??ne et d'h??lium cr???? depuis lors, ont ??t?? faites par divers (fois) naturels ou ?? des m??thodes artificielles de nucl??osynth??se, y compris parfois par des activit??s telles que la fission nucl??aire .
En 2006, il ya 117 ??l??ments connus (dans ce contexte, "connu" moyennes observ??es assez bien, m??me de quelques produits de d??sint??gration, avoir ??t?? diff??renci??e de tout autre ??l??ment). Parmi ces 117 ??l??ments, 94 produisent naturellement sur Terre. Six d'entre eux se produisent en quantit??s infimes extr??mes: techn??tium , num??ro atomique 43; promethium , num??ro 61; astatine , num??ro 85; francium , le num??ro 87; le neptunium , le num??ro 93; et le plutonium , le num??ro 94. Ces 94 ??l??ments, et aussi peut-??tre l'??l??ment 98 californium , ont ??t?? d??tect??s dans l'univers dans son ensemble, dans les spectres des ??toiles et aussi supernovae, o?? des ??l??ments radioactifs ?? vie courte ont ??t?? r??cemment r??alis??s.
Les 22 ??l??ments restants introuvable sur Terre ou dans les spectres astronomiques ont ??t?? obtenus artificiellement. Tous les ??l??ments qui proviennent exclusivement par des moyens artificiels sont radioactifs tr??s courts demi-vie ; si des atomes de ces ??l??ments ??taient pr??sents ?? la formation de la Terre, ils sont extr??mement susceptibles d'avoir d??j?? cari??es, et si pr??sente dans les novae, sont en quantit?? trop faible pour ont ??t?? not??s. techn??tium ??tait le premier ??l??ment pr??tendument non naturelle ?? synth??tiser, en 1937, bien que des quantit??s infimes de techn??tium ont depuis ??t?? trouv??s dans la nature, et l'??l??ment peut avoir ??t?? d??couvert naturellement en 1925. Ce mod??le de production artificielle et de d??couverte naturelle tard a ??t?? r??p??t?? avec plusieurs autres ??l??ments naturels radioactifs de traces .
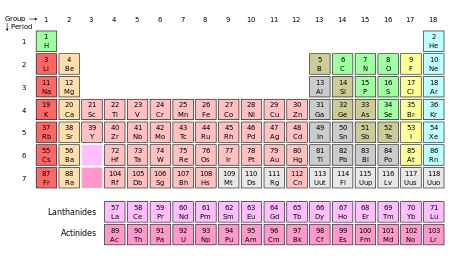
Listes des ??l??ments par nom , par le symbole, par num??ro atomique, par densit??, par le point de fusion, et par point d'??bullition ainsi que ??nergies d'ionisation des ??l??ments sont disponibles. La pr??sentation la plus commode des ??l??ments se trouve dans le tableau p??riodique , les groupes d'??l??ments ayant des propri??t??s chimiques semblables.
Num??ro atomique
Le nombre atomique d'un ??l??ment, Z, est ??gal au nombre de protons qui d??finit l'??l??ment. Par exemple, tous carbone atomes contiennent six protons dans leur noyau ; de sorte que le nombre atomique "Z" de carbone est 6. Les atomes de carbone peuvent avoir diff??rents nombres de neutrons, qui sont connus comme des isotopes de l'??l??ment.
Le nombre de protons dans le noyau atomique d??termine ??galement la charge ??lectrique , qui ?? son tour d??termine les ??lectrons de l'atome dans son ??tat non ionis??. Ceci ?? son tour (au moyen de la Principe d'exclusion de Pauli) d??termine l'atome de diverses propri??t??s chimiques. Donc, tous les atomes de carbone, par exemple, avoir en fin de compte des propri??t??s chimiques identiques parce qu'ils ont tous le m??me nombre de protons dans leur noyau, et ont donc le m??me num??ro atomique. Ce est pour cette raison que le nombre atomique plut??t que nombre de masse (ou poids atomique) est consid??r??e comme la caract??ristique d'identification d'un ??l??ment.
Masse atomique
Le Num??ro de la masse d'un ??l??ment, A, est le nombre de nucl??ons (protons et neutrons) dans le noyau atomique. Diff??rents isotopes d'un ??l??ment donn?? se distinguent par leurs nombres de masse, qui sont classiquement ??crit comme un super-index sur le c??t?? gauche du symbole atomique (par exemple, 238 U).
Le masse atomique relative d'un ??l??ment est la moyenne des masses atomiques de tous les isotopes de l'??l??ment chimique que l'on trouve dans un environnement particulier, pond??r??e par l'abondance isotopique, par rapport ?? la l'unit?? de masse atomique (u). Ce nombre peut ??tre une fraction qui ne est pas proche d'un nombre entier, en raison du processus de calcul de moyenne. D'autre part, la masse atomique de l'isotope pur est assez proche de son nombre de masse. Alors que le nombre de masse est un nombre naturel (ou entier), la masse atomique d'un seul isotope est un nombre r??el qui est proche d'un nombre naturel. En g??n??ral, il diff??re l??g??rement du nombre de masse que la masse des protons et des neutrons ne est pas exactement une u, les ??lectrons contribuent l??g??rement ?? la masse atomique, et en raison de la ??nergie de liaison nucl??aire. Par exemple, la masse de 19 F est 18,9984032 u. La seule exception ?? la masse atomique de l'isotope ne ??tant pas un nombre entier naturel est de 12 C, qui a une masse de 12 exactement, du fait de la d??finition de u (il est fix?? en tant que 1 / 12e de la masse de connexion une liaison carbone-12 atome, exactement).
Isotopes
Les isotopes sont des atomes d'un m??me ??l??ment (ce est, avec le m??me nombre de protons dans leur noyau atomique), mais ayant un nombre diff??rent de neutrons . La plupart (66 sur 94) naturellement ??l??ments pr??sents ont plus d'un isotope stable. Ainsi, par exemple, il ya trois principaux isotopes de carbone . Tous les atomes de carbone avoir six protons dans le noyau, mais ils peuvent avoir soit 6, 7, ou 8 neutrons. ??tant donn?? que les nombres de masse de ceux-ci sont 12, 13 et 14 respectivement, les trois isotopes de carbone sont connues en tant que liaison carbone-carbone 13 14 carbone-12, et, souvent abr??g??s ?? 12 C, 13 C et 14 C. Carbone dans la vie quotidienne et dans la chimie est un m??lange de 12 C, 13 C et 14 atomes de carbone.
Les trois isotopes de carbone ont les m??mes propri??t??s chimiques. Mais ils ont des propri??t??s nucl??aires. Dans cet exemple, le carbone-12 et le carbone-13 sont des atomes stables, mais carbone-14 est instable; il est l??g??rement radioactifs, en d??composition au fil du temps dans d'autres ??l??ments.
Comme le carbone, certains isotopes de divers ??l??ments sont radioactifs et se d??sint??grent en d'autres ??l??ments sur rayonnant d'une particule alpha ou b??ta. Pour certains ??l??ments, tous les isotopes sont des isotopes radioactifs en particulier: les ??l??ments sans aucune isotopes stables sont techn??tium (num??ro atomique 43), le prom??thium (num??ro atomique 61) et tous les ??l??ments observ??s avec un num??ro atomique sup??rieur ?? 82.
Sur les 80 ??l??ments avec un isotope stable, 16 ne ont qu'un seul isotope stable, et le nombre moyen d'isotopes stables pour les 80 ??l??ments stables est 3,4 isotopes stables par ??l??ment. Le plus grand nombre d'isotopes stables qui se produisent pour un ??l??ment est de 10 (pour l'??tain, ??l??ment 50).
Allotropes
Certains ??l??ments peuvent ??tre trouv??s en tant que substances ??l??mentaires multiples, connues sous le nom allotropes , qui diff??rent dans leur structure et les propri??t??s. Par exemple, le carbone peut ??tre trouv?? en tant que diamant , qui a une structure t??tra??drique autour de chaque atome de carbone; graphite, qui a des couches d'atomes de carbone de structure hexagonale, et fuller??nes, qui ont des formes presque sph??riques. La possibilit?? pour un ??l??ment d'exister dans une des nombreuses formes structurelles est connu comme 'allotropie'.
??tat standard
Le ??tat standard, ou de l'??tat de r??f??rence, d'un ??l??ment est d??finie comme son ??tat thermodynamique plus stable ?? 1 bar ?? une temp??rature donn??e (typiquement ?? 298,15 K). En thermochimie, un ??l??ment est d??fini pour avoir un enthalpie de formation de z??ro dans son ??tat standard. Par exemple, l'??tat de r??f??rence pour le carbone est du graphite, car il est plus stable que les autres allotropes.
Nomenclature
La d??signation des ??l??ments pr??c??de la th??orie atomique de la mati??re, m??me si au moment o?? il ne ??tait pas connu quels produits chimiques sont des ??l??ments et qui aggrave. Quand il a appris, les noms existants (par exemple, l'or, le mercure, fer) ont ??t?? maintenus dans la plupart des pays, et les diff??rences nationales ont ??merg?? sur les noms des ??l??ments soit pour plus de commodit??, les subtilit??s linguistiques, ou le nationalisme. Par exemple, les Allemands utilisent "Wasserstoff" pour "hydrog??ne" et "Sauerstoff" pour "l'oxyg??ne", tandis que l'anglais et certains langues romanes utilisent "sodium" pour "natrium" et "potassium" pour "kalium", et les Fran??ais, les Grecs et les Polonais pr??f??rent "azote / Azot" pour "azote".
Mais pour le commerce international, le noms officiels des ??l??ments chimiques ?? la fois anciens et r??cents sont d??cid??es par le Union internationale de chimie pure et appliqu??e, qui a d??cid?? sur une sorte de langage international anglais. Cette organisation a r??cemment prescrit que "aluminium" et "c??sium" prennent la place de l'orthographe ??aluminium?? ??tats-Unis et "c??sium", tandis que le "soufre" US prend la place du "soufre" britannique. Mais les produits chimiques qui sont praticables ?? ??tre vendus en vrac au sein de nombreux pays, cependant, ont encore des noms nationaux et ceux qui ne utilisent pas l' alphabet latin ne peut se attendre ?? utiliser le nom IUPAC. Selon IUPAC, le nom complet d'un ??l??ment ne est pas capitalis??, m??me se il est issu d'un nom propre comme ??l??ments californium ou einsteinium (sauf se il serait capitalis?? par un autre r??gle). Isotopes des ??l??ments chimiques sont ??galement en minuscule si elle ??tait ??crite sur: carbone-12 ou uranium-235.
Dans la seconde moiti?? du XXe laboratoires de physique de si??cle est devenu capable de produire des noyaux des ??l??ments chimiques qui ont une demi-vie trop courte pour eux de rester en quantit??s appr??ciables. Ceux-ci sont ??galement nomm??s par l'IUPAC, qui adopte g??n??ralement le nom choisi par le d??couvreur. Cela peut conduire ?? la question controvers??e de quel groupe de recherche effectivement d??couvert un ??l??ment, une question qui a retard?? la d??signation des ??l??ments de num??ro atomique de 104 et plus ??lev?? pour un temps consid??rable. (Voir ??l??ment nommer controverse).
Les pr??curseurs de ces controverses impliqu??s les d??nominations nationalistes d'??l??ments ?? la fin du XIXe si??cle. Par exemple, le lut??tium a ??t?? nomm?? en r??f??rence ?? Paris, France. Les Allemands ??taient r??ticents ?? renoncer droits de d??nomination ?? la fran??aise, souvent appeler cassiopeium. Le d??couvreur britannique de niobium initialement nomm?? il niobium, en r??f??rence ?? la Nouveau Monde. Il a ??t?? largement utilis?? comme tel par les publications am??ricaines ant??rieures ?? la normalisation internationale.
Symboles chimiques
??l??ments chimiques sp??cifiques
Avant la chimie est devenue une science, alchimistes avaient con??u symboles ??sot??riques pour les m??taux et compos??s communs. Ces ont toutefois ??t?? utilis??s comme des abr??viations dans les diagrammes ou des proc??dures; il n'y avait pas de concept d'atomes se combinent pour former des mol??cules. Avec ses avanc??es dans la th??orie atomique de la mati??re, John Dalton a con??u ses propres symboles simples, bas??es sur des cercles, qui devaient ??tre utilis??s pour d??crire des mol??cules.
Le syst??me actuel de notation chimique a ??t?? invent?? par Berzelius. Dans ce syst??me typographique symboles chimiques ne sont pas utilis??s comme de simples abr??viations - si chacun se compose de lettres de l' alphabet latin - ce sont des symboles destin??s ?? ??tre utilis??s par les peuples de toutes les langues et alphabets. Le premier de ces symboles ??taient destin??s ?? ??tre pleinement universelle; depuis latin ??tait la langue commune de la science ?? cette ??poque, ils ??taient bas??s sur les abr??viations latines noms des m??taux - Fe vient de Ferrum, Ag de Argentum. Les symboles ne ont pas ??t?? suivies d'une p??riode (point) comme des abr??viations ??taient. Plus tard, les ??l??ments chimiques ont ??galement ??t?? attribu??es symboles chimiques uniques, sur la base du nom de l'??l??ment, mais pas n??cessairement en anglais. Par exemple, le sodium a le symbole chimique ??Na?? apr??s le natrium latine. La m??me chose se applique ?? "W" (wolfram) pour le tungst??ne , ??Hg?? (hydrargyrum) pour le mercure , "K" (kalium) pour le potassium , "Au" (Aurum) pour l'or , "Pb" (plumbum) pour le plomb , et ??Sb?? (stibium) pour l'antimoine .
Symboles chimiques sont compris ?? l'??chelle internationale lorsque les noms d'??l??ments peuvent avoir besoin d'??tre traduit. Il ya parfois des diff??rences; par exemple, les Allemands ont utilis?? ??J?? au lieu de ??je?? pour l'iode, de sorte que le caract??re ne serait pas ??tre confondu avec un chiffre romain .
La premi??re lettre d'un symbole chimique est toujours en majuscules, comme dans les exemples pr??c??dents, et les lettres suivantes, le cas ??ch??ant, sont toujours minuscules (petites lettres).
Symboles g??n??raux chimiques
Il ya aussi des symboles pour les s??ries d'??l??ments chimiques, pour les formules comparatifs. Ce sont une lettre majuscule en longueur, et les lettres sont r??serv??s afin qu'ils ne sont pas autoris??s ?? donner les noms des ??l??ments sp??cifiques. Par exemple, un ??X?? est utilis?? pour indiquer un groupe de variables parmi une classe de compos??s (mais le plus souvent un atome d'halog??ne ), tandis que "R" est utilis?? pour une radical, signifiant une structure composite telle qu'une cha??ne hydrocarbon??e. La lettre "Q" est r??serv?? pour des "chaleur" dans une r??action chimique. "Y" est ??galement souvent utilis?? comme un symbole chimique g??n??rale, mais il est aussi le symbole de l'yttrium . "Z" est aussi fr??quemment utilis?? comme groupe de variables g??n??ral. "L" est utilis?? pour repr??senter un g??n??rale ligand en chimie inorganique et organom??tallique. "M" est ??galement souvent utilis?? ?? la place d'un m??tal g??n??ral.
symboles isotopiques
Les trois principaux isotopes de l'??l??ment hydrog??ne sont souvent ??crites comme pour protium H, D pour deut??rium et T pour tritium. Ce est dans le but de le rendre plus facile de les utiliser dans les ??quations chimiques, car il remplace le besoin d'??crire le nombre de masse pour chaque atome. Il est ??crit comme ceci:
D 2 O ( eau lourde)
Au lieu d'??crire comme ceci:
??H 2 O
Abondance
Durant les premi??res phases de la Big Bang , nucleosynthesis de noyaux d'hydrog??ne conduit ?? la production d'hydrog??ne et d'h??lium isotopes, ainsi que des quantit??s tr??s minuscules (de l'ordre de 10 -10) de lithium et le b??ryllium. Il est l'argument de savoir si ou non certains de bore a ??t?? produit dans le Big Bang, comme cela a ??t?? observ?? dans certains tr??s jeunes ??toiles, mais aucun des ??l??ments plus lourds que le bore ont ??t?? produites. En cons??quence, l'abondance primordial d'atomes est compos??e d'environ 75% 1 H, 25% 4 He, et 0,01% deut??rium. Enrichissement ult??rieur de halos galactiques se sont produites en raison de Nucl??osynth??se stellaire et Nucl??osynth??se Supernova. Cependant l'espace intergalactique peut encore ressembler ??troitement ?? l'abondance primordiale, sauf si elle a ??t?? enrichie par certains moyens.
Le tableau suivant montre les dix ??l??ments les plus communs dans notre galaxie (estim??e par spectroscopie), tel que mesur?? en parties par million, en masse. Galaxies proches qui ont ??volu?? dans le m??me sens ont un enrichissement correspondant d'??l??ments plus lourds que l'hydrog??ne et l'h??lium. Les galaxies les plus ??loign??es sont consid??r??s comme ils sont apparus dans le pass??, de sorte que leurs abondances d'??l??ments semblent plus proches au m??lange primordiale. Comme les lois et les processus physiques apparaissent dans toute la commune univers visible , cependant, il est pr??vu que ces galaxies seront ??galement ont ??volu?? abondances d'??l??ments similaires.
| ??l??ment | Parties par million en masse |
|---|---|
| Hydrog??ne | 739000 |
| H??lium | 240000 |
| Oxyg??ne | 10700 |
| Carbone | 4600 |
| N??on | 1340 |
| Fer | 1090 |
| Azote | 970 |
| Silicium | 650 |
| Magn??sium | 580 |
| Soufre | 440 |
R??cemment d??couvert ??l??ments
La premi??re ??l??ment de transuraniens (??l??ment avec le num??ro atomique sup??rieur ?? 92) a d??couvert ??tait le neptunium en 1940. L'??l??ment le plus lourd qui a ??t?? trouv??e ?? ce jour est l'??l??ment 118, ununoctium , qui a ??t?? synth??tis?? avec succ??s le 9 Octobre 2006, par le Flerov Laboratoire de r??actions nucl??aires dans Dubna, en Russie .
Element 117, Ununseptium, n'a pas encore ??t?? cr???? ou d??couvert, bien que sa place dans le tableau p??riodique est pr????tabli, et de m??me pour les ??l??ments possibles au-del?? de 118.

