
Prom??thium
Renseignements g??n??raux
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premier ?
| Prom??thium | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
61 Pm | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
| m??tallique | ||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | promethium, Pm, 61 | |||||||||||||||||||||||||||
| Prononciation | / p r ɵ m Je θ Je ə m / pro- MEE -thee-əm | |||||||||||||||||||||||||||
| ??l??ment Cat??gorie | lanthanides | |||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 6, fa | |||||||||||||||||||||||||||
| Poids atomique standard | [145] | |||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 6s 2 5 2, 8, 18, 23, 8, 2 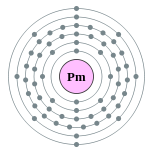 | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| D??couverte | Chien Shiung Wu, Emilio Segre Hans Bethe (1942) | |||||||||||||||||||||||||||
| Premier isolement | Charles D. Coryell, Jacob A. Marinsky, Lawrence E. Glendenin, Harold G. Richter (1945) | |||||||||||||||||||||||||||
| Nomm?? par | Gr??ce Mary Coryell (1945) | |||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 7,26 g ?? cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 1315 K , 1042 ?? C, 1908 ?? F | |||||||||||||||||||||||||||
| Point d'??bullition | 3273 K, 3000 ?? C, 5432 ?? F | |||||||||||||||||||||||||||
| La chaleur de fusion | 7,13 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Chaleur de vaporisation | 289 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||
| ??tats d'oxydation | 3 (l??g??rement oxyde de base) | |||||||||||||||||||||||||||
| ??lectron??gativit?? | ? 1,13 (??chelle de Pauling) | |||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 540 kJ ?? mol -1 | |||||||||||||||||||||||||||
| 2??me: 1050 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| 3??me: 2150 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Rayon atomique | 183 h | |||||||||||||||||||||||||||
| Rayon covalente | 199 h | |||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | |||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) est. 0,75 μΩ ?? m | |||||||||||||||||||||||||||
| Conductivit?? thermique | 17,9 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, le poly) est. 11 pm / (m ?? K) | |||||||||||||||||||||||||||
| Le module d'Young | (Α formulaire) est. 46 GPa | |||||||||||||||||||||||||||
| Module de cisaillement | (Α formulaire) est. 18 GPa | |||||||||||||||||||||||||||
| Module Bulk | (Α formulaire) est. 33 GPa | |||||||||||||||||||||||||||
| Coefficient de Poisson | (Α formulaire) est. 0,28 | |||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-12-2 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de promethium | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Promethium, ?? l'origine prom??th??um, est un ??l??ment chimique avec le symbole Pm et de num??ro atomique 61. Toutes ses isotopes sont radioactifs; il est l'un des deux seuls ??l??ments qui sont suivies dans le tableau p??riodique par des ??l??ments avec des formes stables, une distinction partag??e avec le techn??tium . Chimiquement, le prom??thium est un lanthanide , qui forme des sels en combinaison avec d'autres ??l??ments. Promethium montre un seul ??tat d'oxydation stable de 3; Cependant, quelques deux compos??s peuvent exister.
En 1902, Bohuslav Brauner a sugg??r?? qu'il y avait un ??l??ment ayant des propri??t??s interm??diaires entre celles des ??l??ments connus n??odyme (60) et le samarium (62); cela a ??t?? confirm?? en 1914 par Henry Moseley qui, apr??s avoir mesur?? les num??ros atomiques de tous les ??l??ments alors connus, conclu qu'il n'y avait aucun ??l??ment de num??ro atomique 61. En 1926, un Italien et un groupe am??ricain a affirm?? avoir isol?? un ??chantillon de l'??l??ment 61; deux ??d??couvertes?? furent bient??t r??v??l??es fausses. En 1938, lors d'une exp??rience men??e au nucl??aire Ohio State University, quelques nucl??ides radioactifs ont ??t?? produits qui ne ??taient certainement pas des radio-isotopes de n??odyme ou de samarium, mais il y avait un manque de preuve chimique de cet ??l??ment 61 a ??t?? produite, et la d??couverte a ??t?? g??n??ralement pas reconnus. Promethium a ??t?? produite et caract??ris??e au Oak Ridge National Laboratory en 1945 par la s??paration et l'analyse des produits de fission de l'uranium irradi??s dans un r??acteur ?? graphite. Les d??couvreurs ont propos?? le nom "prom??th??um" (l'orthographe a ensuite ??t?? chang??), d??riv?? de Prom??th??e, le Titan de la mythologie grecque qui a vol?? le feu de l'Olympe et l'abattit ?? l'homme, pour symboliser ???? la fois l'audace et la mauvaise utilisation possible de l'intelligence de l'humanit??." Toutefois, un ??chantillon de m??tal a ??t?? faite seulement ?? 1963.
Il ya deux sources possibles pour promethium naturelle: rares d??sint??grations de naturel europium -151 (production promethium-147), et l'uranium (divers isotopes). Les applications pratiques ne existent que pour les compos??s chimiques de prom??thium-147, qui sont utilis??s dans la peinture lumineuse, piles atomiques et des dispositifs de mesure d'??paisseur, m??me si promethium-145 est un isotope de promethium le plus stable. Depuis promethium naturelle est extr??mement rare, l'??l??ment est g??n??ralement synth??tis?? par bombardant de l'uranium-235 ( uranium enrichi) avec neutrons thermiques pour produire promethium-147.
Propri??t??s
Propri??t??s physiques
Un atome de prom??thium a 61 ??lectrons, dispos??s dans la configuration [ Xe ] 4f 5 6s 2. Dans les compos??s formant, l'atome perd ses deux ??lectrons ultrap??riph??riques et l'un des ??lectrons 4f, qui appartient ?? un sous-shell ouverte. Rayon atomique de l'??l??ment est la troisi??me plus grande parmi tous les lanthanides, mais ne est que l??g??rement sup??rieure ?? celle des ??l??ments voisins. Ce est la seule exception ?? la tendance g??n??rale de la contraction des atomes avec augmentation de rayon atomique (caus?? par la lanthanides contraction) qui ne est pas caus?? par le rempli (ou ?? moiti?? plein) 4f-sous-shell.
Beaucoup de propri??t??s de promethium comptent sur sa position parmi les lanthanides et sont interm??diaires entre celles de n??odyme et le samarium. Par exemple, le point de fusion, les trois premi??res ??nergies d'ionisation, et l'??nergie d'hydratation sont plus grandes que celles de n??odyme et inf??rieurs ?? ceux de samarium; De m??me, l'estimation pour le point d'??bullition, ionique (Pm 3+) rayon, et la chaleur de formation standard de gaz monoatomique sont sup??rieures ?? celles du samarium et moins ceux de n??odyme.
Promethium a une ?? double hexagonal emball?? (DHCP) de structure et une duret?? de 63 kg / mm 2. Cette forme alpha ?? basse temp??rature se transforme en une version b??ta, (BCC) cubique phase centr??e sur le corps lors d'un chauffage ?? 890 ?? C.
Les compos??s chimiques et les propri??t??s
Promethium appartient ?? la de c??rium groupe des lanthanides et est chimiquement tr??s similaires aux ??l??ments voisins. En raison de son instabilit??, de prom??thium ??tudes chimiques sont incompl??tes. Bien que quelques compos??s ont ??t?? synth??tis??s, ils ne sont pas compl??tement ??tudi??es; en g??n??ral, ils ont tendance ?? ??tre de couleur rose ou rouge en couleur. Traitement des solutions acides contenant des ions de Pm avec ammoniac r??sultats dans un s??diment brun clair g??latineux d'hydroxyde, Pm (OH) 3, qui est insoluble dans l'eau. Lorsqu'il est dissous dans de l'acide chlorhydrique, un sel jaune soluble dans l'eau, PMCL 3, est produit; De m??me, lorsqu'il est dissous dans l'acide nitrique, on obtient un nitrate, Pm (NO 3) 3. Ce dernier est ??galement bien soluble; lorsqu'il est s??ch??, il forme des cristaux roses, similaire ?? Nd (NO 3) 3. La configuration d'??lectrons pour Pm 3+ est [Xe] 4f 4, et la couleur de l'ion est rose. L'??tat terme symbole du sol est de 5 I 4. Le sulfate est l??g??rement soluble, comme les autres sulfates de groupe de c??rium. param??tres cellulaires ont ??t?? calcul??s pour son octahydrate; ils conduisent ?? la conclusion que la densit?? de Pm 2 (SO 4) 3 ?? 8 H 2 O est 2,86 g / cm 3. L'oxalate, Pm 2 (C 2 O 4) 3 ?? 10 H 2 O, a la solubilit?? la plus faible de toutes les oxalates de lanthanides.
Contrairement au nitrate, le oxyde est similaire au sel de samarium correspondant et non le sel de n??odyme. Tel que synth??tis??, par exemple par chauffage de l'oxalate, ce est une poudre blanche ou de couleur lavande ?? structure d??sordonn??e. Cette poudre cristallise dans un r??seau cubique lors d'un chauffage ?? 600 ?? C. En outre recuit ?? 800 ?? C, puis ?? 1750 ?? C, il se transforme de fa??on irr??versible ?? un monoclinique et phases hexagonales, respectivement, et les deux derni??res ??tapes peuvent ??tre convertis entre eux en r??glant la dur??e de recuit et la temp??rature.
| Formule | sym??trie | groupe d'espace | Aucun | Symbole de Pearson | un (h) | b (h) | c (h) | Z | la densit??, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|
| α-Pm | dhcp | P6 3 / mmc | 194 | HP4 | 365 | 365 | 1165 | 4 | 7,26 |
| β-Pm | bcc | Fm 3 m | 225 | cF4 | 410 | 410 | 410 | 4 | 6,99 |
| Pm 2 O 3 | cubique | Ia 3 | 206 | cI80 | 1099 | 1099 | 1099 | 16 | 6,77 |
| Pm 2 O 3 | monoclinique | C2 / m | 12 | MS30 | 1422 | 365 | 891 | 6 | 7,40 |
| Pm 2 O 3 | hexagonal | P 3 m1 | 164 | HP5 | 380,2 | 380,2 | 595,4 | 1 | 7,53 |
Formes Promethium seule d'Etat d'oxydation stable, 3, sous la forme d'ions; ce est en ligne avec d'autres lanthanides. Selon sa position dans le tableau p??riodique , l'??l??ment ne peut pas se attendre ?? former quatre stable ou deux ??tats d'oxydation; agents de traitement des compos??s chimiques contenant des ions PM avec une forte oxydante ou r??ductrice ont montr?? que l'ion ne est pas facilement oxyd?? ou r??duit.
| Formule | couleur | coordination nombre | sym??trie | groupe d'espace | Aucun | Symbole de Pearson | mp (?? C) |
|---|---|---|---|---|---|---|---|
| CMR 3 | Rose pourpre | 11 | hexagonal | 3 P c1 | 165 | hP24 | 1338 |
| PMCL 3 | Lavande | 9 | hexagonal | P6 3 / mc | 176 | HP8 | 655 |
| PMBR 3 | Rouge | 8 | orthorhombique | Cmcm | 63 | oS16 | 624 |
| α-PMI 3 | Rouge | 8 | orthorhombique | Cmcm | 63 | oS16 | α → β |
| β-PMI 3 | Rouge | 6 | rhombo??drique | R 3 | 148 | HR24 | 695 |
Isotopes
Promethium est le seul lanthanides et un des deux seuls ??l??ments parmi les 82 premi??res qui n'a pas stable (ou m??me ?? long terme) isotopes; ce est le r??sultat d'une effet de la survenant rarement mod??le de goutte de liquide et de stabilit??s des isotopes de l'??l??ment voisin; il est ??galement l'??l??ment le moins stable de la premi??re 84. Les produits de d??sint??gration primaires sont n??odyme et samarium isotopes (promethium-146 se d??sint??gre en deux, les isotopes g??n??ralement ?? n??odyme l??gers via la d??sint??gration de positons et capture d'??lectrons, et les isotopes plus lourds ?? samarium par d??sint??gration b??ta). Prom??thium isom??res nucl??aires peuvent se d??composer ?? d'autres isotopes de Promethium et un isotope (145 Pm) dispose d'un mode de d??sint??gration alpha tr??s rare de pras??odyme .
L'isotope le plus stable de l'??l??ment est prom??thium-145, qui a une activit?? sp??cifique de 940 Ci (35 TBq) / g et une demi-vie de 17,7 ann??es par capture d'??lectrons. Parce qu'il a 84 neutrons (deux de plus que 82, qui est un nombre magique qui correspond ?? une configuration stable de neutrons), il peut ??mettre un particule alpha (qui a deux neutrons) pour former le pras??odyme-141 avec 82 neutrons. Ainsi, il est le seul isotope de prom??thium avec un observ?? exp??rimentalement d??sint??gration alpha. Son demi-vie partielle pour la d??sint??gration alpha est d'environ 6,3 ?? 10 9 ann??es, et la probabilit?? relative pour un noyau de 145 Pm ?? la pourriture de cette mani??re est de 2,8 ?? 10 -7%. Plusieurs autres Pm isotopes (144 Pm, 146 Pm, 147 Pm etc.) ont aussi une lib??ration d'??nergie positive pour la d??sint??gration alpha; leurs d??sint??grations alpha sont pr??vus pour se produire, mais ne ont pas ??t?? observ??es.
L'??l??ment 18 comporte ??galement des isom??res nucl??aires, avec les nombres de masse de 133 ?? 142, 144, 148, 149, 152, et 154 (certains nombres de masse ont plus d'un isom??re). La plupart d'entre eux est stable prom??thium-148m, avec une demi-vie de 43,1 jours; ce est plus que la demi-vie des ??tats fondamentaux de tous les isotopes de Promethium, sauf que pour le prom??thium-143-147 (?? noter que le prom??thium-148m a une demi-vie plus longue que l'??tat du sol, le prom??thium-148).
Occurrence

En 1934, Willard Libby trouv?? une faible activit?? b??ta dans n??odyme pur, qui a ??t?? attribu??e ?? une demi-vie de plus de 10 12 ans. Pr??s de 20 ans plus tard, il a ??t?? affirm?? que l'??l??ment se produit dans n??odyme naturelle en ??quilibre dans des quantit??s inf??rieures ?? 10 -20 grammes de promethium par un gramme de n??odyme. Cependant, ces observations ont ??t?? r??fut??es par des enqu??tes r??centes, parce que pour les sept isotopes naturels de n??odyme, des d??sint??grations b??ta simples (qui peut produire des nucl??ides Promethium) sont interdites par la conservation de l'??nergie. En particulier, des mesures pr??cises de masses atomiques montrent que la diff??rence de masse 150 Nd 150 Pm est n??gatif (-87 keV), qui emp??che absolument la d??sint??gration b??ta unique de 150 Nd ?? 150 Pm.
Les deux isotopes de l'europium naturelle ont de plus grandes exc??s de masse que des sommes de ceux de leurs filles alpha potentiels ainsi que d'une particule alpha; par cons??quent, ils (stable dans la pratique) peuvent d??sint??gration alpha. Recherche ?? Laboratoire National del Gran Sasso a montr?? que l'europium-151 se d??sint??gre exp??rimentalement promethium-147 avec la demi-vie de 5 ?? 10 18 ans. Il a ??t?? montr?? que l'europium est ??responsable?? pour environ 12 grammes de promethium dans la cro??te de la Terre. Alpha se d??sint??gre pour l'europium-153 ne ont pas encore ??t?? trouv??, et sa demi-vie calcul??e th??oriquement est si ??lev?? (en raison de faible ??nergie de d??croissance) que ce processus ne sera probablement jamais observ??e.
Enfin, le prom??thium peut ??tre form??e dans la nature en tant que produit de fission spontan??e de l'uranium-238. Seules des traces peuvent ??tre trouv??s dans les minerais naturels: un ??chantillon de pechblende a ??t?? trouv?? pour contenir promethium ?? une concentration de quatre parties par trillion (10 18) en masse. Uranium est donc ??responsable?? de 560 g promethium dans la cro??te terrestre .
Prom??thium a ??galement ??t?? identifi?? dans le spectre de l'??toile HR 465 en Andromeda; il a ??galement ??t?? trouv?? dans HD 101065 ( L'??toile de Przybylski) et HD 965. En raison de la courte demi-vie des isotopes de Promethium, ils devraient ??tre form??s pr??s de la surface de ces ??toiles.
Histoire
Recherches pour ??l??ment 61
En 1902, le chimiste tch??que Bohuslav Brauner a d??couvert que la diff??rence entre le n??odyme et le samarium est le plus grand de tous les lanthanides paires voisines; en guise de conclusion, il a sugg??r?? qu'il y avait un ??l??ment avec des propri??t??s interm??diaires entre eux. Cette pr??diction a ??t?? soutenue en 1914 par Henry Moseley qui, apr??s avoir d??couvert que le num??ro atomique est un bien exp??rimentalement mesurables d'??l??ments, trouv?? quelques num??ros atomiques avaient aucun ??l??ment pour correspondre: les lacunes ??taient 43, 61, 72, 75, 85 et 87. Avec la connaissance d'un ??cart dans le tableau p??riodique plusieurs groupes ont commenc?? ?? rechercher l'??l??ment pr??dit entre autres terres rares dans le milieu naturel.
La premi??re demande d'une d??couverte a ??t?? publi??e par Luigi Rolla et Lorenzo Fernandes Florence, Italie. Apr??s la s??paration d'un m??lange de quelques-uns des ??l??ments de terre rare nitrate concentr?? du Br??sil min??ral monazite par cristallisation fractionn??e, ils donn?? une solution contenant essentiellement du samarium. Cette solution a donn?? spectres x-ray attribu?? au samarium et l'??l??ment 61. En l'honneur de leur ville, qu'ils nomm??rent ??l??ment 61 "florentium." Les r??sultats ont ??t?? publi??s en 1926, mais les scientifiques ont affirm?? que les exp??riences ont ??t?? r??alis??es en 1924. Toujours en 1926, un groupe de scientifiques de la Universit?? de l'Illinois ?? Urbana-Champaign, Smith Hopkins et Len Yntema publi?? la d??couverte de l'??l??ment 61. Ils l'ont appel?? "illinium," apr??s l'universit??. Ces deux d??couvertes rapport??s se sont r??v??l??s ??tre erron??e parce que la ligne de spectre qui "correspond" ?? l'??l??ment 61 ??tait identique ?? celle de didymium; les lignes suppos??s appartenir ?? l'??l??ment 61 se est av??r?? appartenir ?? quelques impuret??s (baryum, le chrome et platine).
En 1934, Josef Mattauch enfin formul?? le isobar r??gle. L'une des cons??quences indirectes de cette r??gle ??tait ??tait cet ??l??ment 61 ??tait incapable de former des isotopes stables. En 1938, une exp??rience nucl??aire a ??t?? men??e par HB Law et al. Au Ohio State University. Les nucl??ides produits ??taient certainement pas des radio-isotopes de n??odyme ou de samarium, et le nom "cyclonium" a ??t?? propos??, mais il y avait un manque de preuve chimique de cet ??l??ment 61 a ??t?? produit et la d??couverte pas largement reconnu.
D??couverte et synth??se de promethium m??tal
Promethium a ??t?? produite et caract??ris??e au Oak Ridge National Laboratory (Laboratoires Clinton ?? l'??poque) en 1945 par Jacob A. Marinsky, Lawrence E. Glendenin et Charles D. Coryell par la s??paration et l'analyse des produits de fission de l'uranium combustible irradi?? dans le r??acteur de graphite; Toutefois, ??tant trop occup?? ?? la recherche li??e ?? l'arm??e lors de la Seconde Guerre mondiale , ils ne ont pas annonc?? leur d??couverte jusqu'en 1947. Le nom initial propos?? ??tait "clintonium", apr??s le laboratoire o?? le travail a ??t?? effectu??; Toutefois, le nom "prom??th??um" a ??t?? sugg??r?? par Grace Mary Coryell, l'??pouse de l'un des d??couvreurs. Il est d??riv?? de Prom??th??e, le Titan de la mythologie grecque qui a vol?? le feu de l'Olympe et l'abattit ?? l'homme et symbolise "?? la fois l'audace et la mauvaise utilisation possible de l'intelligence de l'humanit??." L'orthographe a ensuite ??t?? chang?? en "promethium," car ce ??tait plus pr??s en conformit?? avec d'autres m??taux.

Jacob A. Marinsky

Lawrence E. Glendenin

Charles D. Coryell
En 1963, le prom??thium (III) fluorure a ??t?? utilis?? pour faire promethium m??tal. Provisoirement purifi?? des impuret??s de samarium, le n??odyme, et de l'am??ricium, il a ??t?? mis dans un tantale creuset qui ??tait situ?? dans un autre creuset de tantale; le creuset ext??rieur contient m??tal lithium (10 fois en exc??s par rapport ?? prom??thium). Apr??s avoir cr???? un vide, les produits chimiques ont ??t?? m??lang??s pour produire un m??tal prom??thium:
- CMR 3 + 3 Li → Pm + 3 LiF
L'??chantillon de promethium produit a ??t?? utilis?? pour mesurer quelques-unes des propri??t??s du m??tal, telles que son point de fusion .
En 1963, des proc??d??s d'??change d'ions ont ??t?? utilis??s pour pr??parer ORNL ?? environ dix grammes de prom??thium d??chets de r??acteurs nucl??aires de traitement de combustible.
Aujourd'hui, le prom??thium est toujours r??cup??r?? ?? partir des sous-produits de fission de l'uranium; il peut ??galement ??tre obtenu en bombardant 146 Nd avec des neutrons , le transformant en 147 Nd qui se d??sint??gre en 147 Pm par d??sint??gration b??ta avec une demi-vie de 11 jours.
Production
Les m??thodes de production des diff??rents isotopes varient, et que seulement pour le prom??thium-147 est donn??e car il est le seul isotope avec les applications industrielles. Prom??thium-147 est produit en grandes quantit??s (par rapport ?? d'autres isotopes) en bombardant l'uranium-235 avec des neutrons thermiques. La sortie est relativement ??lev??e, ?? 2,6% du produit total. Une autre fa??on de produire le prom??thium-147 se fait via le n??odyme-147, qui se d??sint??gre ?? prom??thium-147, avec une demi-vie courte. N??odyme-147 peut ??tre obtenu soit en bombardant n??odyme-146 avec enrichi neutrons thermiques ou en bombardant une uranium cible de carbure de protons ??nerg??tiques dans un acc??l??rateur de particules. Une autre m??thode consiste ?? bombarder l'uranium-238 avec neutrons rapides pour provoquer fission rapide, qui, entre plusieurs produits de r??action, cr??e promethium-147.
D??s les ann??es 1960, Oak Ridge National Laboratory pourrait produire 650 grammes de promethium par an et ??tait seule installation de synth??se de grande volume du monde. La production Gram-??chelle de prom??thium a ??t?? abandonn??e aux ??tats-Unis au d??but des ann??es 1980, mais sera peut-??tre repris apr??s 2010 ?? la High Flux Isotope Reactor. Actuellement, la Russie est le seul pays producteur promethium-147 sur une ??chelle relativement grande.
Applications
La plupart promethium est utilis?? uniquement ?? des fins de recherche, sauf pour promethium-147, qui se trouve en dehors des laboratoires. Il est obtenu sous forme d'oxyde ou de chlorure, dans les quantit??s en milligrammes. Cet isotope ne ??met pas les rayons gamma, et son rayonnement a une relativement faible profondeur de p??n??tration dans la mati??re et une demi-vie relativement longue.
Certains feux de signalisation utilisent un peinture lumineuse, contenant un luminophore qui absorbe le rayonnement b??ta ??mis par le prom??thium-147 et ??met de la lumi??re. Cet isotope ne provoque pas de vieillissement de la substance luminescente, comme le font les ??metteurs alpha, et par cons??quent l'??mission de lumi??re est stable pendant quelques ann??es. ?? l'origine, le radium -226 a ??t?? utilis?? ?? cette fin, mais il a ensuite ??t?? remplac?? par le prom??thium-147 et tritium (hydrog??ne-3). Promethium peut ??tre favoris??e par rapport tritium des raisons de s??curit??.
En piles atomiques, les particules b??ta ??mises par le prom??thium-147 sont convertis en courant ??lectrique en prenant en sandwich une petite source Pm entre deux plaques de semi-conducteurs. Ces batteries ont une dur??e de vie utile d'environ cinq ans. La batterie ?? base de prom??thium premi??re a ??t?? assembl?? en 1964 et a g??n??r?? "quelques milliwatts de puissance ?? partir d'un volume d'environ 2 pouces cubes, y compris blindage".
Prom??thium est ??galement utilis?? pour mesurer l'??paisseur de mat??riaux en ??valuant la quantit?? de rayonnement d'une source de prom??thium qui passe ?? travers l'??chantillon. Il a utilisations futures possibles de sources de rayons X portables, et comme sources de chaleur ou de puissance auxiliaires pour les sondes spatiales et les satellites (bien que l'??metteur alpha plutonium 238 est devenu un standard pour la plupart des utilisations li??es ?? l'espace-exploration).
Pr??cautions
L'??l??ment, comme les autres lanthanides, ne joue aucun r??le biologique. Promethium-147 peut ??mettre rayons X lors de sa d??sint??gration b??ta, qui sont dangereux pour toute forme de vie. Interactions avec d'infimes quantit??s de promethium-147 ne sont pas dangereux si certaines pr??cautions sont prises. En g??n??ral, gants, couvertures de chaussures, des lunettes de s??curit??, et une couche ext??rieure de v??tements de protection facilement enlev?? devrait ??tre utilis??.
On ne sait pas ce que les organes humains sont touch??s par interaction avec promethium; un candidat possible est le tissus osseux. Sealed promethium-147 ne est pas dangereux. Cependant, si l'emballage est endommag??, puis promethium devient dangereux pour l'environnement et les humains. Si la contamination radioactive est trouv??e, la zone contamin??e doit ??tre lav??e avec de l'eau et du savon, mais, m??me si promethium affecte principalement la peau, la peau ne doit pas ??tre abras??e. Si une fuite de prom??thium est trouv??e, la zone doit ??tre identifi?? comme dangereux et ??vacu??, et les services d'urgence doit ??tre contact??. Aucun danger de promethium de c??t?? de la radioactivit?? sont connus.
