
Actinium
Saviez-vous ...
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. parrainage SOS enfant est cool!
| Actinium | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
89 Ac | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
| blanc argent?? | ||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | actinium, Ac, 89 | |||||||||||||||||||||||||||||||||
| Prononciation | / ?? k t ɪ n Je ə m / TIN ak- -neE-əm | |||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | actinides parfois consid??r?? comme un m??tal de transition | |||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||
| Poids atomique standard | (227) | |||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Rn ] 6d 1 7s 2 2, 8, 18, 32, 18, 9, 2 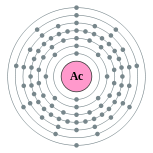 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| D??couverte | Andr??-Louis Debierne (1899) | |||||||||||||||||||||||||||||||||
| Premier isolement | Andr??-Louis Debierne (1899) | |||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 10 g ?? cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | (Circa) 1323 K , 1050 ?? C, 1922 ?? F | |||||||||||||||||||||||||||||||||
| Point d'??bullition | 3471 K, 3198 ?? C, 5788 ?? F | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 14 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 400 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 27,2 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3 (Oxyde neutre) | |||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,1 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 499 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| 2??me: 1170 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon covalente | 215 h | |||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | |||||||||||||||||||||||||||||||||
| Ordre magn??tique | pas de donn??es | |||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 12 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-34-8 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'actinium | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Actinium est un radioactifs ??l??ment chimique avec le symbole Ac (?? ne pas confondre avec l'abr??viation pour un un groupe ac??tyle) et a le num??ro atomique 89, qui a ??t?? d??couvert en 1899. Ce ??tait la premi??re ??l??ment radioactif non-primordiale ?? ??tre isol??. polonium , le radium et le radon ont ??t?? observ??es avant l'actinium, mais ils ne ont pas ??t?? isol?? jusqu'en 1902. Actinium a donn?? le nom ?? la actinides s??rie, un groupe de 15 ??l??ments similaires entre l'actinium et lawrencium dans le tableau p??riodique .
Un blanc-argent??, mou m??tal radioactif, l'actinium r??agit rapidement avec de l'oxyg??ne et de l'humidit?? dans l'air formant un rev??tement blanc d'oxyde d'actinium qui emp??che l'oxydation. Comme avec la plupart des lanthanides et des actinides, l'actinium assume ??tat d'oxydation 3 dans presque tous ses compos??s chimiques. Actinium se trouve uniquement dans les traces en uranium des minerais que l' isotope 227 Ac, qui se d??sint??gre avec une demi-vie de 21,772 ann??es, ??mettant principalement particules b??ta. Une tonne de l'uranium minerai contient environ 0,2 milligrammes de l'actinium. La similitude des propri??t??s physiques et chimiques de l'actinium et le lanthane rend la s??paration de l'actinium du minerai impraticable. Au lieu de cela, l'??l??ment est dispos??, en milligrammes, par l'irradiation neutronique de 226 Ra dans une r??acteur nucl??aire. En raison de sa raret??, prix ??lev?? et la radioactivit??, l'actinium n'a pas d'utilisation industrielle importante. Ses applications actuelles comprennent une source de neutrons et d'un agent de la radioth??rapie ciblant les cellules canc??reuses dans le corps.
Histoire
Andr??-Louis Debierne, un chimiste fran??ais, a annonc?? la d??couverte d'un nouvel ??l??ment en 1899. Il se est s??par?? ?? partir de r??sidus de pechblende laiss??s par Marie et Pierre Curie apr??s avoir extrait le radium . En 1899, Debierne d??crit la substance comme ??tant semblable ?? du titane et (en 1900) comme semblable ?? du thorium . Friedrich Oskar Giesel ind??pendamment d??couvert l'actinium en 1902 comme une substance ??tant semblable ?? de lanthane et l'a appel?? "emanium" en 1904. Apr??s une comparaison des substances demi-vies d??termin??es par Debierne, Hariett Brooks en 1904, et Otto Hahn et Otto Sackur en 1905, le nom choisi par Debierne pour le nouvel ??l??ment a ??t?? retenu parce qu'il avait anciennet??.
Les articles publi??s dans les ann??es 1970 et plus tard sugg??rent que les r??sultats de Debierne publi??s en 1904 conflit avec ceux rapport??s en 1899 et 1900. Cela a conduit certains auteurs ?? pr??coniser que Giesel seul devrait ??tre cr??dit?? de la d??couverte. Une vision moins conflictuelle de la d??couverte scientifique est propos?? par Adloff Il sugg??re que le recul critique des premi??res publications devrait ??tre att??nu?? par l'??tat naissant de radiochimie, souligne la prudence des cr??ances des Debierne dans les documents originaux, et note que personne ne peut pr??tendre que la substance de Debierne ne contenait pas l'actinium. Debierne, qui est maintenant consid??r?? par la grande majorit?? des historiens comme le d??couvreur, a perdu tout int??r??t dans l'??l??ment et a quitt?? le sujet. Giesel, d'autre part, peut l??gitimement ??tre cr??dit?? de la premi??re pr??paration de l'actinium radiochimiquement pure et ?? l'identification de son num??ro atomique 89.
Le nom provient de l'actinium grecque antique aktis, aktinos (ακτίς, ακτίνος), ce qui signifie poutre ou rayons. Son symbole Ac est ??galement utilis?? dans les abr??viations d'autres compos??s qui ne ont rien ?? voir avec l'actinium, comme ac??tyle, ac??tate et parfois l'ac??tald??hyde.
Propri??t??s
Actinium est un blanc-argent??, mou, radioactif, ??l??ment m??tallique. Son estim??e le module de cisaillement est similaire ?? celle de plomb . En raison de sa forte radioactivit??, l'actinium brille dans le noir avec une lumi??re bleu p??le, qui provient de l'air environnant ionis?? par les particules ??nerg??tiques ??mises. Actinium a des propri??t??s chimiques similaires comme le lanthane et les autres lanthanides, et donc ces ??l??ments sont difficiles ?? s??parer lors de l'extraction de minerais d'uranium. Extraction par solvant et Chromatographie d'ions sont couramment utilis??s pour la s??paration.
Le premier ??l??ment des actinides , l'actinium a donn?? son nom au groupe, autant que le lanthane avait fait pour les lanthanides . Le groupe d'??l??ments est plus diversifi??e que les lanthanides et donc ce ne est qu'en 1945 que Glenn T. Seaborg a propos?? le changement le plus important ?? Mendele??ev s ' tableau p??riodique , en introduisant les actinides.
Actinium r??agit rapidement avec de l'oxyg??ne et de l'humidit?? dans l'air formant un rev??tement blanc d'oxyde d'actinium qui emp??che l'oxydation. Comme avec la plupart des lanthanides et des actinides, l'actinium existe dans le degr?? d'oxydation +3, et les ions sont Ac 3+ dans des solutions incolores. L'??tat d'oxydation 3 provient du 6d 1 7s 2 configuration ??lectronique de l'actinium, ce est qu'il fait un don de 3 ??lectrons facilement en supposant une structure de la coque ferm??e stable gaz noble radon . L'??tat d'oxydation 2 ne est connu pour l'actinium dihydrure (ACH 2).
Les compos??s chimiques
Seul un nombre limit?? de compos??s actinium sont connus y compris AcF 3, AcCl 3, ACBR 3, ACOF, AcOCl, AcOBr, Ac 2 S 3, Ac 2 O 3 et 4 ACPO. Sauf pour ACPO 4, ils sont tous similaires aux compos??s de lanthane correspondant et contiennent l'actinium dans l'??tat d'oxydation +3. En particulier, les constantes de r??seau de lanthane et les compos??s analogues actinium diff??rent par seulement quelques pour cent.
| Formule | couleur | sym??trie | groupe d'espace | Aucun | Symbole de Pearson | un (h) | b (h) | c (h) | Z | la densit??, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Un C | argent?? | fcc | Fm 3 m | 225 | cF4 | 531,1 | 531,1 | 531,1 | 4 | 10,07 |
| AcH 2 | cubique | Fm 3 m | 225 | CF12 | 567 | 567 | 567 | 4 | 8,35 | |
| Ac 2 O 3 | blanc | trigone | P 3 m1 | 164 | HP5 | 408 | 408 | 630 | 1 | 9,18 |
| Ac 2 S 3 | cubique | I 4 3d | 220 | CI28 | 778,56 | 778,56 | 778,56 | 4 | 6,71 | |
| AcF 3 | blanc | hexagonal | 3 P c1 | 165 | hP24 | 741 | 741 | 755 | 6 | 7,88 |
| AcCl 3 | hexagonal | P6 3 / m | 165 | HP8 | 764 | 764 | 456 | 2 | 4,8 | |
| ACBR 3 | blanc | hexagonal | P6 3 / m | 165 | HP8 | 764 | 764 | 456 | 2 | 5,85 |
| ACOF | blanc | cubique | Fm 3 m | 593,1 | 8,28 | |||||
| AcOCl | quadrilat??re | 424 | 424 | 707 | 7,23 | |||||
| AcOBr | quadrilat??re | 427 | 427 | 740 | 7,89 | |||||
| ACPO 4 ?? 0,5H 2 O | hexagonal | 721 | 721 | 664 | 5,48 |
Ici, a, b et c sont des constantes r??ticulaires, n est le num??ro de groupe spatial et Z est le nombre de des unit??s de formule par cellule unitaire. La densit?? a ??t?? mesur??e directement, mais pas calcul?? ?? partir des param??tres de maille.
Oxydes
l'oxyde d'actinium (Ac 2 O 3) peut ??tre obtenu par chauffage de l'hydroxyde ?? 500 ?? C ou la oxalate ?? 1100 ?? C, sous vide. Ce r??seau cristallin est isotypique avec les oxydes de la plupart des m??taux de terres rares trivalents.
Halog??nures
Actinium trifluorure peut ??tre produit soit en solution ou en r??action solide. La premi??re r??action est effectu??e ?? temp??rature ambiante, en ajoutant de l'acide fluorhydrique ?? une solution contenant des ions actinium. Dans ce dernier proc??d??, l'actinium m??tal est trait?? avec des vapeurs de fluorure d'hydrog??ne ?? 700 ?? C dans une configuration tout-platine. Traiter l'actinium avec trifluorure hydroxyde d'ammonium au 900-1000 rendements ?? C oxyfluorure ACOF. Consid??rant que oxyfluorure lanthane peut ??tre facilement obtenue par la combustion de trifluorure de lanthane dans l'air ?? 800 ?? C pendant une heure, un traitement similaire de l'actinium trifluorure rendements ne ACOF et seuls r??sultats en fusion du produit initial.
- AcF 3 + 2 NH 3 + H 2 O → ACOF + 2 NH 4 F
Actinium trichlorure est obtenu par r??action de l'hydroxyde de actinium ou oxalate de t??trachlorure de carbone vapeurs ?? des temp??ratures sup??rieures ?? 960 ?? C. Similaire ?? oxyfluorure, l'actinium oxychlorure peuvent ??tre pr??par??s par hydrolyse du trichlorure de actinium avec l'hydroxyde d'ammonium ?? 1000 ?? C. Cependant, contrairement ?? l'oxyfluorure, l'oxychlorure pourrait bien ??tre synth??tis?? par allumage d'une solution de trichlorure actinium dans de l'acide chlorhydrique avec de l'ammoniac .
La r??action de le bromure d'aluminium et l'oxyde d'actinium rendements actinium tribromure:
- Ac 2 O 3 + 2 → 3 AlBr domaine de la RCA 2 3 + Al 2 O 3
et le traitement avec de l'hydroxyde d'ammonium ?? 500 ?? C entra??ne l'oxybromure de AcOBr.
D'autres compos??s
Actinium hydrure a ??t?? obtenu par r??duction de l'actinium trichlorure de potassium ?? 300 ?? C, et sa structure a ??t?? d??duit par analogie avec l'hydrure correspondant LaH 2. La source d'hydrog??ne dans la r??action ne est pas certain.
M??lange le phosphate monosodique (NaH 2 PO 4) avec une solution d'actinium des rendements d'acide chlorhydrique de couleur blanche phosphate de actinium h??mihydrate (ACPO 4 ?? 0,5H 2 O), et le chauffage de l'oxalate de actinium Le sulfure d'hydrog??ne vapeurs ?? 1400 ?? C pendant quelques minutes en r??sulte une actinium sulfure noir Ac 2 S 3. Il peut ??ventuellement ??tre r??alis?? en agissant avec un m??lange de le sulfure d'hydrog??ne et le disulfure de carbone sur oxyde d'actinium ?? 1000 ?? C.
Isotopes
Naturellement actinium se produisant est compos?? d'une radioactif isotope ; 227 Ac. Trente-six radio-isotopes ont ??t?? identifi??s, le plus stable ??tant 227 Ac avec une demi-vie de 21,772 ann??es, 225 Ac avec une demi-vie de 10,0 jours et 226 Ac avec une demi-vie de 29,37 heures. Tout en restant isotopes radioactifs ont des demi-vies qui sont moins de 10 heures et la majorit?? d'entre eux ont des demi-vies de moins d'une minute. L'isotope connu la plus courte dur??e de l'actinium 217 est Ac (demi-vie de 69 nanosecondes) qui se d??sint??gre par d??sint??gration alpha et capture d'??lectrons. Actinium dispose ??galement de deux m??ta-Unis.
Purifi??e 227 Ac vient en ??quilibre avec ses produits de d??sint??gration ?? la fin de 185 jours. Il se d??sint??gre en fonction de sa demi-vie 21,773 ans ??mettant principalement b??ta (98,8%) et des particules alpha (1,2%); les produits de d??sint??gration successives font partie de la s??rie de l'actinium. En raison des faibles quantit??s disponibles, une faible ??nergie de ses particules b??ta (46 keV) et une faible intensit?? de rayonnement alpha, 227 Ac est difficile ?? d??tecter directement par son ??mission et il est donc trac??e par ses produits de d??sint??gration. Les isotopes de l'actinium varient en poids atomique ?? partir de 206 u (206 Ac) ?? 236 u (236 Ac).
| Isotope | Production | Pourriture | Demi-vie |
|---|---|---|---|
| 221 Ac | 232 Th (d, 9n) 225 Pa (α) → 221 Ac | α | 52 ms |
| 222 Ac | 232 Th (d, 8n) 226 Pa (α) → 222 Ac | α | 5,0 s |
| 223 Ac | 232 Th (d, 7n) 227 Pa (α) → 223 Ac | α | 2,1 min |
| 224 Ac | 232 Th (d, 6n) 228 Pa (α) → 224 Ac | α | 2,78 heures |
| 225 Ac | 232 Th (n, γ) 233 Th (β -) → 233 Pa (β -) → 233 U (α) → 229 Th (α) → 225 Ra (β -) 225 Ac | α | 10 jours |
| 226 Ac | 226 Ra (d, 2n) 226 Ac | α, β - capture d'??lectrons | 29,37 heures |
| 227 Ac | 235 U (α) → 231 Th (β -) → 231 Pa (α) → 227 Ac | α, β - | 21,77 ann??es |
| 228 Ac | 232 Th (α) → 228 Ra (β -) → 228 Ac | β - | 6,15 heures |
| 229 Ac | 228 Ra (n, γ) 229 Ra (β -) → 229 Ac | β - | 62,7 min |
| 230 Ac | 232 Th (d, α) 230 Ac | β - | 122 s |
| 231 Ac | 232 Th (γ, p) 231 Ac | β - | 7,5 min |
| 232 Ac | 232 Th (n, p) Ac 232 | β - | 119 s |
Pr??sence et de synth??se

Actinium se trouve uniquement dans les traces en uranium des minerais que 227 Ac - une tonne de minerai contient environ 0,2 milligrammes de l'actinium. L'actinium isotope 227 Ac est un membre de la transitoire s??rie de l'actinium cha??ne de d??sint??gration, qui commence avec l'isotope parent 235 U (ou 239 Pu) et se termine par l'isotope de plomb stable 207 Pb. Un autre isotope actinium (225 Ac) est pr??sent dans le transitoire s??rie neptunium cha??ne de d??sint??gration, commen??ant par 237 Np (ou 233 U) et se terminant par le thallium (Tl 205) et la quasi-stable de bismuth (Bi 209).
La concentration naturelle faible, et la similitude des propri??t??s physiques et chimiques ?? ceux de lanthane et d'autres lanthanides, qui sont toujours abondantes dans les minerais actinium porteurs, rendent la s??paration de l'actinium du minerai impraticable, et la s??paration compl??te n'a jamais ??t?? atteint. Au lieu de cela, l'actinium est pr??par??, en milligrammes, par l'irradiation neutronique de 226 Ra dans une r??acteur nucl??aire.
Le rendement de la r??action est d'environ 2% du poids du radium. Ac 227 peut en outre saisir neutrons r??sultant en de faibles quantit??s de 228 Ac. Apr??s la synth??se, l'actinium est s??par?? du radium et des produits de d??gradation et la fusion nucl??aire, tels que le thorium, le polonium, le plomb et le bismuth. L'extraction peut ??tre r??alis??e avec thenoyltrifluoroacetone- benz??ne solution ?? partir d'une solution aqueuse des produits de rayonnement, et la s??lectivit?? pour un certain ??l??ment est r??alis?? en ajustant la pH (?? environ 6.0 pour l'actinium). Une proc??dure alternative est ??changeuse d'anions avec un appropri?? r??sine dans de l'acide nitrique , ce qui peut se traduire par un facteur de s??paration pour un million de radium et le thorium actinium par rapport ?? un proc??d?? en deux ??tapes. Actinium peut ensuite ??tre s??par?? du radium, avec un rapport d'environ 100, en utilisant une r??sine ??changeuse de cations faible reticulation et de l'acide nitrique en tant que ??luant.
225 Ac a ??t?? produit artificiellement ?? la Institut des transuraniens (ITU) en Allemagne en utilisant un cyclotron et au H??pital St George ?? Sydney en utilisant un Linac en 2000. Cet isotope rare a des applications potentielles dans la radioth??rapie et la plus efficace est obtenu en bombardant une cible de radium-226 avec 20 ?? 30 MeV ions deut??rium. Cette r??action produit ??galement 226 Ac qui d??cro??t cependant avec une demi-vie de 29 heures et par cons??quent, ne pas contaminer 225 Ac.
Actinium m??tal a ??t?? pr??par?? par la r??duction du fluorure d'actinium avec le lithium en phase vapeur sous vide ?? une temp??rature comprise entre 1100 et 1300 ?? C. Des temp??ratures plus ??lev??es conduit ?? l'??vaporation du produit et celles inf??rieures conduisent ?? une transformation incompl??te. Lithium a ??t?? choisi parmi d'autres m??taux alcalins parce que son fluorure est plus volatile.
Applications
En raison de sa raret??, prix ??lev?? et la radioactivit??, l'actinium a actuellement aucune utilisation industrielle importante.
227 Ac est fortement radioactif et a donc ??t?? ??tudi?? pour ??tre utilis?? comme un ??l??ment actif de g??n??rateurs thermo??lectriques radio-isotopes, par exemple dans les vaisseaux spatiaux. L'oxyde de 227 Ac press?? avec le b??ryllium est ??galement un moyen efficace source de neutrons ?? l'activit?? sup??rieure ?? celle des paires de l'am??ricium-b??ryllium et du radium-b??ryllium standard. Dans toutes ces applications, 227 Ac (une source de b??ta) est simplement un anc??tre qui g??n??re isotopes ??metteurs alpha de sa d??sint??gration. Le b??ryllium retient les particules alpha et ??met des neutrons en raison de sa grande section efficace de la r??action nucl??aire (α, n):
Les sources de neutrons 227 ACBE peuvent ??tre appliqu??s dans un sonde ?? neutrons - un dispositif standard pour mesurer la quantit?? d'eau pr??sente dans le sol, ainsi que l'humidit?? / densit?? pour contr??le de la qualit?? dans la construction de l'autoroute. Ces sondes sont ??galement utilis??s dans des applications d'enregistrement et, dans radiographie neutronique, la tomographie et d'autres enqu??tes radiochimique.

225 Ac est appliqu?? en m??decine pour produire 213 Bi dans un g??n??rateur r??utilisable ou peut ??tre utilis?? seul comme agent de la radioth??rapie, en particulier la th??rapie cibl??e alpha (TAT). Cet isotope a une demi-vie de 10 jours qui rend beaucoup plus appropri?? pour la th??rapie par rayonnement de 213 Bi (demi-vie de 46 minutes). Non seulement 225 Ac elle-m??me, mais aussi ses produits de d??sint??gration ??mettent des particules alpha qui tuent les cellules canc??reuses dans le corps. La difficult?? majeure avec application de 225 Ac est que l'injection intraveineuse de complexes d'actinium simples conduit ?? leur accumulation dans les os et le foie pendant une p??riode de plusieurs dizaines d'ann??es. Par cons??quent, apr??s que les cellules canc??reuses ont ??t?? rapidement tu??es par des particules alpha ?? partir de 225 Ac, le rayonnement provenant de la actinium et ses produits de d??sint??gration peuvent induire de nouvelles mutations. Pour r??soudre ce probl??me, 225 Ac a ??t?? li?? ?? un agent ch??latant, tel que citrate, l'acide ??thyl??nediaminet??traac??tique (EDTA) ou l'acide di??thyl??ne triamine pentaac??tique (DTPA). Cela a r??duit l'accumulation de l'actinium dans les os, mais l'excr??tion de l'organisme est rest??e lente. Bien meilleurs r??sultats ont ??t?? obtenus avec des agents ch??latants ou que HEHA DOTA (acide 1,4,7,10-t??traazacyclodod??cane-1,4,7,10-t??traac??tique) coupl?? ?? trastuzumab, un Anticorps monoclonal qui inhibe la HER2 / neu r??cepteur. La combinaison de livraison ci a ??t?? test?? sur des souris et se est av??r?? ??tre efficace contre la leuc??mie, lymphome, sein, de l'ovaire, neuroblastome et cancers de la prostate.
La demi-vie moyenne de 227 Ac (21,77 ann??es) rend isotope radioactif tr??s pratique dans la mod??lisation du m??lange vertical lente des eaux oc??aniques. Les processus associ??s ne peuvent pas ??tre ??tudi??s avec la pr??cision requise par des mesures directes de la vitesse du courant (de l'ordre de 50 m??tres par an). Toutefois, l'??valuation de la profondeur profils de concentration pour diff??rents isotopes permet d'estimer les taux de m??lange. La physique derri??re cette m??thode est la suivante: eaux oc??aniques contiennent dispers??s de fa??on homog??ne 235 U. Son produit de d??sint??gration, 231 Pa, pr??cipite progressivement vers le bas, de sorte que sa concentration augmente d'abord avec la profondeur et puis reste ?? peu pr??s constante 231 Pa se d??sint??gre en 227 Ac. cependant, la concentration de ce dernier ne se ensuit pas isotope 231 Pa le profil de profondeur, mais augmente plut??t vers le fond de la mer. Cela se produit en raison des processus de m??lange qui soul??vent un certain suppl??mentaire 227 Ac du fond de la mer. Ainsi l'analyse des deux 231 Pa et 227 profils de profondeur Ac permet de mod??liser le comportement de m??lange.
Pr??cautions
227 Ac est hautement radioactifs et les exp??riences avec elle sont effectu??es dans un laboratoire sp??cialement con??u ??quip?? d'une bo??te ?? gants et protection contre les rayonnements. Lorsque le trichlorure de actinium est administr?? par voie intraveineuse ?? des rats, environ 33% de l'actinium est d??pos??e dans les os et 50% dans le foie. Sa toxicit?? est comparable, mais l??g??rement inf??rieure ?? celle de l'am??ricium et le plutonium.
![\ Mathrm {^ {226} _ {\ 88} Ra \ + \ ^ _ {1} {0} n \ \ longrightarrow \ ^ {227} _ {\ 88} Ra \ \ xrightarrow [42,2 \ min] {\ beta ^ -} \ ^ {227} _ {\ 89}} Ac](../../images/1192/119255.png)

