
Iode
Saviez-vous ...
SOS Enfants a essay?? de rendre le contenu plus accessible Wikipedia par cette s??lection des ??coles. parrainage SOS enfant est cool!
| Iode | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
53 I | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
gris m??tallique brillant, violet comme gaz  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | iode, I, 53 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / aɪ . ə r?? aɪ n / EYE -ə-dyn, / aɪ . ə r?? ɨ n / EYE -ə-dən, ou / aɪ . ə r?? Je n / EYE -ə-deen | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | halog??ne | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (17) les halog??nes , 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 126,90447 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 4d 10 5s 2 5p 5 2, 8, 18, 18, 7 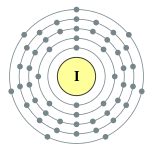 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Bernard Courtois (1811) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Bernard Courtois (1811) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 4,933 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 386,85 K , 113,7 ?? C, 236,66 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 457,4 K, 184,3 ?? C, 363,7 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | 386,65 K (113 ?? C), 12,1 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 819 K, 11,7 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (I 2) 15,52 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | (I 2) 41,57 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | (I 2) 54,44 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur (losange) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 7, 5, 3, 1, -1 (Fortement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,66 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 1008,4 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1845,9 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 3180 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 140 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 139 ?? 15 heures | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 198 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | orthorhombique  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (0 ?? C) de 1,3 x 10 7 Ω ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 0,449 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 7,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'iode | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
L'iode est un ??l??ment chimique avec le symbole I et de num??ro atomique 53. Le nom est d' grecs ioeidēs de ἰοειδής, signifiant violette ou pourpre, en raison de la couleur de la vapeur d'iode ??l??mentaire.
L'iode et de ses compos??s sont principalement utilis??s dans l'alimentation , et industriellement dans la production d' acide ac??tique et de certaines polym??res. Num??ro atomique relativement ??lev?? de l'iode, bas la toxicit?? et la facilit?? d'attachement ?? des compos??s organiques ont fait une partie d'un grand nombre Mat??riaux de contraste pour rayons X de la m??decine moderne. Iode n'a qu'un seul isotope stable . Un certain nombre d'iode des radio-isotopes sont ??galement utilis??s dans des applications m??dicales.
L'iode se trouve sur Terre principalement en tr??s soluble dans l'eau- ion iodure, I -, qui se concentre dans les oc??ans et les lacs de saumure. Comme les autres halog??nes , iode libre se produit principalement en mol??cule diatomique I 2, et alors seulement momentan??ment apr??s avoir ??t?? oxyd?? ?? partir d'iodure par un oxydant comme l'oxyg??ne libre. Dans l'univers et sur la Terre, num??ro atomique ??lev?? de l'iode, il est relativement ??l??ment rare. Cependant, sa pr??sence dans l'eau de mer a donn?? un r??le dans la biologie. Il est le plus lourd ??l??ment essentiel utilis?? largement par la vie dans les fonctions biologiques (seulement tungst??ne , employ?? dans enzymes par quelques esp??ces de bact??ries, est plus lourd). La raret?? de l'iode dans de nombreux sols, en raison de la faible abondance initiale comme un ??l??ment de la cro??te, et aussi le lessivage d'iodure soluble dans l'eau de pluie, a conduit ?? de nombreux probl??mes de carence chez les animaux terrestres et les populations humaines int??rieures. La carence en iode touche environ deux milliards de personnes et est la principale cause ??vitable de une d??ficience intellectuelle.
L'iode est requis par les animaux sup??rieurs, qui l'utilisent pour synth??tiser les hormones thyro??diennes, qui contiennent l'??l??ment. En raison de cette fonction, des radio-isotopes de l'iode sont concentr??es dans la le long de glande thyro??de avec de l'iode non-radioactif. En cas d'inhalation, le radio-isotope l'iode-131, qui a une haute rendement des produits de fission, se concentre dans la thyro??de, mais est facilement r??solu avec l'iodure de potassium traitement.
Caract??ristiques
Iode sous conditions standard est un solide bleu-noir. On voit apparemment sublimant ?? des temp??ratures standard dans un gaz violet-rose qui a une odeur irritante. Cette forme des compos??s d'halog??ne avec de nombreux ??l??ments, mais est moins r??actifs que les autres membres de son groupe VII (halog??nes) et a un peu de lumi??re m??tallique r??flectance.

L'iode ??l??mentaire se dissout facilement dans la plupart organiques des solvants tels que hexane ou chloroforme en raison de son manque de polarit??, mais ne est que l??g??rement soluble dans l'eau. Toutefois, la solubilit?? de l'iode ??l??mentaire dans de l'eau peut ??tre augment??e par l'addition d' iodure de potassium . L'iode mol??culaire r??agit de mani??re r??versible avec l'ion n??gatif, g??n??rant le anion triiodure I 3 - en ??quilibre , qui est soluble dans l'eau. Ce est ??galement la formulation de certains types de m??dicament (antiseptique) iode, bien teinture d'iode dissout l'??l??ment classique dans une solution aqueuse d'??thanol .
L'iode fond ?? la temp??rature relativement basse de 113,7 ?? C, bien que le liquide est souvent obscurci par une vapeur violette dense de l'iode gazeux.
L'iode dans la phase gazeuse est de couleur violette, cela est d?? ?? certaines longueurs d'onde de la lumi??re visible absorb??e quand une transition ??lectronique de la π * MO occup?? le plus ??lev?? ?? la plus bas inoccup??e σ * MO dans la mol??cule se produit. Lorsque l'iode est dissous dans des solvants polaires qui sont solvants donneurs forts tels que les c??tones , les ??thers , la pyridine, la formation de complexe de transfert de charge conduit ?? la modification de l'??cart d'??nergie entre les deux orbitales mol??culaires, donc diff??rentes longueurs d'onde sont absorb??es et l'iode a couleur diff??rente dans les solvants de polarit?? diff??rente.
Les solutions d'iode dans des solvants donneurs forts tels que l'ac??tone , le t??trahydrofuranne, pyridine appara??t brune ou jaune (λ max = 460 ?? 480 nm), tandis que dans les solvants des bailleurs de fonds plus faibles tels que dichlorom??thane il appara??t rouge carmin, dans hydrocarbures aromatiques tels que le benz??ne et le tolu??ne il semble rose ou brun rouge??tre. Dans les solvants non polaires tels que hexane, aucun complexe de transfert de charge est form?? et la solution appara??t violet (λ max = 520-540 nm) puisque l'??cart de l'??nergie en I 2 dans des solvants non polaires est essentiellement le m??me que celui dans la phase gazeuse. Quand une solution brune de l'iode dans un solvant donneur forte est chauff??e, une transition de couleur du brun au violet est observ?? que le complexe de transfert de charge faiblement li??e ?? dissocie en solvants et en iode mol??cules libres.
Des complexes de transfert de charge peuvent ??galement ??tre form??s entre l'iode et un ion m??tallique, dans laquelle des ??lectrons π dans le rempli * orbitales de mol??cules d'iode ont ??t?? offerts aux 5s, et 5d basses terres vides orbitales, quant ?? lui don de retour ?? partir du m??tal se produit, ce qui affaiblit et allonge la liaison I-I. Un exemple est [Agi 2] [SbF 6] o?? une cha??ne polym??re du complexe de transfert de charge [(Agi 2) n] n + existe dans le compos??.

Occurrence
L'iode est rare dans le syst??me solaire et de la cro??te terrestre (de 47-60th en abondance); cependant, sels d'iodure sont souvent tr??s soluble dans l'eau. L'iode se produit dans l??g??rement sup??rieure les concentrations dans l'eau de mer que dans les roches, 0,05 vs 0,04 ppm. Min??raux contenant de l'iode comprennent cal??che, trouv?? dans le Chili . Le brun algues Laminaria et Fucus trouv?? dans les zones temp??r??es de l'h??misph??re Nord contiennent de 0,028 ?? 0,454 pour cent en poids sec de l'iode. Mis ?? part le tungst??ne , l'iode est l'??l??ment le plus lourd d'??tre essentielle dans les organismes vivants. A propos de 19000 tonnes par an sont produites ?? partir de sources naturelles.
Organoiodine compos??s sont produits par des formes de vie marine, l'??tre le plus notable iodom??thane (commun??ment appel?? iodure de m??thyle). Environ 214 kilotonnes / an d'iodom??thane est produit par le milieu marin, par l'activit?? microbienne dans les rizi??res et par la combustion de la mati??re biologique. Le iodom??thane volatile est divis??e dans l'atmosph??re dans le cadre d'un cycle global de l'iode.
Structure de liaison et


Iode existe normalement une mol??cule diatomique avec un II longueur de la liaison de 270 heures, une des plus longues liaisons simples connus. Les deux mol??cules je tendent ?? interagir via les faibles van der Waals forces appel?? Forces de dispersion de London, et cette interaction est responsable du point de fusion plus ??lev?? par rapport aux halog??nes plus compactes, qui sont ??galement diatomique. ??tant donn?? que la taille atomique de l'iode est plus grand, son point de fusion est plus ??lev??. Le solide comme cristallise cristaux orthorhombiques. Le motif de cristal dans la Notation Hermann-Mauguin est Cmca (n ?? 64), Symbole Pearson OS8. La liaison II est relativement faible, avec une obligataire ??nergie de dissociation de 36 kcal / mol, et la plupart des obligations ?? l'iode sont plus faibles que pour les halog??nures l??gers. Une cons??quence de cette liaison faible est la tendance relativement ??lev?? de I deux mol??cules dissocier en iode atomique.
Production
Parmi les plusieurs endroits dans lesquels l'iode se produit dans la nature, que deux sources sont commercialement utile: le cal??che, trouv?? dans le Chili , et les saumures contenant de l'iode de champs de gaz et de p??trole, en particulier au Japon et aux ??tats-Unis. Le caliche contient nitrate de sodium, qui est le produit principal des activit??s d'extraction, et de petites quantit??s d'iodate de sodium et d'iodure de sodium. Dans l'extraction du nitrate de sodium, l'iodate de sodium et d'iodure de sodium sont extraits. La forte concentration d'iode dans la cal??che et l'exploitation extensive faite Chili, le plus grand producteur d'iode en 2007.
La plupart des autres producteurs utilisent de la saumure naturelle se produisant pour la production d'iode. Les Japonais Minami Kanto champ de gaz est de Tokyo et de l'American Champ de gaz du bassin Anadarko dans le nord- Oklahoma sont les deux principales sources de l'iode de la saumure. La saumure a une temp??rature sup??rieure ?? 60 ?? C en raison de la profondeur de la source. Le la saumure est d'abord purifi??e et acidifi?? en utilisant de l'acide sulfurique , puis la pr??sente iodure est oxyd?? ?? l'iode avec du chlore . Une solution d'iode est produit, mais il est dilu?? et doit ??tre concentr??e. Air est souffl?? dans la solution, ce qui provoque l'iode ?? ??vaporer, alors elle est pass??e dans une tour d'absorption contenant de l'acide o?? Le dioxyde de soufre est ajout?? ?? r??duire l'iode. Le l'iodure d'hydrog??ne (HI) est mis ?? r??agir avec du chlore pour pr??cipiter l'iode. Apr??s filtration et la purification de l'iode est emball??.
- 2 HI + Cl 2 → I 2 ↑ + 2 HCl
- I 2 + 2 H 2 O + SO 2 → 2 HI + H 2 SO 4
- 2 HI + Cl 2 → 2 I ↓ + 2 HCl
La production de l'iode ?? partir de l'eau de mer par l'interm??diaire d' ??lectrolyse ne est pas utilis??e en raison de l'abondance de l'iode suffisant saumure riche. Une autre source d'iode est varech, utilis?? dans les 18e et 19e si??cles, mais il ne est plus ??conomiquement viable.
Les ??chantillons commerciaux contiennent souvent des concentrations ??lev??es de les impuret??s, qui peuvent ??tre ??limin??s par sublimation. L'??l??ment peut ??galement ??tre pr??par??e sous une forme ultra-pure par la r??action de l'iodure de potassium avec du sulfate de cuivre (II) , ce qui donne de cuivre (II) initialement iodure. Que se d??compose spontan??ment ?? cuivre (I) et de l'iodure en iode:
- Cu 2+ + 2 I - → 2 Cul
- 2 Cul 2 → 2 + I 2 Cul
Il existe ??galement d'autres proc??d??s d'isolement de cet ??l??ment dans le laboratoire, par exemple, le proc??d?? utilis?? pour isoler d'autres halog??nes: l'oxydation de l'iodure de l'iodure d'hydrog??ne (souvent r??alis??s in situ avec un iodure et d'acide sulfurique) par dioxyde de mangan??se (voir ci-dessous dans la chimie descriptive).
Isotopes et leurs applications
Des 37), caract??ris?? connus ( isotopes de l'iode, un seul, 127 I, est stable.
Le radio-isotope plus longue dur??e, 129 I, a une demi-vie de 15,7 millions d'ann??es. Ce est assez long pour en faire un ??l??ment permanent de l'environnement sur des ??chelles de temps humaines, mais beaucoup trop court pour exister en tant que isotopes primordiale aujourd'hui. Au lieu de cela, l'iode-129 est un radionucl??ide ??teint, et sa pr??sence dans le syst??me solaire primitif est d??duite de l'observation d'un exc??s de sa fille x??non-129. Ce nucl??ide est ??galement faite r??cemment par rayons cosmiques et comme sous-produit de la fission nucl??aire humaine, dont il est utilis?? pour surveiller comme un contaminant environnemental tr??s longue dur??e de vie.
Le radio-isotope prochaine plus longue dur??e, l'iode-125, a une demi-vie de 59 jours. Il est utilis?? comme un marqueur ??mettant des rayons gamma commode pour des prot??ines dans des analyses biologiques et quelques essais nucl??aires de m??decine d'imagerie o?? une demi-vie plus longue est n??cessaire. Il est ??galement couramment utilis?? dans capsules de brachyth??rapie implant??, qui tuent les tumeurs par courte port??e locale un rayonnement gamma (mais o?? l'isotope est jamais lib??r??e dans le corps).
L'iode-123 (demi-vie de 13 heures) est l'isotope de choix pour imagerie de m??decine nucl??aire de la glande thyro??de, qui se accumule naturellement tous les isotopes de l'iode.
L'iode 131 (demi-vie de 8 jours) est un isotope ??metteur b??ta, qui est un produit de fission nucl??aire commun. Elle est de pr??f??rence administr??e ?? l'homme que dans de tr??s fortes doses qui d??truisent tous les tissus qui se accumulent (habituellement la thyro??de), qui ?? son tour emp??che ces tissus de d??velopper un cancer ?? partir d'une dose plus faible (paradoxalement, une dose ??lev??e de cet isotope appara??t plus s??r pour le la thyro??de ?? faible dose). Comme d'autres l'iode radioactif, I-131 se accumule dans la glande thyro??de, mais contrairement aux autres, en petites quantit??s, il est hautement canc??rig??ne l??, il semble que, en raison de la mutation de la cellule locale ??lev??e en raison de dommages de d??sint??gration b??ta. En raison de cette tendance de 131 I ?? entra??ner une forte d??t??rioration des cellules qui se accumulent et autres cellules pr??s d'eux (0,6 ?? 2 mm de distance, la gamme des rayons b??ta), ce est la seule radio-isotope iode utilis?? comme th??rapie directe, de tuer les tissus tels que les cancers qui prennent mol??cules iod??s artificiellement (par exemple, le compos?? iobenguane, ??galement connu sous le MIBG). Pour la m??me raison, seul l'isotope d'iode I-131 est utilis?? pour traiter La maladie de Grave et ces types de cancers de la thyro??de (parfois sous forme m??tastatique) o?? les fonctions de tissus qui exige la destruction, encore accumuler naturellement iodure.
Non radioactif ordinaire de l'iodure de potassium (iode-127), dans un certain nombre de formes avantageuses (comprim??s ou solution) peut ??tre utilis??e pour saturer la capacit?? de la glande thyro??de pour prendre en outre l'iode, et ainsi prot??ger contre toute contamination accidentelle de l'iode-131 produit par la fission nucl??aire accidents, comme la catastrophe de Tchernobyl et plus r??cemment le Accidents nucl??aires de Fukushima I, ainsi que de la contamination de cet isotope dans les retomb??es nucl??aires de l'arme nucl??aire .
Histoire
L'iode a ??t?? d??couvert par le chimiste fran??ais Bernard Courtois en 1811. Il est n?? ?? un fabricant de salp??tre (une partie vitale de la poudre ?? canon ). ?? l'??poque des guerres napol??oniennes , France ??tait en guerre et de salp??tre ??tait en grande demande. Salp??tre produite ?? partir de Fran??ais lits NITER n??cessaires le carbonate de sodium, qui peut ??tre isol?? ?? partir de algues collect??es sur les c??tes de Normandie et Bretagne. Pour isoler le carbonate de sodium, l'algue a ??t?? br??l?? et les cendres lav??es ?? l'eau. Les d??chets restant a ??t?? d??truit par addition d' acide sulfurique . Courtois fois ajout?? l'acide sulfurique excessive et un nuage de vapeur rose pourpre. Il a not?? que la vapeur cristallis?? sur les surfaces froides, la fabrication de cristaux sombres. Courtois soup??onn?? que ce ??tait un ??l??ment nouveau mais il manquait des fonds pour la poursuivre.
Courtois a donn?? des ??chantillons ?? ses amis, Charles Bernard Desormes (1777-1862) et Nicolas Cl??ment (1779-1841), de poursuivre les recherches. Il a ??galement donn?? une partie de la substance ?? chimiste Louis Joseph Gay-Lussac (1778-1850), et physicien Andr??-Marie Amp??re (1775-1836). Le 29 Novembre 1813, Dersormes et Cl??ment fait la d??couverte de Courtois publique. Ils ont d??crit la substance ?? une r??union de la Institut Imp??riale de France. Le 6 D??cembre, Gay-Lussac a annonc?? que la nouvelle substance ??tait soit un ??l??ment ou un compos?? d'oxyg??ne. Ce ??tait Gay-Lussac qui a sugg??r?? le nom "iode", du mot grec (ιώδες des iodes) pour le violet (?? cause de la couleur de la vapeur d'iode). Amp??re avait donn?? une partie de son ??chantillon ?? Humphry Davy (1778-1829). Davy a fait des exp??riences sur le fond et a not?? sa ressemblance avec le chlore . Davy a envoy?? une lettre en date du 10 D??cembre au Royal Society de Londres indiquant qu'il avait identifi?? un nouvel ??l??ment. Arguments ont ??clat?? entre Davy et Gay-Lussac sur qui a identifi?? l'iode en premier, mais les scientifiques ont reconnu Courtois comme le premier ?? isoler l'??l??ment.
Applications
Additif alimentaire humaine
Cette application est tr??s important discut?? dans les sections ?? la fin de cet article, qui traitent iode en biologie.
Les aliments pour animaux
La production de ??thyl??nediammonium diiodure (EDDI) consomme une fraction importante d'iode disponible. EDDI est pr??vu pour le b??tail comme suppl??ment nutritionnel.
Catalyse
L'application majeure de l'iode est en tant que co-catalyseur pour la production d' acide ac??tique par le Monsanto et les processus de Cativa. Dans ces technologies, qui soutiennent la demande mondiale pour l'acide ac??tique, l'acide iodhydrique convertit le m??thanol en charge l'iodure de m??thyle, qui subit carbonylation. L'hydrolyse de l'iodure d'ac??tyle r??sultant r??g??n??re l'acide iodhydrique et l'acide ac??tique donne.
traitement d??sinfectant et de l'eau
L'iode ??l??mentaire est utilis?? comme d??sinfectant sous diverses formes. L'iode existe sous la forme de l'??l??ment, ou que l'eau-soluble anion triiodure I 3 - g??n??r?? in situ par addition iodure en iode ??l??mentaire mal soluble dans l'eau (la r??action chimique inverse rend certains iode ??l??mentaire libre disponible pour l'antisepsie). En mode alternative, l'iode peut provenir iodophores, qui contiennent de l'iode complex?? avec un agent de solubilisation (ion iodure peuvent ??tre consid??r??s comme iodophore librement dans des solutions aqueuses triiodure). Des exemples de telles pr??parations comprennent:
- Teinture d'iode: iode dans l'??thanol, ou l'iode et iodure de sodium dans un m??lange d'??thanol et d'eau.
- Lugol: l'iode et de l'iodure dans l'eau seule, formant essentiellement triiodure. Contrairement ?? la teinture d'iode, Lugol a une quantit?? minime de l'iode libre (I 2) de composant.
- Povidone iode (une iodophore).
L'usage m??dical et radiologique
L'iodure de potassium a ??t?? utilis?? en tant que expectorant, bien que cet usage est de plus en plus rares. En m??decine, l'iodure de potassium est g??n??ralement utilis?? pour traiter aigu thyrotoxicose, habituellement sous forme d'une solution satur??e d'iodure de potassium appel?? SSKI. Il est ??galement utilis?? pour bloquer l'absorption de l'iode-131 dans la glande thyro??de (voir section isotopes ci-dessus), lorsque cet isotope est utilis?? comme partie des produits radiopharmaceutiques (tels que iobenguane) qui ne sont pas cibl??es sur les tissus de la thyro??de ou du type de la thyro??de.
L'iode-131 (habituellement sous la forme chimique de l'iodure) est un composant de retomb??es nucl??aires et particuli??rement dangereuse en raison de la propension de la glande thyro??de de concentrer l'iode ing??r??, o?? il est conserv?? pendant plus de demi-vie radiologique de cet isotope de huit jours. Pour cette raison, si les gens sont cens??s ??tre expos??s ?? une quantit?? importante de l'iode radioactif de l'environnement (iode-131 dans les retomb??es), ils peuvent ??tre charg??s de prendre non radioactifs comprim??s d'iodure de potassium. La dose adulte typique est d'un comprim?? de 130 mg par 24 heures, fournissant 100 mg (100 000 microgrammes ) d'iode, que l'iodure ion. (Dose quotidienne typique d'iode pour maintenir la sant?? normale est de l'ordre de 100 microgrammes;. Voir "Apports Nutritionnels" ci-dessous) En ing??rant cette grande quantit?? d'iode non radioactif, radioactive absorption d'iode par la glande thyro??de est minimis??. Voir l'article sur l'iodure de potassium pour plus sur ce sujet.
Produit de contraste
Iode, comme physiquement dense ??l??ment avec haute la densit?? ??lectronique et de haute num??ro atomique , est assez radio-opaque (ce est ?? dire, il absorbe ainsi des rayons X). Cette propri??t?? peut ??tre pleinement exploit?? en filtrant les rayons X imagerie de sorte qu'ils sont plus ??nergiques que ??K-edge" de l'iode ?? 33,3 keV, ou de l'??nergie, o?? l'iode commence ?? absorber les rayons X fortement en raison de l'effet photo??lectrique des ??lectrons dans sa coquille K. Les compos??s organiques d'un certain type (d??riv??s de benz??ne g??n??ralement l'iode-substitu??s) sont ainsi utilis??s dans la m??decine que X-ray agents contraste radiographiques pour l'injection intraveineuse. Ce est souvent en conjonction avec des techniques de rayons X de pointe telles que angiographie et Tomodensitom??trie. ?? l'heure actuelle, tous les agents radiocontrast solubles dans l'eau se appuient sur l'iode.
D'autres utilisations
Iodures inorganiques trouver des utilisations sp??cialis??es. De hafnium, de zirconium, de titane sont purifi??s par la Proc??d?? van Arkel, qui implique la formation r??versible des tetraiodides de ces ??l??ments. Iodure d'argent est un ingr??dient majeur de film photographique traditionnelle. Des milliers de kilogrammes de l'iodure d'argent sont consomm??es chaque ann??e pour ensemencement de nuages.
Le compos?? organoiodine ??rythrosine est un important agent colorant alimentaire. Des iodures de perfluoroalkyle sont des pr??curseurs de tensioactifs importants, tels que l'acide perfluorooctane sulfonique.
chimie de l'iode
Iode adopte une vari??t?? d'??tats d'oxydation, g??n??ralement allant de (formellement) I (VII) ?? I (-I), et y compris les ??tats interm??diaires de I (V), I (III) et I (I). Pratiquement, seul l'??tat d'oxydation de -1 est d'importance, ??tant le formulaire qui se trouve dans les sels d'iodure et compos??s organoiodine. L'iode est un Acide de Lewis. Avec des donneurs d'??lectrons tels que la triph??nylphosphine et il forme une pyridine complexe de transfert de charge. Avec le anion iodure il forme le ion triiodure. L'iode et le forme un ion iodure quelques redox. I 2 est facilement r??duit et je - est facilement oxyd??.
Solubilit??
??tant une mol??cule non polaire, de l'iode est tr??s soluble dans les solvants organiques non polaires, y compris l'??thanol (20,5 g / 100 ml ?? 15 ?? C, 21,43 g / 100 ml ?? 25 ?? C), l'??ther de di??thyle (20,6 g / 100 ml ?? 17 ?? C, 25,20 g / 100 ml ?? 25 ?? C), le chloroforme, l'acide ac??tique , le glycerol, le benz??ne (14,09 g / 100 ml ?? 25 ?? C), le t??trachlorure de carbone (2,603 g / 100 ml ?? 35 ?? C), et le disulfure de carbone (16,47 g / 100 ml ?? 25 ?? C). L'iode ??l??mentaire est peu soluble dans l'eau, avec une dissolution de 3,450 gramme en ml ?? 20 ?? C et 1 280 ml ?? 50 ?? C, mais il est beaucoup plus soluble dans une solution d'iodure tel qu'il forme des ions polyiodure. Des solutions aqueuses et de l'??thanol sont brun qui refl??te le r??le de ces solvants en tant que Les bases de Lewis. Solutions dans le chloroforme, le t??trachlorure de carbone, le disulfure de carbone et sont violet, la couleur de la vapeur d'iode.
Les r??actions d'oxydor??duction
Dans la vie quotidienne, les iodures sont lentement oxyd??s par l'oxyg??ne atmosph??rique dans l'atmosph??re pour donner l'iode libre. Preuve de cette conversion est la teinte jaune de certains ??chantillons vieillis de sels d'iodure et certains compos??s organoiodine. L'oxydation de l'iodure en iode dans l'air est ??galement responsable de la perte lente de la teneur en iodure sel iod?? se il est expos?? ?? l'air. Certains sels iodate utiliser pour pr??venir la perte d'iode.
L'iode est facilement r??duit. Le plus commun est l'interconversion de I - et je 2. Iode mol??culaire peut ??tre pr??par?? par oxydation iodures avec du chlore:
- 2 I - + Cl 2 → I 2 + 2 Cl -
ou avec le dioxyde de mangan??se en solution acide:
- 2 I - + 4 H + + MnO 2 → I 2 + 2 H 2 O + Mn 2+
L'iode est r??duit ?? l'acide iodhydrique par le sulfure d'hydrog??ne et hydrazine:
- 8 I 2 + 8 H 2 S → 16 HI + S 8
- 2 I 2 + N 2 H 4 → 4 HI + N 2
Lorsque dissous dans fumant de l'acide sulfurique (65% de oleum), l'iode forme une solution de bleu intense. La couleur bleue est due ?? i +
2 cation, le r??sultat ??tant de l'iode oxyd?? en SO 3:
- 2 I 2 + 2 SO 3 + H 2 SO 4 → 2 I +
2 + SO 2 + 2 ASS -
4
Le I +
2 cation est ??galement form??e lors de l'oxydation de l'iode par SbF 5 ou TaF 5. La r??sultante I +
Sb 2
2 F -
11 ou I +
Ta 2
2 F -
11 peut ??tre isol?? sous forme de cristaux d'un bleu profond. Les solutions de ces sels deviennent rouges lorsqu'il est refroidi au-dessous de -60 ?? C, en raison de la formation de la I 2+
4 cation:
- 2 I +
2 Je 2+
Je 2+
4
Dans des conditions l??g??rement plus alcalines, je 2+
4 dismute en I +
3 et un atome d'iode (III) compos??. Exc??s d'iode peut alors r??agir avec I +
3 pour former I +
5 (vert) et je 3+
15 (noir).
Oxyde d'iode
Les oxydes les plus connus sont les anions, IO -
3 et IO -
4, mais plusieurs autres oxydes sont connus, tels que l'oxydant puissant pentoxyde d'iode.
Par contraste avec le chlore , la formation de l'ion hypohalite (IO -) dans des solutions aqueuses neutres de l'iode est n??gligeable.
- I 2 + H 2 O
 + H + I - + HIO (K = 2,0 x 10 -13) dans des solutions basiques (comme aqueuse d'hydroxyde de sodium ), de l'iode se transforme dans une r??action en deux ??tapes pour iodure et iodate:
+ H + I - + HIO (K = 2,0 x 10 -13) dans des solutions basiques (comme aqueuse d'hydroxyde de sodium ), de l'iode se transforme dans une r??action en deux ??tapes pour iodure et iodate:
- Click on the following link to visit or download this HTML page
I 2 + 2 OH - → I - IO + - + H 2 O (K = 30) 3 IO - → 2 I - + IO -
3(K = 10 20)
Les d??riv??s organiques de hypoiodate ( 2-iodoxybenzo??que acide, et P??riodinane de Dess-Martin) sont utilis??es en chimie organique.
Acide iodique (EIO 3), acide p??riodique (EIO 4) et leurs sels sont des oxydants puissants et sont d'une certaine utilit?? dans synth??se organique. L'iode est oxyd??e iodate par l'acide nitrique , ainsi que par chlorates:
- I 2 + 10 HNO 3 → 2 EIO 3 + 10 NO 2 + 4 H 2 O
- I 2 + 2 ClO -
3 → 2 IO -
3 + Cl 2
Compos??s iod??s inorganiques
L'iode forme des compos??s avec tous les ??l??ments ?? l'exception des gaz nobles. Du point de vue des applications commerciales, un compos?? important est l'acide iodhydrique, utilis?? comme co-catalyseur dans le Proc??d?? Cativa pour la production d'acide ac??tique. Les iodures de titane et d'aluminium sont utilis??s dans la production de butadi??ne, un pr??curseur de pneus en caoutchouc.
Les sels de m??taux alcalins sont des solides incolores communes qui sont tr??s solubles dans l'eau. L'iodure de potassium est une source commode de la anions iodure; il est plus facile ?? manipuler que l'iodure de sodium, car il ne est pas hygroscopique. Les sels sont principalement utilis??s dans la production de sel iod??. L'iodure de sodium est particuli??rement utile dans le R??action de Finkelstein, car il est soluble dans l'ac??tone , tandis que l'iodure de potassium est moins. Dans cette r??action, un chlorure d'alkyle est converti en un iodure d'alkyle. Celle-ci repose sur l'insolubilit?? du chlorure de sodium dans de l'ac??tone pour conduire la r??action:
- R-Cl (ac??tone) + Nal (ac??tone) → RI (ac??tone) + NaCl (s)
Malgr?? l'??lectron??gativit?? plus basse des halog??nes communs, l'iode r??agit violemment avec certains m??taux, comme l'aluminium:
- 3 I 2 + 2 Al → 2 AlI 3
Cette r??action produit 314 kJ par mole d'aluminium, comparables ?? 425 kJ de thermite. Pourtant, la r??action d??clenche spontan??ment, et si non confin??, provoque un nuage d'iode gazeux en raison de la temp??rature ??lev??e.
Compos??s interhalog??n??s
Compos??s interhalog??n??s sont bien connus; des exemples comprennent le monochlorure d'iode et le trichlorure; pentafluorure d'iode et heptafluorure.
Compos??s organiques
De nombreux compos??s organoiodine existent; le plus simple est iodom??thane, a approuv?? comme sols fumigant. Des compos??s organiques iod??s sont utilis??s comme r??actifs de synth??se.
Synth??se organique
Organoiodine compos??s peuvent ??tre effectu??s de plusieurs mani??res. Par exemple, l'iodure de m??thyle peut ??tre pr??par?? ?? partir de m??thanol , phosphore rouge, et l'iode. Le r??actif d'iodation est triiodure de phosphore qui est form??e in situ:
- 3 CH 3 OH + PI 3 → 3 CH 3 I + H 3 PO 3
Le iodoforme essai utilise une solution alcaline d'iode de r??agir avec des c??tones de m??thyle pour donner le groupe triiodomethide laissant labile, formant iodoforme, qui pr??cipite.
Aryle et alkyle iodures fois formulaire Les r??actifs de Grignard. L'iode est parfois utilis?? pour activer le magn??sium lors de la pr??paration des r??actifs de Grignard. les iodures d'alkyle tels que l'iodom??thane sont bonnes agents alkylants. Certains inconv??nients ?? l'utilisation des compos??s de organoiodine dans la synth??se chimique sont:
- compos??s d'iode sont plus chers que les bromures et chlorures correspondants, dans cet ordre
- iodures sont des agents alkylants beaucoup plus fortes, et sont plus toxiques (par exemple, l'iodure de m??thyle est tr??s toxique (T +), de sorte.
- iodures bas poids mol??culaire ont tendance ?? avoir un poids ??quivalent beaucoup plus ??lev??, compar?? ?? d'autres agents d'alkylation (par exemple, par rapport ?? l'iodure de m??thyle le carbonate de dim??thyle), du fait de la masse atomique de l'iode.
La chimie analytique et de bioanalyse

L'iode est utile en chimie analytique en raison de ses r??actions avec des alc??nes , l'amidon et les agents oxydants et r??ducteurs. Les esp??ces tr??s color??es impliqu??s dans ces r??actions, il est facile de d??tecter les effets dans de nombreuses d??terminations analytiques. L'iode est une tache g??n??rale couramment utilis?? dans chromatographie sur couche mince. Iode forme un complexe bleu intense avec les polym??res de glucose amidon et glycog??ne. Plusieurs m??thodes d'analyse se appuient sur cette propri??t??:
- Iodom??trie. La concentration d'un oxydant peut ??tre d??termin??e en l'ajoutant ?? un exc??s d'iodure, pour d??truire l'iode ??l??mentaire / triiodure ?? la suite de l'oxydation par l'oxydant. Un indicateur ?? l'amidon est ensuite utilis?? en tant que indicateur proche du point d'extr??mit??, afin d'augmenter le contraste visuel (bleu fonc?? devient incolore, au lieu du jaune dilu??e triiodure devenir incolore).
- Une test ?? l'iode peut ??tre utilis?? pour tester une substance d'??chantillon pour la pr??sence d'amidon. Le R??action de l'horloge d'iode est une extension des techniques dans iodom??trie.
- solutions d'iode sont utilis??s dans stylos contrefaits de d??tection de billets de banque; le principe ??tant que les billets contrefaits fabriqu??s en utilisant du papier disponible dans le commerce contiennent de l'amidon.
- L'amidon-iodure de papier sont utilis??s pour tester la pr??sence d'oxydants tels que peroxydes. Les oxydants iodure convertissent ?? l'iode, qui appara??t en bleu. Une solution d'amidon et d'iodure peut remplir la m??me fonction.
- Pendant colposcopie, de Lugol est appliqu??e ?? la vagin et col de l'ut??rus. Taches normales des tissus vaginaux brun en raison de sa teneur en glycog??ne ??lev??e (une couleur-r??action semblable ?? celle de l'amidon), tandis que les tissus anormaux de suspicion de cancer ne tache pas, et semble donc p??le par rapport aux tissus environnants. La biopsie de tissu suspect peut alors ??tre effectu??e. Ceci est appel?? un Le test de Schiller.
Indice d'iode ou de l'indice d'iode est utilis?? pour indiquer le nombre de carbone-carbone doubles liaisons dans les huiles v??g??tales et les acides gras .
Utilisation de produits chimiques de synth??se clandestine
Aux ??tats-Unis, la Drug Enforcement Administration (DEA) qui concerne l'iode et des compos??s contenant de l'iode (des iodures ioniques, iodoforme, l'iodure d'??thyle, et ainsi de suite) comme r??actifs utiles pour la fabrication clandestine de m??thamph??tamine.
R??le biologique
L'iode est un ??l??ment essentiel oligo-??l??ments pour la vie, l'??l??ment le plus lourd couramment n??cessaire par les organismes vivants. Seulement tungst??ne , un composant de quelques enzymes bact??riennes, a un nombre atomique sup??rieur et le poids atomique.

Le r??le principal de l'iode en biologie animale est en tant que constituant de la thyro??de hormones la thyroxine (T4) et la triiodothyronine (T3). Ceux-ci sont fabriqu??s ?? partir de produits de condensation de l'addition de l'acide amin?? tyrosine, et sont stock??s avant leur lib??ration dans un contenant de l'iode- prot??ine appel??e thyroglobuline. T4 et T3 contiennent quatre et trois atomes d'iode par mol??cule , respectivement. Le glande thyro??de iodure absorbe activement du sang de faire et de lib??rer ces hormones dans le sang, les actions qui sont r??glement??s par une deuxi??me hormone De la TSH pituitaire. Les hormones thyro??diennes sont phylog??n??tiquement tr??s vieilles mol??cules qui sont synth??tis??es par la plupart multicellulaires organismes , et que m??me ont un certain effet sur organismes unicellulaires.
Les hormones thyro??diennes jouent un r??le fondamental dans la biologie, agissant sur la transcription des g??nes pour r??guler le le taux m??tabolique basal. Le d??ficit total de hormones thyro??diennes peut r??duire le taux m??tabolique basal jusqu'?? 50%, tandis que la production excessive d'hormones thyro??diennes le taux m??tabolique de base peut ??tre augment?? de 100%. T4 agit essentiellement comme un pr??curseur de T3, qui est (?? quelques exceptions pr??s) l'hormone biologiquement active. Dans amphibiens m??tamorphose iode et les hormones thyro??diennes exercent une mod??le exp??rimental bien ??tudi?? des apoptose sur les cellules de branchies, la queue et les nageoires de t??tards.
L'iode a une relation nutritionnelle avec le s??l??nium . Une famille d'enzymes d??pendant de s??l??nium appel?? d??siodases convertit T4 en T3 (l'hormone active) en enlevant un atome d'iode ?? partir de l'anneau ext??rieur de la tyrosine. Ces enzymes convertissent ??galement ?? T4 T3 inverse (rT3) en ??liminant un atome d'iode int??rieure, et convertir au T3 3,3'-diiodothyronine (T2) ??galement en retirant un atome de la bague int??rieure. Ces deux derniers sont des hormones inactiv??s qui sont pr??ts pour l'??limination et ont, en substance, pas d'effets biologiques. Une famille d'enzymes non-s??l??nium-d??pendante alors deiodinates en outre les produits de ces r??actions.
L'iode repr??sente 65% de la masse mol??culaire de T4 et 59% de la T3. Quinze ?? 20 mg d'iode est concentr?? dans les tissus de la thyro??de et les hormones, mais 70% de l'iode du corps est distribu?? dans d'autres tissus, y compris les glandes mammaires, les yeux, la muqueuse gastrique, les parois art??rielles, le col de l'ut??rus, et les glandes salivaires. Dans les cellules de ces tissus, l'iodure p??n??tre directement par sodium iodure symporteur (NIS). Son r??le dans le tissu mammaire est li??e au d??veloppement du foetus et du nouveau-n??, mais son r??le dans les autres tissus ne est pas connue.
L'apport alimentaire
Le quotidien Apports nutritionnels recommand??s par les Etats-Unis Institut de m??decine est entre 110 et 130 pg pour les nourrissons jusqu'?? 12 mois, 90 pg pour les enfants jusqu'?? huit ans, 130 ug pour les enfants jusqu'?? 13 ans, 150 pg pour les adultes, 220 mg pour les femmes enceintes et 290 pg pour les m??res allaitantes. Le niveau maximal tol??rable d'admission (UL) pour les adultes est 1 100 mg / jour (1,1 mg / jour). La limite sup??rieure tol??rable a ??t?? ??valu??e par l'analyse de l'effet de la suppl??mentation sur l'hormone stimulant la thyro??de.
La glande thyroïde a besoin de pas plus de 70 microgrammes / jour pour synthétiser les quantités quotidiennes nécessaires de T4 et T3. Les niveaux d'indemnités journalières recommandées d'iode supérieur semblent nécessaires pour un fonctionnement optimal d'un certain nombre de systèmes de l'organisme, y compris en lactation du sein, de la muqueuse gastrique, glandes salivaires, la muqueuse buccale, les parois artérielles
Les sources naturelles d'iode comprennent la vie de la mer, tels quele varech et certains fruits de mer, ainsi que des plantes cultivées sur des sols riches en iode.Le sel iodé est enrichi avec de l'iode.
En 2000, l'apport médian d'iode de la nourriture aux Etats-Unis était de 240 à 300 pg / jour pour les hommes et de 190 à 210 pg / jour pour les femmes. Au Japon, la consommation est beaucoup plus élevée, comprise entre 5,280 pg / jour à 13 800 ug / jour, ce en raison de la consommation fréquente d'algues ou de kombu varech.
Après les programmes d'enrichissement en iode (par exemple, le sel iodé) ont été mises en ??uvre, certains cas de l'iode-induite hyperthyroïdie ont été observés (soi-disant phénomène Jod-Basedow). La condition semble se produire principalement dans les personnes de plus de quarante ans, et le risque semble plus élevé lorsque la carence en iode est sévère et la hausse initiale dans l'apport en iode est élevée.
Traitement de l'information, de la motricité fine, la résolution de problèmes et visuelle sont améliorées par la réplétion iode chez les enfants modérément carence en iode.
Carence
Dans environ deux tiers des ménages sur la Terre, le sel de table est iodé. Toutefois, cela laisse encore un de deux milliards de personnes estimées carence en iode. L'iode est nécessaire pour les hormones thyroxine essentielles produites par et concentrées dans la glande thyroïde.
Dans les zones où il ya peu d'iode dans l'alimentation, les zones intérieures généralement éloignées et semi-aride climat équatorial où aucun aliments marins sont consommés, la carence en iode donne lieu à une hypothyroïdie, dont les symptômes sont la fatigue extrême, le goitre, ralentissement mental, la dépression, le poids gain, et la température du corps de base faible. La carence en iode est la principale cause évitable de l'arriération mentale, un résultat qui se produit principalement quand les bébés ou les petits enfants sont rendus hypothyroidic par un manque de l'élément. L'ajout d'iode au sel de table a largement éliminé ce problème dans les nations les plus riches, mais, à partir de Mars 2006, la carence en iode reste un problème grave de santé publique dans le monde en développement. La carence en iode est également un problème dans certaines régions d'Europe.
Autres effets possibles sur la santé à l'étude comme étant liée à une carence comprennent:
- Le cancer du sein.La poitrine fortement et activement concentre l'iode dans le lait maternel pour le bénéfice de l'enfant en développement, et peut développer une hyperplasie de goitre comme, parfois, se manifestant commemaladie fibrinolytique du sein, lorsque les niveaux d'iode sont faibles.
- Cancer de l'estomac . Certains chercheurs ont constaté une corrélation épidémiologique entre la carence en iode, une carence en iode le goitre et le cancer gastrique. Une diminution de l'incidence des taux de mortalité par cancer de l'estomac après la mise en ??uvre de l'iode-prophylaxie efficaces a été rapporté également.
Précautions et toxicité de l'iode élémentaire
L'iode élémentaire (I 2 ) est toxique si elle est prise par voie orale. La dose mortelle pour un humain adulte est de 30 mg / kg, ce qui est d'environ 2,1-2,4 grammes (même si des expériences sur des rats ont montré que ces animaux pouvaient survivre après avoir mangé une dose de 14000 mg / kg). L'excès d'iode peut être plus cytotoxique en présence d' une carence en sélénium. Supplémentation en iode dans les populations déficients en sélénium est, en théorie, problématique, en partie pour cette raison. Sa toxicité provient de ses propriétés oxydantes, ce qui rend capable de dénaturer les protéines (enzymes et ainsi également).
L'iode élémentaire est un irritant oxydant et le contact direct avec la peau peut provoquer des lésions, de sorte cristaux d'iode doit être manipulé avec soin. Solutions avec une concentration élevée d'iode élémentaire tels que la teinture d'iode et la solution de Lugol sont capables de causer des dommages aux tissus si leur utilisation pour le nettoyage et antiseptiques est prolongée.
La sensibilité de l'iode
Certaines personnes développent une sensibilité à l'iode. Application de teinture d'iode peut provoquer une éruption cutanée. Certains cas de réaction à Povidone-iode (Betadine) ont donné lieu à des brûlures chimiques. L'usage médical de l'iode (IE comme un agent de contraste, voir ci-dessus) peut provoquer un choc anaphylactique chez les patients très sensibles iode. Certains cas de sensibilité à l'iode peuvent être officiellement classés comme des allergies d'iode. La sensibilité de l'iode est rare, mais a un effet considérable étant donné l'utilisation très répandue de produits de contraste à base d'iode.

