
Sulfate de cuivre (II)
?? propos de ce ??coles s??lection Wikipedia
Ce contenu de Wikipedia a ??t?? s??lectionn?? par SOS Enfants d'aptitude dans les ??coles ?? travers le monde. parrainage SOS enfant est cool!
| Sulfate de cuivre (II) | |
|---|---|
 | |
 | |
 | |
 | |
Sulfate de cuivre (II) | |
Autres noms Sulfate de cuivre (II) | |
| Identificateurs | |
| Num??ro CAS | 7758-98-7 |
| Num??ro CE | 231-847-6 |
| Num??ro RTECS | GL8800000 |
| Propri??t??s | |
| Formule mol??culaire | CuSO 4 ?? 5H 2 O (pentahydrat??) CuSO 4 (anhydre) |
| Masse molaire | 249,684 g / mol (pentahydrat??) 159,608 g / mol (anhydre) |
| Apparence | bleu cristallin solide (pentahydrat??) poudre gris-blanc (anhydre) |
| Point de fusion | 110 ?? C (- 4H 2 O) |
| Solubilit?? dans l'eau | 31,6 g / 100 ml (0 ?? C) |
| Structure | |
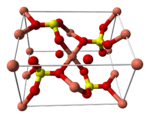
| Crystal structure | Triclinique |
| Coordination g??om??trie | Octahedral |
| Thermochimie | |
| Molaire standard entropie S | 109,05 JK -1 -1 .mol |
| Risques | |
| Classification UE | Nocif (Xn) Dangereux pour l'environnement (N) |
| NFPA 704 |  0 2 0 |
| Point d'??clair | ininflammable |
| Des compos??s apparent??s | |
| D'autres cations | Sulfate de nickel (II) Sulfate de zinc |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Sulfate de cuivre (II) est le compos?? chimique avec la formule Cu S O 4. Ce sel existe sous forme d'une s??rie de compos??s qui diff??rent par leur degr?? de hydratation. Le forme anhydre est une poudre vert ou gris-blanc p??le, alors que le pentahydrate, le sel le plus couramment rencontr??, est bleu vif. Ce sulfate de cuivre hydrat?? se produit dans la nature comme le min??ral appel?? chalcanthite. Noms archa??ques pour le sulfate de cuivre (II) sont "vitriol bleu?? et ??pierre bleue??.
Pr??paration
??tant donn?? qu'il est disponible dans le commerce, un sulfate de cuivre est g??n??ralement achet??, pas pr??par?? au laboratoire. Elle peut ??tre r??alis??e par l'action d' acide sulfurique sur une vari??t?? de cuivre (II) des compos??s, par exemple cuivre (II) oxyde. Cuivre (II) pentahydrate de sulfate d??compose avant de fondre, perdant quatre mol??cules d'eau ?? 110 ?? C et tous les cinq ?? 150 ?? C. A 650 ?? C, le cuivre (II) se d??compose en sulfate de cuivre (II) oxyde (CuO) et le trioxyde de soufre (SO 3). Lorsqu'il est chauff?? dans une flamme nue les cristaux sont d??shydrat??s et tournent blanc gris??tre.
Utilisations
A titre d'herbicide, un fongicide, un pesticide
Le sulfate de cuivre pentahydrate est un fongicide. M??lang?? avec la chaux, il est appel?? Bouillie bordelaise pour contr??ler champignon sur les raisins, melons et autres fruits, une autre application est Cheshunt compos??, un m??lange de sulfate de cuivre et le carbonate d'ammonium utilis?? dans l'horticulture pour emp??cher la fonte des semis des plantules. Son utilisation en tant que herbicide ne est pas l'agriculture, mais plut??t pour le contr??le des plantes aquatiques exotiques envahissantes et les racines d'autres plantes envahissantes pr??s diff??rents tuyaux qui contiennent de l'eau. Une solution dilu??e de sulfate de cuivre est utilis?? pour traiter les poissons d'aquarium de diverses infections parasitaires, et est ??galement utilis?? pour enlever les escargots aquariums. Cependant, comme les ions cuivre sont ??galement tr??s toxique pour les poissons, il faut veiller avec le dosage. La plupart des esp??ces d'algues peuvent ??tre contr??l??es avec de tr??s faibles concentrations de sulfate de cuivre. Le sulfate de cuivre inhibe la croissance de bact??ries telles que E. coli.
R??actif analytique
Plusieurs tests chimiques utilisent du sulfate de cuivre. Il est utilis?? dans Liqueur de Fehling et La solution de Beno??t pour tester sucres r??ducteurs, qui r??duisent le sulfate de cuivre soluble bleu (II) au rouge insoluble cuivre (I) oxyde. Sulfate de cuivre (II) est ??galement utilis?? dans le R??actif Biuret pour tester prot??ines.
Le sulfate de cuivre est ??galement utilis?? pour tester le sang pour l'an??mie . Le sang est test?? en le laissant tomber dans une solution de sulfate de cuivre connue de gravit?? sp??cifique - sang qui contient suffisamment h??moglobine coule rapidement en raison de sa densit??, tandis que le sang qui ne est pas, flotte ou coule lentement.
Dans un essai ?? la flamme, ses cuivre ions ??mettent une lumi??re bleu-vert profond, beaucoup plus bleu que le test de flamme pour le baryum .
Synth??se organique
Le sulfate de cuivre est utilis?? en synth??se organique. Le sel anhydre catalyse la trans ac??talisation en synth??se organique. Le sel hydrat?? r??agit avec le permanganate de potassium pour donner un oxydant pour la conversion des alcools primaires.
enseignement de la chimie
Le sulfate de cuivre est un produit chimique couramment inclus dans pour enfants ensembles de chimie et est souvent utilis?? pour produire des cristaux dans les ??coles et dans les exp??riences de placage de cuivre. En raison de sa toxicit??, il ne est pas recommand?? pour les petits enfants. Le sulfate de cuivre est souvent utilis?? pour d??montrer une r??action exothermique, dans lequel de laine d'acier ou de magn??sium ruban est plac?? dans un solution aqueuse de CuSO 4. Il est utilis?? dans scolaires chimie cours pour d??montrer le principe de hydratation min??rale. Le forme pentahydrate, qui est bleu, est chauff??e, tournant le sulfate de cuivre dans la forme anhydre qui est blanc, tandis que l'eau qui ??tait pr??sente dans la forme de pentahydrate ??vapore. Lorsque l'eau est ensuite ajout?? au compos?? anhydre, il tourne le dos ?? la forme de pentahydrate, retrouver sa couleur bleue.
Dans une illustration d'une ??r??action de substitution de m??tal unique," fer est immerg?? dans une solution de sulfate de cuivre. Au repos, dissout du fer et de pr??cipit??s de cuivre.
- CuSO 4 Fe + → FeSO 4 + Cu
Le cuivre peut ??galement ??tre ??lectrolytique au fer.
D'autres utilisations
D'autres applications incluent les cheveux colorants, coloration du verre, le traitement des cuir et textiles et en pyrotechnie comme un colorant vert.
