
Baryum
Contexte des ??coles Wikip??dia
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. enfants SOS a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Baryum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
56 Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris argent??  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | baryum, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / b ɛər Je ə m / -Əm de BAIR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??taux alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 2 (m??taux alcalino-terreux) , 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 137,327 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 6s 2 2, 8, 18, 18, 8, 2 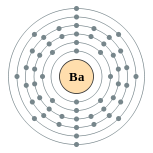 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 3,51 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 3,338 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1000 K , 727 ?? C, 1341 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 2170 K, 1897 ?? C, 3447 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,12 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 140,3 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 28,07 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 2 (Fortement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 0,89 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 502,9 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 965,2 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 3600 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 222 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 215 ?? 23 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 268 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centr??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 332 nΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 18,4 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 20,6 um ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 1,620 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 9,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 1,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de baryum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le baryum est un ??l??ment chimique avec le symbole Ba et de num??ro atomique 56. Ce est le cinqui??me ??l??ment du groupe 2, un mou argent?? m??tallique alcalino-terreux . En raison de sa haute chimique la r??activit?? de baryum ne est jamais trouv?? dans la nature comme un ??l??ment libre. Son hydroxyde a ??t?? connu dans l'histoire pr??-moderne baryte; cette substance ne se produit pas comme un min??ral, mais peut ??tre pr??par?? par chauffage de carbonate de baryum.
Les min??raux d'origine naturelle la plus courante de baryum sont la barytine (sulfate de baryum, BaSO 4) et with??rite (carbonate de baryum, BaCO 3), les deux ??tant insoluble dans l'eau. Le nom de baryum originaire de la d??riv??e alchimique "baryte", qui lui-m??me vient de grecs βαρύς (barys), ce qui signifie ??lourd??. Baryum a ??t?? identifi?? comme un ??l??ment nouveau en 1774, mais ne se r??duit pas ?? un m??tal jusqu'en 1808, peu de temps apr??s des techniques d'isolement ??lectrolytiques sont devenus disponibles.
Baryum a seulement quelques applications industrielles. Le m??tal a ??t?? historiquement utilis?? pour pi??ger air les tubes ?? vide. Ce est un composant de YBCO ( les supraconducteurs ?? haute temp??rature) et ??lectroc??ramique, et on ajoute ?? l'acier et fonte pour r??duire la taille des grains de carbone au sein de la microstructure du m??tal. Les compos??s de baryum sont ajout??s ?? des feux d'artifice pour donner une couleur verte. Le sulfate de baryum est utilis?? comme additif insoluble lourd ?? puits de p??trole fluide de forage, et dans une forme plus pure, comme X-ray radiocontrast agents pour l'imagerie du tractus gastro-intestinal humain. Compos??s solubles de baryum sont toxiques en raison de la lib??ration de l'ion de baryum soluble, et donc ont ??t?? utilis??s comme rodenticides.
Caract??ristiques
Propri??t??s physiques

Le baryum est un m??tal blanc argent?? doux, avec une l??g??re nuance d'or o?? ultrapure. La couleur blanc argent?? de baryum m??tallique dispara??t rapidement apr??s oxydation ?? l'air produisant une couche d'oxyde gris fonc??. Le baryum a un moyen poids sp??cifique et une bonne conductivit?? ??lectrique. Ultrapure baryum est tr??s difficile ?? pr??parer, et donc de nombreuses propri??t??s de baryum ont pas encore ??t?? mesur??e avec pr??cision.
A temp??rature et pression ambiantes, le baryum a une corps-structure cubique centr??e, avec une distance de baryum-baryum 503 picom??tres, l'expansion avec chauffage ?? une vitesse d'environ 1,8 x 10 -5 / ?? C. Ce est un m??tal tr??s doux avec une duret?? Mohs de 1,25. Sa temp??rature de fusion de 1 000 K (730 ?? C; 1 340 ?? F) est interm??diaire entre ceux du strontium briquet (1050 K, 780 ?? C; 1 430 ?? F) et le radium plus lourde (973 K, 700 ?? C; 1 292 ?? F) ; cependant, son point de 2170 K (1900 ?? C; 3450 ?? F) Point d'??bullition sup??rieur ?? celui du strontium (1655 K, 1382 ?? C; 2519 ?? F). La densit?? (3,62 g ?? cm -3) est de nouveau interm??diaires entre celles de strontium (2,36 g ?? cm -3) et le radium (~ 5 g ?? cm -3).
R??activit?? chimique
Le baryum est chimiquement similaire ?? magn??sium, calcium, strontium et, ??tant encore plus r??actif. Il pr??sente toujours l'??tat d'oxydation de +2. R??actions avec chalcog??nes sont tr??s exothermique (?? lib??rer l'??nergie); la r??action avec de l'oxyg??ne ou de l'air se produit ?? la temp??rature ambiante, et donc baryum est stock?? sous atmosph??re d'huile ou de gaz inerte. R??actions avec d'autres les non-m??taux, tels que le carbone, l'azote, le phosphore, le silicium et l'hydrog??ne, sont g??n??ralement exothermique et se d??roulent lors d'un chauffage. R??actions avec l'eau et les alcools sont ??galement tr??s exothermique et lib??rent de l'hydrog??ne gazeux:
- Ba 2 + ROH → Ba (OR) 2 + H 2 ↑ (R est un groupe alkyle ou un atome d'hydrog??ne)
En outre, le baryum r??agit avec l'ammoniac pour former des complexes tels que Ba (NH 3) 6.
Le m??tal est facilement attaqu?? par la plupart des acides. L'acide sulfurique est une exception notable, que passivation arr??te la r??action par la formation du insoluble le sulfate de baryum. Le baryum se combine avec plusieurs m??taux, y compris l'aluminium , le zinc , le plomb et l'??tain , formant phases interm??talliques et alliages.
Compos??s
| O 2- | S 2- | F - | Cl - | SO 2- 4 | CO 2- 3 | O 2- 2 | H - | |
|---|---|---|---|---|---|---|---|---|
| Ca 2+ | 3,34 | 2,59 | 3,18 | 2,15 | 2,96 | 2,83 | 2,9 | 1,7 |
| Sr 2+ | 5.1 | 3,7 | 4,24 | 3,05 | 3,96 | 3,5 | 4,78 | 3,26 |
| Ba 2+ | 5,72 | 4.3 | 2.1 | 1,9 | 4,49 | 4,29 | 4,96 | 4.16 |
| Zn 2+ | 5.6 | 4,09 | 4,9 | 2,09 | 3,8 | 4.4 | 1,57 | - |
sels de baryum sont g??n??ralement blanc lorsqu'ils sont solides et incolore lorsqu'il est dissous, les ions de baryum ne fournissent aucune coloration sp??cifique. Ils sont ??galement plus dense que leurs strontium ou calcium analogues, ?? l'exception de la halog??nures (voir tableau; zinc est donn?? ?? titre de comparaison).
Hydroxyde de baryum (??baryte??) a ??t?? connus pour alchimistes qui ont produit en chauffant du carbonate de baryum. Contrairement ?? l'hydroxyde de calcium, il absorbe tr??s peu de CO 2 dans des solutions aqueuses et est donc insensible aux variations atmosph??riques. Cette propri??t?? est utilis??e pour l'??talonnage des ??quipements de pH.
Compos??s de baryum volatiles br??lent avec un vert ?? vert p??le flamme, qui est un test efficace pour d??tecter un compos?? de baryum. Les r??sultats de couleur de raies spectrales ?? 455,4, 493,4, 553,6, et 611,1 nm.
Organobarium compos??s constituent une classe de compos??s de croissance: par exemple, dialkylbariums sont connus, comme le sont alkylhalobariums.
Isotopes
Baryum se produit naturellement sur Terre comme un m??lange de sept nucl??ides primordiaux, baryum-130, 132, et 134 ?? travers 138. Les deux premiers sont pens??s pour ??tre radioactifs: baryum-130 devrait se d??sint??grer au x??non-130 via deux d??sint??gration b??ta plus, et le baryum-132 devraient ??galement se d??sint??grer au x??non-132. Les demi-vies correspondantes devraient d??passer le ??ge de l'Univers par au moins mille fois. Les abondances sont ~ 0,1% par rapport ?? celle de baryum naturel. Leur radioactivit?? est si faible qu'ils ne posent pas de danger pour la vie. Sur les isotopes stables, le baryum-138 repr??sente 71,7% de l'ensemble de baryum et le briquet l'isotope, moins elle est abondante. Au total, le baryum a environ 50 isotopes connus, allant de masse entre 114 et 153. L'isotope m??tastable plus stable est le baryum-133, qui a une demi-vie d'environ 10,51 ann??es, et les cinq autres isotopes ont leur demi-vie plus longue que un jour. Baryum a aussi 10 Etats m??ta, dont baryum-133m1 est la plus stable, ayant une demi-vie d'environ 39 heures.
Histoire

Alchimistes au d??but du Moyen Age connaissaient certains min??raux de baryum. Pierres lisses de galets comme de barytine min??rale trouv??s dans Bologne , en Italie , ??taient connus comme "pierres de Bologne." Les sorci??res et les alchimistes ont ??t?? attir??s par eux parce que, apr??s exposition ?? la lumi??re qu'ils briller pendant des ann??es. Les propri??t??s phosphorescentes de barytine chauff??s avec des mati??res organiques ont ??t?? d??crits par V. Casciorolus en 1602.
Carl Scheele identifi?? barytine comme contenant un ??l??ment nouveau en 1774, mais n'a pas pu isoler de baryum, ne l'oxyde de baryum. Johan Gottlieb Gahn ??galement isol?? oxyde de baryum deux ans plus tard dans des ??tudes similaires. Baryum oxyd?? fut d'abord appel?? "barote," par Guyton de Morveau, un nom qui a ??t?? modifi?? par Antoine Lavoisier ?? baryte. Toujours dans le 18??me si??cle, anglais min??ralogiste William Withering a not?? un min??ral lourd dans les mines de plomb de Cumberland, maintenant connu pour ??tre with??rite. Baryum a ??t?? isol?? par ??lectrolyse de sels de baryum fondus en 1808, par Sir Humphry Davy en Angleterre . Davy, par analogie avec le calcium nomm?? "baryum" apr??s baryte, avec la "-ium" fin signifiant un ??l??ment m??tallique. Robert Bunsen et Auguste Matthiessen baryum obtenu pur par ??lectrolyse d'un m??lange fondu de le chlorure de baryum et chlorure d'ammonium.
La production d'oxyg??ne pur dans le Brin processus ??tait une application ?? grande ??chelle de peroxyde de baryum dans les ann??es 1880, avant qu'il ne soit remplac?? par ??lectrolyse et distillation fractionn??e de l'air liqu??fi?? dans le d??but des ann??es 1900. Dans ce proc??d??, l'oxyde de baryum r??agit ?? 500-600 ?? C (932-1112 ?? F) avec de l'air pour former du peroxyde de baryum, qui se d??compose au-dessus de 700 ?? C (1292 ?? F) en lib??rant de l'oxyg??ne:
- 2 BaO + O 2 ⇌ 2 BaO 2
En 1908, le sulfate de baryum a ??t?? appliqu?? en tant que Produit de contraste dans Imagerie par rayons X de l'appareil digestif.
Pr??sence et la production
L'abondance de baryum est 0,0425% dans la cro??te de la Terre et 13 ug / L dans l'eau de mer. La principale source commerciale de baryum est barytine (??galement appel??s barytine ou barytine), qui est un min??ral de sulfate de baryum. Ses d??p??ts sont r??partis partout dans le monde. La seule autre source commerciale est beaucoup moins importante que la barytine; il est with??rite, un min??ral de carbonate de baryum. Ses principaux gisements sont situ??s en Angleterre, la Roumanie et l'ex-URSS.



Les r??serves de barytine sont estim??s entre 0,7 et 2 milliards tonnes. La production maximale a ??t?? atteint en 1981, ?? 8,3 millions de tonnes, et seulement 7-8% de celui-ci a ??t?? utilis?? pour faire de baryum ou de ses compos??s. La production de barytine a de nouveau augment?? depuis la deuxi??me moiti?? des ann??es 1990: de 5,6 millions de tonnes en 1996 ?? 7,6 en 2005 et 7,8 en 2011. La Chine repr??sente plus de 50% de cette production, suivie par l'Inde (14% en 2011), Maroc (8,3%), Etats-Unis (8,2%), la Turquie (2,5%), l'Iran et le Kazakhstan (2,6% chacun).
Le minerai extrait est lav??, broy??, class??, et s??par??e de quartz. Si le quartz p??n??tre trop profond??ment dans le minerai, ou le fer, le zinc, ou la teneur en plomb est anormalement ??lev??, alors m??thodes de flottation par mousse sont appliqu??es. Le produit est une barytine pur ?? 98% (en masse); la puret?? doit pas ??tre inf??rieure ?? 95%, avec une teneur minimale en fer et dioxyde de silicium . Il est ensuite r??duit par le carbone au sulfure de baryum:
- BaSO 4 + 2 C → BaS + 2 CO 2 ↑
Le sulfure de baryum soluble dans l'eau est le point de d??part pour d'autres compos??s: BaS dissous par r??action avec l'oxyg??ne donne l'hydroxyde, avec de l'acide nitrique du nitrate, avec du dioxyde de carbone du carbonate, et ainsi de suite. Le nitrate peut ??tre d??compos?? thermiquement pour produire l'oxyde. Le baryum m??tallique est produit par r??duction avec de l'aluminium ?? 1100 ?? C (2010 ?? F). Le compos?? interm??tallique BaAl 4 est d'abord produit:
- 3 BaO + Al → 14 BaAl 4 3 + Al 2 O 3
Ce est un interm??diaire qui r??agit avec l'oxyde de baryum pour donner le m??tal. Notez que le baryum tout ne est pas r??duite.
- 8 BaO + BaAl 4 → Ba ↑ + 7 BaAl 2 O 4
L'oxyde de baryum restant r??agit avec l'oxyde d'aluminium form??:
- BaO + Al 2 O 3 → BaAl 2 O 4
et la r??action globale est
- 4 BaO + 2 Al → 3 Ba ↑ + BaAl 2 O 4
La vapeur de baryum ainsi produit est recueilli ?? la partie plus froide de l'appareil et ensuite emball?? dans des moules sous une atmosph??re d'argon. Cette m??thode est utilis??e dans le commerce et peut donner ultrapure baryum. Baryum est vendu couramment environ 99% pure, avec principales impuret??s ??tant du strontium et du calcium (jusqu'?? 0,8% et 0,25%) et d'autres contaminants contribuant pour moins de 0,1%.
Une r??action similaire avec du silicium ?? 1200 ?? C (2190 ?? F), on obtient le baryum et le baryum m??tasilicate. L'??lectrolyse est pas utilis?? car le baryum se dissout facilement dans halog??nures fondus et est plut??t impure lorsqu'il est isol?? avec cette m??thode.

Gemme
Un min??ral contenant du baryum benitoite (silicate de titane de baryum) se produit comme une pierre pr??cieuse bleue fluorescente tr??s rare, et ce est la pierre officielle de l'??tat de la Californie .
Applications
M??tal et alliages
Le baryum, en m??tal ou en alliage avec de l'aluminium, est utilis?? pour ??liminer les gaz non d??sir??s ( getter) de tubes ?? vide, comme les tubes cathodiques des t??l??viseurs. Le baryum est appropri?? ?? cette fin en raison de sa faible la pression de vapeur et la r??activit?? ?? l'oxyg??ne, l'azote, le dioxyde de carbone et de l'eau; il peut m??me ??liminer en partie les gaz rares en les dissolvant dans le r??seau cristallin. Cette application est progressivement en train de dispara??tre en raison de la popularit?? croissante de l'??cran LCD et plasma tubeless ensembles.
D'autres utilisations de baryum ??l??mentaire sont mineures et comprennent un additif ?? silumin (Les alliages aluminium-silicium) qui affine la structure, ainsi que
- portant alliages;
- plomb-??tain alliages de soudure - pour augmenter la r??sistance au fluage;
- alliage de nickel pour bougies;
- additif ?? l'acier et la fonte comme inoculant;
- alliages contenant du calcium, du mangan??se, du silicium et de l'aluminium de haute qualit?? comme d??soxydants de l'acier.
Le sulfate de baryum et la barytine

Le sulfate de baryum (barytine de la min??rale, BaSO 4) est importante pour l'industrie p??troli??re, par exemple, en tant que Fluide de forage ?? puits de p??trole et de gaz. Le pr??cipit?? du compos?? (appel?? ??blanc fixe", ?? partir d'une expression fran??aise qui signifie ??permanent blanc") est utilis?? dans les peintures et vernis, et aussi comme une charge dans sonner encre, les plastiques et les caoutchoucs. Ce est ??galement un pigment de couchage du papier. Dans la forme de nanoparticules, on peut am??liorer les propri??t??s physiques de certains polym??res, tels que les ??poxydes.
Le sulfate de baryum a une faible toxicit?? et relativement forte densit?? de ca. 4,5 g ?? cm -3 (et donc l'opacit?? aux rayons X). Pour cette raison, il est utilis?? en tant que Produit de contraste dans Imagerie par rayons X de l'appareil digestif (" baryum repas "et" lavements baryt??s ??). Lithopone, un pigment qui contient du sulfate de baryum et sulfure de zinc, est un blanc permanente qui a un bon pouvoir couvrant, et ne fonce pas lorsqu'ils sont expos??s ?? des sulfures.
D'autres compos??s du baryum

Mis ?? part le sulfate, d'autres compos??s de baryum ne trouvent que des applications de niche. Les applications sont limit??es par la toxicit?? des ions Ba 2+ (carbonate de baryum est un le poison ?? rat), qui ne est pas un probl??me pour l'insoluble BaSO 4.
- L'oxyde de baryum est utilis?? dans un rev??tement pour le des ??lectrodes les lampes fluorescentes, ce qui facilite la lib??ration des ??lectrons .
- Le carbonate de baryum est utilis?? en verrerie. ??tre un ??l??ment lourd, le baryum augmente la indice de r??fraction et l'??clat du verre. Le compos?? est ??galement utilis?? pour r??duire les fuites de rayons X ?? partir de tubes cathodiques (CRT) de postes de t??l??vision.
- De baryum, g??n??ralement sous forme nitrate de baryum, est ajout?? ?? des feux d'artifice pour les donner une couleur verte. Les esp??ces responsables du vert brillant est le baryum monochlorure; en l'absence de chlore d'une "pomme" jaune ou vert est produit ?? la place.
- Le peroxyde de baryum peut ??tre utilis?? en tant que catalyseur, pour fournir une r??action aluminothermique lors du soudage voies ferr??es ensemble. Il peut ??galement ??tre utilis?? en vert munitions tra??antes et comme agent de blanchiment.
- Le titanate de baryum est un prometteur ??lectroc??ramique.
- fluorure de baryum est utilis?? pour l'optique dans les applications infrarouges en raison de sa plage de transparence large de 0,15 ?? 12 microm??tres.
- YBCO a ??t?? le premier supraconducteur ?? haute temp??rature qui peut ??tre refroidi par l'azote liquide, en tant que sa temp??rature de transition de 93 K (-180,2 ?? C; -292,3 ?? F) a d??pass?? le point d'??bullition de l'azote (77 K, -196,2 ?? C; -321,1 ?? F) .
Dangers et pr??cautions biologiques
En raison de la forte r??activit?? du m??tal, les donn??es toxicologiques ne sont disponibles que pour les compos??s. Compos??s de baryum solubles dans l'eau sont toxiques. A faibles doses, des ions baryum agissent comme un stimulant du muscle, tandis que des doses plus ??lev??es affectent la syst??me nerveux, provoquant des irr??gularit??s cardiaques, tremblements, faiblesse, anxi??t??, dyspn??e et la paralysie. Cela peut ??tre d?? ?? la capacit?? de Ba 2+ pour bloquer les canaux ioniques de potassium, qui sont essentiels au bon fonctionnement du syst??me nerveux. Autres organes cibles pour les compos??s de baryum solubles dans l'eau (ce est ?? dire, des ions de baryum) sont les yeux, le syst??me immunitaire, le coeur, le syst??me respiratoire et la peau. Ils affectent le corps fortement, provoquant, par exemple, la c??cit?? et la sensibilisation.
Le baryum est pas canc??rig??ne, et ce ne est pas bioaccumulation. Cependant, d'inhalation de la poussi??re contenant des compos??s de baryum solubles peut se accumuler dans les poumons, causant une affection b??nigne appel??e barytose. Pour comparaison avec les poisons solubles, le sulfate insoluble est non toxique et ne est donc pas consid??r?? comme une marchandise dangereuse.
Pour ??viter une r??action chimique potentiellement vigoureuse, le baryum m??tallique est maintenue sous argon ou huiles min??rales. Contact avec l'air est dangereuse, car elle peut provoquer l'inflammation. L'humidit??, la friction, la chaleur, des ??tincelles, des flammes, des chocs, ??lectricit?? statique, des r??actions avec des oxydants et des acides doit ??tre ??vit??. Tout ce qui peut prendre contact avec le baryum devrait ??tre mise ?? la terre. Ceux qui travaillent avec le m??tal devrait porter des chaussures pr??alablement nettoy??es anti-??tincelles, des v??tements en caoutchouc ignifuges, des gants en caoutchouc, un tablier, des lunettes et un masque ?? gaz; ils ne sont pas autoris??s ?? fumer dans la zone de travail et doivent se laver apr??s la manipulation de baryum.
