
Ytterbium
Saviez-vous ...
Enfants SOS offrent un chargement complet de la s??lection pour les ??coles pour une utilisation sur les intranets des ??coles. parrainage SOS enfant est cool!
| Ytterbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
70 Yb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argent??  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | ytterbium, Yb, 70 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɨ t ɜr b Je ə m / i- TUR -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | lanthanides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 173,054 (5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 14 6s 2 2, 8, 18, 32, 8, 2 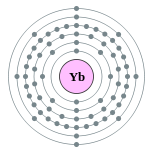 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Jean Charles Galissard de Marignac (1878) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Georges Urbain (1907) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 6,90 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 6,21 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1097 K , 824 ?? C, 1515 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 1469 K, 1196 ?? C, 2185 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,66 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 159 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 26,74 J ?? mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 ( oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | ? 1,1 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 603,4 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1174,8 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2417 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 176 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 187 ?? 20 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (β, le poly) 0,250 μΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 38,5 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (β, poly) 26,3 um / (m ?? K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 1,590 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Sous forme de β) 23,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Sous forme de β) 9,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Sous forme de β) 30,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Sous forme de β) 0,207 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 206 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 343 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-64-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'ytterbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ytterbium est un ??l??ment chimique avec le symbole Yb et le num??ro atomique 70. Ce est l'??l??ment quatorzi??me et avant-dernier dans le lanthanide s??rie, ou dernier ??l??ment de la f-bloc, qui est la base de la stabilit?? relative de la 2 ??tat d'oxydation . Cependant, comme les autres lanthanides, ??tat d'oxydation le plus commun est 3, vu dans son oxyde, des halog??nures et d'autres compos??s. En solution aqueuse, comme d'autres compos??s de lanthanides fin, des compos??s solubles dans l'ytterbium former des complexes avec neuf mol??cules d'eau. En raison de sa configuration ferm??e d'??lectrons-coquille, ses points de densit?? et de fusion et d'??bullition diff??rent de celles des autres lanthanides.
En 1878, le chimiste suisse Jean Charles Galissard de Marignac s??par?? dans la terre "erbia?? rare un autre composant ind??pendant, qu'il a appel?? "ytterbium", pour Ytterby, village de Su??de pr??s du lieu o?? il a trouv?? la nouvelle composante de l'erbium . Il soup??onne que ytterbia ??tait un compos?? d'un ??l??ment nouveau qu'il a appel?? "l'ytterbium" (au total, quatre ??l??ments ont ??t?? nomm??s apr??s le village, les autres ??tant l'yttrium , le terbium et l'erbium). En 1907, la nouvelle terre "lutecia" a ??t?? s??par?? de ytterbium, ?? partir de laquelle l'??l??ment "lut??cium" (maintenant le lut??tium ) a ??t?? extrait par Georges Urbain, Carl Auer von Welsbach, et Charles James. Apr??s discussion, le nom "l'ytterbium" de Marignac a ??t?? retenu. Un ??chantillon relativement pur du m??tal a ??t?? obtenue seulement en 1953. ?? l'heure actuelle, l'ytterbium est principalement utilis?? en tant que dopant en acier inoxydable ou support actif laser, et moins souvent en source de rayons gamma.
Ytterbium naturel est un m??lange de sept isotopes stables, qui sont tout ?? fait pr??sent ?? des concentrations de 3 parties par million. Cet ??l??ment est extrait en Chine, aux ??tats-Unis, le Br??sil et l'Inde en forme des min??raux monazite, euxenite, et x??notime. La concentration d'ytterbium est faible, parce que l'??l??ment se trouve parmi beaucoup d'autres ??l??ments de terres rares; en outre, il est parmi les moins abondantes. Une fois extrait et pr??par??, l'ytterbium est un peu dangereux comme un irritant pour les yeux et la peau. Le m??tal est un risque d'incendie et d'explosion.
Caract??ristiques
Propri??t??s physiques
Ytterbium est un doux, mall??able et ductile ??l??ment chimique qui affiche un argent?? clair lustre lorsqu'il est dans sa forme pure. C'est un ??l??ment des terres rares, et il est facilement attaqu?? et dissous par la forte des acides min??raux. Il r??agit lentement avec le froid de l'eau et il oxyde lentement ?? l'air.
Ytterbium a trois allotropes marqu??s par les lettres grecques alpha, b??ta et gamma; leurs temp??ratures de transformation sont -13 ?? C et 795 ?? C, bien que la temp??rature de transformation exacte d??pend de la pression et stress. Le allotrope b??ta existe ?? la temp??rature ambiante, et il a une cubique ?? faces centr??es la structure cristalline. La forme allotropique gamma ?? haute temp??rature a une corps-centr??e structure cristalline cubique. La forme allotropique alpha a une la structure cristalline hexagonale et est stable ?? basse temp??rature. Normalement, le allotrope b??ta a une m??tallique conductivit?? ??lectrique, mais il devient un semi-conducteur lorsqu'elle est expos??e ?? une pression d'environ 16 000 atmosph??res (1,6 GPa). Son ??lectrique r??sistivit?? augmente dix fois lors de la compression ?? 39 000 atmosph??res (3,9 GPa), mais tombe ?? environ 10% de sa r??sistivit?? ?? la temp??rature ambiante ?? environ 40 000 atm (4,0 GPa).
Par contraste avec les autres m??taux des terres rares, qui ont habituellement antiferromagn??tique et / ou propri??t??s ferromagn??tiques ?? basses temp??ratures , l'ytterbium est paramagn??tique ?? des temp??ratures sup??rieures ?? 1,0 kelvin . Cependant, la forme allotropique alpha est diamagn??tique. Avec un point de fusion de 824 ?? C et un point d'??bullition de 1196 ?? C, l'ytterbium a la plus petite gamme de liquides de tous les m??taux.
Ytterbium a une densit?? de 6,973 g / cm 3, ce qui est nettement inf??rieur ?? celui des voisins les lanthanides, le thulium (9,32 g / cm 3) et le lut??tium (9,841 g / cm 3). Les points de fusion et d'??bullition sont ??galement nettement inf??rieurs ?? ceux de thulium et le lut??tium. Cela est d?? ?? la configuration ferm??e coquille ??lectronique d'ytterbium ([Xe] 4f 14 6s 2), ce qui entra??ne que les deux ??lectrons 6s d'??tre disponible pour la liaison m??tallique (?? la diff??rence des trois autres lanthanides o?? des ??lectrons sont disponibles) et de l'ytterbium r??duit rayon m??tallique.
Propri??t??s chimiques
M??tal ytterbium ternit lentement ?? l'air. Ytterbium finement dispers?? oxyde rapidement dans l'air et sous oxyg??ne. Les m??langes de poudre avec de l'ytterbium polyt??trafluoro??thyl??ne ou hexachloro??thane br??ler avec une flamme de couleur vert ??meraude lumineux. Ytterbium r??agit avec l'hydrog??ne pour former divers non-stoechiom??trique hydrures. Ytterbium se dissout lentement dans l'eau, mais rapidement dans les acides, lib??rant de l'hydrog??ne gazeux.
Ytterbium est assez ??lectropositive, et il r??agit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former ytterbium (III) hydroxyde:
- Yb 2 (s) + 6 H 2 O (l) → 2 Yb (OH) 3 (aq) + 3 H 2 (g)
Ytterbium r??agit avec tous les atomes d'halog??ne :
- 2 YB (s) + 3 F 2 (g) → 2 YbF 3 (s) [blanc]
- 2 YB (s) + 3 Cl 2 (g) → 2 YbCl 3 (s) [blanc]
- 2 YB (s) + 3 Br 2 (g) → 2 YbBr 3 (s) [blanc]
- 2 YB (s) + 3 I 2 (g) → 2 ybi 3 (s) [blanc]
L'ytterbium (III) ions absorbe la lumi??re dans la gamme de longueurs d'onde du proche infrarouge, mais pas dans la lumi??re visible , de sorte que le min??ral ytterbium, Yb 2 O 3, est de couleur blanche et les sels de l'ytterbium sont ??galement incolore. Ytterbium dilu?? dissout facilement dans l'acide sulfurique pour former des solutions qui contiennent les Yb (III) des ions incolores, qui existent comme des complexes nonahydrat??:
- 2 YB (s) + 3 H 2 SO 4 (aq) → 2 [YB (H 2 O) 9] 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
YB (II) contre YB (III)
Bien que g??n??ralement trivalent, l'ytterbium forme facilement des compos??s bivalents. Ce comportement est inhabituel pour la plupart des lanthanides , qui forment presque exclusivement compos??s avec un ??tat d'oxydation de +3. L'??tat 2 a une valence configuration d'??lectrons de 4 f f 14, car le -shell enti??rement rempli donne une plus grande stabilit??. L'ytterbium jaune-vert (II) ion est une tr??s forte agent r??ducteur et d??compose l'eau, lib??rant l'hydrog??ne gaz, et donc seulement l'ytterbium incolore (III) ions se produit dans solution aqueuse. samarium et le thulium se comportent de cette fa??on dans l'??tat 2, mais l'europium (II) est stable en solution aqueuse. Ytterbium (II) se comporte de mani??re similaire ?? l'europium (II) et les m??taux alcalino-terreux, en dissolvant dans de l'ammoniac pour former bleue sels electride.
Isotopes
Ytterbium naturel est compos?? de sept stables isotopes : 168 Yb, 170 Yb, 171 Yb, 172 Yb, 173 Yb, 174 Yb, et 176 Yb, avec 174 Yb ??tant l'isotope le plus abondant, ?? 31,8% de la abondance naturelle). 27 des radio-isotopes ont ??t?? observ??es, avec les plus stables ??tant 169 Yb avec une demi-vie de 32,0 jours, 175 Yb avec une demi-vie de 4,18 jours et 166 Yb avec une demi-vie de 56,7 heures. Tout le reste de ses isotopes radioactifs ont des demi-vies qui sont moins de deux heures et la plupart d'entre eux ont des demi-vies sont ?? moins de 20 minutes. Ytterbium a ??galement 12 ??tats m??ta, avec l'??tre le plus stable 169m YB (t ?? 46 secondes).
Les isotopes de gamme de l'ytterbium dans poids atomique de 147.9674 unit?? de masse atomique (u) pour 148 Yb ?? 180,9562 U pour 181 Yb. Le primaire mode d'ytterbium de d??sint??gration des isotopes plus l??ger que l'isotope stable le plus abondant, 174 Yb, est capture d'??lectrons, et le mode de d??sint??gration primaire pour ceux plus lourd que 174 Yb est d??sint??gration b??ta. Le primaire produits de d??sint??gration des isotopes plus l??gers que l'ytterbium Yb 174 est thulium isotopes, et les produits de d??sint??gration d'isotopes primaires avec d'ytterbium Yb plus lourd que 174 sont lut??tium isotopes.
Occurrence

Ytterbium se trouve avec d'autres ??l??ments de terres rares rares dans plusieurs min??raux . Il est le plus souvent retrouv?? dans le commerce aupr??s le sable monazite (0,03% d'ytterbium). L'??l??ment se trouve aussi dans eux??nite et x??notime. Les principales zones mini??res sont la Chine , le Royaume-Unis , le Br??sil , l'Inde , le Sri Lanka et l'Australie ; et les r??serves de l'ytterbium sont estim??s ?? un million tonnes. Ytterbium est normalement difficile de s??parer d'autres terres rares, mais ??change d'ions et techniques d'extraction par solvant d??velopp??es dans le milieu et la fin du 20e si??cle ont simplifi?? s??paration. Connus des compos??s de l'ytterbium sont rares et ne ont pas encore ??t?? bien caract??ris??s. L'abondance de l'ytterbium dans la cro??te de la Terre est d'environ 3 mg / kg.
En tant que lanthanide de num??ro pair, conform??ment ?? la Oddo r??gle-Harkins, l'ytterbium est nettement plus abondante que ses voisins imm??diats, le thulium et le lut??cium , qui se produisent dans la m??me concentr?? ?? des niveaux d'environ 0,5% chacun. La production mondiale de l'ytterbium est seulement d'environ 50 tonnes par an, refl??tant le fait que l'ytterbium a quelques applications commerciales. Traces microscopiques d'ytterbium sont utilis??s en tant que dopant dans la Yb: YAG, un laser ?? l'??tat solide dans lequel l'ytterbium est l'??l??ment qui subit ??mission stimul??e de rayonnement ??lectromagn??tique .
Production
Il est quelque peu difficile de l'ytterbium s??par?? des autres lanthanides raison de ses propri??t??s similaires. En cons??quence, le processus est un peu longue. Premi??res, des min??raux tels que monazite ou x??notime sont dissous dans divers acides, tels que l'acide sulfurique . Ytterbium peut alors ??tre s??par?? des autres lanthanides par ??change d'ions, comme d'autres lanthanides. La solution est ensuite appliqu??e ?? un r??sine, qui diff??rentes lanthanides liaison ?? diff??rents en mati??re. Ce est alors dissous l'aide des agents complexants, et en raison des diff??rents types de liaison pr??sent??e par les lanthanides diff??rents, il est possible d'isoler les compos??s.
Ytterbium est s??par?? des autres terres rares, soit par l'??change d'ions ou par r??duction avec un amalgame de sodium. Dans ce dernier proc??d??, une solution acide tamponn??e de terres rares trivalentes est trait??e avec un alliage en fusion sodium-mercure, ce qui r??duit dissout et Yb 3+. L'alliage est trait?? avec de l'acide chlorhydrique. Le m??tal est extrait de la solution sous forme d'oxalate et converti en oxyde par chauffage. L'oxyde est r??duit en m??tal par chauffage avec le lanthane , l'aluminium , le c??rium ou le zirconium dans un vide pouss??. Le m??tal est purifi?? par sublimation et recueillies sur une plaque condens??e.
Compos??s

Le comportement de l'ytterbium chimique est similaire ?? celle du reste des lanthanides . La plupart des compos??s d'ytterbium se trouvent dans l'??tat d'oxydation +3 et de ses sels dans cet ??tat d'oxydation sont presque incolore. Comme l'europium , le samarium et le thulium , de l'ytterbium les trihalog??nures peuvent ??tre r??duits par l'hydrog??ne , zinc de la poussi??re, ou par l'addition d'ytterbium pour les dihalog??nures m??talliques. L'??tat d'oxydation +2 ne se produit que dans des compos??s solides et r??agit ?? certains ??gards, est similaire aux m??taux alcalino-terreux des compos??s; par exemple, l'ytterbium (II) oxyde (Ybo) montre la m??me structure que l'oxyde de calcium (CaO).
Halog??nures

les deux formes d'Ytterbium des dihalog??nures et des trihalog??nures avec les atomes d'halog??ne fluor , chlore , brome et iode . Les dihalog??nures sont sensibles ?? l'oxydation pour les trihalog??nures ?? la temp??rature ambiante et hors de proportion avec les trihalog??nures et ytterbium m??tallique ?? haute temp??rature:
Certains halog??nures d'ytterbium sont utilis??s comme r??actifs dans synth??se organique. Par exemple, ytterbium (III) chlorure (YbCl 3) est un Et un acide de Lewis peut ??tre utilis?? en tant que catalyseur dans l' aldol et R??actions de Diels-Alder. Ytterbium (II) d'iodure (YBI 2) peut ??tre utilis??, comme samarium (II) de l'iodure, en tant que agent r??ducteur pour r??actions de couplage. Ytterbium (III) fluorure (YbF 3) est utilis?? comme inerte et non toxique le remplissage de la dent, car elle lib??re en continu ions fluorures, ce qui est bon pour la sant?? dentaire, et est ??galement un bon Des rayons X de l'agent de contraste.
Oxydes
Ytterbium r??agit avec l'oxyg??ne pour former ytterbium (III) oxyde (Yb 2 O 3), qui cristallise dans la structure "de terres rares de type C sesquioxyde?? qui est li?? ?? la la structure fluorite avec un quart des anions enlev??s, conduisant ?? des atomes d'ytterbium dans deux six coordonner diff??rents environnements (non-octa??driques). Ytterbium (III) de l'oxyde peut ??tre r??duite ?? ytterbium (II) oxyde (Ybo) avec ytterbium ??l??mentaire, qui cristallise dans la m??me structure que le chlorure de sodium .
Histoire

Ytterbium ??tait d??couvert par le chimiste suisse Jean Charles Galissard de Marignac en l'ann??e 1878. Alors que l'examen d'??chantillons de gadolinite, Marignac a trouv?? un nouveau composant dans la terre alors connu comme erbium, et il l'a nomm?? ytterbium, pour Ytterby, le Su??dois village proche o?? il a trouv?? la nouvelle composante de l'erbium. Marignac soup??onne que ytterbia ??tait un compos?? d'un ??l??ment nouveau qu'il a appel?? "l'ytterbium".
En 1907, le chimiste fran??ais Georges Urbain s??parait la ytterbia de Marignac en deux composantes: neoytterbia et lutecia. Neoytterbia deviendra plus tard connu comme l'??l??ment d'ytterbium, et lutecia serait connu plus tard comme l'??l??ment le lut??cium . Le chimiste autrichien Carl Auer von Welsbach ind??pendamment isol?? ces ??l??ments de ytterbia ?? peu pr??s au m??me moment, mais il les appelait aldebaranium et cassiopeium; le chimiste am??ricain Charles James a ??galement ind??pendamment isol?? ces ??l??ments ?? peu pr??s au m??me moment. Urbain et Welsbach accusent mutuellement de la publication des r??sultats sur la base de l'autre partie. La Commission sur la masse atomique, compos?? de Frank Wigglesworth Clarke, Wilhelm Ostwald, et Georges Urbain, qui ??tait alors responsable de l'attribution de nouveaux noms d'??l??ments, a r??gl?? le diff??rend en 1909 en accordant la priorit?? ?? Urbain et l'adoption de ses noms comme ceux officielles, bas??es sur le fait que la s??paration des lut??cium de la ytterbium de Marignac ??tait d'abord d??crit par Urbain; apr??s les noms de Urbain ont ??t?? reconnus, neoytterbium a ??t?? revenue ?? l'ytterbium.
Les propri??t??s chimiques et physiques de l'ytterbium n'a pu ??tre d??termin??e avec pr??cision jusqu'en 1953, lorsque le premier ytterbium m??tal presque pur a ??t?? produit ?? l'aide processus d'??change d'ions. Le prix de l'ytterbium a ??t?? relativement stable entre 1953 et 1998 ?? environ US $ 1,000 / kg.
Applications
Dopage de l'acier inoxydable
Ytterbium peut ??galement ??tre utilis?? en tant que dopant pour aider ?? am??liorer l'affinage du grain, de la force, et d'autres propri??t??s m??caniques des acier inoxydable. Certains ytterbium alliages ont rarement ??t?? utilis?? dans dentisterie.
Autres
M??tal ytterbium augmente sa r??sistivit?? ??lectrique lorsqu'il est soumis ?? de fortes contraintes. Cette propri??t?? est utilis??e dans des jauges de contraintes pour surveiller d??formations du sol des tremblements de terre et des explosions.
Les ondes lumineuses vibrent plus vite que les micro-ondes, et donc horloges optiques peuvent ??tre plus pr??cis que c??sium horloges atomiques. Le Physikalisch-Technische Bundesanstalt (PTB) travaille sur plusieurs de ces horloges optiques. Le mod??le avec un ion d'ytterbium unique pris dans un pi??ge ?? ions est tr??s pr??cis. L'horloge optique bas?? sur il est exact de 17 chiffres apr??s la virgule.
Actuellement, l'ytterbium est ?? l'??tude comme un remplacement possible pour le magn??sium en haute densit?? charges pyrotechniques pour cin??matique fus??es-leurres infrarouges. Comme ytterbium (III) a un oxyde significativement plus ??lev??s ??missivit?? dans l'infrarouge que l'oxyde de magn??sium, une intensit?? de rayonnement plus ??lev??e est obtenue avec des charges ?? base d'ytterbium par rapport ?? ceux qui sont couramment bas?? sur magn??sium / t??flon / viton (MTV).
Pr??cautions
Bien ytterbium est assez stable chimiquement, il est stock?? dans des r??cipients ??tanches ?? l'air et dans une atmosph??re inerte telle qu'une bo??te s??che remplie d'azote pour prot??ger le m??tal de l'air et de l'humidit??. Tous les compos??s de l'ytterbium sont trait??s comme hautement toxique, bien que des ??tudes initiales semblent indiquer que le danger est minime. compos??s ytterbium sont, cependant, connus pour provoquer une irritation de la peau humaine et les yeux, et certains pourraient ??tre t??ratog??ne. La poussi??re d'ytterbium m??tallique peut se enflammer spontan??ment, et les fum??es r??sultant sont dangereux. feux de Ytterbium ne peuvent pas ??tre ??teint avec de l'eau, et seulement un produit chimique sec classe D extincteurs peuvent ??teindre les incendies.
