
Indium
Contexte des ??coles Wikip??dia
SOS Enfants a essay?? de rendre le contenu plus accessible Wikipedia par cette s??lection des ??coles. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Indium | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
49 En | |||||||||||||||||||
| |||||||||||||||||||
| Apparence | |||||||||||||||||||
gris argent?? brillant  | |||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||
| Nom, symbole, nombre | indium, In, 49 | ||||||||||||||||||
| Prononciation | / ɪ n r?? Je ə m / EN -dee-əm | ||||||||||||||||||
| Cat??gorie Metallic | post-m??tal de transition | ||||||||||||||||||
| Groupe, p??riode, bloc | 13, 5, p | ||||||||||||||||||
| Poids atomique standard | 114,818 | ||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 4d 10 5s 2 5p 1 2, 8, 18, 18, 3 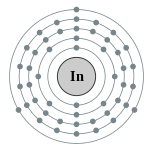 | ||||||||||||||||||
| Histoire | |||||||||||||||||||
| D??couverte | Ferdinand Reich et Hieronimus Theodor Richter (1863) | ||||||||||||||||||
| Premier isolement | Hieronimus Theodor Richter (1867) | ||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||
| Phase | solide | ||||||||||||||||||
| Densit?? (?? proximit?? rt) | 7,31 g ?? cm -3 | ||||||||||||||||||
| Liquid densit?? au mp | 7,02 g ?? cm -3 | ||||||||||||||||||
| Point de fusion | 429.7485 K , 156.5985 ?? C, ?? F 313.8773 | ||||||||||||||||||
| Point d'??bullition | 2345 K, 2072 ?? C, 3762 ?? F | ||||||||||||||||||
| La chaleur de fusion | 3,281 kJ ?? mol -1 | ||||||||||||||||||
| Chaleur de vaporisation | 231,8 kJ ?? mol -1 | ||||||||||||||||||
| Capacit?? thermique molaire | 26,74 J ?? mol -1 .K -1 | ||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||
| |||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 ( l'oxyde amphot??re) | ||||||||||||||||||
| ??lectron??gativit?? | 1,78 (??chelle de Pauling) | ||||||||||||||||||
| ??nergies d'ionisation | 1e: 558,3 kJ ?? mol -1 | ||||||||||||||||||
| 2??me: 1820,7 kJ ?? mol -1 | |||||||||||||||||||
| 3??me: 2704 kJ ?? mol -1 | |||||||||||||||||||
| Rayon atomique | 167 h | ||||||||||||||||||
| Rayon covalente | 142 ?? 17 heures | ||||||||||||||||||
| Rayon de Van der Waals | 193 h | ||||||||||||||||||
| Miscellan??es | |||||||||||||||||||
| Crystal structure | quadrilat??re  | ||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 83,7 nΩ ?? m | ||||||||||||||||||
| Conductivit?? thermique | 81,8 W ?? m -1 ?? K -1 | ||||||||||||||||||
| Dilatation thermique | (25 ?? C) 32,1 um ?? m -1 ?? K -1 | ||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 1,215 m ?? s -1 | ||||||||||||||||||
| Le module d'Young | 11 GPa | ||||||||||||||||||
| Duret?? Mohs | 1.2 | ||||||||||||||||||
| Duret?? Brinell | 8,83 MPa | ||||||||||||||||||
| Num??ro de registre CAS | 7440-74-6 | ||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||
| Article d??taill??: Isotopes d'indium | |||||||||||||||||||
| |||||||||||||||||||
Indium est un ??l??ment chimique avec le symbole In et de num??ro atomique 49. Cette rare, tr??s mou, mall??able et facilement fusible post-m??tal de transition est chimiquement similaire ?? gallium et le thallium , et pr??sente des propri??t??s interm??diaires entre ces deux. Indium a ??t?? d??couvert en 1863 et nomm?? pour le indigo ligne bleue dans son spectre qui ??tait la premi??re indication de son existence dans les minerais de zinc, comme un ??l??ment nouveau et inconnu. Le m??tal a ??t?? isol?? pour la premi??re l'ann??e suivante. Minerais de zinc continuent d'??tre la principale source d'indium, o?? il se trouve sous forme de compos??. Tr??s rarement l'??l??ment peut ??tre trouv?? que des grains de maternelle (gratuit) m??tal, mais ce ne sont pas d'une importance commerciale.
Application principale actuelle de l'indium est de former des ??lectrodes transparentes de oxyde d'indium-??tain (ITO) en ??crans ?? cristaux liquides et ??crans tactiles, et cette utilisation d??termine largement sa production mini??re mondiale. Il est largement utilis?? dans les films minces pour former des couches lubrifi??s (pendant la Seconde Guerre mondiale , il a ??t?? largement utilis?? pour les roulements de manteau en haute performance avions ). Il est ??galement utilis?? pour la fabrication de point de fusion particuli??rement bas alliages, et est un composant dans certaines soudures sans plomb.
L'indium ne est pas connu pour ??tre utilis?? par ne importe quel organisme. D'une mani??re similaire ?? des sels d'aluminium, l'indium (III) des ions peut ??tre toxique pour les reins lorsqu'il est administr?? par injection, mais des compos??s d'indium orale ne ont pas la toxicit?? chronique de sels de m??taux lourds, probablement due ?? une mauvaise absorption dans des conditions basiques. Radioactifs indium-111 (en tr??s petites quantit??s sur une base chimique) est utilis??e dans tests de m??decine nucl??aire, en tant que radiotraceur de suivre le mouvement des prot??ines marqu??es et des globules blancs dans le corps.
Caract??ristiques
Physique

Indium est un tr??s doux, silvery- blanc, relativement rare pauvre en m??taux avec un brillant lustre. Quand il est pli??, l'indium ??met un aigu " pleurer ". Comme le gallium , l'indium est capable de verre mouill??. Indium a un faible point de fusion , 156,60 ?? C (313,88 ?? C); elle est plus ??lev??e que celle de son homologue plus l??ger, le gallium , mais inf??rieur ?? celui de l'homologue plus lourd, le thallium . Son point d'??bullition est cependant mod??r??e, soit 2072 ?? C (3762 ?? F), qui est sup??rieure ?? celle de thallium, mais inf??rieure ?? celle du gallium, montrant opposition ?? la tendance des points de fusion. La densit?? de l'indium, 7,31 g ?? cm -3, est ??galement plus ??lev??e que celle de gallium, mais inf??rieure ?? celle de thallium.
Un atome d'indium a 49 ??lectrons, ayant une configuration ??lectronique de [ Kr ] 4d 10 5s 2 5p 1. Dans ses compos??s, de l'indium perd le plus souvent trois ??lectrons les plus externes, devenant indium (III) des ions In 3+, mais dans certains cas la paire d'??lectrons 5s peut rester ?? l'int??rieur de l'atome, de l'indium oxyd?? ainsi que d'indium (I), In +. Cela est d?? ?? inerte effet de couple, ce qui se produit en raison de la stabilisation de 5s-orbital en raison des effets relativistes, plus fortes plus pr??s du fond de la table p??riodique . thallium montre un effet encore plus forte, ce qui rend l'oxydation de thallium (I) plus susceptibles que de thallium ( III), ce qui rend plus probable une ??tat d'oxydation .
Un certain nombre de potentiels d'??lectrode standard, en fonction de la r??action ?? l'??tude, sont signal??s pour l'indium:
Click on the following link to visit or download this HTML page
| -0,40 | Dans 2+ + e - | In + ↔ |
| -0,49 | Dans 3+ + e - | ↔ En 2+ |
| -0,443 | Dans 3+ + 2 e - | In + ↔ |
| -0,3382 | Dans 3+ + 3 e - | Dans ↔ |
| -0,14 | En + + e - | Dans ↔ |
Chimique
L'indium est un post-m??tal de transition et chimiquement, est l'??l??ment interm??diaire entre sa groupe 13 voisins gallium et le thallium . Il montre deux principaux ??tats d'oxydation, qui sont une et trois, avec ce dernier ??tant plus stable, alors que le seul ??tat d'oxydation commun de gallium et le thallium est 3 montre une plus susceptibles que les trois, au thallium (III) ??tant une mod??r??ment forte agent oxydant, tandis que l'indium (III) est stable et l'indium (I) est un puissant agent r??ducteur.
L'indium ne r??agit pas avec l'eau, mais il est oxyd?? par des agents oxydants forts, tels que des halog??nes ou l'acide oxalique, pour donner des compos??s d'indium (III). Il ne r??agit pas avec le bore , le silicium ou le carbone , et le correspondant borure, siliciure ou carbure ne sont pas connus. De m??me, la r??action entre l'indium et de l'hydrog??ne n'a pas ??t?? observ??e, mais les deux indium (I) et d'indium (III) des hydrures sont connus.
Indium (III) oxyde est form??e ?? des temp??ratures chaudes pendant la r??action entre l'indium et de l'oxyg??ne, avec une flamme bleue. Il est amphot??re, ?? savoir il peut r??agir avec les acides et les bases. Sa r??action avec les r??sultats de l'eau insoluble dans l'indium (III) d'hydroxyde, qui est aussi actif amphot??re, en faisant r??agir avec des alcalis pour donner indates (III) et d'un acide, pour donner l'indium (III) des sels:
- In (OH) 3 + 2 NaOH → 2 Na [InO 2] + H 2 O
- In (OH) 3 + HCl → InCl 3 3 3 + H 2 O
L'hydrolyse de indate de sodium (III) donne l'acide indic faible, Hino 2. Out d'indium commune sels (III), le chlorure, sulfate et nitrate sont solubles. Dans les solutions de l'eau, Dans 3+ et [InO 2] - ions sont hydrolys??es pour donner Inoh 2+ et Hino 2 en raison de caract??re g??n??ralement amphot??re d'indium des ions (III). Indium compos??s (III) ne sont pas bien soluble, de fa??on similaire ?? thallium (III) compos??s; Toutefois, l'indium (III) les sels d'acides forts tels que le chlorure, le sulfate et le nitrate sont solubles, l'hydrolyse dans des solutions aqueuses. Le In 3+ ion en solution est incolore en raison de l'absence d'??lectrons non appari??s dans les d et f ??lectrons coquilles.
Indium (I) compos??s ne sont pas aussi commun que l'indium de ceux (III); que chlorure, bromure, iodure, sulfure et cyclopentadi??nyle sont bien caract??ris??s. Indium (I) sulfure est le produit de r??action entre le soufre et l'indium ou de l'indium et sulfure d'hydrog??ne, et peut ??tre re??u ?? 700-1000 ?? C. Indium (I) de l'oxyde de poudre noire est re??u ?? 850 ?? C pendant la r??action entre l'indium et le dioxyde de carbone ou durant la d??composition de l'indium (III) de l'oxyde ?? 1200 ?? C. Cyclopentadienylindium (I), qui est le premier compos?? organoindium (I) rapport??, est un polym??re constitu?? de cha??nes en zig-zag de l'alternance des atomes d'indium et les complexes de cyclopentadi??nyle.
Moins fr??quemment, l'indium montre l'??tat d'oxydation interm??diaire 2, qui se trouve entre les communes, notamment dans halog??nures, en 2 X 4 et [A 2 X 6] 2-. Plusieurs autres compos??s sont connus pour combiner indium (I) et d'indium (III), comme dans I 6 (En III Cl 6) Cl 3, Dans I 5 (En III Br 4) 2 (III Dans Br 6), Dans I Dans III Br 4.
Isotopes
L'indium est pr??sent naturellement sur terre que dans deux nucl??ides primordiaux, l'indium-113 et l'indium-115. Sur ce deux, l'indium-115 repr??sente 95,7% de l'ensemble de l'indium mais il est radioactif, se d??sint??grant en ??tain-115 via d??sint??gration b??ta avec demi-vie de 4,41 ?? 10 14 ann??es, quatre ordres de grandeur plus grand que l'??ge de l'univers et pr??s de 50 000 fois plus longue que celle des ressources naturelles du thorium . Cette situation est rare parmi les ??l??ments chimiques stables; que l'indium, le tellure et le rh??nium se sont r??v??l??s avoir des isotopes les plus abondantes qui sont radioactifs. L'isotope naturel moins fr??quente de l'indium, de l'indium-113, est stable.
Indium a 39 isotopes connus, allant de masse entre 97 et 135. Un seul d'entre eux est stable et a une demi-vie de plus de 10 14 ann??es; plus stable autre isotope d'indium est le l'indium-111, qui a une demi-vie d'environ 2,8 jours. Tous les autres isotopes ont une demi-vie plus courte de 5 heures. Indium a aussi 47 m??ta Etats, d'o?? l'indium-114m1 est le plus stable, ??tant plus stable que celui de tous les isotopes d'indium de sol, sauf pour ceux primordiales.
La cr??ation et la survenance

L'indium est cr???? via la longue dur??e, (jusqu'?? des milliers d'ann??es), s-processus dans les ??toiles de faible masse-m??dia (qui vont de masse entre 0,6 et 10 masses de Sun ). Quand un atome d'argent-109, qui comprend environ la moiti?? de tout l'argent dans l'existence, attrape un neutron, il subit une d??sint??gration b??ta pour devenir le cadmium-110. Capture d'autres neutrons, il devient le cadmium-115, qui se d??sint??gre ?? l'indium-115 via un autre d??sint??gration b??ta. Cela explique pourquoi l'isotope radioactif pr??domine en abondance par rapport ?? celui stable.
L'indium est 61e ??l??ment le plus abondant dans la cro??te de la Terre ?? environ 49 ppb, ce qui rend l'indium environ aussi abondant que le mercure . Moins de 10 min??raux indium sont connus, tels que dzhalindite (In (OH 3)) et indite (Fein 2 S 4), mais aucun de ceux-ci se produit dans d'importants gisements.
Bas?? sur le contenu de l'indium dans les stocks de minerai de zinc, il ya une base de r??serve dans le monde entier d'environ 6000 tonnes d'indium ??conomiquement viable. Cependant, l'Indium Corporation, le plus important transformateur de l'indium, affirme que, sur la base de l'augmentation des rendements de r??cup??ration lors de l'extraction, la r??cup??ration ?? partir d'une large gamme de m??taux de base (y compris l'??tain, le cuivre et d'autres d??p??ts polym??talliques) et de nouveaux investissements miniers, long approvisionnement -terme d'indium est durable, fiable et suffisant pour r??pondre ?? la demande future.
Cette conclusion peut ??tre raisonnable compte tenu que l'argent, qui est un tiers aussi abondant que l'indium dans la cro??te terrestre, est actuellement exploit?? ?? environ 18 300 tonnes par an, ce qui est 40 fois sup??rieure ?? celle des taux d'extraction d'indium actuelles.
Histoire
En 1863, les chimistes allemands Ferdinand Reich et Hieronimus Theodor Richter testait minerais des mines autour de Freiberg, Saxe. Ils dissous des min??raux de pyrite , ars??nopyrite, gal??ne et de sphal??rite dans l'acide chlorhydrique et distill?? premi??re chlorure de zinc . Comme il ??tait connu que les minerais de cette r??gion contiennent parfois thallium ils ont cherch?? les lignes vertes d'??mission avec la spectroscopie. Les lignes vertes ??taient absents, mais une ligne bleue ??tait pr??sent dans le spectre. Comme aucun ??l??ment n'a ??t?? connu avec une ??mission bleu vif, ils ont conclu qu'un nouvel ??l??ment ??tait pr??sent dans les min??raux. Ils ont appel?? l'??l??ment avec la spectrale indium ligne bleue, de la couleur indigo voit dans son spectre. Richter a continu?? d'isoler le m??tal en 1864. Au World Fair 1867 un lingot de 0,5 kg (1,1 lb) a ??t?? pr??sent??.
En 1924, l'indium se est r??v??l?? avoir une capacit?? utile de stabiliser les m??taux non ferreux, qui ??tait la premi??re utilisation importante de l'??l??ment. Il a fallu attendre 1936 pour le US Bureau of Mines ?? la liste d'indium comme une marchandise, et m??me au d??but des ann??es 1950 seulement des applications tr??s limit??es pour l'indium ??taient connus, le plus important de qui a ??t?? prise diodes et les roulements de rev??tement pour les moteurs d'avions ??mettant de la lumi??re pendant la Seconde Guerre mondiale . Le d??but de la production de semi-conducteurs contenant de l'indium-ouvertes en 1952. Le d??veloppement et l'utilisation g??n??ralis??e des barres de contr??le nucl??aires contenant de l'indium-augmentation de la demande au cours des ann??es 1970, et l'utilisation de l'oxyde d'indium et d'??tain dans les ??crans ?? cristaux liquides ont augment?? et sont devenus l'application majeure en 1992 .
Production
L'absence de d??p??ts min??raux indium et le fait que l'indium est enrichi en sulfure de plomb , ??tain , cuivre , fer et principalement en zinc d??p??ts, rend la production de zinc de la source principale de l'indium. L'indium est lessiv?? ?? partir de scories et de la poussi??re de la production de zinc. Une purification suppl??mentaire est effectu??e par ??lectrolyse . Le processus exact varie en fonction de la composition exacte du laitier et de la poussi??re.
L'indium est principalement produite ?? partir de r??sidus g??n??r??s lors de zinc traitement du minerai, mais se retrouve ??galement dans le fer , plomb et cuivre minerais. La Chine est un important producteur d'indium. Le Teck Cominco raffinerie Trail, Colombie-Britannique, est un grand producteur seule source d'indium, avec une production de 32,5 tonnes en 2005, 41,8 tonnes en 2004 et 36,1 tonnes en 2003. Malku Khota la propri??t?? de South American Silver Corporation Bolivie est une importante ressource d'indium avec une ressource indiqu??e de 1481 tonnes et des ressources inf??r??es de 935 tonnes. Mine Mount Pleasant de Adex Mining Inc. Nouveau-Brunswick, Canada, d??tient certains des totaux connu ressources d'indium du monde.
La quantit?? d'indium consomm??e est largement fonction de dans le monde entier la production de LCD. La production mondiale est actuellement de 475 tonnes par an de l'exploitation mini??re et un autre de 650 tonnes par an de recyclage. La demande a augment?? rapidement ces derni??res ann??es avec la popularit?? de moniteurs LCD d'ordinateur et de t??l??vision, qui repr??sentent d??sormais 50% de la consommation d'indium. Augmentation de l'efficacit?? de la fabrication et de recyclage (en particulier dans le Japon ) de maintenir un ??quilibre entre la demande et l'offre. Selon le PNUE, en fin de vie, le taux de recyclage de l'indium est inf??rieure ?? 1%. La demande a augment?? comme le m??tal est utilis?? dans les ??crans LCD et les t??l??viseurs, et l'offre a diminu?? quand un certain nombre de chinois mini??res pr??occupations arr??t?? l'extraction de leurs indium zinc r??sidus. En 2002, le prix ??tait de US $ 94 par kilogramme. Les r??cents changements dans la demande et l'offre ont conduit ?? des prix ??lev??s et fluctuants d'indium, qui de 2006 ?? 2009 allaient de 382 $ US / kg ?? US $ 918 / kg.
Il a ??t?? estim?? qu'il ya moins de 20 ans ?? gauche de fournitures d'indium, en fonction des taux actuels d'extraction, ce qui d??montre la n??cessit?? de plus de recyclage .
Applications

La premi??re application ?? grande ??chelle pour l'indium ??tait comme rev??tement pour roulements de haute performance avions moteurs pendant la Seconde Guerre mondiale . Par la suite, la production a progressivement augment?? que de nouvelles utilisations ont ??t?? trouv??s dans alliages fusibles, soudures, et l'??lectronique . Dans les ann??es 1950, de minuscules perles de celui-ci ont ??t?? utilis??s pour les ??metteurs et les collectionneurs de PNP alliage de jonction des transistors. Dans les ann??es 1980, milieu et fin, le d??veloppement de phosphure d'indium semi-conducteurs et oxyde d'indium-??tain films minces pour ??crans ?? cristaux liquides (LCD) ont suscit?? beaucoup d'int??r??t. En 1992, l'application ?? couche mince est devenu la plus grande utilisation finale.
??lectronique
- L'oxyde d'indium (In 2 O 3) et oxyde d'indium-??tain (ITO) sont utilis??s en tant que transparent rev??tement conducteur appliqu?? au verre des substrats dans la fabrication de panneaux ??lectroluminescents.
- Certains compos??s de l'indium tels que antimoniure d'indium, le phosphure d'indium, et nitrure d'indium sont semi-conducteurs ayant des propri??t??s utiles.
- L'indium est utilis?? dans la synth??se de la semi-conducteur cuivre indium s??l??niure de gallium (CIGS), qui est utilis?? pour la fabrication de couche mince cellules solaires.
- Utilis?? dans des diodes ??lectroluminescentes (LED) et des diodes laser sur la base de semi-conducteurs compos??s tels que InGaN, InGaP qui sont fabriqu??s par m??talorganique ??pitaxie en phase vapeur ( MOVPE) technologie.
- Ultrapure organom??talliques d'indium comprennent haute puret?? trim??thylindium (TMI), qui est utilis?? en tant que pr??curseur dans III-V semi-conducteurs compos??s, se il est ??galement utilis?? en tant que semi-conducteur dopant dans II-VI semi-conducteurs compos??s.
- L'une des nombreuses remplacer le mercure dans les piles alcalines au zinc pour pr??venir la corrosion et de lib??ration d'hydrog??ne gazeux.
M??tal et alliages

- De tr??s petites quantit??s utilis??es dans alliage d'aluminium anodes sacrificielles (pour les applications d'eau sal??e) pour emp??cher passivation de l'aluminium.
- Pour lier test ??lectrique or conduit ?? supraconducteurs , de l'indium est utilis?? comme une colle conductrice et appliqu??e sous un microscope avec des pinces de pr??cision.
- Dans la forme d'un fil est utilis?? en tant que joint ??tanche au vide et un conducteur thermique dans cryog??nie et applications ultra-vide. Par exemple, dans la fabrication joints qui se d??forment pour combler les lacunes.
- Utilis?? comme mat??riau d'??talonnage pour La calorim??trie diff??rentielle ?? balayage.
- Ce est un ingr??dient dans l'alliage de gallium-indium-??tain Galinstan, qui est liquide ?? temp??rature ambiante tout en ne ??tant pas toxiques comme le mercure.
D'autres utilisations
- Oxyde d'indium-??tain est utilis?? comme un filtre de lumi??re ?? lampes ?? vapeur de sodium ?? basse pression. Le rayonnement infrarouge est r??fl??chie en retour dans la lampe, ce qui augmente la temp??rature ?? l'int??rieur du tube et d'am??liorer le rendement de la lampe par cons??quent.
- Le point de fusion de l'indium de 429.7485 K (156.5985 ?? C) est un point fixe d??finissant sur l'??chelle internationale de temp??rature ITS-90.
- La section efficace de capture de neutrons de l'indium pour les neutrons thermiques rend appropri?? pour une utilisation dans des barres de contr??le des r??acteurs nucl??aires, typiquement en un alliage contenant 80% d'argent, 15% d'indium et 5% de cadmium.
- Dans l'ing??nierie nucl??aire, les (n, n ') r??actions de 113 et 115 Dans En sont utilis??s pour d??terminer les grandeurs de flux de neutrons.
- L'indium est aussi utilis?? comme un mat??riau d'interface thermique par des passionn??s d'ordinateurs personnels sous forme de feuilles m??talliques pr??form??es mont?? entre la surface de transfert de chaleur d'un microprocesseur et son dissipateur de chaleur. L'application de chaleur fait fondre partiellement la feuille et permet au m??tal d'indium pour combler les lacunes et les trous microscopiques entre les deux surfaces, enlever les poches d'air isolantes qui seraient autrement compromettre l'efficacit?? de transfert de chaleur.
- 111 Dans ??met un rayonnement gamma et est utilis?? dans Imagerie indium de leucocytes, ou d'indium scintigraphie, une technique de l'imagerie m??dicale qui est particuli??rement utile dans des conditions de diff??renciation, tels que ost??omy??lite du ulc??res de d??cubitus pour l'??valuation de parcours et la dur??e des antibiotiques th??rapie. Indium leucocytes scintigraphie a de nombreuses applications, y compris le d??veloppement de m??dicament en phase pr??coce et la surveillance de l'activit?? des des globules blancs. Pour l'essai, le sang est pr??lev?? sur le patient, les globules blancs retir??, marqu?? avec la 111 Dans radioactifs, puis r??inject?? dans le patient. Imagerie Gamma sera alors r??v??ler les zones de blanc en cours localisation cellulaire comme nouvelle et d??velopper des zones d'infection.
Pr??cautions et des probl??mes de sant??
Indium pur sous forme de m??tal est consid??r?? comme non toxique par la plupart des sources. Dans les soudage et de semi-conducteurs , les industries o?? l'exposition d'indium est relativement ??lev??, il ya eu aucun rapport de d'effets secondaires toxiques. Compos??s indium, comme compos??s d'aluminium, complexe avec hydroxyles pour former des sels insolubles dans des conditions de base, et ne sont donc pas bien absorb??es par les aliments, leur donnant assez faible subchronique orale. Soluble indium (III) est toxique lorsqu'il est livr?? par voie parenterale, cependant, causant des dommages aux reins essentiellement (les deux parties int??rieure et ext??rieure), mais en plus ?? coeur et le foie, et peut ??tre t??ratog??ne. D'autres compos??s d'indium sont toxiques lorsqu'ils sont administr??s en dehors de la tractus gastro-intestinal: par exemple, anhydre le trichlorure d'indium (incl 3) et le phosphure d'indium (InP) sont assez toxique lorsqu'elle est remise dans les poumons (ce dernier est suspect??e canc??rog??ne). L'exposition professionnelle aux compos??s d'indium a ??t?? associ??e ?? PAP, des cristaux d'ester de cholest??rol et de granulomes, fibrose pulmonaire, l'emphys??me, et pneumothorax. Les donn??es disponibles sugg??rent exposition ?? des compos??s d'indium provoque un roman maladie pulmonaire qui peut commencer avec le PAP et le progr??s pour inclure la fibrose et l'emphys??me, et, dans certains cas, la mort pr??matur??e

