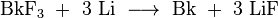Berkelium
Renseignements g??n??raux
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Parrainage d'enfants aide les enfants du monde en d??veloppement ?? apprendre aussi.
| Berkelium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
97 Bk | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
argent??  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | berkelium, Bk, 97 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / b ər k Je l Je . əm / bər--əm -Lee KEE plus rarement: / b ɜr k l Je . əm / -Əm de BERK | ||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | actinides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 7, fa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (247) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Rn ] 5f 9 7s 2 2, 8, 18, 32, 27, 8, 2  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Lawrence Berkeley National Laboratory (1949) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | (Alpha) 14,78 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | (Beta) 13,25 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | (Beta) 1259 K , 986 ?? C, 1807 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,3 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 601 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 170 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 10 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-40-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de berkelium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Berkelium est un transuraniens radioactive ??l??ment chimique avec le symbole Bk et de num??ro atomique 97, un membre de l' actinide et s??rie Transuranien. Il est nomm?? d'apr??s la ville de Berkeley, Californie, l'emplacement de la Universit?? de Californie Radiation Laboratory o?? il a ??t?? d??couvert en D??cembre 1949. Ce ??tait l'??l??ment transuranien cinqui??me d??couverte apr??s le neptunium , le plutonium , le curium et am??ricium .
Le principal isotope de berkelium, berkelium-249, est synth??tis??e en quantit??s infimes en haute flux d??di?? r??acteurs nucl??aires, surtout au Oak Ridge National Laboratory Tennessee, Etats-Unis, et ?? la Institut de recherche des r??acteurs atomiques dans Dimitrovgrad, Russie. La production de la deuxi??me importante isotopes berkelium-247 implique l'irradiation de l'isotope rare curium-244 ?? haute ??nergie des particules alpha.
Un peu plus d'un gramme de berkelium a ??t?? produit aux ??tats-Unis depuis 1967. Il n'y a aucune application pratique de berkelium en dehors de la recherche scientifique qui est principalement destin??e ?? la synth??se de plus lourd transuraniens et transactinides. Un lot de 22 milligramme de berkelium-249 a ??t?? pr??par??e au cours d'une p??riode d'irradiation de 250 jours et ensuite purifi?? pendant encore 90 jours ?? Oak Ridge en 2009. Cet ??chantillon a ??t?? utilis?? pour synth??tiser l'??l??ment Ununseptium pour la premi??re fois en 2009 ?? la Institut unifi?? de recherches nucl??aires, la Russie , apr??s avoir ??t?? bombard?? de calcium-48 ions pour 150 jours. Ce ??tait le point culminant de la collaboration russo-am??ricain sur la synth??se des ??l??ments 113-118.
Berkelium est un blanc-argent??, mou, m??tal radioactif. L'isotope berkelium-249 ??met de faible ??nergie des ??lectrons et est donc relativement s??r ?? manipuler. Cependant, il se d??sint??gre avec une demi-vie de 330 jours ?? californium -249, qui est un ??metteur de forte et dangereuse de particules alpha. Cette transformation progressive est une consid??ration importante lorsque l'on ??tudie les propri??t??s de berkelium ??l??mentaire et ses compos??s chimiques, depuis la formation du californium apporte non seulement la contamination chimique, mais aussi des dommages auto-rayonnement, et l'auto-??chauffement des particules alpha ??mises.
Histoire


Bien que de tr??s petites quantit??s de berkelium ont ??t?? ??ventuellement produites dans des exp??riences nucl??aires pr??c??dents, il ??tait premier intentionnellement synth??tis??, isol?? et identifi?? en D??cembre 1949 par Glenn T. Seaborg, Albert et Ghiorso Stanley G. Thompson. Ils ont utilis?? le 60-pouces cyclotron au Universit?? de Californie, Berkeley. Semblable ?? la d??couverte pr??s simultan??e de l'am??ricium (??l??ment 95) et le curium (??l??ment 96) en 1944, la nouvelle ??l??ments berkelium et californium (??l??ment 98) ont tous deux ??t?? produites en 1949-1950.
Le choix du nom pour l'??l??ment 97 a suivi la tradition pr??c??dente du groupe californien de faire une analogie entre le nouvellement d??couvert actinides et lanthanides ??l??ment positionn?? au-dessus dans le tableau p??riodique . Auparavant, l'am??ricium a ??t?? nomm?? d'apr??s un continent que son analogue l'europium et curium honor?? scientifiques Marie et Pierre Curie comme lanthanides dessus, le gadolinium , a ??t?? nomm?? d'apr??s l'explorateur de la ??l??ments des terres rares Johan Gadolin. Ainsi, le rapport de la d??couverte par le groupe de Berkeley lit comme suit: "Il est sugg??r?? que cet ??l??ment 97 ??tre donn?? le nom berkelium (symbole Bk) apr??s la ville de Berkeley d'une mani??re similaire ?? celle utilis??e pour nommer son homologue chimique terbium (num??ro atomique 65) dont nom est d??riv?? de la ville de Ytterby, Su??de , o?? les min??raux de terres rares ont d'abord ??t?? trouv??. "Cette tradition a pris fin le berkelium, si, comme la d??signation de la prochaine actinides d??couvert, californium , ne ??tait pas li??e ?? son lanthanides analogique dysprosium , mais apr??s le lieu de la d??couverte.
Les ??tapes les plus difficiles dans la synth??se de berkelium ??taient sa s??paration des produits finaux et la production de quantit??s suffisantes de l'am??ricium pour le mat??riau cible. Tout d'abord, l'am??ricium (Am 241) nitrate solution a ??t?? appliqu??e sur une platine feuille, la solution a ??t?? ??vapor??e et le r??sidu converti par recuit ?? dioxyde de am??ricium (OMA 2). Cet objectif a ??t?? irradi?? avec 35 MeV particules alpha pour 6 heures dans le cyclotron de 60 pouces au Lawrence Radiation Laboratory, Universit?? de Californie, Berkeley. Le (α, 2n) r??action induite par l'irradiation a donn?? le Bk isotope 243 et deux gratuits neutrons :
Apr??s l'irradiation, le rev??tement a ??t?? dissous avec de l'acide nitrique , puis pr??cipit?? sous forme de l' hydroxyde aqueux concentr?? en utilisant une solution d'ammoniaque. Le produit ??tait centrifug?? et redissous dans l'acide nitrique. Pour s??parer l'am??ricium de berkelium ne ayant pas r??agi, cette solution a ??t?? ajout??e ?? un m??lange de ammonium et le sulfate d'ammonium et on chauffe ?? convertir tous les am??ricium dissous dans l' ??tat d'oxydation +6. Am??ricium non oxyd?? r??siduel a ??t?? pr??cipit?? par l'addition de acide fluorhydrique que l'am??ricium (III) fluorure (AMF 3). Cette ??tape a donn?? un m??lange du curium de produits d'accompagnement et l'??l??ment pr??vu 97 en forme de trifluorures. Le m??lange a ??t?? converti en les hydroxydes correspondants par traitement avec l'hydroxyde de potassium, et apr??s centrifugation, a ??t?? dissous dans l'acide perchlorique.

En outre la s??paration a ??t?? effectu??e en pr??sence d'un acide citrique / ammonium solution tampon dans un milieu faiblement acide ( pH≈3.5), en utilisant ??change d'ions ?? une temp??rature ??lev??e. Le chromatographique comportement de s??paration ??tait alors inconnu pour l'??l??ment 97, mais a ??t?? pr??vu par analogie avec le terbium (voir courbes d'??lution). Les premiers r??sultats ont ??t?? d??cevants en aucune signature d'??mission de particules alpha pu ??tre d??tect??e ?? partir du produit d'??lution. Seul le plus recherche de les rayons X caract??ristiques et signaux ??lectroniques de conversion ont abouti ?? l'identification d'un isotope de berkelium. Son nombre de masse ??tait incertain entre 243 et 244 dans le rapport initial, mais a ensuite ??t?? ??tabli que 243.
Caract??ristiques
Physique

Berkelium est un blanc argent??, radioactif douce actinides m??tal. Dans le tableau p??riodique , il est situ?? ?? droite de l'actinide curium , ?? la gauche de l'actinide californium -dessous du lanthanide et terbium avec lequel il partage de nombreuses similitudes dans les propri??t??s physiques et chimiques. Sa densit?? de 14,78 g / cm 3 se situe entre ceux de curium (13,52 g / cm 3) et californium (15,1 g / cm 3), de m??me que son point de 986 ?? C point de fusion, inf??rieure ?? celle du curium (1340 ?? C), mais sup??rieure ?? celle du californium (900 ?? C). Berkelium est relativement doux et a un des plus faibles modules en vrac parmi les actinides, ?? environ 20 GPa (10 x 10 2 Pa).
Berkelium (III) montre deux ions forte pics de fluorescence ?? 652 nanom??tres (lumi??re rouge) et 742 nanom??tres (rouge fonc?? - proche infrarouge) en raison de transitions internes ?? la shell f-??lectrons. L'intensit?? relative de ces pics d??pend de la puissance d'excitation et de la temp??rature de l'??chantillon. Cette ??mission peut ??tre observ??, par exemple, apr??s la dispersion des ions Berkelium dans un verre de silicate, par fusion du verre en pr??sence d'oxyde de berkelium ou halog??nure.
Entre 70 K et la temp??rature ambiante, se comporte comme un berkelium Curie-Weiss mat??riau paramagn??tique avec un moment magn??tique effectif de 9,69 Magn??tons Bohr (μ B) et une Temp??rature de Curie de 101 K. Ce moment magn??tique est presque ??gale ?? la valeur th??orique de 9,72 μ B calcul?? ?? l'int??rieur de la simple atomique mod??le de couplage LS. Apr??s refroidissement ?? environ 34 K, berkelium subit une transition ?? un ??tat antiferromagn??tique. L'enthalpie de dissolution dans l' acide chlorhydrique dans des conditions standard est -600 kJ / mol -1, ?? partir de laquelle la changement norme enthalpie de formation (Δ f H ??) du aqueuses Bk 3+ est obtenu comme -601 kJ / mol -1. Le potentiel standard Bk 3+ / Bk est 0 -2,01 V. La potentiel d'ionisation d'un atome d'berkelium neutre est 6,23 eV.
Allotropes
Dans les conditions ambiantes, berkelium assume sa forme α plus stable qui a une hexagonale sym??trie, groupe spatial P6 3 / mmc, param??tres de maille de 341 h et 1107 h. Le cristal a une double Structure de garnissage hexagonal avec la succession de couches et est donc ABAC isotypique (ayant une structure similaire) avec α-α-lanthane et les formes d'actinides au-del?? de curium. Cette structure cristalline varie avec la pression et la temp??rature. Quand comprim?? ?? la temp??rature ambiante ?? 7 GPa, α-berkelium transforme la modification b??ta, qui pr??sente un cubique ?? faces centr??es (cfc) sym??trie et l'espace groupe Fm 3 m. Cette transition se fait sans changement de volume, mais les enthalpie augmente de 3,66 kJ / mol. Apr??s une nouvelle compression ?? 25 GPa, pour un berkelium transforme structure similaire ?? celle de l'uranium α-γ-berkelium orthorhombique. Cette transition se accompagne d'une diminution de volume de 12% et de d??localisation des ??lectrons ?? la Couche ??lectronique 5f. Pas d'autres transitions de phase sont observ??s jusqu'?? 57 GPa.
Lors du chauffage, α-berkelium transforme en une autre phase avec un r??seau cfc (mais l??g??rement diff??rente de β-berkelium), groupe d'espace Fm 3 m et la constante de r??seau de 500 h; cette structure fcc est ??quivalent ?? l'emballage le plus proche avec la s??quence ABC. Cette phase est m??tastable et va progressivement revenir ?? la phase initiale α-berkelium au la temp??rature ambiante. On pense que la temp??rature de la transition de phase ?? ??tre tr??s proche du point de fusion.
Chimique
Comme tous les actinides , berkelium dissout dans divers acides inorganiques aqueuses, lib??rant gazeux d'hydrog??ne et de conversion dans le berkelium (III) l'??tat. Cette trivalent ??tat d'oxydation (3) est la plus stable, en particulier dans des solutions aqueuses, mais t??travalent (4) et, ??ventuellement, divalents (2) des compos??s Berkelium sont ??galement connus. L'existence de sels de Berkelium bivalents est incertain et n'a ??t?? rapport?? dans mixte lanthane chloride le chlorure de strontium fond. Un comportement similaire est observ?? pour l'analogue des lanthanides de berkelium, le terbium . Les solutions aqueuses des ions BK sont verts dans la plupart des acides. La couleur des ions Bk 4+ est jaune dans de l'acide chlorhydrique et de l'orange-jaune dans l'acide sulfurique . Berkelium ne r??agit pas rapidement avec l'oxyg??ne ?? temp??rature ambiante, ??ventuellement en raison de la formation d'une surface de la couche protectrice d'oxyde. Cependant, il r??agit avec les m??taux en fusion, l'hydrog??ne , les halog??nes , chalcog??nes et pnictogens pour former divers compos??s binaires.
Isotopes
Une vingtaine isotopes et six isom??res nucl??aires (??tats excit??s de un isotope) de berkelium ont ??t?? caract??ris??s avec les num??ros atomiques allant de 235 ?? 254. Tous sont radioactifs. Les plus longues demi-vies sont observ??es pour 247 Bk (1380 ann??es), 248 Bk (9 ann??es) et 249 Bk (330 jours); les demi-vies des autres isotopes vont de microsecondes ?? plusieurs jours. L'isotope qui est le plus facile ?? synth??tiser est berkelium-249. Ce HPS douce β-particules qui ne sont pas pratiques pour la d??tection. Son le rayonnement alpha est plut??t faible - 1,45 ?? 10 -3% par rapport ?? la β-rayonnement - mais est parfois utilis?? pour d??tecter cet isotope. Le second isotope de berkelium importante, berkelium-247, est un ??metteur alpha, comme le sont la plupart des isotopes d'actinides.
Occurrence
Tous les isotopes de Berkelium ont une demi-vie beaucoup trop courte pour ??tre primordiale. Par cons??quent, tous berkelium primordial, ce est-?? berkelium pr??sente sur la Terre lors de sa formation, a pourri maintenant.
Sur Terre, berkelium est surtout concentr??e dans certaines r??gions, qui ont ??t?? utilis??s pour l'atmosph??re essais nucl??aires d'armes entre 1945 et 1980, ainsi que sur les sites des incidents nucl??aires, comme la catastrophe de Tchernobyl , accident de Three Mile Island et de 1968 accident Base a??rienne de Thul?? B-52. L'analyse des d??bris sur le site de test de la premi??re US bombe ?? hydrog??ne, Ivy Mike, (1 Novembre 1952, Enewetak Atoll), a r??v??l?? des concentrations ??lev??es de divers actinides, y compris berkelium. Pour des raisons de secret militaire, ce r??sultat a ??t?? publi?? seulement en 1956.
Les r??acteurs nucl??aires produisent la plupart du temps, parmi les isotopes de Berkelium, berkelium-249. Pendant le stockage et avant l'??vacuation du combustible, la plupart de celui-ci beta se d??sint??gre en californium-249. Ce dernier a une demi-vie de 351 ans, ce qui est relativement long par rapport aux autres isotopes produits dans le r??acteur, et est donc ind??sirable dans les produits d'??limination.
Quelques atomes de berkelium peuvent ??tre produits par r??actions de capture de neutrons et d??sint??gration b??ta en tr??s fortement concentr??s uranium d??p??ts -bearing, ce qui en fait l'??l??ment le plus rare d'origine naturelle.
Synth??se et extraction
Pr??paration d'isotopes
Berkelium est produit en bombardant l??ger actinides uranium (238 U) ou le plutonium (Pu 239) avec des neutrons dans un r??acteur nucl??aire. Dans un cas plus courant de combustible ?? l'uranium, le plutonium est d'abord produit par capture de neutrons (ce qu'on appelle la (n, γ) r??action neutronique ou fusion), suivi par d??sint??gration b??ta:
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png) (Les temps sont demi-vie )
(Les temps sont demi-vie )
Le plutonium-239 est en outre irradi??e par une source qui a une haute flux de neutrons, plusieurs fois plus ??lev?? que dans un r??acteur nucl??aire classique, tel que le 85 m??gawatts High Flux Isotope Reactor (HFIR) au Oak Ridge National Laboratory, dans le Tennessee, USA. Le flux ??lev?? favorise les r??actions de fusion impliquant non pas un mais plusieurs neutrons, convertir 239 ?? 244 cm Pu puis ?? 249 cm:
Curium-249 a une demi-vie courte de 64 minutes, et donc plus sa conversion ?? 250 cm a une probabilit?? faible. Au lieu de cela, il se transforme par d??sint??gration b??ta en 249 Bk:
Le ainsi produit 249 Bk a une longue demi-vie de 330 jours et peut donc capturer un autre neutrons. Cependant, le produit, 250 Bk, a encore une demi-vie relativement courte de 3,212 heures et donc, ne donne pas de isotopes de Berkelium lourds. Au lieu de cela se d??sint??gre ?? l'isotope de californium 250 Cf:
Bien que 247 Bk est l'isotope le plus stable de berkelium, sa production dans les r??acteurs nucl??aires est tr??s inefficace en raison de la longue demi-vie de son g??niteur potentiel curium-247, qui ne permet pas suffisamment de temps pour la d??sint??gration b??ta avant de capturer une autre neutrons. Ainsi, 249 Bk est l'isotope le plus accessible de berkelium, qui encore, ne est disponible qu'en petites quantit??s (seulement 0,66 grammes ont ??t?? produites aux ??tats-Unis sur la p??riode 1967-1983) ?? un prix ??lev??e de l'ordre de 185 USD par microgramme.
L'isotope 248 Bk a ??t?? obtenu en 1956 en bombardant un m??lange d'isotopes de curium avec 25 MeV α-particules. Bien que sa d??tection directe a ??t?? entrav??e par une forte interf??rence de signal avec 245 Bk, l'existence d'un nouvel isotope a ??t?? prouv?? par la croissance du produit de d??sint??gration 248 Cf qui avait ??t?? pr??c??demment caract??ris??. La demi-vie de 248 Cf a ??t?? estim??e ?? 23 ?? 5 heures et une valeur plus fiable ne est toujours pas connu. Berkelium-247 a ??t?? produite au cours de la m??me ann??e par irradiation 244 cm avec des alpha-particules:
Berkelium-242 a ??t?? synth??tis?? en 1979 en bombardant 235 U avec 11 B, 238 U avec 10 B, 232 Th avec 14 N ou 232 Th avec 15 N. Il convertit par capture d'??lectrons de 242 cm, avec une demi-vie de 7,0 ?? 1,3 minutes. Une recherche pour un d??part pr??sum?? isotope 241 Bk a ensuite ??chou??; 241 Bk a depuis ??t?? synth??tis??.
S??paration
Le fait que berkelium assume facilement l'??tat d'oxydation 4 dans les solides, et est relativement stable dans cet ??tat dans les liquides aide grandement s??paration des berkelium loin de beaucoup d'autres actinides. Elles sont produites in??vitablement en quantit??s relativement importantes lors de la synth??se nucl??aire et favorisent souvent l'??tat 3. Ce fait ne ??tait pas encore connu dans les premi??res exp??riences, qui a utilis?? une proc??dure de s??paration plus complexe. Divers agents d'oxydation peuvent ??tre appliqu??s ?? la berkelium solutions (III) pour le convertir en l'??tat 4, tels que bromates (Bro -
3), bismuthates (Bio -
3), chromates (CrO 2-
4 et Cr
O 2 2-
7), argent (I) thiolate (Ag 2 S 2 O 8), le plomb (IV) oxyde (PbO 2), l'ozone (O 3), ou des proc??dures d'oxydation photochimique. Berkelium (IV) est ensuite extrait avec ??change d'ions extraction chromatographie ou extraction liquide-liquide en utilisant HDEHP (bis- (2-??thylhexyl) phosphorique SCID), des amines , le phosphate de tributyle ou plusieurs autres r??actifs. Ces proc??dures se s??parent berkelium de la plupart des actinides trivalents et les lanthanides , ?? l'exception du lanthanide c??rium (lanthanides sont absents dans la cible d'irradiation mais sont cr????s dans diverses fission nucl??aire cha??nes de d??sint??gration).
Une proc??dure plus d??taill??e adopt??e ?? la Oak Ridge National Laboratory ??tait la suivante: le m??lange initial des actinides est trait??e avec ??change d'ions en utilisant de chlorure de lithium r??actif, puis pr??cipit?? sous forme d' hydroxydes , filtr?? et dissous dans de l'acide nitrique. Il est ensuite trait?? par haute pression ??lution ?? partir de les r??sines ??changeuses de cations et de la phase berkelium est oxyd?? et extraits en utilisant l'une des proc??dures d??crites ci-dessus. La r??duction de la berkelium ainsi obtenu (IV) ?? l'??tat d'oxydation +3 donne une solution qui est presque exempt d'autres actinides (mais contient du c??rium). Berkelium et le c??rium sont ensuite s??par??s avec un autre cycle de traitement d'??change ionique.
Pr??paration m??tallique en vrac
Afin de caract??riser les propri??t??s chimiques et physiques de berkelium solide et ses compos??s, un programme a ??t?? lanc?? en 1952 ?? la Material Testing Reactor, Arco, Idaho, ??tats-Unis. Elle a abouti ?? la pr??paration d'un huit-gramme cible de plutonium-239 et la premi??re production de quantit??s macroscopiques (0,6 microgrammes) de berkelium par Burris B. Cunningham et Stanley G. Thompson en 1958, apr??s une irradiation du r??acteur continue de cette cible pendant six ans. Cette m??thode d'irradiation ??tait et est toujours la seule fa??on de produire des quantit??s pesables de l'??l??ment, et la plupart des ??tudes ?? l'??tat solide de berkelium ont ??t?? effectu??es sur des ??chantillons de microgramme ou submicrogram taille.
Sources d'irradiation grands du monde sont de 85 m??gawatts ?? haut flux isotopes au r??acteur Oak Ridge National Laboratory, dans le Tennessee, Etats-Unis, et le r??acteur SM-2 ?? la boucle Institut de recherche des r??acteurs atomiques (NIIAR) dans Dimitrovgrad, la Russie, qui sont ?? la fois d??di??e ?? la production d'??l??ments de transcurium (num??ro atomique sup??rieur ?? 96). Ces installations ont des niveaux de puissance et de flux similaires, et on se attend ?? avoir des capacit??s de production comparables pour les ??l??ments de transcurium, bien que les quantit??s produites au NIIAR ne sont pas rendus publics. Dans une "campagne de traitement typique?? ?? Oak Ridge, des dizaines de grammes de curium sont irradi??es pour produire quantit??s de decigramme de californium , quantit??s de milligrammes de berkelium-249 et einsteinium , et des quantit??s de l'ordre du picogramme fermium . Au total, un peu plus d'un gramme de berkelium-249 a ??t?? produite ?? Oak Ridge depuis 1967.
On a pr??par?? le premier ??chantillon berkelium m??tallique pesant 1,7 microgrammes en 1971 par la r??duction des berkelium (III) avec le fluorure de lithium vapeur ?? 1000 ?? C; le fluorure est suspendue sur un fil de tungst??ne au-dessus d'une tantale creuset contenant du lithium fondu. Plus tard, des ??chantillons de m??tal pesant jusqu'?? 0,5 mg ont ??t?? obtenus avec cette m??thode.
Des r??sultats similaires sont obtenus avec berkelium (IV) fluorure. Berkelium m??tal peut ??galement ??tre produit par la r??duction berkelium (IV) avec de l'oxyde de thorium ou de lanthane .
Compos??s
Oxydes
Deux oxydes de berkelium sont connus, avec le berkelium ??tat d'oxydation de +3 (Bk 2 O 3) et 4 (BKO 2). Berkelium (IV) oxyde est un solide brun, tandis que berkelium (III) oxyde est un solide jaune-vert avec un point de 1920 ?? C de fusion et est form?? ?? partir de deux par BKO r??duction mol??culaire avec l'hydrog??ne :
Lors du chauffage ?? 1200 ?? C, l'oxyde Bk 2 O 3 subit un changement de phase; il subit un autre changement de phase ?? 1 750 ?? C. Un tel comportement triphas?? est typique pour l'actinide sesquioxydes. Berkelium (II) oxyde, BKO, a ??t?? rapport?? comme un solide gris fragile mais sa composition chimique exacte reste incertaine.
Halog??nures
En halog??nures, berkelium assume les ??tats d'oxydation 3 et 4. L'??tat 3 est la plus stable, en particulier dans des solutions, tandis que les halog??nures t??travalents BKF 4 et Cs 2 BkCl 6 ne sont connus que dans la phase solide. La coordination de l'atome de fluor dans son berkelium trivalent et le chlorure est tricapped prismatique trigonal, avec le nombre de coordination de 9. Dans le bromure trivalent, il est bicouronn?? trigonal prismatique (coordination 8) ou octa??drique (coordination 6), et l'iodure est octa??drique.
| Oxydation nombre | Fa | Cl | Br | Je |
|---|---|---|---|---|
| 3 | BkF 3 (Jaune) | BkCl 3 (Vert) Cs 2 NaBkCl 6 | BkBr 3 (Jaune-vert) | BKI 3 (Jaune) |
| 4 | BkF 4 (Jaune) | Cs 2 BkCl 6 (Orange) |
Berkelium (IV) fluorure (BkF 4) est un jaune-vert solide ionique et est isotypique avec t??trafluorure d'uranium ou zirconium (IV) fluorure. Berkelium (III) fluorure (BkF 3) est ??galement un solide jaune-vert, mais il a deux structures cristallines. La phase la plus stable ?? basse temp??rature est isotypique avec yttrium (III) fluorure, tandis que lors d'un chauffage ?? entre 350 et 600 ?? C, il se transforme ?? la structure trouv??e dans lanthane (III) fluorure.
Quantit??s visibles de berkelium (III) chlorure (BkCl 3) ont d'abord ??t?? isol??s et caract??ris??s en 1962, et pes??s seulement 3 milliardi??mes de g. Il peut ??tre pr??par?? en introduisant vapeurs de chlorure d'hydrog??ne dans un tube de quartz sous vide contenant de l'oxyde de berkelium ?? une temp??rature d'environ 500 ?? C. Ce solide vert a un point de 600 ?? C de fusion, et est isotypique avec uranium (III) chlorure. Lors du chauffage ?? point de fusion pr??s, BkCl 3 se transforme en une phase orthorhombique.
Deux formes de berkelium (III) du bromure sont connus: l'un avec la coordination berkelium ayant 6, et l'autre avec la coordination 8. Ce dernier est moins stable et se transforme ?? la phase pr??c??dente lors d'un chauffage ?? environ 350 ?? C. Un ph??nom??ne important pour les mati??res solides radioactives a ??t?? ??tudi?? sur ces deux formes cristallines: la structure de BkBr 3 249 ??chantillons frais et vieillis a ??t?? sond??e par Diffraction des rayons X sur une p??riode de plus de 3 ans, de sorte que diff??rentes fractions de berkelium-249 avaient beta diminu?? jusqu'?? californium-249. Pas de changement dans la structure a ??t?? observ??e sur le 249 BkBr 3 - 3 CFBR transformation 249. Cependant, d'autres diff??rences ont ??t?? not??es pour 249 BkBr 3 et 249 CFBR 3. Par exemple, celui-ci pourrait ??tre r??duite avec de l'hydrog??ne ?? 249 CFBR 2, mais l'ancien ne pouvait pas - ce r??sultat a ??t?? reproduite sur 249 personne BkBr 3 et 249 CFBR trois ??chantillons, aussi bien sur les ??chantillons contenant ?? la fois des bromures. L'enchev??trement de californium dans berkelium se produit ?? un taux de 0,22% par jour et est un obstacle intrins??que dans l'??tude des propri??t??s de Berkelium. ?? c??t?? d'une contamination chimique, 249 Cf, ??tant un ??metteur alpha, apporte ind??sirables auto-dommages du r??seau cristallin et l'auto-??chauffement qui en r??sulte. L'effet chimique peut cependant ??tre ??vit?? en effectuant des mesures en fonction du temps et de l'extrapolation des r??sultats obtenus.
D'autres compos??s inorganiques
Le pnictures d'berkelium-249 de la BKX type sont connus pour des ??l??ments azote , phosphore , arsenic et antimoine . Ils cristallisent dans le la structure de sel gemme et sont pr??par??s par la r??action soit berkelium (III) hydrure (bkh 3) ou m??tallique berkelium avec ces ??l??ments ?? une temp??rature ??lev??e (environ 600 ?? C) sous vide pouss??.
Berkelium (III) sulfure, Bk 2 S 3, est pr??par?? soit par de l'oxyde de berkelium traitement avec un m??lange de le sulfure d'hydrog??ne et le disulfure de carbone vapeurs ?? 1130 ?? C, ou en faisant r??agir directement berkelium m??tallique avec du soufre ??l??mentaire. Ces proc??dures donnent des cristaux de brun-noir.
Berkelium (III) et berkelium (IV) hydroxydes sont ?? la fois stable dans une solutions molaires d' hydroxyde de sodium . Berkelium (III) phosphate (BkPO 4) a ??t?? pr??par?? comme un solide, ce qui montre une forte fluorescence sous excitation avec une lumi??re verte. des hydrures de Berkelium sont produits en faisant r??agir le m??tal avec de l'hydrog??ne gazeux ?? des temp??ratures d'environ 250 ?? C. Ils sont non stoechiom??trique avec la formule nominale bkh 2 + x (0 <x <1). Plusieurs autres sels de berkelium sont connus, y compris un oxysulfure (Bk 2 O 2 S), et hydrat?? nitrate (Bk (NO 3) 3 ?? 4H 2 O), le chlorure (BkCl 3 ?? 6H 2 O), sulfate (Bk 2 ( SO 4) 3 ?? 12H 2 O) et oxalate (Bk 2 (C 2 O 4) 3 ?? 4H 2 O). La d??composition thermique ?? environ 600 ?? C dans une atmosph??re d'argon atmosph??re (afin d'??viter l'oxydation ?? deux OBE) de Bk 2 (SO 4) 3 ?? 12H 2 O, on obtient les cristaux de berkelium (III) oxysulfate (BK 2 O 2 SO 4). Ce compos?? est thermiquement stable ?? au moins 1000 ?? C en atmosph??re inerte.
Compos??s Organoberkelium
Berkelium forme un trigone (η 5 -C 5 H 5) 3 Bk complexe de m??talloc??ne avec trois des noyaux cyclopentadi??nyle, qui peuvent ??tre synth??tis??s en faisant r??agir berkelium (III) avec le chlorure beryllocene fondu ( Be (C 5 H 5) 2) ?? environ 70 ?? C. Il a une couleur ambr??e et une densit?? de 2,47 g / cm 3. Le complexe est stable au chauffage ?? au moins 250 ?? C et se sublime sans fondre ?? environ 350 ?? C. La radioactivit?? ??lev?? de berkelium d??truit progressivement le compos?? (dans un d??lai de semaine). Un anneau cyclopentadi??nyle en (η 5 ?? C 5 H 5) 3 Bk peut ??tre substitu?? par le chlore pour donner [Bk (C 5 H 5) 2 Cl] 2. Les spectres d'absorption optique de ce compos?? sont tr??s semblables ?? ceux de (η 5 -C 5 H 5) 3 Bk.
Applications
Il ya actuellement aucune utilisation pour tout isotope de berkelium dehors de la recherche scientifique de base. Berkelium-249 est un nucl??ide cible commune pour pr??parer encore plus lourd transuraniens et transactinides, comme lawrencium , rutherfordium et bohrium . Il est ??galement utile en tant que source de l'isotope de californium-249, qui est utilis?? pour les ??tudes sur la chimie du californium de pr??f??rence au plus radioactif californium-252 qui est produit dans des installations de bombardement de neutrons comme le HFIR.
Un lot de 22 milligramme de berkelium-249 a ??t?? pr??par?? dans une irradiation de 250 jours et ensuite purifi?? pendant 90 jours ?? Oak Ridge en 2009. Cet objectif a donn?? les six premiers atomes de Ununseptium au Institut unifi?? de recherches nucl??aires (JINR), Dubna, en Russie, apr??s avoir bombard?? avec des ions de calcium dans le cyclotron U400 pour 150 jours. Cette synth??se a ??t?? l'aboutissement de la collaboration russo-am??ricain entre IURN et Lawrence Livermore National Laboratory sur la synth??se des ??l??ments 113-118 qui a ??t?? lanc?? en 1989.
Cycle du combustible nucl??aire
Les fission nucl??aire propri??t??s de berkelium sont diff??rents de ceux des actinides voisins curium et californium, et ils sugg??rent berkelium pour effectuer mal comme combustible dans un r??acteur nucl??aire. Plus pr??cis??ment, berkelium-249 a un mod??r??ment grand capture de neutrons section de 710 granges pour neutrons thermiques, 1200 granges r??sonance section fission croix int??grante, mais tr??s faible pour les neutrons thermiques. Dans un r??acteur thermique, une grande partie sera donc converti en Berkelium-250 qui se d??sint??gre rapidement ?? californium-250. En principe, berkelium-249 peut soutenir une r??action nucl??aire en cha??ne dans un surg??n??rateur. Son masse critique est relativement ??lev??e ?? 192 kg; elle peut ??tre r??duite d'un r??flecteur de l'eau ou de l'acier, mais serait encore d??passer la production mondiale de cet isotope.
Berkelium-247 peut maintenir la r??action en cha??ne ?? la fois dans un neutron thermique et dans un r??acteur ?? neutrons rapides, cependant, sa production est assez complexe et donc la disponibilit?? est beaucoup plus faible que sa masse critique, qui est d'environ 75,7 kg pour une sph??re nue, 41,2 kg avec un r??flecteur d'eau et 35,2 kg avec un r??flecteur d'acier (30 cm d'??paisseur).
Les questions de sant??
On sait peu sur les effets de berkelium sur le corps humain, et les analogies avec d'autres ??l??ments ne peuvent ??tre tir??es ?? cause des diff??rents produits de rayonnement ( ??lectrons pour berkelium et les particules alpha, les neutrons ou les deux pour la plupart des autres actinides). La faible ??nergie des ??lectrons ??mis par berkelium-249 (moins de 126 keV) emp??che sa d??tection, en raison de l'interf??rence de signal avec d'autres processus de d??composition, mais rend ??galement cet isotope relativement inoffensif pour les humains par rapport aux autres actinides. Cependant, berkelium-249 transforme avec une demi-vie de seulement 330 jours ?? la forte ??metteur alpha californium-249, ce qui est assez dangereux et doit ??tre trait??e dans un bo??te ?? gants dans un laboratoire d??di??.
La plupart des donn??es sur la toxicit?? de berkelium disponibles proviennent de la recherche sur les animaux. Lors de l'ingestion par des rats, seulement environ 0,01% berkelium se termine dans le flux sanguin. De l??, environ 65% va ?? l'os, o?? il reste pendant environ 50 ans, 25% dans les poumons (la demi-vie biologique d'environ 20 ans), 0,035% sur les testicules ou 0,01% aux ovaires o?? berkelium s??jours ind??finiment. L'??quilibre d'environ 10% est excr??t??. Dans tous ces organes berkelium pourrait favoriser le cancer, et dans le son squelette de rayonnement peuvent endommager les cellules rouges du sang. Le montant maximal autoris?? de berkelium-249 dans le squelette humain est de 0,4 nanogrammes.


![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4,956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {244} _ {\ 95} Am \ \ xrightarrow [10.1 \ h] {\ beta ^ -} \ ^ { 244} _ {\} 96 cm} \ quad; \ Quad \ mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow {5 (n, \ gamma)} \ ^ {249} _ {\} 96 cm}](../../images/1679/167973.png)
![\ Mathrm {^ {249} _ {\ 96 cm} \ \ xrightarrow [64,15 \ min] {\ beta ^ -} \ ^ {249} _ {\ 97} Bk \ \ xrightarrow [330 \ d] {\ beta ^ -} \ ^ {249} _ {\ 98}} Cf](../../images/1679/167974.png)
![\ Mathrm {^ {249} _ {\ 97} Bk \ \ xrightarrow {(n, \ gamma)} \ ^ {250} _ {\ 97} Bk \ \ xrightarrow [3,212 \ h] {\ beta ^ -} \ ^ {250} _ {\ 98}} Cf](../../images/1679/167975.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [] {(\ alpha, n)} \ ^ {247} _ {\} 98 Cf \ \ xrightarrow [3,11 \ h] {\ epsilon} \ ^ {247} _ {\ 97}} Bk](../../images/1679/167976.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [] {(\ alpha, p)} \ ^ {247} _ {\ 97}} Bk](../../images/1679/167977.png)