
Tellure
Saviez-vous ...
SOS Enfants a essay?? de rendre le contenu plus accessible Wikipedia par cette s??lection des ??coles. Cliquez ici pour plus d'informations sur les enfants SOS.
| Tellure | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
52 Te | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris argent?? brillant  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | tellure, Te, 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / t ɨ l ʲ ʊər Je ə m / te- LEWR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tallo??de | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (16) chalcog??nes, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 127,60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 4d 10 5s 2 5p 4 2, 8, 18, 18, 6 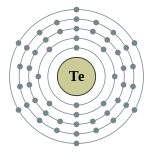 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Franz-Joseph M??ller von Reichenstein (1782) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Martin Heinrich Klaproth | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 6,24 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 5,70 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 722,66 K , 449,51 ?? C, 841,12 ?? C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 1261 K, 988 ?? C, 1810 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 17,49 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 114,1 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,73 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 6, 5, 4, 2, -2 (L??g??rement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,1 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 869,3 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1790 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2698 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 140 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 138 ?? 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 206 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | (1,97 ?? 3,38) W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 2,610 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 65 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 2,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 180 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 13494-80-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de tellure | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le tellure est un ??l??ment chimique avec le symbole Te et de num??ro atomique 52. Un fragile, l??g??rement toxique, rare, blanc argent?? m??tallo??de qui ressemble ?? de l'??tain , du tellure est chimiquement li?? ?? du s??l??nium et du soufre . Il trouve parfois sous forme native, sous forme de cristaux ??l??mentaires. Tellure est beaucoup plus commune dans l'univers dans son ensemble que ce est sur la Terre. Son extr??me raret?? dans la cro??te de la Terre, comparable ?? celle de platine , est d?? en partie ?? son num??ro atomique ??lev??, mais aussi en raison de sa formation d'un volatile hydrure qui a caus?? l'??l??ment ?? ??tre perdu dans l'espace sous forme de gaz lors de la formation de la n??buleuse chaude de la plan??te.
Tellure a ??t?? d??couvert en Transylvanie (aujourd'hui partie de la Roumanie ) en 1782 par Franz-Joseph M??ller von Reichenstein dans un min??ral contenant du tellure et l'or . Martin Heinrich Klaproth nomm?? le nouvel ??l??ment en 1798 apr??s le mot latin pour ??terre??, Tellus. Min??raux de tellurure d'or sont compos??s d'or naturelles les plus notables. Cependant, ils ne sont pas une source importante de tellure dans le commerce lui-m??me, qui est normalement extraite en tant que sous-produit de cuivre et de plomb production.
Commercialement, l'utilisation principale de tellure est en alliages, tout en acier et de cuivre pour am??liorer l'usinabilit??. Applications dans panneaux solaires et comme un semiconducteur mat??riau consomment ??galement une fraction consid??rable de la production de tellure.
Tellure n'a pas de fonction biologique, bien que les champignons peuvent incorporer ?? la place du soufre et du s??l??nium dans les acides amin??s tels que tellurocysteine et telluromethionine. Chez l'homme, le tellure est en partie m??tabolis?? en dim??thyl tellurure, (CH 3) 2 Te, un gaz ?? l'ail -comme l'odeur qui se exhale dans le souffle des victimes de la toxicit?? de tellure ou l'exposition.
Caract??ristiques
Propri??t??s physiques
Lorsque cristalline , le tellure est gris-blanc et quand il est ?? l'??tat pur, il poss??de un ??clat m??tallique. Ce est un m??tallo??de fragile et facilement pulv??ris??. Tellure amorphe est obtenu par pr??cipitation ?? partir d'une solution de tellureux ou tellurique acide (Te (OH 6)). Tellure est un semi-conducteur qui montre une plus grande conductivit?? ??lectrique dans certaines directions qui d??pend atomique alignement; les augmentations de conductivit?? l??g??rement lorsqu'ils sont expos??s ?? la lumi??re ( photoconductivit??). Quand ?? l'??tat fondu, le tellure est corrosif pour le cuivre, le fer et acier inoxydable.
Propri??t??s chimiques
Tellure adopte une structure polym??re, constitu?? de cha??nes en zig-zag des atomes de Te. Ce mat??riau gris r??siste ?? l'oxydation par l'air et est non volatile.
Isotopes
Naturels tellure a huit isotopes. Cinq de ces isotopes, 122 Te, Te 123, 124 Te, Te 125 et 126 Te, sont stables. Les trois autres, Te 120, 128 et 130 Te Te, ont ??t?? observ??s ?? ??tre radioactifs. Les isotopes stables ne repr??sentent que 33,2% du tellure naturel; ce est probablement en raison de la longue demi-vie des isotopes instables. Ils sont dans la plage de 10 13 ?? 2,2 ?? 10 24 ?? 128 ans (Te). Cela rend l'isotope 128 Te avec la demi-vie plus longue parmi tous radionucl??ides, qui est d'environ 160 billion (10 12) fois la l'??ge de l'univers connu .
Il ya 38 connue isom??res nucl??aires de tellure avec masses atomiques qui vont de 105 ?? 142. Tellure est parmi les ??l??ments les plus l??gers connus pour subir une d??sint??gration alpha, avec des isotopes 106 ?? 110 Te Te pouvoir subir ce mode de d??sint??gration. La masse atomique du tellure (127,60 g ?? mol -1) sup??rieure ?? celle de l'??l??ment suivant de l'iode (126,90 g ?? mol -1).
Occurrence


Avec une abondance de la Terre dans la cro??te comparable ?? celle du platine, du tellure est un des ??l??ments solides stables les plus rares de la cro??te de la Terre. Son abondance est environ 1 ug / kg. En comparaison, m??me les plus rares des lanthanides ont abondances cro??te de 500 ug / kg (voir Abondance des ??l??ments chimiques).
L'extr??me raret?? de tellure dans la cro??te de la Terre ne est pas un reflet de son abondance cosmique, qui est en fait sup??rieure ?? celle de rubidium , m??me si le rubidium est dix mille fois plus abondant dans la cro??te terrestre. Le extraordinairement faible abondance de tellure sur Terre est plut??t pens?? pour ??tre en raison de conditions dans la formation de la Terre, lorsque la forme stable de certains ??l??ments, en l'absence de l'oxyg??ne et de l'eau , a ??t?? contr??l?? par la puissance r??ductrice de la libre hydrog??ne . Selon ce sc??nario, certains ??l??ments tels que le tellure qui forment volatile hydrures ont ??t?? gravement appauvris au cours de la formation de la cro??te terrestre, par ??vaporation de ces hydrures. Tellure et le s??l??nium sont des ??l??ments lourds les plus ??puis??s dans la cro??te de la Terre par ce proc??d??.
Tellure est parfois trouv?? dans sa forme native (ce est ?? dire, ??l??mentaire), mais est plus souvent constat?? que les tellurures de l'or , tels que calav??rite et krennerite (deux diff??rent polymorphes de AuTe 2), petzite, Ag 3 AuTe 2, et sylvanite, AgAuTe 4. La ville de Telluride, Colorado a ??t?? nomm?? dans l'espoir d'une gr??ve de tellurure de l'or (qui n'a jamais mat??rialis??, si minerai m??tallique or a ??t?? trouv??). Or lui-m??me se trouve g??n??ralement non combin??e, mais quand on trouve naturellement comme un compos?? chimique, il est le plus souvent combin?? avec le tellure (quelques rares compos??s d'or non comme le tellurure de antimoniure aurostibite, AUSB 2, et bismuthure maldonite, Au 2 Bi, sont ??galement connus).
Bien que le tellure est trouv?? avec l'or le plus souvent sous forme non combin??e, il se trouve encore plus souvent combin??s avec des ??l??ments autres que l'or, que tellurures m??taux les plus courants (par exemple, m??lonite, Nite 2). Naturel tellurite et tellurate min??raux se produisent ??galement, form?? par oxydation de tellurures proches de la surface de la Terre. A la diff??rence de s??l??nium, de tellure est en g??n??ral pas en mesure de remplacer le soufre sous ses min??raux, en raison de la grande diff??rence de rayon ionique de soufre et le tellure. En cons??quence, de nombreux min??raux sulfur??s commune contiennent des quantit??s consid??rables de s??l??nium, mais seulement des traces de tellure.
Dans la ru??e vers l'or de 1893, les machines ?? creuser dans Kalgoorlie jet?? un mat??riau pyritique qui a obtenu dans leur fa??on ils ont cherch?? de l'or pur. Les d??chets Kalgoorlie a donc ??t?? utilis??e pour remplir les nids de poule ou dans le cadre de trottoirs. Trois ann??es se sont ??coul??es avant qu'il a r??alis?? que ceci ??tait d??chets calav??rite, un tellurure d'or qui n'a pas ??t?? reconnu. Cela a conduit ?? une deuxi??me ru??e vers l'or en 1896 qui comprenait l'exploitation mini??re dans les rues.
Production
La principale source de tellure est de anode boues produites lors du raffinage ??lectrolytique du blister cuivre . Ce est un composant de poussi??res ?? partir de haut-fourneau du raffinage du plomb . Traitement de 500 tonnes de minerai de cuivre donne g??n??ralement ?? 1 (0,45 kg) de tellure. Tellure est principalement produite dans le ??tats-Unis , le P??rou , le Japon et le Canada . Pour l'ann??e 2009, le British Geological Survey donne les num??ros suivants: ??tats-Unis 50 t, P??rou 7 t, le Japon et le Canada 40 t 16 t.
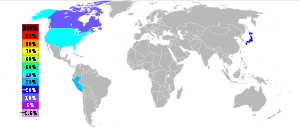
Les boues anodiques contiennent le s??l??niures et des tellurures de la les m??taux nobles des compos??s ayant la formule M 2 M 2 Se ou Te (M = Cu, Ag, Au). A des temp??ratures de 500 ?? C, les boues d'anode sont torr??fi??s avec le carbonate de sodium sous air. Les ions m??talliques sont r??duits en les m??taux, tandis que le tellurure est convertie en tellurite de sodium.
- M 2 Te + O 2 + Na 2 CO 3 → Na 2 TeO 3 + 2 M + CO 2
Tellurites peuvent ??tre lessiv??s ?? partir du m??lange avec de l'eau et sont normalement pr??sents que hydrotellurites HTeO 3 - en solution. S??l??nites sont ??galement form??es au cours de ce processus, mais ils peuvent ??tre s??par??s par l'addition d'acide sulfurique . Les hydrotellurites sont convertis dans la insoluble dioxyde de tellure tandis que les s??l??nites restent en solution.
- HTeO -
3 + OH - + H 2 SO 4 → TeO 2 + SO 2-
4 + 2 H 2 O
La r??duction du m??tal se fait soit par ??lectrolyse ou par r??action du dioxyde de tellure avec du dioxyde de soufre dans l'acide sulfurique.
- TeO 2 + 2 SO 2 + 2H 2 O → Te + SO 2-
4 + 4 H +
Tellure de qualit?? commerciale est g??n??ralement commercialis?? comme 200 mesh poudre, mais est ??galement disponible en dalles, des lingots, des b??tons, ou des morceaux. Le prix de fin d'ann??e pour le tellure en 2000 ??tait de US $ 14 par livre. Au cours des derni??res ann??es, le prix de tellure a ??t?? tir??e par la demande accrue et l'offre limit??e, atteignant jusqu'?? US $ 100 par livre en 2006. Malgr?? un doublement attendu de la production due ?? l'am??lioration des m??thodes d'extraction, le United States Department of Energy (DOE) anticipe un d??ficit d'approvisionnement de tellure en 2025.
Compos??s
Tellure appartient ?? la m??me famille chimique que l'oxyg??ne , le soufre , le s??l??nium et le polonium : la famille chalcog??ne. Les compos??s du tellure et de s??l??nium sont similaires. Il pr??sente l'oxydation d??clare -2, 2, 4 et 6, ?? l'??tat 4 ??tant le plus commun.
- Tellurures
R??duction de Te m??tal produit le tellurures et polytellurides, Te n 2-. L'??tat d'oxydation -2 est expos??e ?? des compos??s binaires avec de nombreux m??taux, tels que le tellurure de zinc, ZnTe, form?? par chauffage de tellure de zinc. D??composition de ZnTe avec acide chlorhydrique rendements le tellurure d'hydrog??ne (H 2 Te), un analogue tr??s instable d'autres hydrures de chalcog??ne, H 2 O , H 2 S et H 2 Se:
- ZnTe + 2 HCl → ZnCl 2 + H 2 Te
H 2 Te est instable, alors que les sels de sa base conjugu??e [Teh] - sont stables.
- Halog??nures
L'??tat d'oxydation +2 est expos??e par les dihalog??nures, TeCl 2, TeBr 2 et TeI 2. Les dihalog??nures ne ont pas ??t?? obtenus sous forme pure, mais ils sont des produits de d??composition des t??trahalog??nures connus dans des solvants organiques, et leurs d??riv??s tetrahalotellurates sont bien caract??ris??s:
- Te + X 2 + 2 X - → TeX 2-
4
o?? X est Cl, Br ou I. Ces anions sont plan carr?? en g??om??trie. Esp??ces anioniques polynucl??aires existent ??galement, comme le brun fonc?? Te
2 I 2
6, et le Te noir
I 4 2-
14.
Fluor forme deux halog??nures avec le tellure: la valence mixte Te 2 F 4 et TeF 6. Dans l'??tat d'oxydation +6, le groupe structurel -OTeF 5 se produit dans un certain nombre de compos??s tels que IEEOH 5, B (OTEF 5) 3, Xe (OTEF 5) 2, Te (OTEF 5) 4 et Te (OTEF 5) 6. Le anion antiprismatique carr?? TeF 2-
8 est ??galement attest??e. Les autres halog??nes ne forment pas halog??nures avec tellure dans l'??tat d'oxydation +6, mais seulement t??trahalog??nures ( TeCl 4, TeBr 4 et TeI 4) dans l'??tat 4, et d'autres halog??nures inf??rieurs (Te 3 Cl 2, Te 2 Cl 2, Br 2 2 Te, Te 2 I et deux formes de TEI). Dans l'??tat d'oxydation +4, halotellurate anions sont connus, tels que le 2- TeCl
6 et Te 2- Cl 2
10. Cations Halotellurium sont ??galement attest??s, y compris TeI +
3, trouv?? dans TeI 3 AsF 6.
- Oxocompounds

Tellure monoxyde a ??t?? signal??e pour la premi??re en 1883 comme un solide amorphe noir form?? par la d??composition thermique de Teso 3 dans le vide, dans dismuter le dioxyde de tellure, TeO 2 et du tellure ??l??mentaire par chauffage. Depuis lors, toutefois, un doute a ??t?? jet?? sur son existence dans la phase solide, m??me se il est connu comme un fragment en phase vapeur; le solide noir peut ??tre simplement un m??lange ??quimolaire de tellure ??l??mentaire et le dioxyde de tellure.
dioxyde de tellure est form?? en chauffant le tellure dans l'air, l'amenant ?? br??ler avec une flamme bleue. Tellure trioxyde, TeO 3 β-, est obtenu par d??composition thermique de Te (OH) 6. Les deux autres formes de trioxyde rapport??s dans la litt??rature, les formes α- et γ-, ont ??t?? trouv??s ne pas ??tre de vrais oxydes de tellure dans l'??tat d'oxydation +6, mais un m??lange de Te 4+, OH - et O -
2. Tellure pr??sente ??galement des oxydes ?? valence mixte, Te 2 O 5 et Te 4 O 9.
Les oxydes de tellure et d'oxydes hydrat??s forment une s??rie d'acides, y compris tellureux acide (H 2 TeO 3), l'acide orthotelluric (Te (OH) 6) et l'acide metatelluric ((H 2 TeO 4) n). Les deux formes de sels de tellurate de forme de l'acide tellurique contenant le TeO 2
4 et TeO 6-
6 anions, respectivement. Formes acides tellureux Tellurite sels contenant l'anion TeO 2-
3. D'autres cations de tellure comprennent TeF 2+
8, qui se compose de deux cycles condens??s de tellure et le polym??re 2+ TeF
7.
- Cations Zintl
Lorsque le tellure est trait?? avec de l'acide sulfurique concentr??, on forme des solutions rouges contenant le Zintl ion, Te 2+
4. L'oxydation du tellure par AsF 5 dans un liquide SO 2 produit ??galement cette cation plane carr??e, de m??me qu'avec la trigonale prismatique, jaune-orange Te 4+
6:
- Te 4 + 3 AsF5 → Te 2+
4 (ASF -
6) 2 + 3 AsF - 6 + 6 Te AsF5 → Te 4+
6 (ASF -
6) 4 + 2 AsF 3
D'autres cations de tellure Te Zintl comprend le polym??re 2+
7 et le Te bleu-noir 2+
8, qui se compose de deux cycles condens??s ?? 5 cha??nons tellure. Cette derni??re cation est form?? par la r??action de tellure avec hexachlorure de tungst??ne:
- Te 8 + 2 WCl 6 → Te 2+
8 (CMT -
6) 2
Cations Interchalcogen existent ??galement, comme Te 2 Se 2+
6 (g??om??trie cubique d??form??e) et Te 2 Se 2+
8. Celles-ci sont form??es par oxydation de m??langes de s??l??nium et de tellure avec AsF 5 ou SbF 5.
- Compos??s organotellure
Tellure ne fait pas facilement analogues de alcools et thiols, avec le groupe fonctionnel et sont appel??s -TeH tellurols. Le groupe fonctionnel -TeH est ??galement attribu??e ?? l'aide de la tellanyl- pr??fixe. Comme H 2 Te, ces esp??ces sont instables par rapport ?? la perte de l'hydrog??ne. Telluraethers (R-Te-R) sont plus stables que sont telluroxides.
Histoire

Tellure ( latine Tellus qui signifie ??terre??) a ??t?? d??couvert au 18??me si??cle dans un minerai d'or ?? partir des mines Zlatna, pr??s de ce qui est maintenant Sibiu, Roumanie . Ce minerai ??tait connu comme "Faczebajer wei??es bl??ttriges Golderz" (feuilles blanc de minerai d'or de Faczebaja, nom allemand de Faceb??nya, maintenant Fata Baii dans Alba) ou antimonalischer Goldkies (antimonic __gVirt_NP_NN_NNPS<__ pyrite d'or), et, selon Anton von Rupprecht, ??tait Spie??glask??nig (argent molybdique), contenant natif d'antimoine . En 1782, Franz-Joseph M??ller von Reichenstein, qui ??tait alors le poste de l'inspecteur en chef des mines autrichienne en Transylvanie, a conclu que le minerai ne contenait pas d'antimoine, mais que ce ??tait le sulfure de bismuth. L'ann??e suivante, il a signal?? que ce ??tait erron?? et que le minerai contenait principalement l'or et un m??tal inconnu tr??s similaire ?? l'antimoine. Apr??s une enqu??te approfondie qui a dur?? trois ans et est compos??e de plus de cinquante essais, M??ller a d??termin?? la densit?? de la mati??re min??rale et de noter le radis de l'odeur de la fum??e blanche qui fait passer lorsque le nouveau m??tal a ??t?? chauff??, la couleur rouge du m??tal qui conf??re ?? l'acide sulfurique , et le pr??cipit?? noir qui donne cette solution lorsqu'elle est dilu??e avec de l'eau. N??anmoins, il ne ??tait pas en mesure d'identifier ce m??tal et lui donna le nom aurum paradoxium et metallum problematicum, car il n'a pas montr?? les propri??t??s pr??vues pour l'antimoine pr??vu.
En 1789, un autre scientifique hongrois, P??l Kitaibel, a ??galement d??couvert l'??l??ment de fa??on ind??pendante dans un minerai de Deutsch-Pilsen qui avait ??t?? consid??r?? comme argentif??re molybd??nite, mais plus tard, il a donn?? le cr??dit pour M??ller. En 1798, il a ??t?? nomm?? par Martin Heinrich Klaproth qui, plus t??t il isol?? du min??ral calav??rite. Les ann??es 1960 ont apport?? la croissance dans les applications thermo??lectriques pour le tellure (comme tellurure de bismuth), ainsi que son utilisation en libre-usinage acier , qui est devenu l'utilisation dominante.
Applications
M??tallurgie
Le plus grand consommateur de tellure est m??tallurgie , o?? il est utilis?? en fer, cuivre et alliages de plomb. Lorsqu'il est ajout?? ?? acier inoxydable et le cuivre , il rend ces m??taux plus usinable. Il est alli?? dans fonte pour la promotion de la fra??cheur ?? des fins spectroscopiques, comme la pr??sence de graphite libre ??lectriquement conducteur a tendance ?? affecter de mani??re nuisible les r??sultats des tests d'??mission d'allumage. Dans plomb il am??liore la r??sistance et la durabilit?? et diminue l'action corrosive de l'acide sulfurique .
Semiconductor et utilisations ??lectroniques de l'industrie

Le tellure est utilis?? dans tellurure de cadmium (CdTe) panneaux solaires. Tests de laboratoire National Renewable Energy Laboratory utilisant ce mat??riau atteint certains des rendements les plus ??lev??s pour cellule solaire production d'??nergie ??lectrique. La production commerciale massive de CdTe panneaux solaires par First Solar au cours des derni??res ann??es a consid??rablement augment?? la demande de tellure. Si une partie du cadmium dans CdTe est remplac?? par le zinc puis (Cd, Zn) Te est form?? qui est utilis?? dans l'??tat solide D??tecteurs de rayons X.
Alli?? ?? la fois le cadmium et le mercure , pour former mercure tellurure de cadmium, un sensible ?? l'infrarouge semi-conducteur mat??riau est form??. Compos??s tels que organotellure tellurure de dim??thyle, tellurure de di??thyle, tellurure de diisopropyle, tellurure de diallyle et tellurure d'allyle de m??thyle sont utilis??es comme pr??curseurs pour croissance en phase vapeur d'??pitaxie organom??tallique en phase de II-VI semi-conducteurs compos??s. Diisopropyl tellurure (DIPTe) est utilis?? comme le pr??curseur pr??f??r?? pour r??aliser la croissance ?? basse temp??rature de CdHgTe par MOVPE. Pour ces proc??d??s plus grande puret?? organom??talliques ?? la fois le s??l??nium et le tellure sont utilis??s. Les compos??s pour l'industrie des semi-conducteurs et sont pr??par??s par purification produit d'addition.
Tellure comme un sous-oxyde de tellure est utilis?? dans la couche de support de plusieurs types de r??inscriptible disques optiques, y compris R??inscriptibles disques compacts ( CD-RW), r??inscriptible disques vid??o num??riques ( DVD-RW) et r??inscriptibles Disques Blu-ray.
Le tellure est utilis?? dans les nouveaux puces de m??moire ?? changement de phase au point par Intel . Le tellurure de bismuth (Bi 2 Te 3) et tellurure de plomb sont des ??l??ments de travailler dispositifs thermo??lectriques. Tellurure de plomb est utilis?? dans Extr??me- des d??tecteurs ?? infrarouge.
D'autres utilisations
- Utilis?? pour la couleur c??ramiques.
- La forte augmentation de la r??fraction optique lors de l'addition des s??l??niures et des tellurures en verre est utilis?? dans la production de fibres de verre pour les t??l??communications. Ces verres de chalcog??nure sont largement utilis??s.
- Des m??langes de s??l??nium et de tellure sont utilis??s avec le peroxyde de baryum comme comburant dans la poudre de retard ??lectrique d??tonateurs.
- Tellurures organiques ont ??t?? utilis??s comme initiateurs de polym??risation radicalaire vivante et riche en ??lectrons mono- et tellurures poss??dent antioxydant activit??.
- Caoutchouc peut ??tre vulcanis?? avec le tellure lieu de soufre ou de s??l??nium. Le caoutchouc produit de cette mani??re pr??sente une meilleure r??sistance ?? la chaleur.
- Tellurite agar-agar est utilis??e pour identifier le membre genre Corynebacterium, le plus typiquement Corynebacterium diphtheriae, l'agent pathog??ne responsable de la la dipht??rie.
R??le biologique
Tellure n'a pas de fonction biologique connue, bien que les champignons peuvent incorporer ?? la place du soufre et du s??l??nium dans des acides amin??s comme la cyst??ine et telluro-telluro-m??thionine. Organismes ont montr?? une tol??rance tr??s variable compos??s de tellure. La plupart des organismes m??tabolisent tellure partie pour former dim??thyle tellurure bien ditellurure dim??thyle est ??galement form?? par certaines esp??ces. Tellurure de dim??thyle a ??t?? observ?? dans des sources chaudes ?? des concentrations tr??s faibles.
Pr??cautions
Les compos??s du tellure et du tellure sont consid??r??es comme faiblement toxiques et doivent ??tre manipul??s avec soin, bien intoxication aigu?? est rare. Tellure ne est pas cit?? comme canc??rog??ne.
Les humains expos??s ?? aussi peu que 0,01 mg / m 3 ou moins dans l'air d??gagent une faute ail -comme odeur connu comme ??souffle de tellure". Cela est d?? ?? partir du tellure est m??tabolis?? par le corps, convertissant de ne importe quel ??tat d'oxydation de tellurure de dim??thyle, (CH 3) 2 Te. Ce est un compos?? volatile avec une odeur d'ail comme tr??s piquante. M??me si les voies m??taboliques de tellure ne sont pas connus, il est g??n??ralement admis qu'ils ressemblent ?? ceux de la plus largement ??tudi?? le s??l??nium , parce que les produits m??taboliques m??thyl??s finales des deux ??l??ments sont similaires.
