
acides amin??s
Contexte des ??coles Wikip??dia
Enfants SOS offrent un chargement complet de la s??lection pour les ??coles pour une utilisation sur les intranets des ??coles. Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .


Les acides amin??s sont des mol??cules contenant une amine groupe, un acide carboxylique et un groupe de cha??ne lat??rale qui varie entre les diff??rents acides amin??s. Les principaux ??l??ments d'un acide amin?? sont le carbone , l'hydrog??ne , l'oxyg??ne et l'azote . Ils sont particuli??rement importants dans la biochimie, o?? le terme se r??f??re g??n??ralement ?? des acides alpha-amin??s.
Un acide alpha-amin?? a la g??n??rique formule H 2 NCHRCOOH, o?? R est un compos?? organique substituant; le groupe amino est attach?? ?? l'atome de carbone imm??diatement adjacent au groupe carboxylate (le α-carbone). Il existe lorsque le groupe amino est attach?? ?? un atome de carbone diff??rent autres types d'acide amin??; par exemple, dans les acides gamma-amino (tel que gamma-amino-butyrique) l'atome de carbone auquel le groupe amino attache est s??par?? du groupe carboxylate de deux autres atomes de carbone. Les diff??rents acides alpha-amin??s diff??rent dans laquelle la cha??ne lat??rale (groupe R) est fix?? sur le carbone alpha, et peut varier en taille d'un seul atome d'hydrog??ne en un atome glycine dans une large un groupe h??t??rocyclique ?? tryptophane.
Les acides amin??s sont essentiels ?? la vie, et ont de nombreuses fonctions dans m??tabolisme. Une fonction particuli??rement importante est de servir les blocs de construction de prot??ines , qui sont simplement des cha??nes lin??aires d'acides amin??s. De m??me que les lettres de l'alphabet peuvent ??tre combin??s pour former une vari??t?? presque infinie de mots, les acides amin??s peuvent ??tre li??s ensemble dans des s??quences variables pour former une grande vari??t?? de prot??ines.
En raison de leur r??le central dans la biochimie, les acides amin??s sont importants dans la nutrition et sont couramment utilis??s dans technologie alimentaire et de l'industrie . Par exemple, glutamate monosodique est un commune exhausteur de go??t qui donne le go??t des aliments umami. Dans l'industrie, les applications comprennent la production de plastiques biod??gradables, m??dicaments, et catalyseurs chiraux.
Histoire
Les premiers acides amin??s ont ??t?? d??couverts quelques au d??but du 19??me si??cle. En 1806, les chimistes fran??ais Louis-Nicolas Vauquelin et Pierre Jean Robiquet isol?? un compos?? dans les asperges qui se est av??r??e l'asparagine, le premier acide amin?? ?? d??couvrir. Un autre acide amin?? qui a ??t?? d??couvert au d??but du 19e si??cle a ??t?? cystine, en 1810, bien que son monom??re, cyst??ine, a ??t?? d??couvert beaucoup plus tard, en 1884. Glycine et leucine ont ??galement ??t?? d??couvert ?? cette ??poque, en 1820. L'utilisation de l'acide amin?? terme en langue anglaise est de 1,898 .
Structure g??n??rale
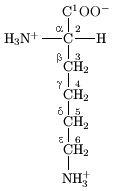
Dans la structure repr??sent??e en haut de la page, R repr??sente un la cha??ne lat??rale sp??cifique pour chaque acide amin??. Le carbone atome c??t?? du groupe carboxyle est appel?? le α-carbone et des acides amin??s avec une cha??ne lat??rale li??e ?? ce carbone sont appel??s des acides amin??s alpha. Ce sont la forme la plus commune dans la nature. Dans les acides alpha-amin??s, la α-carbone est un atome de carbone chiral, ?? l'exception de glycine. Dans les acides amin??s qui ont une cha??ne carbon??e fix??e ?? la α-carbone (tel que lysine, indiqu??s ?? la droite) les atomes de carbone sont ??tiquet??s afin que α, β, γ, δ, et ainsi de suite. Dans certains acides amin??s, le groupe amine est attach??e ?? la β ou γ-carbone, et ceux-ci sont donc appel??e b??ta ou gamma amino-acides.
Les acides amin??s sont g??n??ralement class??s par la propri??t??s de leur cha??ne lat??rale en quatre groupes. La cha??ne lat??rale peut faire un acide amin?? d'une acide faible ou d'un faible base, et une hydrophile si la cha??ne lat??rale est polaire ou un composant hydrophobe se il se agit non polaire. Le les structures chimiques des vingt-deux acides amin??s standards, ainsi que leurs propri??t??s chimiques, sont d??crits plus en d??tail dans l'article sur celles-ci les acides amin??s prot??inog??niques.
La phrase " ?? cha??ne ramifi??e d'acides amin??s ??ou BCAA se r??f??re aux acides amin??s ayant des cha??nes lat??rales aliphatiques, qui sont non-lin??aire; ceux-ci sont la leucine, l'isoleucine, et valine. Proline est le seul acide amin?? dont le groupe prot??inog??ne c??t?? relie au groupe α-amino et, par cons??quent, est ??galement le seul acide amin?? prot??inog??ne contenant une amine secondaire dans cette position. Chimiquement, la proline est donc un acide imino car il manque un groupe amino primaire , bien qu'il soit toujours class?? comme un acide amin?? dans la nomenclature biochimique de courant, et peut ??galement ??tre appel?? "alpha-amino acide N-alkyl??".

Isomerism
De la norme α-acides amin??s, mais tous glycine peut exister dans l'un des deux les isom??res optiques, appel??s L ou D des acides amin??s, qui sont des images sp??culaires l'une de l'autre (voir ??galement Chiralit??). Bien que les acides L-amin??s repr??sentent de tous les acides amin??s pr??sents dans les prot??ines lors de la traduction dans le ribosome, les acides D se trouvent dans de certaines prot??ines produites par enzyme modifications post-traductionnelles apr??s traduction et la translocation dans le r??ticulum endoplasmique, comme dans les organismes marins vivant exotiques tels que escargots de c??ne. Ils sont ??galement des composantes abondantes de la peptidoglycane les parois cellulaires des bact??ries , et D -s??rine peut agir comme un neurotransmetteur dans le cerveau . La L et D convention pour la configuration d'acides amin??s se r??f??re pas ?? l'activit?? optique de l'acide amin?? lui-m??me, mais plut??t ?? l'activit?? de l'isom??re optique de glyc??rald??hyde ?? partir de laquelle cet acide amin?? peut th??oriquement ??tre synth??tis?? (D -glyc??rald??hyde est dextrogyre, l??vogyre est glyc??rald??hyde-L). Alternativement, le (S) et (R) d??signateurs sont utilis??s pour indiquer l'absolu st??r??ochimie. Presque tous les les acides amin??s dans les prot??ines sont (S) au niveau du carbone α, avec de la cysteine ??tant (R) et de la glycine non-chiral. La cyst??ine est inhabituel car il a un soufre atome au niveau de la seconde position dans sa cha??ne lat??rale, qui pr??sente une plus grande masse atomique que les groupes fix??s ?? la premi??re carbone qui est fix?? ?? l'α-carbone dans les autres acides amin??s standards, donc le (R) au lieu de (S).

Zwitt??rions
Les groupes fonctionnels amine et acide carboxylique pr??sents dans les acides amin??s permettent d'avoir amphiprotoniques propri??t??s. A un certain pH, connu sous le nom point iso??lectrique, un acide amin?? a pas de charge globale puisque le nombre de proton??s groupes d'ammoniac (charges positives) et des groupes de carboxylate d??proton??s (charges n??gatives) sont ??gaux. Les acides amin??s ont tous des points iso??lectriques diff??rents. Les ions produits au point iso??lectrique ont des charges positives et n??gatives et sont connus en tant que zwitterion, qui vient du mot allemand Zwitter signifie ??hermaphrodite?? ou ??hybride??. Les acides amin??s peuvent exister sous forme de zwitterions et de mati??res solides dans les solutions polaires tels que l'eau, mais pas dans la phase gazeuse. Zwitt??rions ont minime solubilit?? ?? leur point iso??lectrique et un acide amin?? peuvent ??tre isol??s par le pr??cipitant de l'eau en ajustant le pH jusqu'?? son point iso??lectrique particulier.
Pr??sence et fonctions en biochimie

Acides amin??s standards
Les acides amin??s sont les unit??s de structure qui composent les prot??ines. Ils se unissent pour former courte cha??nes de polym??res appel??s peptides ou des cha??nes plus longues appel?? soit des polypeptides ou des prot??ines . Ces polym??res sont lin??aires et non ramifi??s, avec chaque acide amin?? dans la cha??ne attach??e ?? deux acides amin??s voisins. Le processus de prot??ines rendant est appel?? traduction et implique l'addition ??tape par ??tape des acides amin??s ?? une cha??ne prot??ique en croissance par un un ribozyme qui est appel?? un ribosome. L'ordre dans lequel les acides amin??s sont ajout??s est lu par le code g??n??tique d'un ARNm matrice, qui est un copie d'ARN de l'un de l'organisme de g??nes.
Vingt-deux acides amin??s sont naturellement int??gr??es dans polypeptides et sont appel??s les acides amin??s prot??inog??niques ou standard. Parmi ces vingt-deux, vingt sont cod??s par le code g??n??tique universel. Les deux autres, s??l??nocyst??ine et pyrrolysine, sont incorpor??s dans les prot??ines par des m??canismes synth??tiques uniques. S??l??nocyst??ine est incorpor?? lors de l'ARNm est traduit comprend un SECIS ??l??ment, ce qui provoque le codon UGA s??l??nocyst??ine pour coder au lieu d'un codon stop. Pyrrolysine est utilis?? par certains m??thanog??ne arch??es dans les enzymes qu'ils utilisent pour produire du m??thane . Elle est cod??e par le codon pour UAG, qui est normalement un codon d'arr??t dans d'autres organismes.

Des acides amin??s non standard
Outre les vingt-deux acides amin??s standard, il existe un grand nombre d'acides amin??s "non-standard". Ces acides amin??s non standard trouv??s dans les prot??ines sont constitu??es par modification post-traductionnelle, qui est une modification apr??s la traduction dans la synth??se des prot??ines. Ces modifications sont souvent essentiels pour la fonction ou le r??glement d'une prot??ine; par exemple, la carboxylation de glutamate permet une meilleure liaison de des cations de calcium, et le hydroxylation de proline est essentiel pour maintenir les tissus conjonctifs. Un autre exemple est la formation de hypusine dans le Traduction facteur d'initiation EIF5A, par modification d'un r??sidu de lysine. De telles modifications peuvent ??galement d??terminer la localisation de la prot??ine, par exemple, l'addition de groupements hydrophobes longues peut provoquer une prot??ine ?? se lier ?? un membrane phospholipidique.
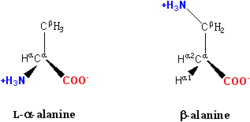
Exemples d'acides amin??s non standard qui ne figurent pas dans les prot??ines comprennent lanthionine, L'acide 2-aminoisobutyrique, d??hydro-alanine et le neurotransmetteur acide gamma-aminobutyrique. Des acides amin??s non standard produisent souvent comme interm??diaires dans la voies m??taboliques acides amin??s standards - par exemple ornithine et citrulline se produisent dans le cycle de l'ur??e, une partie de l'acide amin?? catabolisme (voir ci-dessous). Une rare exception ?? la domination d'acides α-amin?? en biologie est l'acide β-amino b??ta alanine (acide 3-aminopropano??que), qui est utilis?? dans les plantes et les micro-organismes dans la synth??se du l'acide pantoth??nique (vitamine B5), un composant de coenzyme A.
En nutrition humaine
Lorsque repris dans le corps humain ?? partir de l'alimentation, les vingt-deux acides amin??s standards sont soit utilis??s pour synth??tiser des prot??ines et d'autres biomol??cules ou oxyd??s en ur??e et du dioxyde de carbone comme source d'??nergie. La voie d'oxydation commence par l'??limination du groupe amino par un transaminase, le groupe amino est ensuite introduite dans le cycle de l'ur??e. L'autre produit de transamidation est un acide c??to qui p??n??tre dans le cycle de l'acide citrique. Acides amin??s glucog??nes peuvent ??galement ??tre convertis en glucose, par n??oglucogen??se.
Pyrrolysine trait est limit??e ?? plusieurs microbes, et un seul organisme a ?? la fois Pyl et Sec. Parmi les vingt-deux acides amin??s standard, huit sont appel??s des acides amin??s essentiels, car le corps humain ne peut pas les synth??tiser ?? partir d'autres compos??s au niveau n??cessaire pour une croissance normale, de sorte qu'ils doivent ??tre obtenus de la nourriture. Cependant, la situation est tr??s compliqu??e, car cyst??ine, taurine, la tyrosine, histidine et arginine sont des acides amin??s semiessential chez les enfants, parce que les voies m??taboliques qui synth??tisent ces acides amin??s sont pas pleinement d??velopp??s. Les montants n??cessaires d??pendent ??galement de l'??ge et de la sant?? de l'individu, il est donc difficile de faire des d??clarations g??n??rales sur l'obligation alimentaire pour certains acides amin??s.
| Essentiel | Non essentiel |
|---|---|
| Isoleucine | Alanine |
| Leucine | Asparagine |
| Lysine | L'acide aspartique |
| M??thionine | Cyst??ine * |
| Ph??nylalanine | L'acide glutamique |
| Thr??onine | Glutamine * |
| Tryptophane | Glycine * |
| Valine | Proline * |
| Selenocysteine * | |
| Serine * | |
| Tyrosine * | |
| Arginine * | |
| Histidine * | |
| Ornithine * | |
| Taurine * |
(*) Essential que dans certains cas.
Fonctions non prot??iques
Chez les humains, la prot??ine non-acides amin??s ont ??galement des r??les importants que interm??diaires m??taboliques, par exemple dans la biosynth??se de la neurotransmetteur acide gamma-aminobutyrique. De nombreux acides amin??s sont utilis??s pour synth??tiser d'autres mol??cules, par exemple:
- Le tryptophane est un pr??curseur du neurotransmetteur s??rotonine.
- La tyrosine est un pr??curseur de la neurotransmetteur la dopamine.
- La glycine est un pr??curseur de les porphyrines telles que h??me.
- L'arginine est un pr??curseur de l'oxyde nitrique.
- L'ornithine et La S-ad??nosylm??thionine sont des pr??curseurs de polyamines.
- Aspartate, glycine et glutamine sont des pr??curseurs de nucl??otides.
- La ph??nylalanine est un pr??curseur de diff??rents ph??nylpropano??des qui sont importants dans le m??tabolisme des plantes.
Toutefois, toutes les fonctions d'autres acides amin??s non standard abondantes sont connus, par exemple taurine est un acide amin?? important dans les tissus musculaires et c??r??brales, mais m??me si de nombreuses fonctions ont ??t?? propos??es, son r??le pr??cis dans le corps n'a pas ??t?? d??termin??e.
Certains acides amin??s non standards sont utilis??s comme d??fenses contre les herbivores dans les plantes. Par exemple canavanine est un analogue de arginine que l'on trouve dans de nombreux l??gumineuses, et notamment de grandes quantit??s dans Canavalia gladiata (pois sabre). Cet acide amin?? prot??ge les plantes contre les pr??dateurs tels que les insectes et peut causer des maladies chez les personnes si certains types de l??gumineuses sont consomm??s sans transformation. L'acide amin?? non-prot??ique mimosine se trouve dans d'autres esp??ces de l??gumineuses, en particulier Leucaena leucocephala. Ce compos?? est un analogue du tyrosine et peuvent empoisonner les animaux qui paissent sur ces plantes.
Utilise la technologie
Les acides amin??s sont utilis??s pour une vari??t?? d'applications dans l'industrie, mais leur utilisation principale est comme additifs ?? l'alimentation animale. Ceci est n??cessaire ??tant donn?? que bon nombre des composants en vrac de ces charges, telles que le soja , soit avoir des taux faibles ou manquer une partie de la acides amin??s essentiels: la lysine, la m??thionine, la thr??onine et le tryptophane sont plus importants dans la production de ces aliments. Le industrie alimentaire est ??galement un grand consommateur d'acides amin??s, en particulier l'acide glutamique, qui est utilis?? en tant que exhausteur de go??t, et L'aspartame (aspartyl-ph??nylalanine 1-m??thyl ester) en tant que basses calories ??dulcorant artificiel. Le reste de la production d'acides amin??s est utilis?? dans la synth??se du m??dicaments et les cosm??tiques.
| D??riv?? d'acide amin?? | Application pharmaceutique |
|---|---|
| 5-HTP (5-hydroxy) | Le traitement exp??rimental pour la d??pression. |
| L-DOPA (L-dihydroxyph??nylalanine) | Traitement pour Parkinsonisme. |
| Eflornithine | M??dicament qui inhibe l'ornithine-d??carboxylase et est utilis?? dans le traitement de la maladie du sommeil. |
Code g??n??tique ??largi
Depuis 2001, les 40 acides amin??s non naturels ont ??t?? ajout??s en une prot??ine par la cr??ation d'un codon unique (recodage) et un ARN de transfert correspondant: aminoacyl - paire ARNt-synth??tase pour coder avec physico-chimiques diverses et les propri??t??s biologiques afin d'??tre utilis?? comme un outil pour explorer structure de la prot??ine et la fonction ou pour cr??er de nouveaux ou des prot??ines am??lior??es.
blocs de construction chimiques
Les acides amin??s sont importants car low-cost mati??res premi??res. Ces compos??s sont utilis??s en synth??se chirale comme la piscine blocs de construction ??nantiom??riquement purs.
Les acides amin??s ont ??t?? ??tudi??s en tant que pr??curseurs catalyseurs chiraux, par exemple pour asym??triques hydrog??nation r??actions, m??me si aucune des applications commerciales existent.
Les plastiques biod??gradables
Les acides amin??s sont en cours de d??veloppement en tant que composants d'une s??rie de polym??res biod??gradables. Ces mat??riaux ont des applications comme l'emballage respectueux de l'environnement et en m??decine au d??livrance de m??dicament et la construction de implants proth??tiques. Ces polym??res comprennent des polypeptides, des polyamides, des polyesters et des polyur??thanes, polysulfures avec des acides amin??s, soit faisant partie de leurs cha??nes principales ou coll??s comme cha??nes lat??rales. Ces modifications modifient les propri??t??s physiques et les r??activit??s des polym??res. Un exemple int??ressant de ces mat??riaux est polyaspartate, un polym??re biod??gradable soluble dans l'eau qui peuvent avoir des applications dans jetable couches et l'agriculture. En raison de sa solubilit?? et la capacit?? de ions m??talliques chelates, polyaspartate est ??galement utilis??e comme un anti-biod??gradable d??tartrant et un inhibiteur de corrosion. En outre, l'acide amin?? aromatique tyrosine est d??velopp?? comme un remplacement possible pour toxiques ph??nols tels que le bisph??nol A dans la fabrication de polycarbonates.
R??actions
Comme acides amin??s ont ?? la fois une premi??re amine et un groupe primaire carboxyle groupe, ces produits chimiques peuvent subir plupart des r??actions associ??es ?? ces groupes fonctionnels. Il se agit notamment addition nucl??ophile, formation d'une liaison amide et formation d'imine pour le groupe amine et est??rification, formation d'une liaison amide et d??carboxylation du groupe d'acide carboxylique. Les multiples cha??nes lat??rales des acides amin??s peuvent ??galement subir des r??actions chimiques. Les types de ces r??actions sont d??termin??s par les groupes de ces cha??nes lat??rales et sont donc diff??rentes entre les diff??rents types d'acides amin??s.

La synth??se chimique
Plusieurs m??thodes existent pour synth??tiser les acides amin??s. Une des plus anciennes m??thodes, commence avec le bromation ?? l'α-carbone d'un acide carboxyic. La substitution nucl??ophile avec de l'ammoniac convertit ensuite le bromure d'alkyle ?? l'acide amin??. Alternativement, le Synth??se d'acides amin??s de Strecker implique le traitement d'un ald??hyde avec le cyanure de potassium et l'ammoniac, ce qui produit un nitrile α-amino en tant qu'interm??diaire. L'hydrolyse du nitrile en acide obtient ainsi un acide α-amin??. Utilisation de sels d'ammonium ou d'ammonium dans cette r??action donne les acides amin??s non substitu??s, tandis que la substitution des amines primaires et secondaires donnera acides amin??s substitu??s. De m??me, en utilisant les c??tones , au lieu d'ald??hydes, α, donne acides amin??s de α-disubstitu??. La synth??se classique donne des m??langes rac??miques d'acides α-amin??s en tant que produits, mais plusieurs autres proc??dures utilisant des auxiliaires asym??triques ou des catalyseurs asym??triques ont ??t?? d??velopp??s.
Actuellement, la m??thode la plus adopt??e est un synth??se automatis??e sur un support solide (par exemple, polystyr??ne ) de perles, ?? l'aide des groupes protecteurs (par exemple, Fmoc et t-Boc) et groupes d'activation (par exemple, DCC et DIC).
formation d'une liaison peptidique

A la fois l'amine et les groupes acide carboxylique des acides amin??s peuvent r??agir pour former des liaisons amide, une mol??cule d'acide amin?? peut r??agir avec un autre joint et devient par une liaison amide. Cette polym??risation d'acides amin??s est ce qui cr??e des prot??ines. Cette r??action de condensation donne le nouvellement form?? liaison peptidique et une mol??cule d'eau. Dans les cellules, cette r??action ne se produit pas directement; ?? la place de l'acide amin?? est d'abord activ?? par fixation ?? un transf??rer mol??cule d'ARN par une liaison ester. Cette aminoacyl-ARNt est produit dans un ATP d??pendante r??action r??alis??e par un aminoacyl ARNt synthetase. Cette aminoacyl-ARNt est alors un substrat pour la ribosome, qui catalyse l'attaque du groupe amino de la cha??ne prot??ique d'allongement de la liaison ester. En raison de ce m??canisme, tous les prot??ines produites par les ribosomes sont synth??tis??s ?? partir de leur extr??mit?? N-terminale et se dirigeant vers leur extr??mit?? C-terminale.
Cependant, toutes les liaisons peptidiques sont form??es de cette mani??re. Dans quelques cas, les peptides sont synth??tis??s par des enzymes sp??cifiques. Par exemple, le tripeptide glutathion est un ??l??ment essentiel de la d??fense de cellules contre le stress oxydatif. Ce peptide est synth??tis?? en deux ??tapes ?? partir des acides amin??s libres. Dans la premi??re ??tape gamma-glutamylcyst??ine synthetase condense la cyst??ine et l'acide glutamique par une liaison peptidique form??e entre le groupe carboxyle de cha??ne lat??rale du glutamate (l'atome de carbone gamma de cette cha??ne lat??rale) et le groupe amino de la cyst??ine. Ce dipeptide est ensuite condens?? avec glycine par glutathion synth??tase pour former le glutathion.
En chimie, les peptides sont synth??tis??s par une s??rie de r??actions. L'un des plus utilis??s en la synth??se de peptides en phase solide, qui utilise les d??riv??s d'oxime aromatiques d'acides amin??s que les unit??s activ??es. Ceux-ci sont ajout??s en s??quence sur la cha??ne peptidique en croissance, qui est fix?? ?? un support de r??sine solide. La capacit?? de synth??tiser facilement un grand nombre de peptides diff??rents en faisant varier les types et l'ordre des acides amin??s (en utilisant chimie combinatoire) a fait la synth??se des peptides particuli??rement important dans la cr??ation de biblioth??ques de peptides pour une utilisation dans la d??couverte de m??dicaments par le biais criblage ?? haut d??bit.
La biosynth??se et du catabolisme
Chez les plantes, l'azote est d'abord assimil??e en compos??s organiques sous forme de glutamate, form??s ?? partir d'alpha-c??toglutarate et de l'ammoniac dans la mitochondrie. Afin de former d'autres acides amin??s, l'installation utilise transaminases pour d??placer le groupe amino d'un autre acide carboxylique alpha-c??to. Par exemple, l'aspartate aminotransf??rase convertit glutamate oxaloac??tate et ?? l'alpha-c??toglutarate et d'aspartate. D'autres organismes utilisent transaminases pour la synth??se d'acides amin??s aussi. Transaminases sont ??galement impliqu??s dans la d??gradation des acides amin??s. D??grader un acide amin?? implique souvent le d??placement de son groupe amino ?? l'alpha-c??toglutarate, formant glutamate. Dans de nombreux vert??br??s, le groupe amino est ensuite retir?? ?? travers la cycle de l'ur??e et est excr??t?? sous forme d' ur??e . Toutefois, la d??gradation des acides amin??s peut produire l'acide urique ou de l'ammoniac ?? la place. Par exemple, s??rine d??shydratase convertit la serine en pyruvate et ammoniac.
Acides amin??s non standard sont g??n??ralement form??s par des modifications des acides amin??s standards. Par exemple, homocyst??ine est form?? ?? travers la voie de transsulfuration ou par la d??m??thylation de la m??thionine par le m??tabolite interm??diaire S-ad??nosyl m??thionine, tandis que hydroxyproline est constitu?? par un modification post-traductionnelle de proline.
Les micro-organismes et les plantes peuvent synth??tiser de nombreux acides amin??s rares. Par exemple, certains microbes rendent L'acide 2-aminoisobutyrique et lanthionine, qui est un d??riv?? de sulfure de pontage alanine. Ces deux acides amin??s se trouvent dans peptidique lantibiotiques tels que alam??thicine. Alors que chez les plantes, L'acide 1-aminocyclopropane-1-carboxylique est un petit acide amin?? cyclique disubstitu?? qui est un interm??diaire cl?? dans la production de l'hormone v??g??tale ??thyl??ne .
Propri??t??s physico-chimiques des acides amin??s
Les 20 acides amin??s cod??s directement par le code g??n??tique peuvent ??tre divis??s en plusieurs groupes en fonction de leurs propri??t??s. Les facteurs importants sont responsables, hydrophile ou hydrophobie, la taille et des groupes fonctionnels. Ces propri??t??s sont importantes pour la structure des prot??ines et interactions prot??ine-prot??ine. Les prot??ines solubles dans l'eau ont tendance ?? avoir leurs r??sidus hydrophobes (Leu, Ile, Val, Phe et Trp) enfouis dans le milieu de la prot??ine, tandis que les cha??nes lat??rales hydrophiles sont expos??s au solvant aqueux. Le des prot??ines membranaires int??grales ont tendance ?? avoir des bagues ext??rieures expos??es les acides amin??s hydrophobes que les ancrer dans le bicouche lipidique. Dans le cas ?? mi-chemin entre ces deux extr??mes, certains des prot??ines membranaires p??riph??riques ont un patch d'acides amin??s hydrophobes sur leur surface qui se verrouille sur la membrane. De m??me, des prot??ines qui ont ?? se lier ?? des mol??cules charg??es positivement ont des surfaces riche en acides amin??s charg??s n??gativement tels que glutamate et aspartate, tandis que les prot??ines de liaison aux mol??cules charg??es n??gativement ont des surfaces riche avec des cha??nes charg??s positivement comme lysine et arginine. Il existe diff??rents ??chelles d'hydrophobicit?? de r??sidus d'acides amin??s.
Certains acides amin??s ont des propri??t??s sp??ciales telles que cyst??ine, qui peut former covalente liaisons disulfures ?? d'autres r??sidus cyst??ine, proline formes que un cycle au squelette du polypeptide, et glycine qui est plus flexible que d'autres acides amin??s.
De nombreuses prot??ines subissent une gamme de modifications post-traductionnelles, lorsque des groupes chimiques suppl??mentaires sont fix??s aux acides amin??s dans les prot??ines. Certaines modifications peuvent produire hydrophobe lipoprot??ines, ou hydrophile glycoprot??ines. Ce type de modification r??versible permet le ciblage d'une prot??ine sur une membrane. Par exemple, l'addition et l'enl??vement de l'acide gras l'acide palmitique aux r??sidus de cysteine dans certaines prot??ines de signalisation provoque les prot??ines pour fixer et d??tacher ensuite ?? partir de membranes cellulaires.
Tableau des abr??viations et les propri??t??s des acides amin??s standards
| Acide Amin?? | 3-Lettre | 1-Lettre | Une cha??ne lat??rale de polarit?? | responsable de la cha??ne lat??rale (pH 7,4) | Indice d'hydropathie | Absorbance λ max (nm) | ε au λ max (x10 -3 M -1 cm -1) |
|---|---|---|---|---|---|---|---|
| Alanine | Ala | Un | non polaire | neutre | 1,8 | ||
| Arginine | Arg | R | polaire | positif | -4,5 | ||
| Asparagine | Asn | N | polaire | neutre | -3,5 | ||
| L'acide aspartique | Aspic | R?? | polaire | n??gatif | -3,5 | ||
| Cyst??ine | Cys | C | non polaire | neutre | 2,5 | 250 | 0,3 |
| L'acide glutamique | Glu | E | polaire | n??gatif | -3,5 | ||
| Glutamine | Gin | Q | polaire | neutre | -3,5 | ||
| Glycine | Gly | Sol | non polaire | neutre | -0,4 | ||
| Histidine | Son | H | polaire | positive (10%) neutre (90%) | -3,2 | 211 | 5,9 |
| Isoleucine | Ile | Je | non polaire | neutre | 4.5 | ||
| Leucine | Leu | L | non polaire | neutre | 3,8 | ||
| Lysine | Lys | K | polaire | positif | -3,9 | ||
| M??thionine | Met | M | non polaire | neutre | 1,9 | ||
| Ph??nylalanine | Phe | Fa | non polaire | neutre | 2,8 | 257, 206, 188 | 0,2, 9,3, 60,0 |
| Proline | Pro | P | non polaire | neutre | -1,6 | ||
| Serine | Ser | S | polaire | neutre | -0,8 | ||
| Thr??onine | Thr | T | polaire | neutre | -0,7 | ||
| Tryptophane | Trp | W | non polaire | neutre | -0,9 | 280, 219 | 5,6, 47,0 |
| Tyrosine | Tyr | Y | polaire | neutre | -1,3 | 274, 222, 193 | 1,4, 8,0, 48,0 |
| Valine | Val | V | non polaire | neutre | 4.2 |
En outre, il existe deux acides amin??s suppl??mentaires qui sont incorpor??s en substituant des codons d'arr??t:
| 21 et 22e acides amin??s | 3-Lettre | 1-Lettre |
|---|---|---|
| Selenocysteine | Seconde | U |
| Pyrrolysine | Pyl | O |
En plus des codes d'acides amin??s sp??cifiques, des espaces r??serv??s sont utilis??s dans les cas o?? chimique ou analyse cristallographique d'un peptide ou d'une prot??ine ne peut pas d??terminer de fa??on concluante l'identit?? d'un r??sidu.
| Amino Acids ambigu?? | 3-Lettre | 1-Lettre |
|---|---|---|
| Asparagine ou l'acide aspartique | Asx | B |
| La glutamine ou l'acide glutamique | Glx | Z |
| Leucine ou isoleucine | XLE | J |
| Acide amin?? sp??cifi?? ou connu | Xaa | X |
Unk est parfois utilis?? ?? la place de Xaa, mais est moins standard.
En outre, de nombreux acides amin??s non standard ont un code sp??cifique. Par exemple, plusieurs m??dicaments peptidiques, tels que Le bort??zomib ou MG132 sont synth??tis?? artificiellement et conserver leur des groupes protecteurs, qui ont des codes sp??cifiques. Le bort??zomib est Pyz-Phe-boroLeu et MG132 est Z-Leu-Leu-Leu-al. En outre, pour faciliter l'analyse de la structure des prot??ines, photor??ticulation d'analogues d'acides amin??s sont disponibles. Il se agit notamment photoleucine (peuls) et photomethionine (PMET).
