
Prot??ine
Contexte des ??coles Wikip??dia
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille pr??s de la charit??. Lire la suite ...

Prot??ines (pron .: / /; On conna??t ??galement que des polypeptides) sont des compos??s organiques en acides amin??s dispos??s en une cha??ne lin??aire et pli??es dans une globulaire ou forme fibreuse. Les acides amin??s dans un polym??re sont reli??s entre eux par le des liaisons peptidiques entre les carboxyles et amino des groupes d'acide amin?? adjacent r??sidus. Le s??quence d'acides amin??s dans une prot??ine est d??finie par la une s??quence de g??ne, qui est cod??e dans le code g??n??tique . En g??n??ral, le code g??n??tique pr??cise 20 acides amin??s standards; toutefois, dans certains organismes du code g??n??tique peut comprendre s??l??nocyst??ine et dans certains archaea- pyrrolysine. Peu de temps apr??s ou m??me pendant la synth??se, les r??sidus dans une prot??ine sont souvent modifi??s chimiquement par modification post-traductionnelle, qui modifie les propri??t??s physiques et chimiques, le pliage, la stabilit??, l'activit??, et, finalement, la fonction des prot??ines. Les prot??ines peuvent aussi travailler ensemble pour parvenir ?? une fonction particuli??re, et ils associent souvent pour former stable complexes.
Une des caract??ristiques les plus distinctives de polypeptides est leur capacit?? ?? se replier dans un ??tat globulaire ou ??structure??. La mesure dans laquelle les prot??ines se replient en une structure d??finie est tr??s variable. Certaines prot??ines se plient en une structure tr??s rigide avec de petites fluctuations et sont donc consid??r??s comme structure unique. D'autres prot??ines subissent des r??arrangements de grands une conformation ?? l'autre. Ce changement de conformation est souvent associ??e ?? une signalisation ??v??nement. Ainsi, la structure d'une prot??ine servant de support ?? travers laquelle une ou l'autre de r??guler la fonction d'une prot??ine ou de l'activit?? d'une enzyme. Pas toutes les prot??ines n??cessitant un processus de pliage pour fonctionner, comme une fonction dans un ??tat d??pli??.
Comme d'autres biologique des macromol??cules telles que polysaccharides et acides nucl??iques, prot??ines sont des ??l??ments essentiels d'organismes et participez dans pratiquement tous les processus au sein des cellules . De nombreuses prot??ines sont enzymes qui catalysent les r??actions biochimiques et sont vitales pour m??tabolisme. Les prot??ines ont ??galement des fonctions structurelles ou m??caniques, tels que actine et la myosine dans le muscle et les prot??ines dans le cytosquelette, qui forment un syst??me de ??chafaudage qui maintient la forme des cellules. D'autres prot??ines sont importantes la signalisation cellulaire, des r??ponses immunitaires , l'adh??sion cellulaire, et la cycle cellulaire. Les prot??ines sont ??galement n??cessaires dans l'alimentation des animaux, puisque les animaux ne peuvent pas synth??tiser tous les acides amin??s dont ils ont besoin et doivent obtenir acides amin??s essentiels de la nourriture. Gr??ce au processus de la digestion, les animaux se d??composent prot??ines ing??r??es en acides amin??s libres qui sont ensuite utilis??s dans le m??tabolisme.
Les prot??ines ont d'abord ??t?? d??crits par la Chimiste hollandais Johannes Gerhardus Mulder et nomm?? par le chimiste su??dois J??ns Jakob Berzelius en 1838. Les premiers scientifiques nutritionnels tels que l'allemand Carl von Voit croit que la prot??ine ??tait le nutriment le plus important pour le maintien de la structure du corps, car il a ??t?? g??n??ralement admis que ??la chair fait chair." Le r??le central des prot??ines telles que des enzymes dans les organismes vivants n'a cependant pas ??t?? pleinement appr??ci?? jusqu'?? 1926, lorsque James B. Sumner a montr?? que l'enzyme ur??ase est en effet une prot??ine. La premi??re prot??ine soit s??quenc?? ??tait l'insuline , par Frederick Sanger , qui a remport?? le prix Nobel pour cette r??alisation en 1958. La premi??re structures de prot??ines ?? r??soudre ??taient h??moglobine et la myoglobine, par Max Perutz et Sir John Cowdery Kendrew, respectivement, en 1958. Les structures tridimensionnelles des deux prot??ines ont d'abord ??t?? d??termin??s par L'analyse par diffraction de rayons X; Perutz et Kendrew partag?? le 1962 Prix Nobel de chimie pour ces d??couvertes. Les prot??ines peuvent ??tre purifi??e ?? partir d'autres composants cellulaires en utilisant une vari??t?? de techniques telles que ultracentrifugation, pr??cipitation, ??lectrophor??se et chromatographie ; l'av??nement de g??nie g??n??tique a permis un certain nombre de m??thodes pour faciliter la purification. Des proc??d??s couramment utilis??s pour ??tudier la structure et la fonction des prot??ines comprennent immunohistochimie, mutagen??se dirig??e, r??sonance magn??tique nucl??aire et spectrom??trie de masse .
Biochimie

La plupart des prot??ines sont lin??aires polym??res construits ?? partir de la s??rie de jusqu'?? 20 diff??rent -α- L des acides amin??s . Tous les acides amin??s poss??dent des caract??ristiques structurelles communes, comprenant une α-atome de carbone auquel un groupe amino groupe, un carboxyle groupe, et une variable cha??ne lat??rale sont li?? . Seulement proline diff??re de cette structure de base, car il contient un cycle inhabituel pour le groupe amine N-fin, ce qui force le fragment amide CO-NH dans une conformation fixe. Les cha??nes lat??rales des acides amin??s classiques, d??crites dans le liste des acides amin??s standards, avoir une grande vari??t?? de structures et propri??t??s chimiques; ce est l'effet combin?? de l'ensemble des cha??nes lat??rales d'acides amin??s dans une prot??ine qui d??termine finalement la structure en trois dimensions et de sa r??activit?? chimique.
 |  | |
La structure chimique de la liaison peptidique (?? gauche) et d'une liaison peptidique entre leucine et thr??onine (?? droite) | ||
Les acides amin??s dans une cha??ne polypeptidique sont li??s par des liaisons peptidiques. Une fois li?? ?? la cha??ne de prot??ine, un acide amin?? particulier est appel?? un r??sidu, et la s??rie li??e de carbone, d'azote et des atomes d'oxyg??ne sont connus en tant que cha??ne principale ou squelette prot??ique. La liaison peptidique a deux formes de r??sonance qui contribuent un certain caract??re de double liaison et emp??cher une rotation autour de son axe, de sorte que les atomes de carbone alpha sont plus ou moins coplanaires. Les deux autres les angles di??dres de la liaison peptidique d??terminer la forme locale assum??e par le squelette prot??ique. L'extr??mit?? de la prot??ine avec un groupe carboxyle libre est connue comme la C-terminale ou carboxy-terminale, tandis que l'extr??mit?? avec un groupe amino libre est connue comme la N-terminale ou amino-terminale.
La prot??ine de mots, polypeptide, et peptide sont un peu ambigus et peuvent se chevaucher dans un sens. La prot??ine est g??n??ralement utilis?? pour d??signer la mol??cule biologique complet dans une ??table conformation, alors que le peptide est g??n??ralement r??serv?? pour une courte oligom??res d'acide amin?? manque souvent une structure tridimensionnelle stable. Cependant, la fronti??re entre les deux ne est pas bien d??fini et se trouve g??n??ralement pr??s de 20 ?? 30 r??sidus. Polypeptide peut se r??f??rer ?? toute cha??ne lin??aire simple des acides amin??s, g??n??ralement ind??pendamment de la longueur, mais implique souvent une absence de sens conformation.
Synth??se

Les prot??ines sont assembl??es ?? partir des acides amin??s en utilisant les informations cod??es dans g??nes. Chaque prot??ine a sa propre s??quence d'acides amin??s unique qui est sp??cifi?? par le s??quence de nucleotides du g??ne codant pour cette prot??ine. Le code g??n??tique est un ensemble de trois ensembles de nucl??otides appel??s codons et chaque combinaison de trois nucleotides d??signe un acide amin??, par exemple ao??t ( adenine- uracil- guanine) est le code pour m??thionine. ??tant donn?? que l'ADN contient quatre nucleotides, le nombre total de codons possibles est 64; par cons??quent, il existe une certaine redondance dans le code g??n??tique, certains acides amin??s sp??cifi??s par plus d'un codon. Les g??nes cod??s dans l'ADN sont tout d'abord transcrit en pr??- L'ARN messager (ARNm) par des prot??ines telles que ARN polym??rase. La plupart des organismes traiter ensuite le pr??-ARNm (aussi connu comme un transcrit primaire) en utilisant diff??rentes formes de modification post-transcriptionnelle pour former l'ARNm mature, qui est ensuite utilis?? comme matrice pour la synth??se de prot??ine par la ribosome. En procaryotes l'ARNm peut soit ??tre utilis?? d??s qu'il est produit, ou ??tre li?? par un ribosome apr??s avoir ??cart?? de la nucl??o??de. En revanche, les eucaryotes font ARNm dans le noyau de la cellule et ensuite translocation ?? travers la dans la membrane nucl??aire cytoplasme, o?? la synth??se des prot??ines a alors lieu. Le taux de synth??se des prot??ines est plus ??lev??e que chez les procaryotes et les eucaryotes peut atteindre jusqu'?? 20 acides amin??s par seconde.
Proc??d?? de synth??se d'une prot??ine ?? partir d'une matrice d'ARNm est connu comme traduction. L'ARNm est charg?? sur le ribosome et trois nucleotides est lue ?? la fois par chaque codon correspondant ?? sa appariement de bases situ?? sur un anticodon transf??rer une mol??cule d'ARN, qui porte l'acide amin?? correspondant au codon il reconna??t. L'enzyme aminoacyl ARNt synth??tase "frais" l'ARNt mol??cules avec les acides amin??s corrects. Le polypeptide en croissance est souvent appel??e la cha??ne naissante. Les prot??ines sont toujours biosynth??tis??es ?? partir de N-terminale ?? l'extr??mit?? C-terminale.
La taille d'une prot??ine synth??tis??e peut ??tre mesur??e par le nombre d'acides amin??s qu'il contient et par sa totale masse mol??culaire , qui est normalement rapport?? en unit??s de daltons (synonyme de unit??s de masse atomique), ou le d??riv?? de l'unit?? kilodaltons (kDa). levure de prot??ines sont une moyenne de 466 acides amin??s de long et de 53 kDa de la masse. Les prot??ines connues les plus importants sont le titins, une composante de la muscle sarcom??re, avec une masse mol??culaire de pr??s de 3 000 kDa et une longueur totale de pr??s de 27 000 acides amin??s.
La synth??se chimique
Courts prot??ines peuvent ??galement ??tre synth??tis??s chimiquement par une famille de proc??d??s connus en tant que la synth??se des peptides, qui se appuient sur des techniques de synth??se organiques tels que ligature chimique pour produire des peptides avec un rendement ??lev??. Synth??se chimique permet l'introduction d'acides amin??s non naturels dans les cha??nes de polypeptides, tels que la fixation de sondes fluorescentes aux acides des cha??nes lat??rales d'acides. Ces proc??d??s sont utiles dans le laboratoire de biochimie et biologie cellulaire, bien que g??n??ralement pas pour des applications commerciales. La synth??se chimique est inefficace pour des polypeptides plus longs ?? environ 300 acides amin??s, et les prot??ines synth??tis??es peuvent pas facilement assumer leur native structure tertiaire. La plupart des m??thodes de synth??se chimique proc??dent d'extr??mit?? C-terminale ?? N-terminale, oppos??e ?? la r??action biologique.
Structure

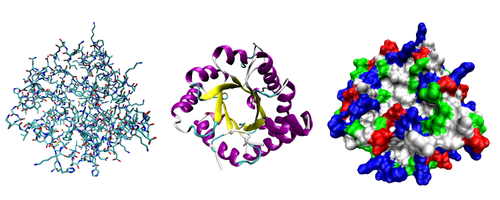
La plupart des prot??ines plier en trois dimensions des structures uniques. La forme dans laquelle une prot??ine naturellement plis est connu comme son conformation native. Bien que de nombreuses prot??ines peuvent se replier sans aide, tout simplement ?? travers les propri??t??s chimiques de leurs acides amin??s, d'autres n??cessitent l'aide d'mol??culaire chaperons se replier dans leurs ??tats indig??nes. Biochimistes se r??f??rent souvent ?? quatre aspects distincts de la structure d'une prot??ine:
- Structure primaire: le s??quence d'acides amin??s.
- Structure secondaire: r??p??ter r??guli??rement les structures locales stabilis??s par des liaisons hydrog??ne. Les exemples les plus courants sont le h??lice alpha, feuille b??ta et tourne. ??tant donn?? que les structures secondaires sont locaux, de nombreuses r??gions de structure secondaire diff??rente peuvent ??tre pr??sents dans la m??me mol??cule de prot??ine.
- La structure tertiaire: la forme g??n??rale d'une seule mol??cule de prot??ine; la relation spatiale entre les structures secondaires les unes aux autres. Structure tertiaire est g??n??ralement stabilis?? par des interactions non locales, le plus souvent la formation d'une noyau hydrophobe, mais aussi par des ponts de sel, des liaisons hydrog??ne, ponts disulfures, et m??me modifications post-traductionnelles. Le terme ??structure tertiaire" est souvent utilis?? comme synonyme de la bergerie terme. La structure tertiaire est ce qui contr??le la fonction de base de la prot??ine.
- Structure quaternaire: la structure form??e par plusieurs mol??cules de prot??ine (cha??nes polypeptidiques), habituellement appel??e sous-unit??s prot??iques dans ce contexte, qui fonctionnent comme un seul complexe prot??ique.
Les prot??ines ne sont pas enti??rement mol??cules rigides. En plus de ces niveaux de la structure, les prot??ines peuvent se d??placer entre plusieurs structures li??es pendant qu'ils exercent leurs fonctions. Dans le cadre de ces r??arrangements fonctionnels, ces structures tertiaires ou quaternaires sont habituellement appel??s " conformations ", et les transitions entre elles sont appel??es des changements conformationnels. De telles modifications sont souvent induites par la liaison d'un mol??cule de substrat ?? une enzyme de site actif, ou la r??gion physique de la prot??ine qui participe ?? la catalyse chimique. Dans les prot??ines de la solution subir ??galement des variations dans la structure par vibration thermique et la collision avec d'autres mol??cules.

Les prot??ines peuvent ??tre informelle divis??s en trois classes principales, qui sont en corr??lation avec les structures tertiaires typiques: les prot??ines globulaires, des prot??ines fibreuses, et des prot??ines membranaires. Presque toutes les prot??ines globulaires sont solubles et beaucoup sont des enzymes. Prot??ines fibreuses sont souvent structurelles, telles que le collag??ne, le composant majeur du tissu conjonctif, ou k??ratine, le composant prot??ique des cheveux et des ongles. Les prot??ines membranaires servent souvent des r??cepteurs ou des canaux pour fournir polaire ou des mol??cules charg??es de passer ?? travers le membrane cellulaire.
Un cas particulier de liaisons hydrog??ne intramol??culaires au sein de prot??ines, mal prot??g?? contre les attaques de l'eau et donc la promotion de leur propre la d??shydratation, sont appel??s dehydrons.
D??termination de la structure
D??couverte de la structure tertiaire d'une prot??ine, ou de la structure quaternaire de ses complexes, peuvent fournir des indices importants sur la fa??on dont la prot??ine exerce sa fonction. M??thodes exp??rimentales communes de d??termination de la structure comprennent Cristallographie aux rayons X et Spectroscopie RMN, qui peuvent tous deux produire de l'information au atomique r??solution. Cependant, des exp??riences de RMN sont en mesure de fournir des informations ?? partir de laquelle un sous-ensemble de distances entre paires d'atomes peut ??tre estim??e, et les conformations possibles finales pour une prot??ine sont d??termin??es par r??solution d'un probl??me de g??om??trie ?? distance. Interf??rom??trie ?? double polarisation est une m??thode d'analyse quantitative de mesure de la prot??ine globale conformation et changements conformationnels dus ?? des interactions ou autre stimulus. Dichro??sme circulaire est une autre technique de laboratoire pour d??terminer la composition interne feuille / h??lico??dal b??ta de prot??ines. cryomicroscopie ??lectronique est utilis?? pour produire ?? faible r??solution des informations structurales sur de tr??s grands complexes de prot??ines, y compris assembl??s virus ; une variante appel??e cristallographie ??lectronique peut ??galement produire de l'information ?? haute r??solution, dans certains cas, en particulier pour cristaux bidimensionnelles de prot??ines membranaires. R??solu structures sont habituellement d??pos??s dans le Protein Data Bank (PDB), une ressource librement accessible ?? partir de laquelle les donn??es structurelles sur des milliers de prot??ines peuvent ??tre obtenues sous la forme de coordonn??es cart??siennes de chaque atome dans la prot??ine.
Beaucoup plus de s??quences de g??nes sont connus que des structures de prot??ines. En outre, l'ensemble des structures r??solues est sollicit?? vers prot??ines qui peuvent ??tre facilement soumises ?? des conditions requises en Cristallographie aux rayons X, l'une des principales m??thodes de d??termination de la structure. En particulier, les prot??ines globulaires sont relativement faciles ?? cristalliser en vue de cristallographie aux rayons X. Les prot??ines membranaires, en revanche, sont difficiles ?? cristalliser et sont sous-repr??sent??es dans l'APB. Initiatives de g??nomique structurale ont tent?? de rem??dier ?? ces carences en r??solvant syst??matiquement structures repr??sentatives des principales cat??gories de pliage. Prot??ines m??thodes de pr??diction de la structure tentent de fournir un moyen de g??n??ration d'une structure plausible pour des prot??ines dont les structures ne ont pas ??t?? d??termin??e exp??rimentalement.
Fonctions cellulaires
Les prot??ines sont les principaux acteurs au sein de la cellule, a d??clar?? ?? l'accomplissement des t??ches sp??cifi??es par l'information cod??e dans les g??nes. A l'exception de certains types de ARN, la plupart des autres mol??cules biologiques sont des ??l??ments relativement inertes sur lequel agissent les prot??ines. Les prot??ines constituent la moiti?? du poids sec d'un cellule d 'Escherichia coli, alors que d'autres macromol??cules telles que l'ADN et l'ARN ne repr??sentent que 3% et 20%, respectivement. L'ensemble des prot??ines exprim??es dans une cellule ou un type cellulaire particulier est connu en tant que prot??ome.

La caract??ristique principale de prot??ines qui permet aussi leur ensemble vari?? de fonctions est leur capacit?? ?? se lier d'autres mol??cules sp??cifiquement et ??troitement. La r??gion de la prot??ine responsable de la liaison ?? une autre mol??cule est connue sous le site de liaison et est souvent une d??pression ou ??poche?? sur la surface mol??culaire. Cette capacit?? de liaison est m??di??e par la structure tertiaire de la prot??ine, qui d??finit la poche de site de liaison, et par les propri??t??s chimiques des cha??nes lat??rales des acides amin??s environnants. La liaison aux prot??ines peut ??tre extr??mement serr?? et sp??cifique; par exemple, la prot??ine d'inhibiteur de ribonucl??ase humaine se lie ?? angiog??nine avec un sous-femtomolaire constante de dissociation (<10 -15 M) mais ne se lie pas du tout ?? son homologue amphibie onconase (> 1 M). Changements chimiques extr??mement mineures telles que l'ajout d'un groupe m??thyle unique ?? un partenaire de liaison peuvent parfois suffire ?? ??liminer presque contraignant; par exemple, la aminoacyl ARNt synth??tase sp??cifique de l'acide amin?? valine discriminatoire ?? l'??gard de la cha??ne lat??rale tr??s similaire de l'acide amin?? isoleucine.
Les prot??ines peuvent se lier ?? d'autres prot??ines ainsi que de substrats ?? petites mol??cules. Lorsque les prot??ines se lient sp??cifiquement ?? d'autres copies de la m??me mol??cule, ils peuvent oligom??riser pour former des fibrilles; ce processus se produit souvent dans les prot??ines structurelles qui se composent de monom??res globulaires qui se auto-associer pour former des fibres rigides. Les interactions prot??ine-prot??ine r??gulent ??galement l'activit?? enzymatique, contr??lent la progression ?? travers le cycle cellulaire, et permettre ?? l'ensemble de grande complexes de prot??ines qui effectuent de nombreuses r??actions ??troitement li??s avec une fonction biologique commune. Les prot??ines peuvent ??galement se lier ??, ou m??me ??tre int??gr?? dans les membranes cellulaires. La capacit?? des partenaires de liaison pour induire des changements conformationnels de prot??ines permet la construction d'une tr??s grande complexit?? r??seaux de signalisation. Il est important, que les interactions entre prot??ines sont r??versibles, et d??pendent fortement de la disponibilit?? des diff??rents groupes de prot??ines de partenaires pour former des agr??gats qui sont capables de r??aliser des ensembles discrets de la fonction, l'??tude des interactions entre prot??ines sp??cifiques est une cl?? pour comprendre les aspects importants de la fonction cellulaire, et finalement les propri??t??s qui le distinguent des types cellulaires particuliers.
Enzymes
Les plus connus r??le des prot??ines dans la cellule est aussi des enzymes qui catalysent des r??actions chimiques. Les enzymes sont habituellement hautement sp??cifique et acc??l??rer seulement une ou quelques r??actions chimiques. Les enzymes effectuent la plupart des r??actions impliqu??es dans m??tabolisme, ainsi que la manipulation de l'ADN dans des proc??d??s tels que r??plication de l'ADN, la r??paration d'ADN , et transcription. Certaines enzymes agissent sur d'autres prot??ines pour ajouter ou supprimer des groupes chimiques dans un processus connu sous le nom modification post-traductionnelle. Environ 4.000 r??actions sont connues pour ??tre catalys??e par des enzymes. L'acc??l??ration de la vitesse conf??r??e par catalyse enzymatique est souvent ??norme-jusqu'?? 10 -fois 17 augmentation de la fr??quence au-dessus de la r??action non catalys??e dans le cas de d??carboxylase orotate (78 millions d'ann??es sans l'enzyme, 18 millisecondes avec l'enzyme).
Les mol??cules li??es et ex??cut??es par des enzymes sont appel??s substrats. Bien que les enzymes peuvent ??tre constitu??es de plusieurs centaines d'acides amin??s, ce est g??n??ralement seulement une petite fraction des r??sidus qui entrent en contact avec le substrat, et une fraction encore plus petite trois ou quatre r??sidus en moyenne, qui sont directement impliqu??s dans la catalyse. La r??gion de l'enzyme qui se lie au substrat et qui contient des r??sidus catalytiques est connue sous le nom site actif.
la signalisation cellulaire et la liaison du ligand

Plusieurs prot??ines sont impliqu??es dans le processus de la signalisation cellulaire et la transduction de signal. Certaines prot??ines telles que l'insuline , sont des prot??ines extracellulaires qui transmettent un signal de la cellule dans laquelle ils ont ??t?? synth??tis??s ?? d'autres cellules dans la lointaine tissus. D'autres sont les prot??ines membranaires qui agissent comme r??cepteurs dont la fonction principale est de lier une mol??cule de signalisation et induisent une r??ponse biochimique dans la cellule. De nombreux r??cepteurs ont un site de liaison expos??e sur la surface des cellules et un domaine effecteur dans la cellule, qui peut avoir une activit?? enzymatique ou peut subir un changement de conformation d??tect?? par d'autres prot??ines dans la cellule.
Les anticorps sont des composants prot??iques de le syst??me immunitaire adaptatif dont la fonction principale est de lier antig??nes, ou des substances ??trang??res dans le corps, et les cibler pour la destruction. Les anticorps peuvent ??tre s??cr??t??e dans le milieu extracellulaire ou ancr??e dans la membrane des sp??cialis?? cellules B connu sous le nom les cellules plasmatiques. Consid??rant que les enzymes sont limit??s dans leur affinit?? de liaison pour leurs substrats par la n??cessit?? d'effectuer leur r??action, les anticorps ne ont pas de telles contraintes. L'affinit?? de liaison d'un anticorps ?? son objectif est extraordinairement ??lev??.
Beaucoup de prot??ines de transport ligands se lient notamment petites biomol??cules et les transportent ?? d'autres endroits dans le corps d'un organisme multicellulaire. Ces prot??ines doivent avoir une affinit?? de liaison ??lev??e lorsque leur ligand est pr??sent dans des concentrations ??lev??es, mais doit ??galement lib??rer le ligand lorsqu'il est pr??sent en faibles concentrations dans les tissus cibles. L'exemple type d'une prot??ine de liaison de ligand est h??moglobine qui transporte l'oxyg??ne ?? partir de la poumons ?? d'autres organes et tissus dans tous les vert??br??s et compte pr??s homologues dans chaque biologique royaume. Les lectines sont des prot??ines de liaison ?? sucre qui sont hautement sp??cifiques pour les fragments de sucre. Les lectines jouent g??n??ralement un r??le dans biologique ph??nom??nes de reconnaissance impliquant des cellules et des prot??ines. R??cepteurs et hormones sont des prot??ines de liaison hautement sp??cifiques.
prot??ines transmembranaires peuvent ??galement servir de prot??ines de transport de ligand qui modifient la la perm??abilit?? de la membrane cellulaire ?? petites mol??cules et ions. La membrane seul a coeur hydrophobe ?? travers laquelle mol??cules polaires ou charg??s ne peut pas diffuser. Les prot??ines membranaires contiennent des canaux internes qui permettent de telles mol??cules d'entrer et de sortir de la cellule. Beaucoup prot??ines de canaux ioniques sont sp??cialis??es pour s??lectionner seulement un ion particulier; par exemple, de potassium et de sodium sont souvent discriminatoires canaux pour une seule des deux ions.
Prot??ines structurales
Prot??ines structurales conf??rent rigidit?? et la rigidit?? des composants biologiques contraire fluides. La plupart des prot??ines structurales sont des prot??ines fibreuses; par exemple, actine et tubuline sont globulaire soluble et sous forme de monom??res, mais polym??riser pour former des longues fibres rigides qui composent le cytosquelette, ce qui permet ?? la cellule de maintenir sa forme et sa taille. Collag??ne et ??lastine sont des composantes essentielles de tissu conjonctif tel que cartilage, et k??ratine se trouve dans des structures dures ou filamenteux tels que cheveux, ongles, plumes , sabots, et certains coquilles d'animaux.
D'autres prot??ines qui servent des fonctions structurelles sont prot??ines motrices telles que myosine, kin??sine, et dyn??ine, qui sont capables de g??n??rer des forces m??caniques. Ces prot??ines sont essentielles pour cellulaire motilit?? des organismes unicellulaires et la spermatozo??des de nombreux organismes multicellulaires qui reproduisent sexuellement. Ils g??n??rent ??galement les forces exerc??es par traitance muscles.
M??thodes d'??tude
Comme certains d'entre mol??cules biologiques les plus couramment ??tudi??es, les activit??s et les structures de prot??ines sont examin??s ?? la fois in vitro et in vivo Des ??tudes in vitro de prot??ines purifi??es dans des environnements contr??l??s sont utiles pour apprendre une prot??ine exerce sa fonction:. par exemple, la cin??tique enzymatique ??tudes explorent la m??canisme chimique de l'activit?? catalytique d'une enzyme et son affinit?? relative pour diff??rentes mol??cules de substrat possibles. En revanche, dans des exp??riences in vivo sur les activit??s de prot??ines dans les cellules ou m??me au sein des organismes entiers peuvent fournir des informations compl??mentaires sur l'endroit o?? une des fonctions des prot??ines et comment il est r??glement??.
La purification des prot??ines
Pour effectuer L'analyse in vitro, une prot??ine doit ??tre purifi?? loin des autres composants cellulaires. Ce processus commence habituellement par la lyse des cellules, dans lequel la membrane de la cellule est interrompue et son contenu interne lib??r?? dans une solution connue en tant que lysat brut. Le m??lange r??sultant peut ??tre purifi?? en utilisant ultracentrifugation, qui fractionne les diff??rents composants cellulaires en fractions contenant des prot??ines solubles; membrane lipides et des prot??ines; cellulaire organelles, et acides nucl??iques. La pr??cipitation par un proc??d?? connu sous le nom relargage peut concentrer les prot??ines de ce lysat. Diff??rents types de chromatographie sont ensuite utilis??s pour isoler la ou les prot??ines d'int??r??t en fonction des propri??t??s telles que le poids mol??culaire, charge nette et affinit?? de liaison. Le niveau de purification peut ??tre contr??l??e en utilisant divers types de ??lectrophor??se sur gel si le poids mol??culaire de la prot??ine souhait??e et point iso??lectrique sont connus, par spectroscopie si la prot??ine a des caract??ristiques spectroscopiques distinctes, ou en des dosages d'enzymes si la prot??ine a une activit?? enzymatique. En outre, les prot??ines peuvent ??tre isol??s selon leur charge ?? l'aide ??lectrofocalisation.
Pour les prot??ines naturelles, une s??rie d'??tapes de purification peut ??tre n??cessaire d'obtenir la prot??ine suffisamment pur pour les applications de laboratoire. Pour simplifier ce processus, g??nie g??n??tique est souvent utilis?? pour ajouter des fonctionnalit??s chimiques aux prot??ines qui les rendent plus facile pour purifier sans affecter leur structure ou l'activit??. Ici, un ??tag?? consistant en une s??quence d'acides amin??s sp??cifique, souvent une s??rie de r??sidus histidine (a ?? His-tag "), est fix?? ?? une extr??mit?? de la prot??ine. Par cons??quent, lorsque le lysat est pass??e sur une colonne de chromatographie contenant du nickel , les r??sidus d'histidine ligaturer le nickel et le fixent ?? la colonne tandis que les composants non marqu??s de l'??tape de lysat sans entrave. Un certain nombre de marqueurs diff??rents ont ??t?? d??velopp??s pour aider les chercheurs ?? purifier des prot??ines sp??cifiques ?? partir de m??langes complexes.
Localisation cellulaire
L'??tude in vivo de prot??ines est souvent concern??s par la synth??se et la localisation de la prot??ine dans la cellule. Bien que de nombreuses prot??ines intracellulaires sont synth??tis??es dans le cytoplasme et membranaires ou des prot??ines s??cr??t??es dans le r??ticulum endoplasmique, les d??tails de la fa??on dont les prot??ines sont cibl?? vers les organites sp??cifiques ou des structures cellulaires est souvent difficile. Une technique utile pour l'??valuation de la localisation cellulaire utilise le g??nie g??n??tique pour exprimer dans une cellule un Prot??ine de fusion ou chim??re consistant en la prot??ine naturelle d'int??r??t li?? ?? un " journaliste "tels que la prot??ine fluorescente verte (GFP). La position de la prot??ine fusionn??e dans la cellule peut ??tre proprement et efficacement visualis??e en utilisant microscopie, comme le montre la figure ci-contre.
D'autres m??thodes pour ??lucider la localisation cellulaire des prot??ines n??cessite l'utilisation de marqueurs compartimentaux connus pour des r??gions comme l'ER, le, lysosomes / vacuoles, les mitochondries, les chloroplastes, membrane plasmique Golgi, etc. Avec l'utilisation de fluorescence marqu??s versions de ces marqueurs ou des anticorps dirig??s contre des marqueurs connus, il devient beaucoup plus simple pour identifier la localisation d'une prot??ine d'int??r??t. Par exemple, immunofluorescence indirecte permettra de fluorescence colocalisation et la d??monstration de l'emplacement. Les colorants fluorescents sont utilis??s pour marquer des compartiments cellulaires dans un but similaire.
D'autres possibilit??s existent, aussi bien. Par exemple, immunohistochimie utilise g??n??ralement un anticorps dirig?? contre une ou plusieurs prot??ines d'int??r??t qui sont conjugu??s ?? des enzymes donnant des signaux non luminescent ou chromog??nes qui peuvent ??tre compar??es entre les ??chantillons, ce qui permet ?? des informations de localisation. Une autre technique est applicable cofractionation dans le saccharose (ou autre mat??riau) en utilisant des gradients centrifugation isopycnique. Bien que cette technique ne prouve pas colocalisation d'un compartiment de densit?? connue et la prot??ine d'int??r??t, elle augmente la probabilit??, et se pr??te davantage ?? des ??tudes ?? grande ??chelle.
Enfin, le proc??d?? de localisation cellulaire ??talon-or est immunomicroscopie. Cette technique utilise ??galement un anticorps dirig?? contre la prot??ine d'int??r??t, ainsi que des techniques de microscopie ??lectronique classique. L'??chantillon est pr??par?? pour examen au microscope ??lectronique normal, puis trait??e avec un anticorps dirig?? contre la prot??ine d'int??r??t qui est conjugu?? ?? un mat??riau extr??mement ??lectro-dense, g??n??ralement en or. Cela permet la localisation des deux d??tails ultrastructuraux ainsi que la prot??ine d'int??r??t.
Gr??ce ?? une autre application du g??nie g??n??tique connue sous le nom mutagen??se dirig??e, les chercheurs peuvent modifier la s??quence de la prot??ine et par cons??quent sa structure, localisation cellulaire, et la sensibilit?? ?? la r??glementation. Cette m??me technique permet l'incorporation d'acides amin??s non naturels dans des prot??ines, en utilisant des ARNt modifi??s, et peut permettre ?? la conception rationnelle de nouvelles prot??ines avec des propri??t??s nouvelles.
Prot??omique et bioinformatique
Le compl??ment total de prot??ines pr??sentes ?? la fois dans un type de cellule ou d'une cellule est connue comme son prot??ome, et l'??tude de ces ensembles de donn??es ?? grande ??chelle d??finit le domaine de la prot??omique, nomm??s par analogie avec le domaine connexe de g??nomique. Techniques exp??rimentales en prot??omique cl??s comprennent ??lectrophor??se 2D, ce qui permet la s??paration d'un grand nombre de prot??ines, la spectrom??trie de masse , ce qui permet l'identification ?? haut d??bit rapide des prot??ines et le s??quen??age de peptides (le plus souvent apr??s dans le gel digestion), des puces ?? prot??ines, qui permettent la d??tection des niveaux relatifs d'un grand nombre de prot??ines pr??sentes dans une cellule, et Double hybride, qui permet l'exploration syst??matique de interactions prot??ine-prot??ine. Le compl??ment total de telles interactions possibles biologiquement est connu comme le interactome. Une tentative syst??matique de d??terminer les structures de prot??ines repr??sentant tous les plis possible est connu comme g??nomique structurale.
La grande quantit?? de donn??es g??nomiques et prot??omiques disponibles pour une vari??t?? d'organismes, y compris la g??nome humain, permet aux chercheurs d'identifier efficacement prot??ines homologues dans les organismes apparent??s de loin par alignement de s??quences . outils de profilage s??quence peuvent effectuer des manipulations de s??quences plus sp??cifiques tels que des cartes d'enzymes de restriction, analyses cadre de lecture ouvert pour des s??quences nucl??otidiques, et pr??diction de la structure secondaire. De ces donn??es, arbres phylog??n??tiques peuvent ??tre construits et ??volutifs hypoth??ses d??velopp??es en utilisant un logiciel sp??cial comme ClustalW concernant l'ascendance des organismes modernes et les g??nes qu'ils expriment. Le domaine de la bioinformatique cherche ?? assembler, annoter, et analyser les donn??es g??nomiques et prot??omiques, l'application de calcul des techniques ?? des probl??mes biologiques tels que d??couverte de g??nes et cladistics.
La pr??diction des structures et de la simulation
Compl??mentaire dans le domaine de la g??nomique structurale, la pr??diction de la structure des prot??ines cherche ?? d??velopper des moyens efficaces pour fournir des mod??les plausibles pour des prot??ines dont les structures ne ont pas encore ??t?? d??termin??e exp??rimentalement. Le type le plus r??ussi de pr??diction de la structure, connue sous le nom mod??lisation d'homologie, se appuie sur l'existence d'une structure en "template" avec similarit?? de s??quence avec la prot??ine en cours de mod??lisation; L'objectif de la g??nomique structurale est de fournir une repr??sentation suffisante dans les structures r??solus pour mod??liser la plupart de ceux qui restent. Bien que la production de mod??les pr??cis reste un d??fi lorsque les structures de mod??le qu'un lointain rapport sont disponibles, il a ??t?? sugg??r?? que l'alignement de s??quence est le goulot d'??tranglement dans ce processus, comme des mod??les tr??s pr??cis peuvent ??tre produites si un alignement de s??quences ??parfait?? est connu. De nombreuses m??thodes de pr??diction de la structure ont servi ?? informer le domaine ??mergent de la ing??nierie des prot??ines, dans laquelle de nouveaux plis de prot??ines ont d??j?? ??t?? con??us. Un probl??me de calcul plus complexe est la pr??diction d'interactions intermol??culaires, comme dans amarrage mol??culaire et prot??ine-prot??ine de pr??diction de l'interaction.
Les proc??d??s de et le repliement des prot??ines de liaison peuvent ??tre simul??s ?? l'aide de ces techniques comme m??canique mol??culaire, en particulier, la dynamique moléculaire et de Monte Carlo , qui prennent de plus en plus avantage de parallèle et l'informatique distribuée ( Folding @ Home projet; modélisation moléculaire sur GPU). Le pliage de petits domaines de protéines alpha-hélicoïdale comme le casque de la villine et VIH protéine accessoire ont été simulé avec succès in silico , et les méthodes hybrides qui combinent la dynamique moléculaire standard avec la mécanique quantique calculs ont permis d'exploration des états électroniques de rhodopsines.
Nutrition
Plus les micro-organismes et les plantes peuvent tous 20 types biosynthèse des acides aminés , tandis que les animaux (y compris humains) doivent obtenir certains des acides aminés de l' alimentation. Les acides aminés que l'organisme ne peut pas synthétiser de sa propre sont considérés comme des acides aminés essentiels. Enzymes clés qui synthétisent certains acides aminés ne sont pas présents chez les animaux - tels que l'aspartokinase, qui catalyse la première étape dans la synthèse de la lysine, la méthionine et la thréonine à partir de l'aspartate. Si acides aminés sont présents dans l'environnement, les microorganismes peuvent économiser de l'énergie en reprenant les acides aminés de leur environnement et de la régulation négative de leurs voies de biosynthèse.
Chez les animaux, les acides aminés sont obtenus par la consommation d'aliments contenant des protéines. Protéines ingérées sont ensuite décomposées en acides aminés à travers la digestion, ce qui implique généralement la dénaturation de la protéine par l'exposition à l'acide et l'hydrolyse par des enzymes appelées proteases. Certains acides aminés ingérés sont utilisés pour la biosynthèse des protéines, tandis que d'autres sont convertis en glucose par néoglucogenèse, ou introduits dans l' cycle de l'acide citrique. utilisation de la protéine Cet comme combustible est particulièrement important en vertu des conditions de famine, car il permet propres protéines de l'organisme à être utilisés pour soutenir la vie, en particulier ceux trouvés dans les musculaire. acides aminés sont également une importante source alimentaire de l'azote .
Histoire et ??tymologie
Les protéines ont été reconnus comme une catégorie distincte de molécules biologiques dans le XVIIIe siècle par Antoine Fourcroy et d'autres, qui se distingue par la capacité des molécules à coaguler ou floculer sous traitements avec de la chaleur ou de l'acide. Parmi les exemples cités à l'époque d'albumine, de blancs d'??ufs, le sang , le sérum albumine fibrine, et le blé gluten. Chimiste hollandais Gerhardus Johannes Mulder effectués analyse élémentaire des protéines communes et a constaté que presque toutes les protéines ont la même formule empirique, C 400 H 620 N 100 O 120 P 1 S 1 . Il est venu à la conclusion erronée qu'ils pourraient être composés d'un seul type de (très grande) molécule. Le terme «protéine» pour décrire ces molécules a été proposé en 1838 par l'associé de Mulder Jöns Jakob Berzelius; protéine est dérivée du grec mot ????????????????? ( proteios ), ce qui signifie "primaire", "dans la tête", ou "debout devant". Mulder a continué à identifier les produits de dégradation des protéines telles que l' acide aminé leucine pour lequel il a trouvé un (presque correct) poids moléculaire de 131 Da.
La difficulté dans la purification de protéines en grandes quantités les rendait très difficile pour les premiers biochimistes de protéines pour étudier. Par conséquent, les premières études ont porté sur les protéines qui pourraient être purifiés en grandes quantités, par exemple, ceux de sang , blanc d'oeuf, diverses toxines, et digestifs / enzymes métaboliques obtenus à partir des abattoirs. Dans les années 1950, l' Armour Hot Dog Co. purifié 1 kg de pur pancréatique bovine ribonucléase A et fait librement disponible pour les scientifiques; ce geste a aidé ribonucléase A devenir une cible majeure pour l'étude biochimique pour les décennies suivantes.
Linus Pauling est crédité de la prédiction réussie de protéines réguliers structures secondaires basées sur la liaison hydrogène, une idée la première fois par William Astbury en 1933. travail plus tard par Walter Kauzmann sur la dénaturation, basée en partie sur des études antérieures par Kaj Linderstrøm-Lang, a contribué d'une compréhension de repliement des protéines et de la structure à médiation par des interactions hydrophobes. En 1949 Fred Sanger correctement déterminé la séquence d'acides aminés de l'insuline , ce qui démontre de façon concluante que les protéines étaient composés de polymères linéaires d'acides aminés plutôt que des chaînes ramifiées, des colloïdes ou des cyclols. Les premières structures à résolution atomique de protéines ont été résolues par cristallographie aux rayons X dans les années 1960 et par RMN dans les années 1980. En 2009, le Protein Data Bank a plus de 55 000 structures à résolution atomique de protéines. Dans des temps plus récents, cryo-microscopie électronique de grands assemblages macromoléculaires et de calcul de prédiction de la structure des protéines de petites protéines domaines sont deux méthodes approchant résolution atomique.


