Spectrom??trie de masse
?? propos de ce ??coles s??lection Wikipedia
SOS Enfants, un organisme de bienfaisance de l'??ducation , a organis?? cette s??lection. Cliquez ici pour plus d'informations sur les enfants SOS.
La spectrom??trie de masse (MS) est la science de l'affichage de la spectre (spectre singulier) de la masse des mol??cules comprenant un ??chantillon de mat??riau. Il est utilis?? pour d??terminer la composition ??l??mentaire d'un ??chantillon, la masse des particules et des mol??cules et pour ??lucider les structures chimiques de mol??cules, telles que peptides et d'autres compos??s chimiques . Spectrom??trie de masse par ionisation fonctionne compos??s chimiques pour g??n??rer des mol??cules charg??es ou fragments de mol??cules et de mesurer leur masse-charge ratios. Dans un mode op??ratoire typique MS:
- Un ??chantillon (qui peut ??tre solide, liquide ou gaz) est ionis??.
- Les ions sont s??par??s en fonction de leur rapport masse-charge. Ce est l'??tape cl??.
- Les ions sont d??tect??s dynamiquement par un m??canisme capable de d??tecter des particules charg??es ??nerg??tiques.
- Le signal est trait?? dans le spectre (spectre singulier) de la masse des particules de cet ??chantillon.
Les ??l??ments ou de mol??cules sont identifi??es par corr??lation masses connues par les masses identifi??es.
Un instrument de spectrom??tre de masse sera compos?? de quatre modules:
1. ioniseur convertit une partie de l'??chantillon en ions. Il existe une grande vari??t?? de techniques pour ce, en fonction de la phase (solide, liquide, gaz) de l'??chantillon, et l'efficacit?? des divers m??canismes d'ionisation de l'esp??ce cible en question. Les spectrom??tres de masse sont g??n??ralement nomm??s d'apr??s la source d'ions utilis??e. Certains exemples sont les suivants:
- Electron ionisation
- Glow spectrom??trie de masse ?? d??charge luminescente (GDMS)
- ICPMS
- Ionisation de r??sonance spectrom??trie de masse (RIMS)
- SIMS
- TIMS
2. Un syst??me d'extraction qui ??limine les ions de l'??chantillon et leur donne une trajectoire qui permet ?? l'analyseur de masse pour les transmettre.
3. Un analyseur de masse trie les ions en masse. Les m??thodes utilis??es incluent:
- Secteur magn??tique
- Quadripolaire
- Temps de vol
4. Un d??tecteur qui mesure la valeur d'une grandeur d'indicateur et fournit des donn??es pour le calcul de l'abondance de chaque ion pr??sente ainsi. Certains d??tecteurs donnent ??galement des informations spatiale, par exemple une plaque multicanal. La technique a ?? la fois qualitative et Utilisations quantitatives. Il se agit notamment d'identifier des compos??s inconnus, la d??termination de la isotopique composition d'??l??ments dans une mol??cule, et la d??termination de la la structure d'un compos?? en observant sa fragmentation. D'autres utilisations incluent quantifier la quantit?? d'un compos?? dans un ??chantillon ou d'??tudier les fondements de la chimie des ions en phase gazeuse (la chimie des ions et des neutres dans le vide). MS est actuellement en usage tr??s courant dans les laboratoires analytiques qui ??tudient les propri??t??s biologiques d'une grande vari??t?? de compos??s physiques, chimiques ou.
??tymologie
Le mot spectrographe ??tait devenu une partie de la vocabulaire scientifique internationale en 1884. Le racines linguistiques sont une combinaison et l'??limination des morph??mes li??s et morph??mes libres qui se rapportent aux modalit??s SPECTR ographie plaque -ic -um et phot-. Premiers appareils de spectrom??trie qui ont mesur?? le rapport de masse sur charge des ions ont ??t?? appel??s spectrographes de masse qui consistaient en instruments qui ont enregistr?? une spectre des valeurs de masse sur un plaque photographique. Un spectroscope de masse est similaire ?? un spectrographe de masse, sauf que le faisceau d'ions est dirig?? sur un ??cran luminescent. Une configuration de spectroscope de masse a ??t?? utilis??e dans les premiers instruments quand on voulait que les effets des ajustements soient observ??s rapidement. Une fois que l'instrument a ??t?? correctement r??gl??, une plaque photographique a ??t?? ins??r?? et expos??. Le spectroscope de masse terme a continu?? ?? ??tre utilis?? m??me si l'??clairage direct d'un ??cran de phosphore a ??t?? remplac?? par des mesures indirectes avec un oscilloscope. L'utilisation de la spectrom??trie de masse de terme est maintenant d??conseill??e en raison de la possibilit?? de confusion avec la lumi??re spectroscopie . La spectrom??trie de masse est souvent abr??g?? en masse spec ou simplement comme MS.
Histoire

En 1886, Eugen Goldstein observ??e en rayons les rejets de gaz sous basse pression qui a voyag?? loin de l'anode et ?? travers les canaux dans un perfor??e cathode, oppos??e ?? la direction de charge n??gative rayons cathodiques (qui se d??placent de la cathode vers l'anode). Goldstein a appel?? ces charg?? positivement rayons anodiques "Kanalstrahlen"; la traduction standard de cette expression en anglais est " rayons canaux ". Wilhelm Wien a constat?? que les champs ??lectriques ou magn??tiques puissants d??vi??s les rayons canaux et, en 1899, un dispositif construits avec des champs ??lectriques et magn??tiques parall??les qui s??paraient les rayons positifs selon leur charge ?? la masse rapport (Q / m). Wien trouv?? que le rapport charge-masse d??pend de la nature du gaz dans le tube ?? d??charge. Scientifique anglais JJ Thomson tard am??lior??e sur les travaux de Wien en r??duisant la pression pour cr??er le spectrographe de masse.
La premi??re application de la spectrom??trie de masse pour l'analyse des acides amin??s et des peptides a ??t?? rapport??e en 1958. Carl-Ove Andersson a mis en ??vidence les principaux ions fragments observ??s dans l'ionisation des esters m??thyliques.
Certaines des techniques modernes de spectrom??trie de masse ont ??t?? con??us par Arthur Jeffrey Dempster et FW Aston en 1918 et 1919 respectivement. En 1989, la moiti?? du prix Nobel de physique a ??t?? d??cern?? ?? Hans et Dehmelt Wolfgang Paul pour le d??veloppement de la technique de pi??ge ?? ions dans les ann??es 1950 et 1960. En 2002, le prix Nobel de chimie a ??t?? d??cern?? ?? John Bennett Fenn pour le d??veloppement de ionisation par ??lectropulv??risation (ESI) et Koichi Tanaka pour le d??veloppement de d??sorption laser douce (SLD) et leur application ?? l'ionisation des macromol??cules biologiques, en particulier les prot??ines.
Exemple simplifi??

L'exemple suivant d??crit le fonctionnement d'un analyseur de masse du spectrom??tre, ce qui est de la Type de secteur. (Autres types d'analyseurs sont trait??s ci-dessous.) Consid??rons un ??chantillon de chlorure de sodium (sel de table). Dans la source d'ions, l'??chantillon est vaporis?? (transform?? en gaz ) et ionis?? (transform?? en particules charg??es ??lectriquement) en sodium (Na +) et chlorure (Cl -) ions. des atomes de sodium et des ions sont monoisotopique, avec une masse d'environ 23 amu. atomes de chlore et les ions sont de deux isotopes de masses d'environ 35 amu (?? une abondance naturelle d'environ 75 pour cent) et environ 37 amu (?? une abondance naturelle d'environ 25 pour cent). La partie de l'analyseur du spectrom??tre contient ??lectrique et champs magn??tiques, qui exercent des forces sur les ions traversent ces domaines. La vitesse d'une particule charg??e peut ??tre augment??e ou diminu??e en passant par le champ ??lectrique, et la direction peut ??tre modifi??e par le champ magn??tique. L'ampleur de la d??viation de la trajectoire de l'ion d??placement d??pend de son rapport masse-charge. Ions l??gers se d??vi??s par la force magn??tique plus des ions plus lourds (bas??es sur la deuxi??me loi du mouvement de Newton , F = ma). Les flux d'ions tri?? passent de l'analyseur vers le d??tecteur, qui enregistre l'abondance relative de chaque type d'ion. Cette information est utilis??e pour d??terminer la composition chimique de l'??l??ment de l'??chantillon initial (ce est ?? dire qu'?? la fois le sodium et le chlore sont pr??sents dans l'??chantillon) et la composition isotopique de ses constituants (le rapport de 35 ?? 37 Cl Cl).
Cr??ation d'ions
La source d'ions est la partie du spectrom??tre de masse qui ionise le mat??riau ?? analyser (analyte). Les ions sont ensuite transport??s par magn??tiques ou des champs ??lectriques ?? l'analyseur de masse.
Techniques pour ionisation ont ??t?? la cl?? de d??terminer quels types d'??chantillons peuvent ??tre analys??s par spectrom??trie de masse. Electron ionisation et ionisation chimique sont utilis??s pour les gaz et vapeurs. En sources d'ionisation chimiques, l'analyte est ionis?? par des r??actions chimiques ion-mol??cule au cours de collisions dans la source. Deux techniques souvent utilis??s avec liquides et solides ??chantillons biologiques comprennent ionisation par ??lectron??bulisation (invent?? par John Fenn) et laser assist??e par matrice de d??sorption / ionisation (MALDI, initialement d??velopp??e comme une technique similaire "Soft d??sorption laser (SLD)" par K. Tanaka pour lesquels un prix Nobel a ??t?? attribu?? et que MALDI par M. Karas et Hillenkamp F.).
Plasma ?? couplage inductif
Plasma ?? couplage inductif (ICP) sources sont principalement utilis??s pour l'analyse de cations d'un large ??ventail de types d'??chantillons. Dans ce type de Ion Source Technology, une ??flamme?? de plasma qui est ??lectriquement neutre dans l'ensemble, mais qui a eu une fraction substantielle de ses atomes ionis??s par haute temp??rature, est utilis?? pour atomiser mol??cules de l'??chantillon introduites et de d??pouiller davantage les ??lectrons externes de ces atomes. Le plasma est g??n??ralement produite ?? partir de gaz d'argon, ??tant donn?? que la premi??re ??nergie d'ionisation des atomes d'argon est sup??rieure ?? la premi??re des autres ??l??ments sauf He, O, F et Ne, mais inf??rieure ?? la seconde ??nergie d'ionisation de tous sauf les m??taux plus ??lectropositifs. Le chauffage est r??alis?? par un courant ?? haute fr??quence pass?? ?? travers une bobine entourant le plasma.
D'autres techniques d'ionisation
D'autres incluent d??charge luminescente, d??sorption de champ (FD), bombardement atomique rapide (FAB), thermospray, la d??sorption / ionisation sur silicium (DIOS), Analyse directe en temps r??el (DART), ionisation chimique ?? pression atmosph??rique (APCI), ions secondaires spectrom??trie de masse (SIMS), allumage et ionisation ionisation thermique (TIMS). Ion fixation ionisation est une technique d'ionisation qui permet une analyse libres de fragmentation.
La s??lection de masse
Analyseurs de masse s??parer les ions en fonction de leur rapport masse-charge. Les deux lois suivantes r??gissent la dynamique des particules charg??es dans des champs ??lectriques et magn??tiques dans le vide:
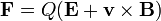 ( Lorentz de loi de force);
( Lorentz de loi de force);
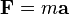 ( deuxi??me loi de Newton du mouvement en cas de non-relativiste, ce est ?? dire valable uniquement ?? une vitesse bien inf??rieure ?? la vitesse de la lumi??re d'ions).
( deuxi??me loi de Newton du mouvement en cas de non-relativiste, ce est ?? dire valable uniquement ?? une vitesse bien inf??rieure ?? la vitesse de la lumi??re d'ions).
Ici, F est la force appliqu??e ?? l'ion, m est la masse de l'ion, a est l'acc??l??ration, Q est la charge ionique, E est le champ ??lectrique, et v ?? B est le produit vecteur transversale de la vitesse des ions et la champ magn??tique
Assimiler les expressions ci-dessus pour la force appliqu??e sur les rendements d'ions:
Cette ??quation diff??rentielle est l'??quation classique de motion particules charg??es. Avec les conditions initiales de la particule, il d??termine compl??tement le mouvement de la particule dans l'espace et le temps en termes de m / Q. Ainsi spectrom??tres de masse pourraient ??tre consid??r??s comme des "masse-charge spectrom??tres". Lors de la pr??sentation des donn??es, il est courant d'utiliser le (officiellement) sans dimension m / z, o?? z est le nombre de charges ??l??mentaires (e) sur l'ion (z = Q / e). Cette quantit??, m??me si elle est officieusement appel?? le rapport de masse sur charge, parlant plus de pr??cision repr??sente le rapport entre le nombre de masse et le nombre de charge, z.
Il existe de nombreux types d'analyseurs de masse, en utilisant soit des champs statiques ou dynamiques, et les champs magn??tiques ou ??lectriques, mais tous fonctionnent selon l'??quation diff??rentielle ci-dessus. Chaque type d'analyseur a ses forces et faiblesses. Beaucoup de spectrom??tres de masse utilisent deux ou plusieurs analyseurs de masse pour spectrom??trie de masse tandem (MS / MS). En plus des analyseurs de masse les plus courants ??num??r??s ci-dessous, il ya d'autres con??ues pour des situations particuli??res.
Il existe plusieurs caract??ristiques importantes de l'analyseur. Le pouvoir de r??solution de masse est la mesure de la capacit?? de distinguer deux pics de l??g??rement diff??rent m / z. La pr??cision de masse est le rapport entre l'erreur de mesure m / z pour la vraie m / z. Pr??cision de la masse est g??n??ralement mesur??e en ppm ou milli unit??s de masse. La gamme de masse est la gamme de m / z pr??tant ?? une analyse par un analyseur donn??. Le domaine de lin??arit?? est la plage sur laquelle le signal d'ions est lin??aire avec la concentration de l'analyte. Vitesse se r??f??re ?? la p??riode de l'exp??rience et en fin de compte est utilis?? pour d??terminer le nombre de spectres par unit?? de temps qui peut ??tre g??n??r??e.
instruments sectoriels
Un champ de secteur analyseur de masse utilise un champ ??lectrique et / ou magn??tique pour influer sur le trajet et / ou la vitesse des accus??s de particules d'une certaine fa??on. Comme indiqu?? ci-dessus, instruments du secteur plier les trajectoires des ions lors de leur passage ?? travers l'analyseur de masse, selon leurs rapports masse-charge, d??vier les ions plus charg??e et se d??pla??ant plus rapidement, plus l??gers plus. L'analyseur peut ??tre utilis?? pour s??lectionner une gamme ??troite de m / z ou de parcourir une gamme de m / z au catalogue les ions pr??sents.
Temps de vol
Le ?? temps de vol (TOF) analyseur utilise un champ ??lectrique pour acc??l??rer les ions ?? travers le m??me potentiel, puis mesure le temps qu'ils prennent pour atteindre le d??tecteur. Si les particules ont tous la m??me accusation , les ??nergies cin??tiques seront identiques, et leurs vitesses d??pendra uniquement sur leurs masses . Ions l??gers atteindront d'abord le d??tecteur.
Filtre de masse quadripolaire
Analyseurs de masse quadripolaires utilisent des champs ??lectriques oscillants pour stabiliser ou d??stabiliser de mani??re s??lective les trajets d'ions passant ?? travers une fr??quence radio (RF) champ quadripolaire cr???? entre quatre tiges parall??les. Seuls les ions dans une plage de rapport masse / charge sont pass??s ?? travers le syst??me ?? tout moment, mais les modifications apport??es aux potentiels sur les tiges permettent une large gamme de valeurs m / z pour balayer rapidement, en continu ou en une succession de houblon discrets. Analyseur de masse quadrupolaire agit comme un filtre s??lectif en masse et est ??troitement li??e ?? la quadripolaire pi??ge ?? ions, en particulier le pi??ge ?? ions quadripolaire lin??aire sauf qu'il est con??u pour laisser passer les ions non pi??g??s plut??t que recueillir ceux qui sont pris au pi??ge, et est pour cette raison appel?? un quadrip??le de transmission. Une variation commune du quadrip??le de transmission est le spectrom??tre de masse triple quadrip??le. Le "triple quad" comporte trois ??tapes cons??cutives, quadripolaires le premier agissant comme un filtre de masse pour transmettre un ion entrant particuli??re ?? la seconde quadripolaire, une chambre de collision, dans lequel l'ion qui peut ??tre divis?? en fragments. Le troisi??me quadripole agit ??galement comme un filtre de masse, pour transmettre un ion de fragment particulier au d??tecteur. Si un quadrip??le est fait pour faire d??filer rapidement et de fa??on r??p??titive ?? travers une gamme de r??glages de filtre de masse, spectres complet peut ??tre rapport??. De m??me, un triple quad peut ??tre fait pour effectuer diverses types de scan caract??ristique de spectrom??trie de masse tandem.
Les pi??ges ?? ions
Tridimensionnelle pi??ge ?? ions quadripolaire
Le pi??ge ?? ions quadripolaire fonctionne sur les m??mes principes physiques que l'analyseur de masse quadripolaire, mais les ions sont pi??g??s et s??quentiellement ??ject??. Les ions sont pi??g??s dans un champ de quadrup??le RF principalement, dans un espace d??fini par une ??lectrode annulaire (habituellement reli??e au potentiel RF principal) entre deux ??lectrodes d'extr??mit??s (typiquement connect?? ?? courant continu ou ?? courant alternatif potentiels auxiliaires). L'??chantillon est ionis?? soit en interne (par exemple avec un ??lectron ou faisceau laser), ou ?? l'ext??rieur, dans ce cas, les ions sont souvent introduits ?? travers une ouverture dans une ??lectrode d'embout.
Il existe de nombreux / CHARGE s??paration et d'isolement m??thodes de masse mais le plus couramment utilis?? est le mode d'instabilit?? masse dans laquelle le potentiel de RF est une rampe de sorte que l'orbite des ions d'une masse a> b sont stables tandis que les ions dont la masse b deviennent instables et sont ??ject?? sur l'axe z sur un d??tecteur. Il existe ??galement des m??thodes d'analyse non destructive.
Les ions peuvent aussi ??tre ??ject??s par le proc??d?? d'excitation de r??sonance, gr??ce ?? quoi une tension d'excitation oscillatoire suppl??mentaire est appliqu??e aux ??lectrodes d'extr??mit??s, et l'amplitude de tension de pi??geage et / ou la fr??quence de la tension d'excitation est modifi??e pour amener des ions dans une condition de r??sonance en fonction de leur rapport masse / charger rapport.
Le cylindrique spectrom??tre de masse ?? pi??ge ?? ions est un d??riv?? de la ions quadripolaire spectrom??tre de masse ?? pi??ge.
Linear pi??ge ?? ions quadripolaire
Un lin??aire pi??ge ?? ions quadripolaire est similaire ?? un pi??ge ?? ions quadripolaire, mais il pi??ge des ions dans un champ quadripolaire ?? deux dimensions, au lieu d'un champ quadripolaire tridimensionnel dans un pi??ge ?? ions quadripolaire 3D. LTQ de Thermo Fisher (??lin??aire pi??ge de quadrip??le??) est un exemple de pi??ge ?? ions lin??aire.
Un pi??ge ?? ions toro??dale peut ??tre visualis?? comme un quadrip??le lin??aire courb?? autour et reli?? ?? l'extr??mit?? ou dans une section transversale d'un pi??ge ?? ions 3D en rotation sur le bord pour former le tore, en forme de beignet pi??ge. Le pi??ge peut stocker de grandes quantit??s d'ions en les distribuant dans toute la structure de pi??ge en forme d'anneau. Ce pi??ge en forme toro??dale est une configuration qui permet la miniaturisation accrue d'un analyseur de masse ?? pi??ge ?? ions. En outre tous les ions sont stock??s dans le m??me champ de pi??geage et en simplifiant ainsi ??ject??es d??tection qui peut ??tre compliqu??e avec des configurations de r??seau due ?? des variations dans l'alignement du d??tecteur et l'usinage des matrices.
Orbitrap
Ils sont semblables ?? Transform??e de Fourier r??sonance cyclotron d'ions spectrom??tres de masse (voir texte ci-dessous). Les ions sont ??lectrostatiquement pi??g?? dans une orbite autour d'un, en forme de broche ??lectrode centrale. L'??lectrode confine les ions de telle sorte qu'ils orbite autour de l'??lectrode centrale et osciller d'avant en arri??re long du grand axe de l'??lectrode centrale. Cette oscillation produit un courant d'image dans les plaques de d??tection qui est enregistr??e par l'instrument. Les fr??quences de ces courants de l'image d??pendent du rapports masse sur charge des ions. Les spectres de masse sont obtenus par transformation de Fourier des courants d'image enregistr??es.
Orbitraps ont une pr??cision de masse ??lev??e, une haute sensibilit?? et une bonne gamme dynamique.
Transform??e de Fourier r??sonance cyclotron d'ions
Transform??e de Fourier spectrom??trie de masse (FTMS), ou plus pr??cis??ment Transform??e de Fourier MS de r??sonance de cyclotron d'ions, mesure de masse en d??tectant la actuelle de l'image produite par des ions cyclotroning en pr??sence d'un champ magn??tique. Au lieu de mesurer la d??viation d'ions d'un d??tecteur tel qu'un Multiplicateur d'??lectrons, les ions sont inject??s dans une Penning pi??ge (une ??lectricit?? statique magn??tique / pi??ge ?? ions) o?? ils forment effectivement partie d'un circuit. D??tecteurs ?? des positions fixes dans l'espace mesurer le signal ??lectrique d'ions qui passent pr??s d'eux au fil du temps, la production d'un signal p??riodique. Depuis la fr??quence du cyclisme un ion est d??termin??e par sa masse ?? la charge, cela peut ??tre l'ex??cution d'une d??convolution par Transform??e de Fourier sur le signal. FTMS a l'avantage de haute sensibilit?? (depuis chaque ion est "compt??" plus d'une fois) et beaucoup plus la r??solution et donc la pr??cision.
R??sonance cyclotronique ionique (ICR) est une technique d'analyse de masse ??g?? FTMS similaire ?? l'exception que les ions sont d??tect??s avec un d??tecteur classique. Ions pi??g??s dans un Penning pi??ge sont excit??s par un champ ??lectrique RF jusqu'?? ce qu'ils influent sur la paroi du pi??ge, o?? le d??tecteur est situ??. Ions de masses diff??rentes sont r??solus en fonction du temps d'impact.
D??tecteurs

L'??l??ment final du spectrom??tre de masse est le d??tecteur. Les dossiers de d??tection soit la charge induite ou le courant produit quand un ion passe ou frappe une surface. Dans un instrument de balayage, le signal produit dans le d??tecteur au cours du balayage par rapport ?? laquelle l'instrument est dans le balayage (quelle m / Q) va produire un spectre de masse, un record d'ions en fonction de m / Q.
Typiquement, un certain type de multiplicateur ??lectrons est utilis??, bien que d'autres d??tecteurs, y compris Faraday et les d??tecteurs d'ions ?? photons sont ??galement utilis??s. Parce que le nombre d'ions laissant l'analyseur de masse ?? un instant particulier est g??n??ralement assez petite, l'amplification consid??rable est souvent n??cessaire pour obtenir un signal. des d??tecteurs de galette de microcanaux sont couramment utilis??s dans les instruments commerciaux modernes. En FTMS et Orbitraps, le d??tecteur se compose d'une paire de surfaces m??talliques ?? l'int??rieur de la r??gion de masse ?? pi??ge analyseur / ion de laquelle les ions ne passent pr??s comme ils oscillent. Aucun courant continu est produit, seul un courant de l'image ?? courant alternatif faible est produite dans un circuit entre les ??lectrodes. D'autres d??tecteurs inductifs ont ??galement ??t?? utilis??s.
Spectrom??trie de masse tandem
Un spectrom??tre de masse en tandem est capable de multiples cycles de spectrom??trie de masse, g??n??ralement s??par??es par une certaine forme de fragmentation mol??cule. Par exemple, un analyseur de masse peut isoler une peptide ?? partir de la saisie d'un grand nombre spectrom??tre de masse. Un deuxi??me analyseur de masse se stabilise ensuite les ions peptidiques tandis qu'ils entrent en collision avec un gaz, en les faisant fragment par dissociation induite par collision (CID). Un troisi??me analyseur de masse trie ensuite les fragments produits ?? partir des peptides. Tandem MS peut ??galement ??tre effectu??e dans un seul analyseur de masse au cours du temps, comme dans un pi??ge ?? ions quadripolaire. Il existe diff??rentes m??thodes pour fragmenter mol??cules pour tandem MS, y compris dissociation induite par collision (CID), capture d'??lectrons dissociation (DPE), transfert d'??lectrons dissociation (ETD), dissociation multiphotonique infrarouge (IRMPD), noir dissociation radiatif infrarouge (BIRD), ??lectrons d??tachement dissociation (EDD) et dissociation induite par surface (SID). Une application importante en utilisant spectrom??trie de masse tandem est dans l'identification des prot??ines .
Spectrom??trie de masse tandem permet une vari??t?? de s??quences exp??rimentales. Beaucoup de spectrom??tres de masse commerciaux sont con??us pour acc??l??rer l'ex??cution de ces s??quences de routine que surveillance de r??action s??lectionn??e (MRS) et balayage d'ions pr??curseurs. Pour SRM, le premier analyseur ne permet qu'une seule masse ?? travers et les secondes de l'analyseur pour moniteurs multiples ions fragments d??finis par l'utilisateur. SRM est le plus souvent utilis?? avec des instruments d'analyse o?? le deuxi??me ??v??nement d'analyse de masse est cycle de service limit??e. Ces exp??riences sont utilis??s pour augmenter la sp??cificit?? de la d??tection de mol??cules connues, notamment dans les ??tudes pharmacocin??tiques. Balayage d'ions pr??curseur se r??f??re ?? la surveillance d'une perte sp??cifique l'ion pr??curseur. Les premier et deuxi??me analyseurs de masse balaient l'ensemble du spectre comme partitionn??e par une valeur m / z d??fini par l'utilisateur. Cette exp??rience est utilis??e pour d??tecter des motifs sp??cifiques au sein des mol??cules inconnues.
Un autre type de spectrom??trie de masse tandem utilis?? pour datation au radiocarbone est Acc??l??rateur de spectrom??trie de masse (AMS), qui utilise des tensions tr??s ??lev??es, habituellement dans la gamme m??ga volts, afin d'acc??l??rer les ions n??gatifs dans un type de spectrom??tre de masse en tandem.
Configurations de spectrom??trie de masse communs et techniques
Quand une configuration sp??cifique de la source, un analyseur et d??tecteur devient classique dans la pratique, souvent un compos?? acronyme se pose pour le d??signer, et l'acronyme compos?? peut-??tre mieux connu parmi nonspectrometrists que les acronymes composants. La quintessence de ce est MALDI-TOF, qui se r??f??re simplement ?? la combinaison d'un la source laser d??sorption / ionisation assist??e par matrice avec un analyseur ?? temps de vol de masse. Le surnom MALDI-TOF est plus largement reconnu par les spectrometrists non-masse MALDI ou que TOF individuellement. D'autres exemples comprennent couplage inductif spectrom??trie de masse ?? plasma (ICP-MS), spectrom??trie de masse par acc??l??rateur (SMA), spectrom??trie de masse thermique-ionisation (TIMS) et source d'??tincelle spectrom??trie de masse (SSMS). Parfois, l'utilisation du g??n??rique "MS" connote en fait un tr??s sp??cifique analyseur de masse et le syst??me de d??tection, comme ce est le cas avec AMS, qui est toujours en fonction du secteur.
Certaines applications de la spectrom??trie de masse ont d??velopp?? surnoms que bien que strictement parlant semble se r??f??rer ?? une large application, dans la pratique, sont venus ?? la place pour d??signer un particulier ou un nombre limit?? de configurations de l'appareil. Un exemple de ceci est isotope par spectrom??trie rapport de masse (IRMS), qui fait r??f??rence dans la pratique de l'utilisation d'un nombre limit?? de secteur sur la base des analyseurs de masse; ce nom est utilis?? pour d??signer ?? la fois la demande et l'appareil utilis?? pour l'application.
Les techniques chromatographiques coupl??e ?? la spectrom??trie de masse
Une am??lioration importante ?? la masse et la masse r??soudre d??terminer les capacit??s de spectrom??trie de masse est de l'utiliser en tandem avec chromatographiques techniques de s??paration.
Chromatographie en phase gazeuse

Une combinaison commune est le gaz chromatographie-spectrom??trie de masse (GC / MS ou GC-MS). Dans cette technique, un chromatographe en phase gazeuse est utilis?? pour s??parer les diff??rents compos??s. Ce flux de compos??s s??par??s est aliment?? en ligne dans l' ion source, une m??tallique filament pour lequel une tension est appliqu??e. Ce filament ??met des ??lectrons qui ionisent les compos??s. Les ions peuvent alors autre fragment, produisant des mod??les pr??visibles. Ions intacts et des fragments passent dans la analyseur du spectrom??tre de masse et sont finalement d??tect??es.
Chromatographie liquide
Similaire ?? chromatographie en phase gazeuse MS (GC / MS), la chromatographie liquide spectrom??trie de masse (LC / MS ou LC-MS) s??pare compos??s par chromatographie avant qu'ils ne soient introduits ?? la source d'ions et spectrom??tre de masse. Elle diff??re de GC / MS en ce que la phase mobile est liquide, habituellement un m??lange de l'eau et organiques solvants , au lieu de gaz et les fragments des ions ne peut pas donner des mod??les pr??visibles. Le plus souvent, un source d'ionisation par ??lectropulv??risation est utilis??e en LC / MS. Il ya aussi quelques techniques d'ionisation nouvellement d??velopp??s comme pulv??risation laser.
La mobilit?? Ion
Spectrom??trie de mobilit?? ionique / spectrom??trie de masse (IMS / MS ou IMMS) est une technique o?? les ions sont d'abord s??par??s par le temps de d??rive gr??ce ?? un peu de gaz neutre sous un gradient de potentiel ??lectrique appliqu??e avant d'??tre introduit dans un spectrom??tre de masse. La d??rive du temps est une mesure du rayon par rapport ?? la charge de l'ion. Le cycle de service d'IMS (le temps pendant lequel l'exp??rience a lieu) est plus longue que la plupart des techniques de spectrom??trie de masse, tels que le spectrom??tre de masse peut d??guster le long du parcours de la s??paration IMS. Ce produit des donn??es sur la s??paration IMS et le rapport masse sur charge des ions d'une mani??re similaire ?? LC / MS.
Le cycle de service d'IMS est courte par rapport ?? la Chromatographie ou la Chromatographie en phase gazeuse des s??parations de liquide et peut donc ??tre coupl?? ?? de telles techniques, produisant triples modalit??s telles que LC / IMS / MS.
Et analyse des donn??es
repr??sentations de donn??es
Spectrom??trie de masse produit diff??rents types de donn??es. La repr??sentation de donn??es la plus commune est la spectre de masse.
Certains types de donn??es de spectrom??trie de masse sont le mieux repr??sent??es en tant que chromatogramme de masse. Types de chromatogrammes s??lectionn??s comprennent la surveillance d'ions (SIM), le courant ionique total (TIC), et la r??action de surveillance chromatogramme (SRM) s??lectionn??s, parmi beaucoup d'autres.
D'autres types de donn??es de spectrom??trie de masse sont bien repr??sent??s comme une tridimensionnel carte contour. Sous cette forme, la masse-charge, m / z est sur le axe x, l'intensit?? axe des y, et un param??tre suppl??mentaire exp??rimentale, comme le temps, est enregistr??e sur l'axe z.
L'analyse des donn??es
Notions de base
Masse analyse des donn??es de spectrom??trie est un sujet complexe qui est tr??s sp??cifique pour le type d'essai produisant des donn??es. Il ya subdivisions g??n??rales de donn??es qui sont essentielles ?? la compr??hension des donn??es.
Beaucoup de spectrom??tres de masse fonctionnent en mode d'ions n??gatifs ou en mode ion positif. Il est tr??s important de savoir si les ions observ??s sont charg?? n??gativement ou positivement. Ce est souvent important dans la d??termination de la masse neutre, mais il indique ??galement quelque chose ?? propos de la nature des mol??cules.
Diff??rents types de source d'ions entra??nent diff??rents tableaux de fragments produits ?? partir des mol??cules d'origine. Une source d'ionisation d'??lectrons produit de nombreux (1-) radicaux seule charge (nombre impair d'??lectrons) et la plupart des fragments, alors une source ??lectrospray produit habituellement ions quasimolecular non radicaux qui sont fr??quemment ?? charges multiples. Spectrom??trie de masse tandem produit volontairement ions fragments post-source et peut changer radicalement le type de donn??es obtenus par une exp??rience.
Par la compr??hension de l'origine d'un ??chantillon, certaines attentes peuvent ??tre consid??r??es comme les mol??cules constitutives de l'??chantillon et leurs fragmentations. Un ??chantillon provenant d'un processus / de fabrication de synth??se sera probablement contenir des impuret??s chimiquement li??s au composant cible. Un ??chantillon biologique relativement grossi??rement pr??par?? contiendra probablement une certaine quantit?? de sel, qui peut former produits d'addition avec les mol??cules d'analyte dans certaines analyses.
Les r??sultats peuvent ??galement d??pendra fortement de la fa??on dont l'??chantillon a ??t?? pr??par?? et comment il a ??t?? ex??cut?? / introduit. Un exemple important est la question de la matrice qui est utilis?? pour MALDI spotting, puisqu'une grande partie de l'??nerg??tique de l'??v??nement d??sorption / ionisation est contr??l??e par la matrice plut??t que la puissance du laser. Parfois ??chantillons sont dop??s avec du sodium ou un autre ion porteurs esp??ces pour produire les produits d'addition plut??t qu'une esp??ce proton??s.
La plus grande source d'ennuis quand spectrometrists non-masse essaient de mener spectrom??trie de masse sur leurs propres ou collaborer avec un en spectrom??trie de masse est insuffisante d??finition de l'objectif de la recherche de l'exp??rience. D??finition ad??quate de l'objectif exp??rimental est une condition pr??alable pour la collecte des donn??es appropri??es et avec succ??s l'interpr??ter. Parmi les d??cisions qui peuvent ??tre atteints avec la spectrom??trie de masse sont la masse mol??culaire, la structure mol??culaire, et la puret?? ??chantillon. Chacune de ces questions n??cessite une proc??dure exp??rimentale diff??rente. Il suffit de demander un "spectre de masse" sera tr??s probablement pas r??pondre ?? la vraie question ?? port??e de main.
Interpr??tation des spectres de masse
Depuis le pr??cise la structure ou s??quence peptidique d'une mol??cule est d??chiffr?? ?? travers l'ensemble des masses de fragments, l'interpr??tation de spectres de masse n??cessite l'utilisation combin??e de diff??rentes techniques. Habituellement, la premi??re strat??gie pour identifier un compos?? inconnu est de comparer son spectre de masse exp??rimental contre une biblioth??que de spectres de masse. Si la recherche est en place vide, alors l'interpr??tation manuelle ou logiciel interpr??tation assist??e de spectres de masse sont effectu??es. La simulation par ordinateur de ionisation et processus de fragmentation survenant dans le spectrom??tre de masse est le principal outil pour affecter la structure ou la s??quence peptidique ?? une mol??cule. Une une information structurelle priori est fragment?? in silico et le motif r??sultant est compar?? au spectre observ??. Cette simulation est souvent soutenue par une biblioth??que de fragmentation qui contient des motifs publi??s de r??actions de d??composition. Logiciel profiter de cette id??e a ??t?? d??velopp??e pour les petites mol??cules et prot??ines.
Une autre fa??on d'interpr??ter les spectres de masse implique spectres masse pr??cise. Une valeur Rapport masse sur charge (m / z) avec seulement une pr??cision entier peut repr??senter un nombre immense de structures d'ions th??oriquement possibles. Chiffres de masse plus pr??cises de r??duire consid??rablement le nombre de candidats formules mol??culaires , mais chacun peut encore repr??senter un grand nombre de compos??s structurellement divers. Un algorithme informatique appel?? g??n??rateur de formule calcule toutes les formules mol??culaires qui correspondent ?? une donn??e th??oriquement masse avec la tol??rance sp??cifi??e.
Une technique r??cente pour ??lucidation de la structure en spectrom??trie de masse, appel?? empreintes digitales pr??curseur d'ions identifie morceaux individuels de l'information structurelle en effectuant une recherche de la spectres tandem de la mol??cule ?? l'??tude avec une biblioth??que de la Les spectres d'ions produit des ions pr??curseurs structurellement caract??ris??s.
Applications
rapport isotopique MS: la datation isotopique et le suivi

La spectrométrie de masse est également utilisé pour déterminer la isotopique composition d'éléments au sein d'un échantillon. Différences de masse entre les isotopes d'un élément sont très petites, et les isotopes moins abondantes d'un élément sont généralement très rares, donc un instrument très sensible est nécessaire. Ces instruments, parfois appelés spectromètres rapport isotopique de masse (IR-MS), utilisent généralement un seul aimant à plier un faisceau de particules ionisées vers une série de cages de Faraday qui convertissent les impacts de particules à courant ??lectrique. une analyse rapide en ligne de contenu en deutérium de l'eau peut être fait en utilisant la spectrométrie de masse rémanence Circuler, FA-MS. Probablement spectromètre de masse le plus sensible et précis à cet effet est le spectromètre de masse par accélérateur (SMA). les rapports isotopiques sont des marqueurs importants d'une variété de procédés. Certains rapports isotopiques sont utilisées pour déterminer l'âge des matériaux par exemple comme dans datation au carbone. l'étiquetage avec des isotopes stables est également utilisé pour la quantification des protéines. (Voir la caractérisation des protéines ci-dessous)
l'analyse des gaz de trace
Plusieurs techniques utilisent des ions créés dans une source d'ions dédié injecté dans un tube d'écoulement ou un tube de dérive:tube d'écoulement d'ions sélectionnés (SIFT-MS), etla réaction de transfert de proton (PTR-MS), sont des variantes del'ionisation chimique dédiés pour l'analyse de traces de gaz de l'air, souffle ou espace de tête liquide en utilisant un temps de réaction bien défini permettant les calculs de concentrations d'analyte à partir de la cinétique de réaction connues, sans la nécessité de l'étalon interne ou d'étalonnage.
sonde Atom
Une sonde atomique est un instrument qui combinespectrométrie de temps de vol de masse etmicroscopie ionique de champ (FIM) à cartographier l'emplacement des atomes individuels.
Pharmacocin??tique
Pharmacocinétique est souvent étudiée en utilisant la spectrométrie de masse à cause de la nature complexe de la matrice (souvent du sang ou de l'urine) et la nécessité d'une haute sensibilité pour observer faible dose et des données de point de longues périodes. L'instrumentation la plus couramment utilisée dans cette application est LC-MS avec un spectromètre de masse triple quadripôle. Spectrométrie de masse tandem est habituellement utilisé pour la spécificité ajouté. Les courbes d'étalonnage et des étalons internes sont utilisés pour la quantification d'un seul pharmaceutique habituellement dans les échantillons. Les échantillons représentent différents points de temps comme produit pharmaceutique est administrée et ensuite métabolisé ou éliminé de l'organisme. Blancs ou t = 0 échantillons prélevés avant l'administration sont importantes dans la détermination de fond et d'assurer l'intégrité des données avec ces matrices complexes. Une grande attention est accordée à la linéarité de la courbe standard; Cependant il est courant d'utiliser raccord avec des fonctions plus complexes telles que quadratiques courbe depuis la réponse de la plupart des spectromètres de masse est inférieure linéaire sur de grandes gammes de concentration.
Il ne existe actuellement un int??r??t consid??rable pour l'utilisation de tr??s haute sensibilit?? de spectrom??trie de masse ??tudes de microdosage, qui sont consid??r??es comme une alternative prometteuse ?? l'exp??rimentation animale.
La caract??risation des prot??ines
La spectrom??trie de masse est une nouvelle m??thode importante pour la caract??risation et le s??quen??age de prot??ines. Les deux m??thodes principales pour l'ionisation des prot??ines enti??res sont ionisation par ??lectropulv??risation (ESI) et laser assist??e par matrice de d??sorption / ionisation (MALDI). Conform??ment ?? la performance et de la masse gamme de spectrom??tres de masse disponibles, deux approches sont utilis??es pour caract??riser les prot??ines. Dans la premi??re, les prot??ines intactes sont ionis??es par l'une des deux techniques d??crites ci-dessus, puis introduit dans un analyseur de masse. Cette approche est appel??e " top-down "strat??gie de l'analyse des prot??ines. Dans la seconde, les prot??ines sont digestion enzymatique en plus petits peptides ?? l'aide des proteases telles que trypsine ou la pepsine, soit en solution ou en gel apr??s s??paration ??lectrophor??tique. D'autres agents protéolytiques sont également utilisés. La collection de produits peptidiques sont ensuite introduit dans l'analyseur de masse. Lorsque le motif caractéristique de peptides est utilisée pour l'identification de la protéine de la méthode est appelée masse peptidique empreintes digitales (PMF), si l'identification est effectuée en utilisant les données de la séquence déterminée dans l'analyse MS en tandem, il est appelé séquençage de novo. Ces procédures d'analyse des protéines sont aussi appelés le « bottom-up ».
Analyse Glycan
La spectrométrie de masse (MS), avec son exigence d'échantillon faible et une sensibilité élevée, a été principalement utilisé dans glycobiology pour la caractérisation et l'élucidation des structures glycanniques. La spectrométrie de masse fournit un procédé complémentaire à une HPLC pour l'analyse des glycanes. Glycanes intactes peuvent être détectés ions directement comme charge unique par assistée par matrice de désorption / ionisation laser spectrométrie de masse (MALDI-MS) ou, après perméthylation ou peracétylation, par bombardement atomique rapide spectrométrie de masse (FAB-MS). Electrospray spectrométrie de masse à ionisation (ESI -MS) donne aussi de bons signaux pour les petites glycanes. Divers logiciel libre et commercial sont maintenant disponibles qui interprètent des données MS et de l'aide dans la structure Glycan caractérisation.
L'exploration spatiale
Comme une méthode standard pour l'analyse, spectromètres de masse ont atteint d'autres planètes et lunes. Deux ont été prises pour Mars par le programme Viking. Au début de 2005, la mission Cassini-Huygens a prononcé un spécialisé instrument GC-MS à bord de la sonde Huygens dans l'atmosphère de Titan, la plus grande lune de la planète Saturne . Cet instrument a analysé des échantillons atmosphériques le long de sa trajectoire de descente et était capable de vaporiser et analyser des échantillons de surface gelée, recouverte d'hydrocarbures de Titan, une fois la sonde avait atterri. Ces mesures comparer l'abondance de l'isotope (s) de chaque particule relativement à l'abondance naturelle de la terre. Également à bord de la sonde Cassini-Huygens est un ion et neutre spectromètre de masse qui a été pris des mesures de la composition atmosphérique de Titan ainsi que la composition de les panaches d'Encelade. Un thermique et Analyseur de gaz Evolved spectromètre de masse a été réalisée par le Phoenix Mars Lander lancé en 2007.
Spectromètres de masse sont aussi largement utilisés dans les missions spatiales pour mesurer la composition des plasmas. Par exemple, la sonde Cassini porte le Spectromètre Plasma Cassini (CAPS), qui mesure la masse des ions dans Saturne magn??tosph??re.
Moniteur de gaz respiré
Spectromètres de masse ont été utilisés dans les hôpitaux pour l'analyse des gaz respiratoires commençant dans les années 1975 jusqu'à la fin du siècle. Certains sont probablement encore en usage mais aucun sont actuellement en cours de fabrication.
Trouvé principalement dans la salle d'opération, ils faisaient partie d'un système complexe, dans lequel les échantillons de gaz respirés de patients subissant une anesthésie ont été entraînés dans l'instrument à travers un mécanisme de soupape conçu pour connecter séquentiellement jusqu'à 32 chambres au spectromètre de masse. Un ordinateur a dirigé toutes les opérations du système. Les données recueillies par le spectromètre de masse a été livré aux chambres individuelles pour l'anesthésiste à utiliser.
L'originalité de ce spectromètre de masse à secteur magnétique peut avoir été le fait qu'un plan de détecteurs, chacun positionné délibérément de recueillir toutes les espèces d'ions qui devraient être dans les échantillons, a permis à l'instrument de rendre compte simultanément tous les gaz respirés par le patient . Bien que la gamme de masse a été limitée à un peu plus de 120 u, la fragmentation d'une partie des molécules plus lourdes nié la nécessité d'une limite de détection plus élevé.