
Isotope
Contexte des ??coles Wikip??dia
Cette s??lection ??coles a ??t?? choisi par SOS Enfants pour les ??coles dans le monde en d??veloppement ne ont pas acc??s ?? Internet. Il est disponible en t??l??chargement intranet. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
Les isotopes sont l'une des diff??rentes formes d'un ??l??ment de masse atomique chacun ayant diff??rentes ( nombre de masse). Les isotopes d'un ??l??ment ont des noyaux ayant le m??me nombre de protons (le m??me nombre d'atomes ), mais un nombre diff??rent de neutrons . Par cons??quent, les isotopes ont diff??rentes nombres de masse, qui donnent le nombre total de nucl??ons-le nombre de protons et de neutrons.
Un nucl??ide est toute noyau atomique notamment avec un num??ro atomique Z sp??cifique et nombre de masse A; il est de fa??on ??quivalente un noyau atomique avec un certain nombre de protons et de neutrons. Collectivement, tous les isotopes de tous les ??l??ments forment l'ensemble des nucl??ides. La distinction entre les termes isotopes et nucl??ide a un peu floue, et ils sont souvent utilis??s indiff??remment isotopes est utilis?? au mieux en se r??f??rant ?? plusieurs nucl??ides diff??rents d'un m??me ??l??ment;. Nucl??ide est plus g??n??rique et est utilis?? lors du r??f??rencement un seul noyau ou plusieurs noyaux de diff??rents ??l??ments. Par exemple, il est plus exact de dire que un ??l??ment tel que le fluor se compose d'un nucl??ide stable plut??t que qu'il a un isotope stable.
Dans la nomenclature IUPAC , isotopes et les nucl??ides sont sp??cifi??s par le nom de l'??l??ment particulier, donnant implicitement le num??ro atomique, suivi d'un trait d'union et le nombre de masse (par exemple, h??lium-3, carbone 12, carbone-13, l'iode-131 et l'uranium-238). Dans une forme symbolique, le nombre de nucl??ons est not??e comme un en exposant au pr??fixe symbole chimique (par exemple 3 He, 12 C, 13 C, 131 I et 238 U).
Environ 339 nucl??ides pr??sents naturellement sur Terre, dont environ 79% sont stables. Compter les nucl??ides radioactifs ne trouve pas dans la nature qui ont ??t?? cr????es artificiellement, plus de 3100 nucl??ides sont actuellement connus.
Histoire du terme
L'isotope de terme a ??t?? invent?? en 1913 par Margaret Todd, un m??decin ??cossais, au cours d'une conversation avec Frederick Soddy (?? qui elle a ??t?? de loin li?? par le mariage). Soddy, chimiste ?? l'Universit?? de Glasgow, a expliqu?? qu'il ressort de ses investigations comme si plusieurs ??l??ments occup??es chaque position dans le tableau p??riodique . Ainsi Todd a sugg??r?? le terme grec pour ??au m??me endroit??, comme un nom appropri??. Soddy a adopt?? le terme et a remport?? le prix Nobel de chimie en 1921 pour ses travaux sur les substances radioactives.
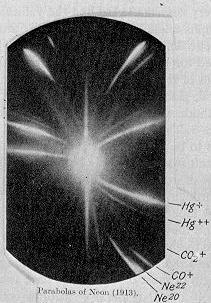
En 1913, dans le cadre de son exploration dans la composition de rayons canaux, JJ Thomson canalis??es un flux de n??on ionis?? par un champ magn??tique et un champ ??lectrique et mesur??es sa d??flexion en pla??ant une plaque photographique sur son passage. Thomson a observ?? deux taches de lumi??re sur la plaque photographique (voir l'image ?? droite), qui a sugg??r?? deux paraboles diff??rentes de d??viation. Thomson a conclu que certains des atomes dans le gaz ??taient de masse plus ??lev??e que le reste.
Variation des propri??t??s entre isotopes
Les propri??t??s chimiques et atomiques
Un atome neutre a le m??me nombre d'??lectrons que des protons. Ainsi, diff??rents isotopes d'un ??l??ment donn?? ont toutes le m??me nombre de protons et d'??lectrons et la m??me structure ??lectronique, et parce que le comportement chimique d'un atome est largement d??termin??e par sa structure ??lectronique, les diff??rents isotopes ont un comportement chimique presque identique. La principale exception ?? cette r??gle est le effet isotopique cin??tique: en raison de leurs grandes masses, des isotopes plus lourds ont tendance ?? r??agir un peu plus lentement que isotopes les plus l??gers du m??me ??l??ment. Ce est le plus prononc?? pour protium (1 H) vis-??-vis deut??rium (2 H), parce que le deut??rium a deux fois la masse de protium. L'effet de masse entre le deut??rium et le protium relativement l??ger affecte ??galement le comportement de leurs liaisons chimiques respectives, par des moyens de changer le centre de gravit?? ( masse r??duite) des syst??mes atomiques. Toutefois, pour les ??l??ments plus lourds, la masse absolue de noyau par rapport ?? ??lectrons si beaucoup plus, et la diff??rence de masse entre les isotopes rapport est beaucoup moins, et donc les effets de masse diff??rence sur la chimie sont g??n??ralement n??gligeable.

De m??me, deux mol??cules qui ne diff??rent que par la nature de leurs atomes isotopique ( isotopologues) aura la structure ??lectronique identiques et propri??t??s physiques et chimiques donc presque indiscernables (nouveau avec le deut??rium fournissant la principale exception ?? cette r??gle). Les modes de vibration d'une mol??cule sont d??termin??es par la forme et par les masses de ses atomes constitutifs. Par cons??quent, les isotopologues auront diff??rents ensembles de modes de vibration. Comme modes de vibration permettent une mol??cule d'absorber des photons d'??nergies correspondant, isotopologues ont des propri??t??s optiques dans le domaine de l'infrarouge.
Propri??t??s et la stabilit?? nucl??aires
Les noyaux atomiques sont constitu??s de protons et de neutrons li??s ensemble par le force nucl??aire forte. Parce que les protons sont charg??s positivement, ils se repoussent mutuellement. Les neutrons, qui sont ??lectriquement neutres, permettent une certaine s??paration entre les protons charg??s positivement, ce qui r??duit la r??pulsion ??lectrostatique. Neutrons stabilisent le noyau ?? courte port??e parce qu'ils se attirent mutuellement et protons ?? parts ??gales par la force nucl??aire forte, et cette force suppl??mentaire de liaison compense aussi la r??pulsion ??lectrique entre protons. Pour cette raison, une ou davantage de neutrons sont n??cessaires pour deux ou plusieurs protons ?? ??tre li??s en un noyau. Comme le nombre de protons augmente, l'augmentation du ratio de neutrons sont n??cessaires pour former un noyau stable (voir le graphique ?? droite). Par exemple, bien que le neutron: rapport de proton de 3 Il est de 1: 2, le neutron: rapport de protons de 238 U est sup??rieur ?? 3: 2. En r??gle g??n??rale, il est, pour chaque num??ro atomique (chaque ??l??ment), seule une poign??e d'isotopes stables, la moyenne ??tant de 3,4 isotopes stables par ??l??ment qui a des isotopes stables. Seize ??l??ments ne ont qu'un seul isotope stable, tandis que le plus grand nombre d'isotopes stables observ??s pour tout ??l??ment , est de dix.
Bien isotopes pr??sentent un comportement ??lectronique et chimique presque identique, leur comportement nucl??aire varie consid??rablement. Ajout de neutrons aux isotopes peuvent varier leurs spins nucl??aires et les formes nucl??aires, provoquant des diff??rences dans capture de neutrons sections et spectroscopie gamma et propri??t??s de r??sonance magn??tique nucl??aire.
Si trop ou trop peu de neutrons sont pr??sents en ce qui concerne le rapport optimal, le noyau devient instable et soumis ?? certains types de d??sint??gration nucl??aire. Isotopes instables avec un nombre non-optimale des neutrons se d??sint??grent en d??sint??gration alpha, d??sint??gration b??ta, ou d'autres moyens exotiques, tels que fission spontan??e et carie cluster.
Pr??sence dans la nature
Les ??l??ments sont constitu??s d'une ou des isotopes, qui sont normalement plus stable d'origine naturelle. Certains ??l??ments ont instables isotopes (radioactifs), soit parce que leur d??composition est si lent qu'une fraction reste car ils ont ??t?? cr????s (exemples: uranium, potassium), ou parce qu'ils sont continuellement cr???? par le rayonnement cosmique (tritium, carbone-14) ou par la d??sint??gration d'un isotope dans la premi??re cat??gorie (le radium, le radon).
Seuls les 80 ??l??ments ont isotopes stables, et 16 d'entre eux ont un seul isotope stable. La plupart des ??l??ments sont pr??sents naturellement sur Terre dans plusieurs isotopes stables, avec le plus grand nombre d'isotopes stables d'un ??l??ment ??tant dix, pour l'??tain (??l??ment num??ro 50). Il ya environ 94 ??l??ments trouv??s naturellement sur Terre (jusqu'?? plutonium, ??l??ment 94, inclusivement), m??me si certains sont d??tect??s seulement dans tr??s petites quantit??s, tels que plutonium-244. Lindsay estime que les ??l??ments qui se trouvent naturellement sur la Terre (une partie seulement comme des radio-isotopes) se produisent en tant que isotopes (339 nucl??ides) au total. Seulement 269 de ces isotopes naturels sont stables, et les 70 autres sont radioactifs, mais se produisent sur Terre en raison de leurs demi-vies relativement longues, ou d'autres moyens de production naturelle. Suppl??mentaires ~ 2700 isotopes radioactifs ne trouve pas dans la nature ont ??t?? cr????s dans les r??acteurs nucl??aires et les acc??l??rateurs de particules. De nombreux isotopes de courte dur??e se trouvent pas naturellement sur Terre ont ??galement ??t?? observ??s par analyse spectroscopique, ??tant naturellement cr????s dans les ??toiles ou supernovae. Un exemple est aluminium-26, qui ne est pas naturellement pr??sente sur Terre, mais qui se trouve en abondance sur une ??chelle astronomique.
Les masses atomiques figurant au tableau sont des moyennes des ??l??ments qui tiennent compte de la pr??sence de plusieurs isotopes ayant des masses diff??rentes. Un bon exemple est le chlore , ayant la composition 35 Cl, 75,8%, et de 37 Cl, 24,2%, donnant une masse atomique de 35,5. Les valeurs de ce genre confondus scientifiques avant la d??couverte des isotopes, comme la plupart des ??l??ments de lumi??re masses atomiques sont proches ?? des multiples entiers de l'hydrog??ne.
Selon g??n??ralement reconnus cosmologie seuls les isotopes de l'hydrog??ne et de l'h??lium et des traces de certains isotopes du lithium, le b??ryllium et le bore ont ??t?? cr????s au Big Bang, alors que tous les autres ont ??t?? synth??tis??s dans les ??toiles et les supernovae. (Voir nucl??osynth??se.) leurs abondances respectives sur le r??sultat de la Terre ?? partir des quantit??s form??es par ces processus, leur propagation ?? travers la galaxie, et leur taux de d??croissance. Apr??s la coalescence initiale du syst??me solaire, les isotopes ont ??t?? redistribu??es en fonction de la masse et la composition isotopique des ??l??ments varie l??g??rement de plan??te en plan??te. Cela rend parfois possible de retracer l'origine des m??t??orites.
La masse mol??culaire des isotopes
La masse mol??culaire (M r) d'un ??l??ment est d??termin??e par ses nucl??ons. Par exemple, le carbone-12 (12 C) dispose de 6 protons et 6 neutrons . Lorsqu'un ??chantillon contient deux isotopes de l'??quation ci-dessous est appliqu??, o?? M r (1) r et M (2) sont les masses mol??culaires de chaque isotope particulier, et l'abondance% est le pourcentage d'abondance de cet isotope dans l'??chantillon.
Applications d'isotopes
Plusieurs applications existent qui capitalisent sur les propri??t??s des diff??rents isotopes d'un ??l??ment donn??.
Utilisation des propri??t??s chimiques et biologiques
- analyse isotopique est la d??termination de signature isotopique, les abondances relatives des isotopes d'un ??l??ment donn?? dans un ??chantillon particulier. Pour substances biog??niques en particulier, des variations importantes d'isotopes de C, N et O peuvent se produire. L'analyse de ces variations a une large gamme d'applications telles que la d??tection de l'alt??ration des produits alimentaires. L'identification des certaines m??t??orites comme ayant son origine sur Mars est bas?? en partie sur la signature isotopique de traces de gaz qu'ils contiennent.
- Une autre application est commune marquage isotopique, l'utilisation d'isotopes inhabituels comme traceurs ou marqueurs dans des r??actions chimiques. Normalement, les atomes d'un ??l??ment donn?? sont indiscernables les uns des autres. Toutefois, en utilisant des isotopes de masses diff??rentes, ils peuvent ??tre distingu??s par spectrom??trie de masse ou spectroscopie infrarouge (voir "Propri??t??s"). Par exemple, dans ??marquage isotopique stable avec des acides amin??s dans une culture cellulaire ( SILAC) 'isotopes stables sont utilis??es pour quantifier les prot??ines . Si des isotopes radioactifs sont utilis??s, ils peuvent ??tre d??tect??s par le rayonnement qu'elles ??mettent (ce est ce qu'on appelle l'??tiquetage radioisotopique).
- Une technique similaire ?? l'??tiquetage radio-isotopique est datation radiom??trique: utilisant le connu demi-vie d'un ??l??ment instable, on peut calculer la quantit?? de temps qui se est ??coul?? depuis un niveau connu d'isotope existait. L'exemple le plus connu est datation au radiocarbone utilis?? pour d??terminer l'??ge des mat??riaux carbon??s.
- Substitution isotopique peut ??tre utilis??e pour d??terminer le m??canisme d'une r??action par l'interm??diaire du effet cin??tique isotopique.
Utilisation des propri??t??s nucl??aires
- Plusieurs formes de spectroscopie se appuient sur les propri??t??s nucl??aires uniques d'isotopes sp??cifiques. Par exemple, r??sonance magn??tique (RMN) nucl??aire peut ??tre utilis??e que pour les isotopes avec un spin nucl??aire non nul. Les isotopes les plus couramment utilis??s par spectroscopie RMN 1 H sont, 2 D, 15 N, 13 C et 31 P.
- Spectroscopie M??ssbauer se appuie ??galement sur les transitions nucl??aires des isotopes sp??cifiques, tels que 57 Fe.
- Radionucl??ides ont aussi des utilisations importantes. L'??nergie nucl??aire et les armes nucl??aires d??veloppement n??cessitent des quantit??s relativement importantes d'isotopes sp??cifiques. Le processus de la s??paration isotopique repr??sente un d??fi technologique significatif, mais davantage d'??l??ments lourds comme l'uranium ou du plutonium, que des ??l??ments plus l??gers tels que l'hydrog??ne, le lithium, le carbone, l'azote et l'oxyg??ne. Les ??l??ments l??gers sont g??n??ralement s??par??s par diffusion gazeuse de leurs compos??s tels que CO et NO. isotopes de l'uranium ont ??t?? s??par??s en vrac par diffusion gazeuse, la centrifugation de gaz, la s??paration d'ionisation au laser, et (dans le Projet Manhattan) par un type de production spectroscopie de masse .

