
Fluor
Saviez-vous ...
SOS Enfants a fait cette s??lection Wikipedia aux c??t??s d'autres ??coles des ressources . Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
| Fluor | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
9 F | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
| gaz: jaune tr??s p??le liquide: jaune vif solide: transparent (beta), opaque (alpha)  Fluor liquide ?? des temp??ratures cryog??niques | ||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | fluor, F, 9 | |||||||||||||||||||||||||||
| Prononciation | / fa l ʊər Je n /, / fa l ʊər ɪ n /, / fa l ɔər Je n / | |||||||||||||||||||||||||||
| ??l??ment Cat??gorie | halog??ne | |||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (17) les halog??nes , 2, p | |||||||||||||||||||||||||||
| Poids atomique standard | 18.9984032 (5) | |||||||||||||||||||||||||||
| Configuration ??lectronique | [Il] 2s 2 2p 5 2, 7  | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| D??couverte | Andr??-Marie Amp??re (1810) | |||||||||||||||||||||||||||
| Premier isolement | Henri Moissan (26 Juin, 1886) | |||||||||||||||||||||||||||
| Nomm?? par | Humphry Davy | |||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||
| Phase | gaz | |||||||||||||||||||||||||||
| Densit?? | (0 ?? C, 101,325 kPa) 1,696 g / L | |||||||||||||||||||||||||||
| Liquid densit?? ?? BP | 1,505 g ?? cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 53,53 K , -219,62 ?? C, -363,32 ?? F | |||||||||||||||||||||||||||
| Point d'??bullition | 85,03 K, -188,12 ?? C, -306,62 ?? F | |||||||||||||||||||||||||||
| Point critique | 144,4 K, 5,215 MPa | |||||||||||||||||||||||||||
| Chaleur de vaporisation | 6,51 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Capacit?? thermique molaire | (C p) (21,1 ?? C) 825 J ?? mol -1 ?? K -1 (C v) (21,1 ?? C) 610 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||
| ??tats d'oxydation | -1 (Oxyde oxyg??ne) | |||||||||||||||||||||||||||
| ??lectron??gativit?? | 3,98 (??chelle de Pauling) | |||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 1681 kJ ?? mol -1 | |||||||||||||||||||||||||||
| 2??me: 3374 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| 3??me: 6147 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Rayon covalente | 64 h | |||||||||||||||||||||||||||
| Rayon de Van der Waals | 135 h | |||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||
| Crystal structure | cubique  la structure d??signe le fluor solide, juste en dessous du point de fusion, 1 atm | |||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | |||||||||||||||||||||||||||
| Conductivit?? thermique | 0,02591 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||
| Num??ro de registre CAS | 7782-41-4 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de fluor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Fluor (symbole F) est l' ??l??ment chimique avec num??ro atomique 9. Il est le plus l??ger halog??ne . ?? pression et temp??rature standard, le fluor est un gaz jaune p??le compos?? de mol??cules diatomiques, F 2. Le fluor est le plus ??l??ment ??lectron??gatif et est extr??mement r??actif, exigeant beaucoup de soin dans la manipulation. Il a une seule stable isotope , le fluor-19.
Dans les ??toiles, le fluor est rare par rapport ?? d'autres ??l??ments l??gers. Dans la cro??te terrestre, le fluor est l'??l??ment le plus abondant treizi??me. Min??ral le plus important de fluor, fluorite, a d'abord ??t?? d??crit formellement en 1530, dans le cadre de fusion. Le nom du min??ral d??rive du verbe latin fluo, ce qui signifie ??flux??, parce fluorite a ??t?? ajout?? ?? minerais m??talliques pour abaisser leur point de fusion. Sugg??r?? comme un ??l??ment chimique en 1811, le fluor a ??t?? nomm?? d'apr??s le min??ral de source, mais r??sist?? ?? plusieurs tentatives pour isoler l'??l??ment. En 1886, le chimiste fran??ais Henri Moissan r??ussi. Sa m??thode de l'??lectrolyse reste la m??thode de la production industrielle pour le gaz de fluor. La principale utilisation de fluor ??l??mentaire, l'enrichissement d'uranium, a ??t?? d??velopp?? au cours de la Projet Manhattan.
En raison de la difficult?? ?? faire le fluor ??l??mentaire, la plus utilis??e dans le commerce de fluor ne est jamais transform??e en fluor libre. Au lieu de cela, l'acide fluorhydrique est la cl?? interm??diaire pour les 16 milliards de dollars par l'industrie fluor??e mondiale de l'ann??e. Le fluorures de m??taux bas pratiqu??s sont compos??s ioniques (sels); ceux des m??taux ??lev??s pratiqu??s sont volatils compos??s mol??culaires . Les plus grandes utilisations de fluorures inorganiques fabrication de l'acier et raffinage d'aluminium.
Compos??s fluor??s organiques ont tendance ?? avoir une grande stabilit?? thermique et chimique. Le plus grand usage commercial est en des gaz r??frig??rants (les nombreux types de "fr??ons"). Bien que traditionnelle chlorofluorocarbones sont largement interdits, les gaz de remplacement contiennent encore du fluor. Le polyt??trafluoro??thyl??ne (Teflon) est le plus important fluoropolym??re et est utilis?? dans l'isolation ??lectrique, des pi??ces r??sistant aux produits chimiques, les toits du stade, et ustensiles de cuisine. Une fraction croissante de produits pharmaceutiques modernes contiennent du fluor; Lipitor et Prozac sont des exemples frappants. Bien que quelques plantes et les bact??ries synth??tisent poisons organofluor??s, le fluor ne joue aucun r??le m??tabolique chez les mammif??res. L'ion fluorure, lorsqu'il est directement appliqu?? sur les dents, r??duit la d??composition et pour cette raison on utilise dans la p??te dentifrice et municipal fluoration de l'eau.
Caract??ristiques
Propri??t??s physiques
formes de fluor mol??cules diatomiques qui sont gazeux ?? temp??rature ambiante. La densit?? est d'environ 1,3 fois celle de l'air. Bien que parfois cit?? comme jaune-vert, le gaz de fluor est en fait un jaune tr??s p??le. Sa couleur ne peut ??tre observ?? dans le gaz de fluor concentr?? quand on regarde vers le bas l'axe de longs tubes. Il semble transparente lorsqu'elle est observ??e depuis le c??t?? dans des tubes de verre normal ou si on les laisse se ??chapper dans l'atmosph??re. L'??l??ment a une odeur caract??ristique "piquant" qui est sensible ?? des concentrations aussi faibles que 20 ppb.
Le fluor se condense en un liquide jaune clair ?? -188 ?? C (-307 ?? F), ?? proximit?? de la temp??rature de condensation de l'oxyg??ne et de l'azote. Fluor se solidifie ?? -220 ?? C (-363 ?? F) dans un structure cubique, appel?? b??ta-fluor. Cette ??tape est transparent et souple, avec un trouble significatif de mol??cules. A -228 ?? C (-378 ?? F) de fluor subit une solide-solide transition de phase dans un appel??e structure monoclinique alpha-fluor. Cette phase est opaque et difficile avec des couches de serr??e de mol??cules. Le changement de phase ?? l'??tat solide n??cessite plus d'??nergie que la transition de point de fusion et peut ??tre violent, brisant ??chantillons et souffler les fen??tres de porte-??chantillons. En g??n??ral, l'??tat solide de fluor est plus semblable ?? l'oxyg??ne de que les autres halog??nes ??.
 |  |
| Phases de fluor basse temp??rature | Structure cristalline alpha-fluor |
Structure atomique
Un atome de fluor poss??de neuf protons et neuf ??lectrons , un de moins que le n??on , dispos??s dans le configuration ??lectronique [He] 2s 2 2p 5. ??lectrons externes de fluor sont relativement s??par??s les uns des autres, et donc ils ne prot??gent pas les uns les autres ?? partir du noyau. Par cons??quent, ils ??prouvent une forte charge nucl??aire effective. Fluor a une relativement faible rayon covalente, un peu moins de 60 picom??tres, qui est inf??rieure ?? son voisinage, l'oxyg??ne et le n??on.

Le fluor est r??ticent pour ioniser et a une attirance pour un ??lectron plus pour atteindre l'arrangement de n??on comme extr??mement stable ?? la place. Fluor de premi??re ??nergie d'ionisation (??nergie n??cessaire pour arracher un ??lectron pour former F +) est 1681 kilojoules par mole, qui est plus ??lev?? que pour tout autre ??l??ment, sauf n??on et l'h??lium. Fluor de affinit?? d'??lectrons (??nergie lib??r??e par addition d'un ??lectron pour former F -) est de 328 kilojoules par mole, ce qui est sup??rieur ?? celui de tout autre ??l??ment ?? l'exception du chlore.
Structure mol??culaire

Bien qu'un atome de fluor individu a un ??lectron non appari??, au fluor mol??culaire tous les ??lectrons sont appari??s. De ce fait, le fluor ??l??mentaire est diamagn??tique (l??g??rement repouss?? par des aimants). En revanche, les mol??cules de l'??l??ment voisin de l'oxyg??ne, avec deux ??lectrons non appari??s par mol??cule, sont paramagn??tique (attir??s vers des aimants). La valeur mesur??e de fluor de susceptibilit?? magn??tique est -9,6 ?? 10 -6 (CGS), qui est proche de pr??dictions th??oriques. Le r??sultat exp??rimental n'a pas ??t?? accompli jusqu'en 1999 en raison des difficult??s de manipulation du fluor gazeux ainsi que la n??cessit?? de purifier sp??cialement le fluor de toute trace d'oxyg??ne paramagn??tique.
La liaison du fluor fluor de la mol??cule d'difluorine est relativement faible par rapport ?? la liaison des autres halog??nes. L'??nergie de liaison est significativement plus faible que celles des mol??cules de dichlorine ou Dibrome et semblables aux obligations facilement cliv??s oxyg??ne-oxyg??ne de peroxydes ou des liaisons azote-azote hydrazines. Le rayon covalent de fluor dans les mol??cules difluorine, environ 71 picom??tres, est nettement plus grande que celle des autres compos??s en raison de la faible liaison entre des atomes de fluor. Cela arrive parce que l'??lectron et r??pulsions internucl??aires sont relativement grande, et le chevauchement orbitale collage est diminu?? en raison de la petite taille des atomes.
??lectrons 2p de fluor sont purement 2p, et la mol??cule de difluorine a exactement une obligation (un ordre de liaison d'exactement 1). En revanche, p ??lectrons les niveaux des halog??nes plus lourds hybrident partie avec ceux des ??lectrons d. Cela les rend se comportent en partie comme des ??lectrons d, et ce caract??re partielle d permet de montrer la liaison partielle entre ??lectrons d. Par cons??quent, les halog??nes plus lourds ont un Afin efficace sup??rieure ?? 1 liaison; par exemple, le chlore a un ordre de liaison de 1,12. Les ??lectrons de fluor ne peuvent pas afficher ce caract??re d parce qu'il n'y a pas d ??lectrons proches de l'??nergie au fluor de 2p.
| X | X 2 | HX | BX 3 | AlX 3 | CX 4 |
|---|---|---|---|---|---|
| Fa | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| Je | 151 | 294 | 272 | 285 | 239 |
R??activit?? chimique
La chimie du fluor est domin?? par sa tendance ?? gagner un ??lectron. Il est le plus ??l??ment ??lectron??gatif et un oxydant puissant. L'??limination d'un ??lectron d'un atome de fluor n??cessite autant d'??nergie que ne oxydant connue peut oxyder l'une quelconque fluor positif ??tat d'oxydation .
R??actions avec du fluor sont souvent soudaine ou explosive. De nombreuses substances g??n??ralement non r??actifs tels que l'acier en poudre, des fragments de verre et les fibres d'amiante sont facilement consomm??s par du fluor gazeux froid. Du bois et de l'eau, m??me avec des flammes br??lent lorsqu'ils sont soumis ?? un jet de fluor, sans la n??cessit?? d'une ??tincelle.
Fluor r??agir avec le c??sium, la vid??o par la Royal Institution. (Les deux vid??os film??s dans un laboratoire de fluor de l'Universit?? de Leicester.) |
forme des compos??s de fluor, fluorures, avec tous les ??l??ments sauf le n??on et l'h??lium . Tous les ??l??ments jusqu'?? einsteinium , ??l??ment 99, ont ??t?? v??rifi??es, sauf pour astate et le francium . Le fluor est ??galement connu de former des compos??s avec rutherfordium , l'??l??ment 104, et seaborgium , ??l??ment 106. Plusieurs ??l??ments radioactifs lourds ne ont pas ??t?? fluor??e en raison de leur extr??me raret??, mais de telles r??actions sont th??oriquement possibles.
Tous les m??taux r??agissent avec le fluor, mais les conditions varient avec le m??tal. Souvent, le m??tal doit ??tre parce que de nombreux m??taux sous forme de poudre passiver (former des couches protectrices de fluorure de m??tal qui r??siste davantage fluoration). Les m??taux alcalins r??agissent avec du fluor avec un bang (petite explosion), tandis que les m??taux alcalino-terreux r??agissent ?? la temp??rature ambiante ainsi, mais pas de mani??re aussi agressive. Le des m??taux nobles ruth??nium, le rhodium, le palladium, le platine, l'or et r??agissent moins facilement, ce qui n??cessite du fluor gazeux pur ?? 300-450 ?? C (575-850 ?? F).
Le fluor r??agit de fa??on explosive avec l'hydrog??ne d'une mani??re similaire ?? celle des m??taux alcalins. Les halog??nes r??agissent facilement avec le gaz de fluor comme la lourde gaz noble radon . Les gaz nobles l??gers x??non et le krypton peuvent ??tre amen??s ?? r??agir avec du fluor dans des conditions particuli??res et l'argon se combinera avec fluorure d'hydrog??ne. Azote, avec son tr??s stable triples liaisons, n??cessite d??charge ??lectrique et des temp??ratures ??lev??es de combiner directement avec le fluor.
Isotopes
Fluor se produit naturellement sur Terre exclusivement sous la forme de son seul stable isotope , le fluor-19, ce qui rend l'??l??ment monoisotopique et mononuclidic. Dix-sept radio-isotopes ont ??t?? synth??tis??s: nombres de masse 14-18 et 20-31. Le fluor-18 est le plus stable du radio-isotope de fluor, avec une demi-vie de 109,77 minutes. Ce est aussi le plus l??ger instable nucl??ide avec des nombres impairs ??gaux de protons et de neutrons .
Les plus l??gers isotopes de fluor, ceux qui nombres de masse de 14-16, la pourriture via capture ??lectronique. 17 F et 18 F subir carie et des b??ta (par ??mission de positons). Tous les isotopes plus lourds que l'??curie du fluor-19 d??sint??gration par le mode moins beta (d'??mission d'??lectrons). Certains d'entre eux Decay aussi par ??mission de neutrons.
Un seul isom??re nucl??aire (Etat nucl??aire excit?? ?? long v??cu), le fluor-18m, a ??t?? caract??ris??. Sa demi-vie avant ??mission de rayons gamma est 160 nanosecondes. Ce est moins que la demi-vie de l'un des radio-isotopes fluor ??tats fondamentaux de d??sint??gration nucl??aire, sauf les num??ros 14 ?? 16, 28 et 31.
Origine et pr??sence
Dans l'univers
| Atomique nombre | ??l??ment | Relatif montant |
|---|---|---|
| 6 | Carbone | 4800 |
| 7 | Azote | 1500 |
| 8 | Oxyg??ne | 8800 |
| 9 | Fluor | 1 |
| 10 | N??on | 1400 |
| 11 | Sodium | 24 |
| 12 | Magn??sium | 430 |
Du point de vue de la cosmologie, le fluor est relativement rare avec 400 ppb dans l'univers. Dans ??toiles, qui est ne importe quel atome de fluor cr???? est ??limin??e rapidement par la fusion nucl??aire: soit avec l'hydrog??ne pour former de l'oxyg??ne et de l'h??lium, ou avec de l'h??lium pour faire n??on et d'hydrog??ne. La pr??sence de fluor du tout-en dehors de l'existence temporaire ??toiles-est un peu un myst??re en raison de la n??cessit?? d'??chapper ?? ces r??actions de fluor-d??truire.
Trois solutions th??oriques au myst??re existent. En supernovae de type II, les atomes de n??on sont frapp??s par neutrinos lors de l'explosion et converti en fluor. En ??toiles Wolf-Rayet (??toiles bleues plus de 40 fois plus lourd que le Soleil), un vent solaire souffle fort du fluor sur l'??toile avant que l'hydrog??ne ou l'h??lium peut d??truire. En Branche g??ante asymptotique (un type de g??ante rouge) ??toiles, les r??actions de fusion se produisent dans impulsions et convection soul??ve fluor sur l'??toile int??rieure. Seule l'hypoth??se de g??ante rouge a preuves ?? l'appui des observations.
Dans l'espace, le fluor associe couramment avec de l'hydrog??ne pour former du fluorure d'hydrog??ne. (Ce compos?? a ??t?? sugg??r??e comme un proxy pour permettre le suivi des r??servoirs d'hydrog??ne dans l'univers.) En plus de HF, le fluor monoatomique a ??t?? observ?? dans le milieu interstellaire. Fluor cations ont ??t?? observ??s dans les n??buleuses plan??taires et dans les ??toiles, y compris notre Soleil
Sur Terre
Le fluor est l'??l??ment le plus commun treizi??me dans la cro??te terrestre, comprenant entre 600 et 700 ppm de la cro??te en masse. En raison de sa r??activit??, ce est essentiellement seulement trouv?? dans les compos??s. Trois min??raux exister qui sont des sources pertinentes pour l'industrie: fluorite, fluorapatite, et cryolithe.
- Fluorite (CaF 2), ??galement appel?? le spath fluor ou de Blue John, est la principale source de fluor commerciale. La fluorite est un min??ral color?? associ??e ?? des d??p??ts hydrothermaux. Il est courant et a trouv?? dans le monde entier. La Chine fournit plus de la moiti?? de la demande mondiale; Le Mexique est le deuxi??me plus grand producteur. Les ??tats-Unis a produit la plupart de la fluorite dans le monde au d??but du 20e si??cle, mais la derni??re mine, dans l'Illinois, ferm?? en 1995.
- Fluorapatite (Ca 5 (PO 4) 3 F) est extrait en m??me temps que les autres apatites pour son la teneur en phosphate et est principalement utilis?? pour la production d'engrais. La plupart du fluor de la Terre est li?? en ce min??ral, mais parce que le pourcentage dans le min??ral est faible (3,5%), le fluor est jet?? comme un d??chet. Seulement aux ??tats-Unis est-il reprise significative. Il le hexafluorosilicates produits comme sous-produits sont utilis??s pour fournir la fluoration de l'eau municipale.
- Cryolite (Na 3 AlF 6) est le moins abondant des trois, mais est une source concentr??e de fluor. Il ??tait autrefois utilis?? directement dans la production d'aluminium. Cependant, la principale mine commerciale, sur la c??te ouest du Groenland, ferm?? en 1987.
| Principaux min??raux contenant du fluor | ||
 |  |  |
| Fluorine | Fluorapatite | Cryolite |
Plusieurs autres min??raux, tels que la pierre pr??cieuse topaze, contiennent du fluorure. Fluorure ne est pas significatif dans l'eau de mer ou de saumures, contrairement ?? l'autre halog??nures, comme les fluorures alcalino-terreux pr??cipitent hors de l'eau.
Organofluorines ont ??t?? observ??es dans les ??ruptions volcaniques et les sources g??othermiques. Leur origine ultime est dit varier de formation physique dans des conditions g??ologiques de parapher la production biologique et d??p??t dans les s??diments. Cependant, la provenance est encore ?? l'??tude, comme ce est la distribution organofluor?? naturel. Ils ne sont pas trouv??s dans de grandes quantites (comparez aussi le nombre de organofluorines naturels connus, 30, ?? celle de compos??s organochlor??s, 2150), de sorte qu'ils ne sont pas commercialement importante source de fluor.
La possibilit?? de petites quantit??s de fluor gazeux dans les cristaux a ??t?? d??battue depuis de nombreuses ann??es. Une forme de fluorite, antozonite, a une odeur suggestive de fluor quand on les ??crase. Le min??ral a aussi une couleur noir fonc??, peut-??tre de calcium libre (non li?? au fluorure). En 2012, une ??tude a rapport?? la d??tection de traces (0,04% en poids) de fluor diatomique antozonite. Il a ??t?? sugg??r?? que le rayonnement des petites quantit??s d'uranium dans les cristaux avaient caus?? le fluor libre d??fauts.
Histoire

Le mot "fluor" d??rive de la tige latine de la principale source min??rale, fluorite, qui a ??t?? d'abord mentionn?? en 1529 par Georgius Agricola, qui l'a d??crit comme un flux-un additif qui permet de minerais ?? l'??tat fondu et les scories pendant la fusion. Fluorite pierres ont ??t?? appel??s dans les schone Flusse allemande de l'??poque. Agricola, ??crit en latin, mais d??crivant l'industrie du 16??me si??cle, a invent?? plusieurs centaines de nouveaux termes latins. Pour les pierres schone de Fl??sse, il a utilis?? les fluo nominaux latine, "flux", parce qu'ils ont fait minerais m??talliques flux Lorsque dans un incendie. Apr??s Agricola, le nom pour le min??ral a ??volu?? pour spath fluor (encore couramment utilis??e), puis ?? la fluorite.
Certaines sources affirment que la premi??re production d'acide fluorhydrique ??tait par Heinrich Schwanhard, un coupeur de verre allemand, en 1670. Une ??tude r??vis??e par des pairs des ??crits de Schwanhard, cependant, ne ont montr?? aucune mention sp??cifique de la discussion fluorite et seulement d'un acide tr??s fort. Il a ??t?? ??mis l'hypoth??se qu'il se agissait probablement de l'acide nitrique ou l'eau r??gale, tous deux capables de gravure sur verre doux. Andreas Sigismund Marggraf a enregistr?? la premi??re pr??paration de l'acide fluorhydrique en 1764 quand il a chauff?? la fluorine avec de l'acide sulfurique en verre, qui a ??t?? fortement corrod?? par le produit. En 1771, le chimiste su??dois Carl Wilhelm Scheele r??p??t?? cette r??action. Scheele a reconnu le produit de la r??action comme un acide, qu'il a appel?? "Fluss-gu??tres-Syran" (spath fluor ?? l'acide); en anglais, il ??tait connu comme "l'acide fluorhydrique". En 1810, le physicien fran??ais Andr??-Marie Amp??re a sugg??r?? que l'acide ??tait un compos?? d'hydrog??ne, avec un ??l??ment inconnu, analogue au chlore. Fluorine a ensuite ??t?? montr?? pour ??tre essentiellement compos?? de fluorure de calcium.
Sir Humphry Davy origine a sugg??r?? le nom de fluor, prenant la racine du nom de "l'acide fluorhydrique?? et le suffixe -ine, similaire ?? d'autres halog??nes. Ce nom, avec des modifications, est venu ?? la plupart des langues europ??ennes. (Grec, russe, et plusieurs autres langues utilisent le nom ftor ou des d??riv??s, qui a ??t?? sugg??r?? par Amp??re et provient de la φθόριος grec (de phthorios), ce qui signifie ??destructrice??.) Le nom New latine (de fluorum) a donn?? l'??l??ment son symbole actuel , F, bien que le symbole Fl est vu au d??but de papiers. Le symbole Fl est maintenant utilis?? pour la super-lourds ??l??ment Fl??rovium .
En raison de son extr??me r??activit??, fluor ??l??mentaire n'a pas ??t?? isol?? que de nombreuses ann??es apr??s la caract??risation de la fluorite. Progr??s ?? isoler le fluor ??l??mentaire a ??t?? lente parce que son ??lectrolytique pr??paration a ??t?? difficile ?? faire, et parce que le gaz r??agit avec la plupart des mat??riaux. La g??n??ration de fluor ??l??mentaire se est av??r??e exceptionnellement dangereuse, tuant ou aveuglante plusieurs premiers exp??rimentateurs. Jean Dussaud r??f??rence ?? ces hommes comme des ??martyrs de fluor??, un terme encore utilis??.
Edmond Fr??my pensait que passer un courant ??lectrique ?? travers l'acide fluorhydrique pur pourrait fonctionner. Auparavant, le fluorure d'hydrog??ne ne ??tait disponible dans une solution aqueuse. Fr??my donc mis au point un proc??d?? de production de fluorure d'hydrog??ne anhydre en acidifiant bifluorure de potassium (KHF 2). Malheureusement, le fluorure d'hydrog??ne pur ne est pas pass?? un courant ??lectrique.

Chimiste fran??ais Henri Moissan, autrefois l'un des ??l??ves de Fr??my, a continu?? la recherche. Apr??s avoir essay?? de nombreuses approches diff??rentes, il a construit la tentative ant??rieure de Fr??my en combinant bifluorure de potassium et de fluorure d'hydrog??ne. La solution r??sultante men??e ??lectricit??. Moissan ??galement construit ??quipements sp??cialement r??sistant ?? la corrosion: r??cipients fabriqu??s ?? partir d'un m??lange de platine et d'iridium (plus chimiquement r??sistant que le platine pur) avec des bouchons de fluorine. Apr??s 74 ann??es d'efforts d??ploy??s par de nombreux chimistes, le 26 Juin 1886, Moissan rapport?? l'isolement du fluor ??l??mentaire. Le rapport de Moissan ?? l'Acad??mie fran??aise de faire le fluor a montr?? appr??ciation pour l'exploit:
On peut en effet faire diverses hypoth??ses sur la nature du gaz lib??r??; le plus simple serait que nous sommes en pr??sence de fluor
Moissan tard con??u un appareil moins co??teux pour la fabrication de fluor: ??quipements de cuivre rev??tu de fluorure de cuivre. En 1906, deux mois avant sa mort, Moissan a re??u le prix Nobel de chimie pour son isolement de fluor ainsi que l'invention de la Four ?? arc ??lectrique.
Pendant les ann??es 1930 et 1940, les Soci??t?? DuPont commercialis?? compos??s organofluor??s ?? grande ??chelle. Apr??s des essais de chlorofluorocarbures que les r??frig??rants par des chercheurs General Motors, DuPont a d??velopp?? la production ?? grande ??chelle de Fr??on-12. DuPont et GM ont form?? une coentreprise en 1930 pour commercialiser le nouveau produit; en 1949 DuPont a repris l'entreprise. Fr??on se est av??r?? ??tre un succ??s de march??, rapidement remplacer plus t??t, plus toxique, r??frig??rants et croissante du march?? global pour les r??frig??rateurs de cuisine.
En 1938, le polyt??trafluoro??thyl??ne (t??flon) a ??t?? d??couvert par hasard par un doctorat DuPont r??cemment embauch??, Roy Plunkett. En travaillant avec un cylindre de t??trafluoro??thyl??ne, il ??tait incapable de lib??rer le gaz, bien que le poids ne avait pas chang??. Raclant le conteneur, il a trouv?? flocons blancs d'un un polym??re, nouveau dans le monde. Les tests ont montr?? la substance ??tait r??sistant ?? la corrosion de la plupart des substances et avait une meilleure stabilit?? de la temp??rature ??lev??e que tout autre plastique. Au d??but de 1941, un programme d'urgence faisait quantit??s commerciales.

Productions ?? grande ??chelle de fluor ??l??mentaire ont commenc?? pendant la Seconde Guerre mondiale. Allemagne a utilis?? l'??lectrolyse ?? haute temp??rature pour produire des tonnes de le trifluorure de chlore, d'un compos?? pr??vu pour ??tre utilis?? comme un incendiaire. Le Projet Manhattan aux Etats-Unis ont produit encore plus de fluor pour une utilisation dans s??paration de l'uranium. Gazeux l'hexafluorure d'uranium a ??t?? utilis?? pour s??parer l'uranium-235, une importante nucl??aire explosive, de la plus lourde l'uranium-238 en centrifugeuses et usines de diffusion. Parce que l'hexafluorure d'uranium lib??re de petites quantit??s de fluor corrosifs, les usines de s??paration ont ??t?? construites avec des mat??riaux sp??ciaux. Tous les tuyaux ont ??t?? rev??tus de nickel; les articulations et les parties flexibles sont fabriqu??s ?? partir de Teflon.
En 1958, un gestionnaire de la recherche dans l'entreprise DuPont Teflon, Bill Gore, a quitt?? la soci??t?? en raison de son unwillingess de d??velopper l'isolation t??flon fil rev??tement. Le fils de Gore Robert trouv?? un proc??d?? permettant de r??soudre le probl??me fil de rev??tement et la soci??t?? WL Gore and Associates est n??. En 1969, Robert Gore a d??velopp?? une membrane PTFE expans?? qui a conduit ?? la grande Gore-tex affaires en v??tements imperm??ables respirant. La soci??t?? a d??velopp?? de nombreuses autres utilisations de PTFE.
Dans les ann??es 1970 et 1980, les pr??occupations d??velopp??s sur le r??le chlorofluorocarbones jouent dans l'endommager couche d'ozone. En 1996, presque toutes les nations avaient interdit r??frig??rants chlorofluorocarbones et la production commerciale cess??. Fluor a continu?? ?? jouer un r??le dans la r??frig??ration si: hydrochlorofluorocarbones (HCFC) et hydrofluorocarbones (HFC) ont ??t?? d??velopp??s comme r??frig??rants de remplacement.
Industrie et applications
Le march?? mondial des produits chimiques fluor??s ??tait d'environ 16 milliards de dollars par ann??e ?? compter de 2006. Historiquement, l'industrie a connu une croissance de quelques pour cent par an et est pr??vu de le faire dans l'avenir. Bien que la demande fluor?? contract??e pendant la r??cession mondiale de 2008-2009, l'industrie a ??t?? pr??dit pour atteindre 2,6 millions de tonnes par an d'ici 2015.
Le plus grand march?? est aux ??tats-Unis. Europe de l'Ouest est le deuxi??me plus grand. Asie-Pacifique est la r??gion la plus forte croissance de la production. La Chine en particulier a connu une croissance importante en tant que march?? fluor?? et devenir un producteur d'eux ainsi.
Mini??re fluorite (la principale source de fluor) a ??t?? estim?? en 2003 ?? ??tre une industrie $ 550,000,000, extraire 4,5 millions de tonnes par an. La plupart des minerais doivent ??tre trait??es de concentrer la fluorite des autres min??raux par divers proc??d??s de s??paration par flottation. Cependant, seulement environ 1% de la fluorite extrait est jamais converti en fluor ??l??mentaire.

Les fluorures inorganiques
Fluorite extrait est s??par?? en deux cat??gories principales, avec une production ?? peu pr??s ??gale de chaque Acidspar est au moins 97% CaF 2;. Metspar est la puret?? beaucoup plus faible, de 60 ?? 85%. (Une petite quantit?? de l'interm??diaire, la c??ramique, la qualit?? est ??galement faite.)
Metspar est utilis?? presque exclusivement pour la fonte du fer. Acidspar est principalement converti en acide fluorhydrique (par r??action avec de l'acide sulfurique). Le HF r??sultante est principalement utilis?? pour produire organofluorides et cryolithe synth??tique.
Environ 3 kg (6,5 lb) de fluorine de qualit?? metspar, ajout??s directement au lot, sont utilis??s pour chaque tonne d'acier fait. Les ions fluorure de CaF 2 inf??rieure de la temp??rature de la masse fondue et viscosit?? (faire le runnier liquide). La teneur en calcium a un avantage tangentiel pour ??liminer le soufre et le phosphore, mais d'autres additifs tels que la chaux sont encore n??cessaires. Metspar est similaire utilis?? dans la production de fonte et d'autres alliages contenant du fer.
Fluorine de la note acidspar est utilis?? directement comme additif pour des c??ramiques et des ??maux, des fibres de verre et verre opacifi?? et le ciment, ainsi que dans le rev??tement ext??rieur de baguettes de soudage. Acidspar est principalement utilis?? pour la fabrication de l'acide fluorhydrique, qui est un produit chimique interm??diaire pour la plupart des compos??s contenant du fluor. Usages directs importants de HF comprennent d??capage (nettoyage) de l'acier, craquage des alcanes dans l'industrie p??trochimique, et la gravure du verre.

Un tiers des HF (un sixi??me de fluor extrait) est utilis?? pour faire cryolithe synth??tique ( hexafluoroaluminate de sodium) et le trifluorure d'aluminium. Ces compos??s sont utilis??s dans l'??lectrolyse de l'aluminium. Environ 23 kg (51 lb) sont n??cessaires pour chaque tonne d'aluminium. Ces compos??s sont ??galement utilis??s comme un flux de verre.
Fluorosilicates sont les prochaines fluorures inorganiques les plus importants form??s ?? partir de HF. La plus courante, celle du sodium, est utilis?? pour la fluoruration de l'eau, comme interm??diaire pour la synth??se de la cryolite et du t??trafluorure de silicium, et pour le traitement des effluents dans les blanchisseries.
MgF 2 et, dans une moindre mesure, d'autres difluorures alcalino-terreux sont des mat??riaux optiques sp??cialis??s. Difluorure de magn??sium est largement utilis?? comme un rev??tement antireflet pour les lunettes et l'??quipement optique. Le compos?? est ??galement un composant nouvellement ??labor??s dans les constructions ( m??tamat??riaux d'index n??gatives) qui font l'objet de la recherche "d'invisibilit??". Les structures en couches peut courbe de lumi??re autour des objets.
D'autres fluorures inorganiques faites en grandes quantit??s comprennent difluorure de cobalt (pour la synth??se de organofluor??), le nickel difluorure (??lectronique), le fluorure de lithium (un flux), le fluorure de sodium (la fluoration de l'eau), le fluorure de potassium (flux), et du fluorure d'ammonium (divers). Le sodium et le potassium bifluorures sont importants pour l'industrie chimique.
Fluorocarbones
Faire fluorures organiques est la principale utilisation de l'acide fluorhydrique, consommant plus de 40% de celui-ci (plus de 20% de tous fluorite extrait). Dans organofluorides, gaz r??frig??rants sont encore le segment dominant, consommant environ 80% de HF. M??me si les chlorofluorocarbures sont largement interdits, les r??frig??rants de remplacement sont souvent d'autres mol??cules fluor??es. Les fluoropolym??res sont moins d'un quart de la taille des gaz r??frig??rants en termes d'utilisation de fluor, mais se d??veloppent plus rapidement. Fluor??s sont un petit segment de la masse, mais sont importants sur le plan ??conomique en raison des prix tr??s ??lev??s.
Les gaz frigorig??nes
Traditionnellement, les chlorofluorocarbures (CFC) ??taient le produit chimique organique fluor?? pr??dominante. Les CFC sont identifi??s par un syst??me de num??rotation qui explique la quantit?? de fluor, de chlore, de carbone et de l'hydrog??ne dans les mol??cules. Le terme Fr??on a ??t?? famili??rement utilis?? pour les CFC et les mol??cules halog??nes similaires, bien que strictement parlant ce est juste un nom de marque DuPont, et de nombreux autres producteurs existe. Marque une terminologie neutre est d'utiliser "R" comme pr??fixe. CFC ??minents inclus R-11 ( trichlorofluorom??thane), le R-12 ( dichlorodifluorom??thane), et le R-114 ( 1,2-dichlorot??trafluoro??thane).

La production de CFC a fortement augment?? dans les ann??es 1980, principalement pour la r??frig??ration et la climatisation, mais aussi pour les propulseurs et solvants. Depuis l'utilisation finale de ces mat??riaux est interdit dans la plupart des pays, cette industrie a diminu?? de fa??on spectaculaire. En ce d??but de 21e si??cle, la production de CFC ??tait inf??rieure ?? 10% du milieu des ann??es 1980 de pointe, avec le reste de l'utilisation principalement comme interm??diaire pour d'autres produits chimiques. L'interdiction des CFC initialement d??prim?? la demande globale de fluorite mais 21e si??cle la production de la source min??rale a retrouv?? son niveau des ann??es 1980.
Hydrochlorofluorocarbones (HCFC) et les hydrofluorocarbures (HFC) servent d??sormais de remplacements pour les r??frig??rants CFC; quelques-uns ont ??t?? fabriqu??es commercialement avant 1990. Actuellement, plus de 90% de fluor utilis?? pour les produits biologiques va dans ces deux classes (en quantit??s ?? peu pr??s ??gales). HCFC importants incluent R-22 ( chlorodifluorom??thane) et le R-141b ( 1,1-dichloro-1-fluoro??thane). Le HFC principal est le R-134a ( Le 1,1,1,2-t??trafluoro??thane).
Un bromofluoroalkane, "halon" ( bromotrifluorom??thane) est encore largement utilis?? dans navires et des a??ronefs gazeux syst??mes d'extinction d'incendie. Parce que la production Halon a ??t?? interdite depuis 1994, les syst??mes sont tributaires des magasins avant l'interdiction et sur le recyclage.
Fluoropolym??res
Les polym??res fluor??s sont ?? moins de 0,1% de tous les polym??res produits en terme de poids. Ils sont plus chers et ont des taux de croissance sup??rieurs ?? la moyenne des polym??res. Comme d'environ 2006-2007, les estimations de la production mondiale de fluoropolym??re variaient de plus de 100 000 ?? 180 000 tonnes m??triques par ann??e. Les estimations annuelles de revenus allaient de plus de 2,5 milliards de dollars ?? plus de 3,5 milliards de dollars.
PTFE (polyt??trafluoro??thyl??ne) est de 60-80% de la production de polym??re fluor?? dans le monde sur une base de poids. Le terme est parfois utilis?? Teflon g??n??rique de la substance, mais est une marque DuPont producteurs de PTFE nom-autre existent et DuPont utilise parfois la marque T??flon pour les autres mat??riaux. PTFE tire son fluor sans qu'il soit n??cessaire pour le gaz de fluor: chloroforme (trichlorom??thane) est trait??e avec HF pour faire chlorodifluorom??thane (R-22, HFC); ce produit chimique lors marques chauff??es t??trafluoro??thyl??ne (TFE abr??g??), le point de d??part de PTFE.
La plus grande demande de PTFE est en l'isolation ??lectrique. Ce est un excellent di??lectrique et chimiquement tr??s stable. Il est ??galement largement utilis??e dans l'industrie des proc??d??s chimiques o?? la r??sistance ?? la corrosion est n??cessaire: dans les tuyaux de rev??tement, dans des tubes, et joints. Une autre utilisation majeure est tissu architectural (fibre de verre de tissu recouvert de PTFE utilis?? pour les toits des stades et autres). La principale application du consommateur est ustensiles antiadh??sifs.
| Les principales applications de PTFE | ||
 |  |  |
| PTFE di??lectrique s??parant base et m??tallique ext??rieure dans un c??ble coaxial sp??cialit?? | Premi??re marque Teflon po??le, 1961 | L'int??rieur de la Tokyo Dome. Le toit est en fibre de verre rev??tus de PTFE et gonflable. |
Lorsque ??tir?? avec une secousse, films de PTFE rend une amende pores Membrane: PTFE expans?? ( ePTFE). Le terme ??Gore-tex?? est parfois utilis?? de mani??re g??n??rique pour ce mat??riau, mais ce est un nom de marque sp??cifique. WL Gore ne est pas le seul producteur de ePTFE et en outre "Gore-tex" se r??f??re souvent ?? plus compliqu??e membranes multicouches ou tissus lamin??s. ePTFE est utilis?? dans les v??tements de pluie, v??tements de protection et de liquides et des filtres ?? gaz. PTFE peut ??galement ??tre form?? en des fibres qui sont utilis??s dans pomper l'emballage (phoques) etfiltres sac des maisons pour les industries avec les échappements corrosifs.
Autres polymères fluorés ont tendance à avoir des propriétés similaires à résistance chimique PTFE-élevée et de bonnes propriétés diélectriques, qui conduit à utiliser dans l'industrie des procédés chimiques et de l'isolation électrique. Ils sont plus faciles à travailler avec (pour former dans des formes complexes), mais sont plus chers que PTFE et avoir une stabilité thermique plus faible. éthylène propylène fluoré (FEP) est la deuxième fluoropolymère le plus produit. Films de deux polymères fluorés différents servent de verre-remplacements dans les cellules solaires.

Fluorés ionomères sont des matériaux coûteux, résistants aux produits chimiques utilisés comme membranes dans certaines cellules électrochimiques. Nafion, développés dans les années 1960, a été le premier exemple et demeure le matériau le plus important dans la classe. La demande initiale était Nafion comme un matériau de pile à combustible dans les vaisseaux spatiaux. Depuis lors, le matériau a été de transformer les 55 millions de tonnes par an industrie du chlore-alcali; il remplace les cellules à base de mercure dangereux avec des cellules membranaires qui sont aussi plus économes en énergie. Alors que les centrales plus anciennes de la technologie continuent de courir, de nouvelles usines utilisent typiquement des cellules membranaires. En 2002, plus d'un tiers de la capacité mondiale de l'industrie était à la membrane cellulaire en fonction. Récemment, la demande de pile à combustible a réapparu; recherche important est en cours et les investissements effectués liés à l'obtention des cellules à membrane échangeuse de protons (PEM) de carburant dans les véhicules.
Elastomères fluorés sont des substances de type caoutchouc qui sont composés de mélanges de polymères fluorés réticulés. Viton est un exemple bien connu. Résistant aux produits chimiques joints toriques sont la principale application. Fluoroélastomères ont tendance à être plus rigides que des élastomères conventionnels, mais avec une résistance chimique et thermique supérieure.
Tensioactifs

Tensioactifs fluorés sont de petites molécules organiques fluorés, utilisés principalement dans DWR (déperlant durable). Fluorés forment un grand marché, plus de 1 milliard de dollars par an à partir de 2006. Scotchgard est une marque de premier plan, avec plus de 300 millions de dollars de recettes en 2000. Les tensioactifs fluorés sont des produits chimiques coûteux, comparables à des produits chimiques pharmaceutiques: 200-2000 $ par kilogramme (90 à 900 $ la livre ).
Fluorés font une très petite partie de l' ensemble du marché de surfactant, la plupart de ce qui est à base d'hydrocarbure et beaucoup moins cher. Certaines applications potentielles (par exemple des peintures à faible coût) sont incapables d'utiliser fluorés en raison de l'impact de prix de compoundage même de petites quantités de fluoré. Utilisation dans les peintures était seulement d'environ 100 millions de dollars de 2006.
DWR est une finition (revêtement très mince) mis sur les tissus qui les rend légèrement la pluie résistant, qui fait eau perle. D'abord développé dans les années 1950, fluorés étaient de 90% de l'industrie en 1990. DWR DWR est utilisé avec des tissus de vêtements, tapis, et les emballages alimentaires. DWR est appliquée aux tissus par "immersion-compression-dry" (immersion dans un bain DWR-eau, l'eau sous pression sur, puis séchage).
Le gaz fluoré
Pour les pays ayant des données disponibles (les pays de marché libre), environ 17.000 tonnes de fluor sont produites par an par 11 entreprises, toutes G7-résident. Le fluor est relativement peu coûteux, coûtant environ US $ 5-8 par kilogramme (2-4 $ la livre) lorsqu'il est vendu sous forme d'hexafluorure d'uranium ou de l'hexafluorure de soufre. En raison des difficultés de stockage et de manutention, le prix du gaz de fluor pur est beaucoup plus élevé. Processus exigeant de grandes quantités de gaz de fluor généralement intégrer verticalement et produisent du gaz sur place pour une utilisation directe.
La plus grande demande de fluor élémentaire est la préparation d'hexafluorure d'uranium, qui est utilisé dans la production de combustibles nucléaires. Pour obtenir le composé, de dioxyde d'uranium est d'abord traité avec de l'acide fluorhydrique pour produire le tétrafluorure d'uranium. Ce composé est ensuite fluoré par exposition directe au fluor gaz pour faire l'hexafluorure. Phénomène naturel monoisotopique de fluor rend utile dans l'enrichissement d'uranium, car les molécules d'hexafluorure d'uranium seront une différence de masse seulement à cause de différences de masse entre l'uranium 235 et l'uranium-238. Ces différences de masse sont utilisés pour séparer l'uranium 235 et de l'uranium 238 par l'intermédiaire de la diffusion et la centrifugation. Jusqu'à 7000 tonnes par an de fluor gazeux sont utilisés pour cette application.

La deuxième plus grande demande pour le gaz de fluor est l'hexafluorure de soufre, qui est utilisé comme milieu diélectrique dans les stations de commutation à haute tension. SF 6 gaz a une rigidité diélectrique beaucoup plus élevé que l'air. Il est extrêmement inerte et, par rapport à l'appareillage rempli d'huile, n'a pas de PCB (un produit chimique dangereux). L'hexafluorure de soufre est également utilisé dans des fenêtres insonorisées, dans le secteur de l'électronique, ainsi que les applications médicales et militaires niche. Le composé peut être faite sans l'aide de gaz de fluor, mais la réaction entre le soufre pur et du fluor gazeux pur, d'abord développé par Moissan, reste la pratique commerciale. Environ 6.000 tonnes par an de gaz de fluor sont consommés.
Plusieurs composés à base de fluor élémentaire servent l'industrie de l'électronique. Rhénium et de tungstène hexafluorures sont utilisés pour le dépôt chimique en phase vapeur de films minces métalliques sur les semi-conducteurs. Tétrafluorométhane, est utilisé pour la gravure par plasma à semi-conducteurs de fabrication, plat production de panneau d'affichage, et les systèmes microélectromécaniques fabrication. trifluorure d'azote est de plus en plus utilisés pour le nettoyage du matériel à des usines de fabrication d'affichage . Fluor élémentaire, elle-même, est parfois utilisé pour le nettoyage du matériel.
Pour faire organofluorines de niche et de produits pharmaceutiques contenant du fluor, fluoration directe est généralement trop difficile à contrôler. Préparation de fluorinators de résistance intermédiaires à partir du gaz de fluor résout ce problème. L'halogène fluorures ClF 3 , BrF 3 et SI 5 fournir fluoration doux, avec une série de points forts. Ils sont également plus faciles à manipuler. Le tétrafluorure de soufre est utilisé notamment pour la fabrication Pharmacueticals fluorés.
États-Unis et scientifiques de l'espace soviétique au début des années 1960 ont étudié fluor élémentaire comme un possible propulseur de fusée en raison de la plus élevée impulsion spécifique générée lorsque le fluor remplacé l'oxygène dans la combustion. Les expériences ont échoué parce que le fluor avéré difficile à manipuler, et de son produit de combustion (typiquement de fluorure d'hydrogène) était extrêmement toxique et corrosif.
La production de gaz de fluor

Les producteurs commerciaux de fluor gazeux continuent à utiliser la méthode de l'électrolyse au point par Moissan, avec quelques modifications dans la conception de la cellule. En raison de la corrosivité du gaz, matériaux de confinement spéciales et précautions d'emploi sont nécessaires. Voies chimiques à la forme élémentaire ont été publiés en 1986.
Synthèse électrolytique
Plusieurs milliers de tonnes de fluor élémentaire sont produites annuellement par électrolyse de bifluorure de potassium dans du fluorure d'hydrogène. Formes de bifluorure de potassium spontanément à partir de fluorure de potassium et le fluorure d'hydrogène:
- HF + KF ??? KHF2
Un mélange ayant la composition approximative KF ??? 2HF fondant à 70 ° C (158 ° F) et est électrolysée entre 70 ° C et 130 ° C (160-265 ° F). Bifluorure de potassium augmente la conductivité électrique de la solution et fournit l'anion bifluorure, ce qui libère du fluor à l'anode (la partie négative de la cellule). Si HF seul est électrolysée, des formes d'hydrogène à la cathode (partie positive de la cellule) et les ions fluorures restent en solution. Après l'électrolyse, le fluorure de potassium reste en solution.
- 2 HF2 -??? H2+ F ???2??? + 2 F-
Plusieurs autres aspects biologiques de fluor existent. Le fluorure est largement utilisé pour la prévention des caries dentaires. Dans le secteur pharmaceutique et l'agrochimie, le fluor voit utilisation croissante dans les nouvelles molécules. Poisons contenant du fluor sont bien connues pour tuer les insectes et les rongeurs et les très rares organismes qui intègrent fluor dans leur biochimie faire pour faire en sorte poisons naturels. Les deux isotopes radioactifs de fluor et naturels sont importants dans les applications de numérisation respectifs. perfluorocarbures porteurs d'oxygène présentent une possibilité pour l'homme de la respiration liquide.
Soins dentaires
Ions fluorures dans le contact avec les dents ont été longtemps pensé pour limiter cavités en tournant la formation de la hydroxyapatite de dents en moins fluorapatite soluble. Les études les plus up-to-date de ne montrent aucune différence dans les niveaux de caries entre les dents avec l'émail fluorée à des degrés divers, tandis que les faibles niveaux de fluorure dans le liquide plaque et la salive font certainement aider à combattre les caries précoces. Le processus d'absorption de fluorure ne fonctionne que par contact direct ( de traitement topique). Ions fluorure qui sont avalés ne bénéficient pas les dents.

La fluoration de l'eau est la plus contrôlée de fluorure à un approvisionnement public en eau pour réduire la carie dentaire. Son utilisation a commencé dans les années 1940, après des études d'enfants dans une région où l'eau est fluorée naturellement. Il est maintenant utilisé pour environ les deux tiers de la population des États-Unis sur les systèmes publics de l'eau et pour environ 5,7% de la population mondiale. Bien que la meilleure preuve disponible montre pas d'association avec des effets indésirables autres que la fluorose (dentaire et, dans le pire des cas, squelettiques), dont la plupart est doux, la fluoration de l'eau a été controversée pour l'éthique, la sécurité, et des raisons d'efficacité, et de l'opposition à la fluoration de l'eau existe en dépit de son soutien par les organismes de santé publique. Les avantages de la fluoration de l'eau ont diminué récemment, probablement en raison de la disponibilité de fluorure dans d'autres formes, mais sont encore mesurables, en particulier pour les groupes à faible revenu. Les revues systématiques en 2000 et 2007 a ??????montré une réduction significative de cavités dans les enfants associés à la fluoration de l'eau.
Le fluorure de sodium, de l'étain difluorure, et, le plus souvent, le monofluorophosphate de sodium, sont utilisés dans dentifrice. En 1955, le premier dentifrice au fluorure a été introduit, aux États-Unis. Maintenant, presque tous dentifrice dans les pays développés est fluorée. Par exemple, 95% de pâte dentifrice contenant du fluorure européen. Gels et mousses sont souvent conseillés pour les groupes de patients particuliers, en particulier ceux qui subissent une radiothérapie à la tête (de patients atteints de cancer). Le patient reçoit une demande de quatre minutes d'une grande quantité de fluorure. Vernis existent qui remplissent une fonction similaire, mais plus rapidement appliquée. Le fluorure est également contenue dans ordonnance et sans ordonnance et les bains de bouche est un composant de trace d'aliments fabriqués à partir de fluoration de l'eau.
Médicaments

Plusieurs produits pharmaceutiques importants contiennent du fluor. Parmi les médicaments commercialisés, déjà 20% contient un atome de fluor, comme un seul atome de celui-ci améliore la réactivité chimique de la molécule de médicament utilisé.
En raison de la grande stabilité de la liaison carbone-fluor, de nombreux médicaments sont fluoré à retarder leur métabolisme (en tournant dans une autre molécule, le procédé chimique sous-jacente est la façon dont les médicaments agissent). Cela prolonge leurs demi-vies et permet des temps plus longs entre le dosage et l'activation. Par exemple, un cycle aromatique peut ajouter à éviter le métabolisme d'un médicament, mais cela pose un problème de sécurité, car certains composés aromatiques sont métabolisés dans l'organisme en toxiques époxydes par l'organisme de natif enzymes. substituant un atome de fluor dans un para la position, cependant, protège le noyau aromatique et empêche l'époxyde de se produire.
Ajout de fluor organiques biologiquement actives augmente leur caractère lipophile (capacité à se dissoudre dans les graisses), parce que la liaison carbone-fluor est encore plus hydrophobe que la liaison carbone-hydrogène. Cet effet augmente souvent d'un médicament en raison de la biodisponibilité accrue pénétration de la membrane cellulaire. Bien que le potentiel du fluor à libérer un fluorure en tant que groupe partant dépend de sa position dans la molécule, organofluorides sont généralement très stables, étant donné que la liaison carbone-fluor est forte.
Fluor trouvent aussi leurs utilisations dans communs minéralocorticoïdes, une classe de médicaments qui augmentent la pression sanguine . Ajout d'un fluor augmente à la fois son pouvoir médical et les effets anti-inflammatoires. Contenant du fluor fludrocortisone est l'un de ces médicaments les plus communs. dexaméthasone et la triamcinolone, qui sont parmi les plus puissants de la synthèse liées corticostéroïdes classe de médicaments, contiennent du fluor ainsi.
Plusieurs généraux inhalésagents anesthésiques inhalés, y compris les agents les plus couramment utilisés, contiennent également du fluor. Des exemples comprennent sévoflurane,desflurane etl'isoflurane, qui sontdérivés hydrofluorocarbures.
Beaucoup Antidépresseurs ISRS sont organiques fluorés, y comprisle citalopram,l'escitalopram etla fluoxétine.fluoroquinolones sont une famille couramment utilisée deantibiotiques à large spectre.
 |  |  |  |
|---|---|---|---|
| Lipitor (atorvastatine) | 5-FU (fluorouracile) | Florinef (Fludrocortisone) | Isoflurane |
L'agrochimie et poisons naturels

On estime que 30% des composés agrochimiques contiennent du fluor. La plupart d'entre eux sont des poisons, mais quelques-uns de stimuler la croissance à la place. La poursuite de l'utilisation de produits agrochimiques de fluor est dit compter sur l'amélioration de la réaction de synthèse (en abaissant les coûts soulevées par teneur en fluor) et le niveau de la chimie verte compte (fluorés sont plus respectueux de l'environnement).
Synth??tique fluoroacétate de sodium a été utilisé comme insecticide, mais est particulièrement efficace contre les parasites de mammifères. Le nom de «1080» se réfère au nombre de catalogue de poison, qui est devenu son nom de marque. Fluoracétate est similaire à l'acétate, qui a un rôle central dans le cycle de Krebs (un élément clé du métabolisme cellulaire). Fluoracétate stoppe le cycle et provoque des cellules d'être privé de l'énergie. Plusieurs autres insecticides contiennent du fluorure de sodium, qui est beaucoup moins toxique que le fluoroacétate. Actuellement, le composé est interdite. Un autre agrichemcial important est trifluraline. Il était une fois très important (par exemple, en 1998, plus de la moitié de la superficie des États-Unis de champ de coton a été revêtu avec les substances chimiques); cependant, ses propriétés cancérogènes suspectés causé certains pays d'Europe du Nord pour l'interdire en 1993. Actuellement, l'ensemble de l'Union européenne a elle interdit, mais il y avait un cas destiné à annuler la décision.
Les produits agrochimiques utilisés actuellement utilisent une autre tactique: au lieu d'être toxiques eux-mêmes, ils pénètrent dans le métabolisme de ne pas affecter directement, mais se transformer en composés toxiques effectivement. Par exemple, les insectes nourris de 29 fluorostigmasterol produire fluoroacétates d'elle. Si un atome de fluor est transférée vers une cellule du corps, il bloque le métabolisme à la position occupée.
Organofluorines biologiquement synthétisés ont été trouvés dans des micro-organismes et les plantes, mais pas chez les animaux. L'exemple le plus courant est fluoroacétate, avec une molécule de poison actif commerciale identique à "1080". Il est utilis?? en tant que défense contre les herbivores par au moins 40 plantes vertes en Australie, le Brésil et l'Afrique; d'autres organofluorines biologiquement synthétisés comprennent ??-fluoro acides gras , et la fluoro- 2-fluorocitrate. Chez les bactéries, l'enzyme adénosyl-synthase fluorure, ce qui rend la liaison carbone-fluor, a été isolé. La découverte a été présenté comme pouvant conduire à des itinéraires biologiques pour la synthèse organique fluoré.
Balayage

Composés contenant du fluor-18, un isotope radioactif qui émet des positons, sont souvent utilisés dans la tomographie par émission de positons (TEP), car la demi-vie de l'isotope de l'ordre de 110 minutes est longue par rapport aux normes positron-émetteur. Un tel produit radiopharmaceutique est le 2-désoxy-2- ( 18 F) fluoro-D-glucose (génériquement dénommés fludésoxyglucose), généralement abrégé en tant que 18 F-FDG, ou simplement FDG. Dans l'imagerie par TEP, FDG peut être utilisé pour asessing métabolisme du glucose dans le cerveau et pour l'imagerie de tumeurs cancéreuses. Après injection dans le sang, le FDG est absorbé par les tissus "FDG-avides" avec un besoin élevé de glucose, comme le cerveau et la plupart des types de tumeurs malignes. tomographie, souvent assisté par un ordinateur pour former un PET / CT (CT signifie) machine "de tomographie par ordinateur", peut alors être utilisée pour diagnostiquer ou surveiller le traitement de cancers, notamment la maladie de Hodgkin, cancer du poumon et le cancer du sein.
Fluor naturel est monoisotopique, composé uniquement de fluor-19. Les composés fluorés sont extrêmement sensibles à la résonance magnétique nucléaire (RMN), parce que le fluor-19 a un spin nucléaire de ½, un haut moment magnétique nucléaire, et un haut rapport gyromagnétique. Les composés fluorés ont typiquement une RMN rapide relaxation, ce qui permet l'utilisation d'étalement rapide pour obtenir un rapport signal-sur-bruit similaire à un atome d'hydrogène spectres RMN-1. Le fluor-19 est couramment utilisé dans l'étude RMN du métabolisme, les structures des protéines et des changements conformationnels. En outre, les gaz fluorés inertes ont le potentiel d'être un outil pas cher et efficace pour la ventilation imagerie du poumon.
recherche sur les transports de l'oxygène
Fluorocarbones liquides ont une très grande capacité pour la tenue de gaz en solution. Ils peuvent contenir plus d'oxygène ou de dioxyde de carbone que le sang fait. Pour cette raison, ils ont suscité l'intérêt en cours liée à la possibilité de sang artificiel ou de la respiration liquide.

substituts sanguins sont l'objet de recherches parce que la demande pour les transfusions sanguines croît plus vite que les dons. Dans certains scénarios, le sang artificiel peut être plus commode ou sécuritaire. Parce que les fluorocarbones ne se mélangent normalement pas avec de l'eau, ils doivent être mélangés dans des émulsions (petites gouttelettes d'hydrocarbure perfluoré en suspension dans l'eau) pour être utilisés comme du sang. Un tel produit, Oxycyte, a été à travers les premiers essais cliniques.
Utilisations médicales possibles de la respiration liquide (qui utilise un liquide de perflurocarbon pur, pas une émulsion d'eau) impliquent une assistance pour les bébés prématurés ou pour les victimes de brûlures (parce que la fonction pulmonaire normale est compromise). Les deux remplissage partiel des poumons et le remplissage complet des poumons ont été envisagées, bien que seul le premier a des tests significatifs chez les humains. Plusieurs tests sur les animaux ont été réalisées et certaines partielles essais de ventilation liquides humains. Un effort, par Alliance Pharmaceuticals, a atteint les essais cliniques, mais a été abandonné en raison de l'avantage insuffisant par rapport à d'autres thérapies.
Nanocristaux représentent une méthode possible de délivrer des médicaments solubles dans l'eau ou de graisse dans un fluide perfluoré. L'utilisation de particules est en cours d'élaboration pour aider les bébés traiter avec des poumons endommagés.
Autres applications postulées incluent plongée sous-marine et Voyage espace, les applications qui permettrait à la fois besoin d'une ventilation liquide totale, pas de ventilation partielle. Le film 1989 The Abyss a montré une utilisation fictive de perfluorocarbone pour la plongée humaine mais aussi filmé un vrai rat survivre tout refroidi et immergé dans perfluorocarbone. (Voir aussi liste des traitements fictifs de la respiration perfluorocarbone.)
Risques
fluor gazeux et ion fluorure

Fluor élémentaire est hautement toxique. Delà d'une concentration de 25 ppm, le fluor provoque une irritation importante tout en attaquant les yeux, les voies respiratoires, les poumons, le foie et les reins. A une concentration de 100 ppm, les yeux et le nez humains sont gravement endommagés.
Fluorures solubles sont modérément toxique. Pour fluorure de sodium, la dose létale pour les adultes est de 5 à 10 g, ce qui équivaut à 32 à 64 mg de fluorure élémentaire par kg de poids corporel. La dose qui peut conduire à des effets néfastes sur la santé est d'environ un cinquième de la dose létale. Consommation excessive chronique de fluorure peut conduire à la fluorose squelettique, une maladie des os qui affecte des millions en Asie et en Afrique.
L'ion fluorure est facilement absorbé par l'estomac et les intestins. Ingéré formes fluorure acide fluorhydrique dans l'estomac. Sous cette forme, le fluorure traverse les membranes cellulaires et se lie alors avec le calcium et interférer avec différentes enzymes. Le fluorure est excrété par l'urine. Les limites d'exposition au fluorure sont basées sur des tests d'urine qui a déterminé la capacité du corps humain pour se débarrasser de fluorure.
Historiquement, la plupart des cas d'empoisonnement au fluorure ont été causés par l'ingestion accidentelle d' insecticides contenant du fluorure inorganique, Actuellement, la plupart des appels aux centres antipoison pour possible empoisonnement au fluorure proviennent de l'ingestion de dentifrice contenant du fluorure. Dysfonctionnement des équipements de fluoration de l'eau a eu lieu à plusieurs reprises, y compris un incident de l'Alaska, qui a touché près de 300 personnes et tué un.
Acide hydrofluorique
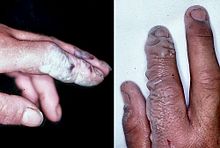
L'acide fluorhydrique est un poison de contact et doit être manipulé avec un soin extrême, bien au-delà qui est accordé à d'autres acides minéraux. En raison de sa moindre dissociation chimique dans l'eau (reste d'une molécule neutre), le fluorure d'hydrogène pénètre dans le tissu plus rapidement que les acides typiques. L'intoxication peut se produire facilement à travers l'exposition de la peau ou des yeux, ou en cas d'inhalation ou d'ingestion. Les symptômes de l'exposition à l'acide fluorhydrique peuvent ne pas être immédiatement évident, avec un retard de 8 heures, 50% de HF et jusqu'à 24 heures si la concentration est plus faible. Le fluorure d'hydrogène interfère avec la fonction nerveuse, ce qui signifie que les brûlures peuvent pas initialement être douloureux. Expositions accidentelles peuvent passer inaperçues, retarder le traitement et l'augmentation de l'étendue et de la gravité de la blessure. Si la brûlure a été initialement remarqué, puis HF doivent être lavés avec un puissant jet d'eau pour les dix à quinze minutes, pour empêcher sa pénétration dans le corps. Les vêtements utilisés par la personne brûlée peuvent aussi présenter un danger.
Une fois dans le sang, le fluorure d'hydrogène réagit avec le calcium et le magnésium, ce qui entraîne un déséquilibre électrolytique, l'arythmie cardiaque, et potentiellement, la mort. Formation de insoluble fluorure de calcium provoque éventuellement les deux une baisse de calcium sérique et la douleur associée à la forte toxicité tissulaire. Dans certains cas, les expositions peuvent conduire à une hypocalcémie. Burns, avec des zones de plus de 160 cm 2 (25 à 2 ) peuvent provoquer une toxicité systémique grave de toute interférence avec des niveaux sanguins de calcium et de tissus.
Exposition à l'acide fluorhydrique est souvent traitée avec du gluconate de calcium, une source de Ca 2+ qui se lie aux ions fluorure. brûlures de la peau peuvent être traitées avec un lavage à l'eau et du gel de gluconate de calcium à 2,5% ou solutions de rinçage spéciaux. Cependant, parce que HF est absorbé, le traitement médical est nécessaire; parfois l'amputation peut être nécessaire.
Les pr??occupations environnementales
Atmosph??re
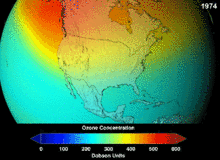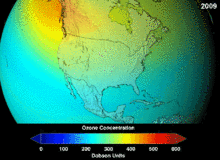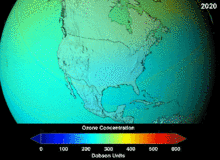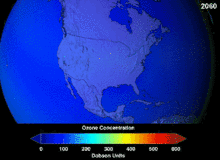
Les chlorofluorocarbures (CFC) et bromofluorocarbones (BFC) ont été strictement réglementée par une série d'accords internationaux, le Protocole de Montréal, car ils appauvrissent la couche d'ozone. Il est le chlore et le brome à partir de ces molécules qui causent un préjudice, pas de fluor. En raison de la stabilité inhérente de ces molécules entièrement halogénés (qui les rend si ininflammable et utile), ils sont en mesure d'atteindre la partie supérieure de l'atmosphère, avant de se décomposer, puis relâchez le chlore et le brome pour attaquer la couche d'ozone à ces altitudes. Les prédictions sont que les générations seront tenus, même après l'interdiction des CFC, pour ces molécules à quitter l'atmosphère et de la couche d'ozone pour récupérer. Les premières indications sont que l'interdiction des CFC travaille-couche d'ozone a cessé et la récupération est en cours.
Hydrochlorofluorocarbones (HCFC) sont des remplacements actuels des CFC; HCFC ont environ un dixième de l'ozone endommager potentiel (ODP) des CFC. Ils ont été initialement prévues pour l'élimination d'ici 2030 dans les pays développés (2040 en sous-développée). En 2007, un nouveau traité a été signé par presque toutes les nations à se déplacer jusqu'à ce que l'élimination progressive de dix ans parce que les HFC, qui ont pas de chlore et donc zéro ODP, sont disponibles. Pendant ce temps, les HCFC individuelles avec le plus fort potentiel de appauvrissant anti-ozone sont progressivement supprimées en premier. Par exemple, en 2003, le HCFC-141b a été supprimée aux Etats-Unis par la réglementation Environmental Protection Agency. Beaucoup d'autres HCFC sont maintenant produites à une fraction de leur taux de production antérieurs.
gaz de fluorocarbone de toutes sortes (CFC, HFC, etc.) sont à effet de serre d'environ 4000 à 10 000 fois plus puissant que le dioxyde de carbone. L'hexafluorure de soufre présente un effet encore plus forte, environ 20 000 fois le potentiel de réchauffement planétaire de dioxyde de carbone.
Biopersistance

En raison de la force de la liaison carbone-fluor, organofluorines endurent dans l'environnement. L'acide perfluorooctanoïque (PFOA) et l'acide perfluorooctane (SPFO), utilisé dans les sprays imperméabilisants, sont des contaminants mondiaux persistants. Des traces de ces substances ont été détectées dans le monde entier, des ours polaires de l'Arctique à la population humaine mondiale. Une étude indique que les niveaux de SPFO dans la faune commencent à descendre en raison de la récente réduction de la production de ce produit chimique.
La distribution tissulaire de l'APFO chez l'homme est inconnue, mais des études chez les rats suggèrent qu'il est susceptible d'être présent principalement dans le foie, les reins et le sang. Dans l'organisme, l'APFO se lie à une protéine, l'albumine de sérum; il a été détecté dans le lait maternel et le sang de nouveau-nés. PFOA est pas métabolisé par le corps, mais est excrété par les reins.
Les effets potentiels sur la santé de PFOA ne sont pas claires. Contrairement hydrocarbures chlorés, le PFOA est pas lipophile (stockées dans la graisse), ni (gènes nuisibles) génotoxiques. Bien que les deux PFOA et le PFOS causer le cancer en grandes quantités chez les animaux, des études sur les humains exposés ont pas été en mesure de prouver un impact à des expositions actuelles. Les grands dauphins sont parmi les concentrations de SPFO les plus élevées de toute la faune étudiée; une étude suggère un impact sur ??????leurs systèmes immunitaires.
Parce que les systèmes biologiques ne métabolisent pas facilement molécules fluorées, les produits pharmaceutiques fluorés (souvent des antibiotiques et antidépresseurs) sont parmi les principaux organiques fluorés présents dans les eaux usées traitées de la ville et des eaux usées. Agrochimiques contenant du fluor sont mesurables dans les terres agricoles et le ruissellement des rivières à proximité.
Compos??s

Seule commune de fluor état ??????d'oxydation est de -1. Avec d'autres atomes, des formes de fluor soit liaisons covalentes polaires ou des liaisons ioniques. Le plus souvent, des liaisons covalentes impliquant des atomes de fluor sont des liaisons simples, bien qu'il existe au moins deux exemples d'une obligation d'ordre supérieur. Le fluor peut agir comme un ligand de pontage entre les deux métaux dans certaines molécules complexes. Molécules contenant du fluor peuvent également présenter une liaison hydrog??ne. fluor a une chimie riche comprenant des composés inorganiques formés avec de l'hydrogène, les métaux, non-métaux, et même gaz nobles; ainsi que d'un ensemble diversifié de composés organiques.
Inorganique
Le fluorure d'hydrogène
| HF et H2similitudes S | |
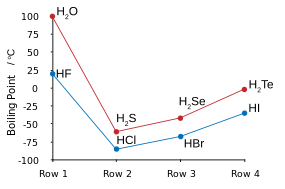 |  |
| Points d'ébullition des halogénures d'hydrogène (en bleu) et chalcogénures d'hydrogène (en rouge): HF et H2O tendances de pause. | Point de HF / H de congélation2des mélanges O: les flèches indiquent composés à l'état solide. |
Le fluor se combine avec l'hydrogène pour effectuer un composé (HF) appelé fluorure d'hydrogène ou, en particulier dans le contexte des solutions aqueuses, de l'acide fluorhydrique. Le type de liaison HF est l'un des rares capable de liaison hydrogène (créant des associations de clustering supplémentaires avec des molécules similaires). Cela influe sur divers aspects particuliers des propriétés de fluorure d'hydrogène. À certains égards, la substance se comporte plus comme de l'eau, également très sujettes à liaison hydrogène, que l'une des autres halogénures d'hydrogène tels que HCl.
Liaison hydrogène entre les molécules HF donne lieu à haute viscosité en phase liquide et inférieure à la pression prévue dans la phase gazeuse. Le fluorure d'hydrogène ne bout pas jusqu'à 20 ° C contrairement aux halogénures d'hydrogène les plus lourds qui bouillent entre -85 ° C et -35 ° C (-120 à 30 ° F). HF est complètement miscible avec l'eau (se dissout en toutes proportions), tandis que les autres halogénures d'hydrogène ont de grands écarts de solubilité à l'eau. Le fluorure d'hydrogène et l'eau forment également plusieurs composés à l'état solide, et plus particulièrement un mélange 1: 1 composé qui ne fond pas jusqu'à -40 ° C (-40 ° F), qui est de 44 degrés Celsius (79 degrés Fahrenheit) au-dessus du point de fusion de HF pur.
Contrairement à d'autres acides halohydriques, tels que l'acide chlorhydrique , l'acide fluorhydrique est seulement un acide faible en solution aqueuse, avec la constante de dissociation acide (pKa une ) est égale à 3,19. La faiblesse de HF comme un acide aqueuse est paradoxal envisage comment polaire la liaison HF est, beaucoup plus que le lien dans HCl, HBr ou HI. L'explication pour le comportement est compliqué, ayant à voir avec diverses tendances de la grappe de formation de HF, l'eau et l'ion fluorure, ainsi que les questions thermodynamiques. Au grandes concentrations, une propriété appelée homoconjugaison est révélé. HF commence à accepter des ions fluorure, en formant des ions polyatomiques (par exemple le bifluorure, HF -
2 ) et des protons, ce qui augmente considérablement l'acidité du composé. L'acide fluorhydrique est également le plus fort des acides halohydriques dans de l'acide acétique et des solvants similaires. Son potentiel d'acidité caché est également révélé par le fait qu'il protone acides tels que l'acide chlorhydrique, sulfurique, nitrique ou. Malgré sa faiblesse, l'acide fluorhydrique est très corrosif, attaquant même verre (hydraté seulement).
Fluorure d'hydrogène se dissout à sec à faible valence fluorures métalliques facilement. Plusieurs fluorures moléculaires se dissolvent également dans HF. De nombreuses protéines et de glucides peuvent être dissous dans HF sec et peuvent être récupérés à partir de cela. La plupart des produits chimiques inorganiques non-fluorure réagissent avec HF plutôt que de se dissoudre.
fluorures de métal
fluorures métalliques ont des similitudes avec d'autres halogénures de métaux, mais sont plus ionique. A bien des égards, les fluorures de métaux se distinguent des autres halogénures métalliques (chlorures, bromures, iodures), très semblables les uns aux autres. Au lieu de cela, les fluorures sont plus semblables aux oxydes, ayant souvent collage et cristal structures similaires.
Les fluorures métalliques montrent les grandes tendances sur la base de la charge du métal. Métaux dans un état ??????d'oxydation +3 ou plus bas ont tendance à former des fluorures ioniques réfractaires. Métaux facturés 5 ou plus ont tendance à former des fluorures liés de façon covalente, des polymères ou molécules discrètes, et sont plus volatile. (Les tetrafluorides sont une zone de transition). Les variations de collage font que les fluorures métalliques peuvent être des solides, des liquides ou des gaz à température ambiante.
La solubilité des fluorures varie considérablement, mais a tendance à diminuer à mesure que la charge de l'ion de métal augmente. Fluorures dissous produisent des solutions de base. (F - est une base faible parce HF est un acide faible.) Comme hydroxydes, les fluorures peuvent être considérés comme de base, amphotère, et acide, avec la propriété d'acidité augmentant généralement avec l'état de d'oxydation du métal; un fluorure est une base beaucoup plus faible que un hydroxyde, cependant.
États d'oxydation faibles

Les métaux alcalins forment monofluorides. Tous sont solubles et ont la structure de chlorure de sodium (le sel gemme), qui est également adopté par certains oxydes d'alcalino-terreux tels que CaO. Parce que l'anion fluorure est fortement basique, de nombreux fluorures de métaux alcalins forment des bifluorures de formule MHF 2 . Ils donnent également hors du fluorure facilement lors de la réaction avec un acide. Entre autres monofluorides, seulement argent (I) et de thallium (I) les fluorures sont bien caractérisés. Les deux sont très solubles, contrairement aux autres halogénures de ces métaux. Un autre fluorure d'argent est de ce point une «demi-fluorure" (un subfluoride, composé contenant moins de saturation normale avec du fluor), formulé comme Ag 2 F . Ce composé a été décrit comme ayant F - et inhabituels "Ag ½ + centres ".
Contrairement aux monofluorides, les difluorures peuvent être soit soluble ou insoluble. Plusieurs difluorures de métaux de transition, tels que ceux de cuivre (II) et nickel (II), sont solubles. Les métaux alcalino-terreux forment difluorures qui sont insolubles. En revanche, les chlorures d'alcalino-terreux sont facilement solubles. L'insolubilité de fluorures alcalino-terreux provient de l'énergie haute treillis négatif de la commune dans la structure de la chimie de fluorite (adoptée par plusieurs dioxydes métalliques tels que CeO 2 , UO 2 , ThO 2 , etc.), de sorte qu'il est plus favorable pour le solide pour rester solide plutôt que de se dissolvent, de sorte qu'ils sont insolubles (voir le tableau, notez les signes moins ignorés). Cependant, le fluorure de béryllium montre des différences frappantes d'autres fluorures d'alcalino-terreux, il suffit de béryllium est différente de celle d'autres métaux alcalino-terreux (qui tend à lier de manière covalente, de sorte BeF 2 montre un caractère significatif covalente). Les composés a de nombreuses similitudes avec SiO 2 (quartz): a principalement lié de façon covalente solide réseau, la formation de verres (sont difficiles à cristalliser), la même chambre structure cristalline de température lorsque cristallin, etc. Il est très soluble dans l'eau, à la différence des autres terres alcalines .
De nombreux métaux forment trifluorures, tels que le fer, le bismuth, les éléments de terres rares et les métaux de la colonne d'aluminium de la classification périodique. À ce stade, l'ionicité des fluorures commence à réduire, et l'acidité commence à croître, même si les composés sont encore solides ioniques, principalement faiblement basiques. Dans de nombreux cas, tandis que les trifluorures sont encore ionique, d'autres peuvent être trihalogénures volatile (par exemple, de l'aluminium ou de l'or). N est le trifluorure soluble dans l'eau, mais sont solubles dans plusieurs autres solvants.
Le tetrafluorides montrent un mélange de liaison ionique et covalente: zirconium, le hafnium, plus beaucoup des actinides former carrés-antiprismatique tetrafluorides ionique, haute-fusion. Le titane, le niobium et le vanadium sont tetrafluorides polymère, avec des points de fusion ou de décomposition inférieures à 400 ° C (de vanadium peut également disproportionnée à 100-120 ° C et à la trifluorure le pentafluorure). Beaucoup tetrafluorides des métaux de transition montrent structures inhabituelles intermédiaires entre covalente ionique et monomère (notamment tétrafluorure iridium avec les deux atomes de fluor partagées et non partagées). Ils ont généralement des points de fusion bas (osmium tétrafluorure de est, par exemple, 230 ° C) ou sont de faible stabilité (manganèse tétrafluorure décompose même à température ambiante). formes Germanium tétrafluorure molécules tétraédriques et est un gaz à température ambiante.
États d'oxydation élevés
penta métalliques et des fluorures supérieures sont tous liés de manière covalente et volatile. Ce comportement contraste avec les oxydes correspondants. L'oxygène est un oxydant plus faible et intrinsèquement plus susceptibles de former des liaisons covalentes, mais il ne se forme avec cinq molécules métaux ( heptoxyde manganèse, technétium heptoxyde, le tétroxyde de ruthénium, le tétroxyde d'osmium, iridium et tétroxyde). formes de fluor molécules parce que sa petite taille et la charge unique comme un ion permet entourant atomes de métal avec plusieurs atomes de fluor que l'oxygène boîte avec quinze métaux.


Le plus élevé de fluorure de bismuth est un pentafluorure volatile qui est un agent de fluoration puissant. Dans l'état solide, il est polymère, composé de chaînes linéaires d'octaèdres partageant fluorures axiales. de bismuth pentavalent se comporte comme un acide et hexafluorobismuthate de formes, [BiF 6 ] - , par réaction avec un donneur de fluorure, soit une forte (comme NaF) ou non (tels que XeF 4 ), étant ainsi un acide. Niobium et de tantale pentafluorures, tandis thermiquement stable, sont également des acides forts et donc hydrolysent facilement. Ils sont vraiment moléculaire, en formant des molécules tétramères. Beaucoup de métaux qui forment fluorures plus élevés peuvent également former pentafluorures, mais ils peuvent être instables. Par exemple, osmium et ruthénium pentafluorures, tout en polymère, avoir une structure différente, et sont de faible stabilité (hydrolyser facilement, ne sont pas de l'état d'oxydation le plus élevé, ni l'un stable).
Les métaux qui font bien caractérisés hexafluorure comprennent neuf métaux dans le centre de la table périodique et trois actinides . A température ambiante, l'hexafluorure de tungstène est un gaz, l'hexafluorure de molybdène et le rhénium hexafluorure sont des liquides, et le reste sont des solides volatils. M??tal hexafluorures sont oxydants en raison de leur tendance à se réduire: par exemple, l'hexafluorure de platine était le premier composé pour oxyder l'oxygène moléculaire et xénon. L'hexafluorure moins instable est celle d'osmium. Polonium forme également un hexafluorure, mais il est peu étudié.

Rhénium est le seul métal connu pour se lier avec sept fluorures dans le composé de métal à charge neutre, qui est le chargé-ligands nombre record. Rhenium heptafluorure peuvent être synthétisés à partir des éléments, et est relativement stable contre la chaleur. Chimiquement, il peut servir comme un acide non oxydant pour former l'anion correspondant, ref -
8 , ou avec des acides forts comme une base pour former un cation, ref +
6 . La molécule adopte une géométrie moléculaire de bipyramide pentagonale (qui devrait être partagée avec le heptafluorure actuellement inconnue mais peut-être possible d'iridium (rapport de synthèse est en cours de préparation), le technétium heptafluorure, et l'osmium heptafluorure).
Fluorures non métalliques
Le fluorures binaires non métalliques sont des composés volatils. Ils montrent une grande différence entre la période 2 et d'autres fluorures. Par exemple, éléments période de 2 éléments fluorures ne dépassent jamais l' octet de leurs atomes. ( Boron est une exception en raison de sa position spécifique dans le tableau périodique.) éléments Basse-période, cependant, peuvent former des molécules hypervalentes, comme le pentafluorure de phosphore ou l'hexafluorure de soufre. La réactivité de ces espèces varie grandement l'hexafluorure de soufre est inerte, tandis que le trifluorure de chlore est extrêmement réactif, mais il ya des tendances basées sur les emplacements de la table périodique.
Le trifluorure de bore est une molécule plane. Il ne comporte que six électrons autour de l'atome de bore central (et donc un octet incomplet), mais il accepte facilement une base de Lewis, en formant des produits d'addition avec des mono- paire contenant des molécules ou des ions tels que l'ammoniac ou un autre ion fluorure qui peut donner deux électrons pour compléter l'octet. Boron monofluorure est une molécule instable avec un (plus élevé que seule) liaison inhabituelle au fluor. L'ordre de liaison a été décrit comme 1.4 (intermédiaire entre une liaison simple et double). Il est isoélectronique avec N 2 .

Tétrafluorure de silicium, semblable à du tétrafluorure de carbone et de tétrafluorure de germanium, adopte une moléculaire tétraédrique structure. SiF 4 est stable contre un échauffement ou une étincelle électrique, mais réagit avec l'eau (même de l'air humide), les métaux et alcalis, démontrant ainsi un faible caractère acide. Les réactions avec des composés organomagnésiens, les alcools, les amines et les composés d'adduction de l'apport en ammoniac. acide fluorosilicique, un dérivé de SiF 4 , est un acide fort en solution aqueuse (ne pas exister sous forme anhydre).
Pnictogens (colonne de table périodique de l'azote) montrent des tendances très similaires dans la réactivité et de l'acidité des plus hauts fluorures (pentafluorures) et les plus communs (trifluorures), avec ladite propriété croissante sur le groupe: NF 3 est stable contre l'hydrolyse, PF 3 hydrolyse très lentement air humide, tandis que AsF 3 hydrolyse complètement. SbF 3 hydrolyse partiellement en raison du caractère ionique croissante de la liaison à un atome de fluor. Les composés sont faibles bases de Lewis, avec NF 3 étant à nouveau une exception. Les pentafluorures de phosphore et d'arsenic sont beaucoup plus réactifs que les trifluorures; le pentafluorure d'antimoine est un acide fort tel qu'il détient le titre de l'acide de Lewis fort. L'azote est pas connue pour former un pentafluorure, bien que le cation tetrafluoroammonium ( NF +
4 ) dispose d'azote dans l'état d'oxydation formel de +5. monofluorure azote est une espèce métastables qui a été observé dans les études de laser. Il est isoélectronique avec O 2 et comme BF, inhabituellement, a un ordre de liaison plus élevée que le fluor unique lié.

Le chalcogènes (colonne de table périodique de l'oxygène) sont assez semblables: Les tetafluorides sont thermiquement instables et hydrolysent, et sont également prêts à utiliser leur seule paire pour former des adduits à d'autres fluorures (acides). Soufre et de sélénium sont tetrafluorides moléculaire tandis que TeF 4 est un polymère. Les hexafluorures sont le résultat de fluoration directe des éléments (comparer: ne existent même d'autres hexahalides des éléments). Ils augmentent la réactivité avec le nombre atomique: SF 6 est extrêmement inerte, SeF 6 est moins noble (par exemple, réagit avec l'ammoniac à 200 ° C (400 ° F)), et TeF 6 facilement hydrolyse pour donner un oxacide. Le plus élevé de fluorure de l'oxygène est le difluorure d'oxygène, le fluor, mais peut théoriquement (à partir de 2012) oxyder à un état ??????d'oxydation exceptionnellement élevé de +4 dans le fluorocation: DE +
3 .
Les halogènes bien caractérisés lourds (chlore, brome, et d'iode) toute forme mono-, tri- et pentafluorures: XF, XF 3 et XF 5 . Parmi les sept espèces neutres, ne heptafluorure d'iode est connu. Alors que chlore et de brome heptafluorides ne sont pas connus, les cations correspondants CLF +
6 et BRF +
6 , extrêmement oxydants puissants, sont. Astatine est pas bien étudié, et bien qu'il y ait un rapport d'un astatine monofluorure non-volatile, son existence est débattue. Beaucoup de fluorures d'halogènes sont fluorinators puissants. Trifluorure de chlore est particulièrement remarquable facilement fluoration-amiante et oxydes réfractaires et peut être encore plus réactif que le pentafluorure de chlore. Utilisé industriellement, ClF 3 nécessite des précautions particulières similaires à ceux pour le gaz de fluor en raison de son agressivité et les risques pour les humains.
Superacides
Plusieurs acides minéraux importants contiennent du fluor. Ils sont généralement très forte en raison de la forte électronégativité du fluor. Un acide tel, acide fluoroantimonique (HSbF 6 ), est l'acide le plus fort de charge neutre connu. La dispersion de la charge sur l'anion affecte l'acidité du proton solvaté (en forme de H 2 F + ): Le composé a un très faible pK une de -28 et 10 quadrillions (10 16 ) fois plus fort que l'acide sulfurique pur. Acide fluoroantimonique est si forte qu'elle protone composés autrement inertes comme les hydrocarbures. Chimiste américano-hongrois George Olah a reçu le prix Nobel 1994 de chimie pour enquêter sur ces réactions.
Des composés de gaz rares
Les gaz rares sont généralement non réactif parce qu'ils ont entièrement rempli couches électroniques, qui sont extrêmement stables. Jusque dans les années 1960, aucune liaison chimique avec un gaz noble était connu. En 1962, Neil Bartlett utilisé hexafluorure de platine contenant du fluor à réagir avec du xénon. Il a appelé le composé il a préparé hexafluoroplatinate xénon, mais depuis lors, le produit a été révélé être un mélange de différents produits chimiques. Bartlett probablement synthétisé un mélange de monofluoroxenyl (II) pentafluoroplatinate, [XeF] + [PtF 5 ] - , monofluoroxenyl (II) undecafluorodiplatinate, [XeF] + [Pt 2 F 11 ] - , et trifluorodixenyl (II) hexafluoroplatinate, [Xe 2 F 3 ] + [PtF 6 ] - . La fluoration de Bartlett de xénon a été appelé une des dix plus belles expériences de l'histoire de la chimie. Plus tard en 1962, le xénon a été signalé à réagir directement avec du fluor pour former le di- et tetrafluorides. Depuis lors, les chimistes ont fait des efforts considérables pour former d'autres fluorures de gaz noble.
Ayant commencé la classe noble des composés de fluor-gaz, le xénon est aussi le gaz noble d'avoir de tels composés les plus connus. Les composés binaires comprennent difluorure de xénon, le tétrafluorure de xénon et de l'hexafluorure de xénon, ainsi que leurs dérivés. Xenon forme plusieurs oxyfluorures, tels que le xénon oxydifluoride, XeOF 2 , par réaction de tétrafluorure de xénon avec de l'eau. Son voisin supérieure, le krypton, est le seul autre pour former un composé bien établie: difluorure de krypton. Krypton tétrafluorure a été signalé en 1963, mais il a été démontré par la suite d'être une identification erronée; le composé semble être très difficile de synthétiser aujourd'hui (bien que même l'hexafluorure peut exister).
En forte selon les tendances périodiques, le radon est notamment plus réactif aux oxydants, y compris le fluor. Il a été montré à réagir aisément avec du fluor pour former un composé solide, ce qui est généralement considéré comme le difluorure de radon. La composition exacte est incertaine tant que le composé est sujette à la décomposition. Les calculs indiquent que le radon difluorure peut être ionique, contrairement à tous les autres fluorures de gaz nobles binaires.
Les gaz nobles légers (hélium d'argon) ne font pas de fluorures binaires stables. Formes de fluorure d'argon aucun binaire, mais réagit dans des conditions extrêmes avec du fluorure d'hydrogène pour former de l'argon fluorohydride; il est le seul composé d'argon "stable". L'hélium et le néon ne forment pas de composés chimiques stables du tout. Helium forme hélium fluorohydride; il a été montré à être instables en phase gazeuse, mais il existe des conditions particulières pour lesquelles il peut être stable. Enseigne lumineuse, l'élément le moins réactif, ne devrait maintenant pour former un composé stable capable de synthèse.
Ununoctium , le dernier connu actuellement groupe 18 élément , est prévu pour former difluorure ununoctium, UuoF 2 et tétrafluorure ununoctium, UuoF 4 , qui est susceptible d'avoir la géométrie moléculaire tétraédrique. Cependant, seulement quelques atomes de ununoctium ont été synthétisés, et ses propriétés chimiques ont pas été examinés.
Les plus hauts états d'oxydation: le fluor par rapport à l'oxygène
| Le plus élevé de fluorure et d'oxyde de ruthénium | |||
| Pour groupes 1-5, 10, 13-16, les états d'oxydation plus élevés d'oxydes et de fluorures sont toujours égales. Les seules différences sont visibles dans le chrome, les groupes 7-9, le cuivre, le mercure et les gaz nobles. La fluoration permet éléments pour atteindre des états d'oxydation relativement faibles qui sont, cependant, difficile à réaliser. Par exemple, aucun oxyde binaire est connu pour le krypton, mais Difluorure de krypton est bien étudié. Dans le même temps, des états d'oxydation très élevées sont connues pour des espèces à base d'oxygène seulement. Pour les oxydes volatils mentionnés précédemment, il n'y a pas octafluorides hepta- ou correspondantes. (Par exemple, le ruthénium octafluoride est peu probable que jamais synthétisé, tandis que le tétroxyde de ruthénium a même trouvé une utilisation industrielle.) Le principal problème qui empêche la formation de fluor états les plus élevés dans covalente hepta et octafluorides est qu'il est difficile de fixer un tel grand nombre de ligands autour d'un seul atome; le nombre de ligands est divisée par deux en oxydes analogues. Cependant, les anions octafluoride, tels que le octafluoroiodate ( SI - 8 ), octafluorozirconate ( ZrF 4 8 ), et octafluoroxenate ( XeF 2- 8 ) des anions sont bien connues. Les états d'oxydation plus élevés peuvent être rare de la vie quotidienne, ou même l'utilisation industrielle. Par exemple, la synthèse de mercure tétrafluorure, le premier composé de parvenir à un état ??????d'oxydation supérieur à +2 pour un élément du groupe 12, brisant le 5d-shell rempli, montrant à nouveau l'importance des effets relativistes sur les éléments lourds, et d'alimenter le débat quant à savoir si le mercure , le cadmium et le zinc sont des métaux de transition, est produite à des températures cryogéniques et le composé se décompose aux températures de l'azote solide. Plus instable encore, la seule cobalt (V) espèces, l' CoF + OrganiqueCarbone-fluor liaison chimique des composés organofluorés est le lien le plus fort dans la chimie organique. Avec la faible polarisabilité des molécules, ce sont les facteurs les plus importants contribuant à la grande stabilité des organofluorines. La liaison carbone-fluor des molécules plus petites est formée de trois façons principales: fluor remplace un atome d'halogène ou un atome d'hydrogène, ou ajoute sur une liaison multiple. La réaction directe d'hydrocarbures avec du gaz de fluor peut être dangereusement réactive, de sorte que la température peut avoir besoin d'être abaissé, même à -150 ° C (-240 ° F). «porteurs de fluor sous forme solide", les composés pouvant libérer du fluor lors du chauffage, notamment le trifluorure de cobalt, peuvent être utilisés à la place, ou le fluorure d'hydrogène. Après la réaction, la taille de la molécule ne soit pas modifié de manière significative, que les éléments ont van der Waals très similaire rayons. Fluoration directe devient encore moins important quand il vient à organohalogènes ou composés insaturés réactions, ou quand un prefluorocarbon est souhaitée (puis électrolyse à base de HF est généralement utilisé). En revanche, les polymères fluorés sont formés par la polymérisation de radicaux libres; d'autres techniques utilisées pour les polymères d'hydrocarbures ne fonctionnent pas de cette façon avec du fluor. La gamme de composés organiques fluorés est diverse, reflétant la complexité inhérente de la chimie organique . Un grand nombre de petites molécules existent avec des quantités variables de substitution de fluor, ainsi que de nombreux polymères-recherche dans des domaines particuliers est entraîné par la valeur commerciale des applications.
| |||
Lorsque tous les atomes d'hydrogène sont remplacés par du fluor pour obtenir les perfluoroalcanes, une grande différence est révélé. Ces composés sont extrêmement stables, et seulement sodium dans l'ammoniac liquide qui les attaque dans des conditions normales. Ils sont également très insoluble, avec peu de solvants organiques capables de les dissoudre.
Toutefois, si un perfluorocarbone contenant des liaisons doubles ou triples (perfluoro alcènes ou - alcynes)., un ligand très réactif vers acceptant résultat, même moins stables que les hydrocarbures correspondant difluoroacétylène, qui se décompose même sous la température de l'azote liquide, est un exemple notable. Si une telle molécule est asymétrique, alors le carbone plus fluoré est attaqué, car il tient charge positive provoquée par les liaisons C-F et est protégé faiblement (de manière similaire à celle comment insaturé hydrocarbures attaqués par HF ajouter de l'hydrogène au plus un atome d'hydrogène riche par La r??gle de Markovnikov).
Les composés perfluorés, par opposition aux hydrocarbures perfluorés, est le terme utilisé pour les molécules qui seraient exclusivement perfluorocarbures carbone et de fluor, sauf pour ayant un groupe fonctionnel supplémentaire (même si une autre définition existe). Ils partagent la plupart des propriétés de perfluorocarbures (inertie, la stabilité, non-wettingness et de l'insolubilité dans l'eau et les huiles, glissance, etc.), mais peuvent différer en raison des propriétés de groupes fonctionnels, bien que la queue perfluorocarbone diffèrent les propriétés spécifiques à un groupe par rapport à ceux des composés hydrocarbonés de Virginie.
Perfluoroalkanic acides des acides organiques peuvent également être considérés comme des composés perfluorés, avec perfluoroalkyle relié à un groupement carboxyle. Étant donné que les atomes de fluor sont ajoutés à l'acide, sa résistance augmente: Voir l'acide acétique et son mono-, di-, et leurs dérivés trifluoroacétique et de pK une valeurs (4,74, 2,66, 1,24, et 0,23). Cela arrive parce que des atomes de fluor, l'anion formé après avoir donné le proton hors devient stable, un effet provoqué par une grande de fluor effet inductif. Pour cette raison, la derative trifluoroacétique est 33 800 fois plus forte que l'acide acétique. De même, l'acidité est fortement augmentée pour d'autres acides perfluorocarboxyl, ainsi que les amines (ici, il est plus logique de parler de l'élimination de la basicité, cependant).
Les acides perfluoroalcanesulfoniques sont également très remarquable pour leur acidité. Le dérivé d'acide sulfonique, acide trifluorométhanesulfonique, est comparable à la résistance à l'acide perchlorique. ces composés de l'énergie de surface inférieure; pour cette raison, ils, en particulier l'acide perfluorooctane sulfonique (SPFO, anciennement le composant actif dans la marque "Scotchgard") ont trouvé une utilisation industrielle comme tensioactifs (voir ci-dessus).
Si un composé perfluoré a une queue fluoré, mais aussi quelques carbones non-fluorés (généralement deux) à proximité du groupe fonctionnel, il est appelé un fluorotélomère (telles molécules sont traités commercialement comme perfluoré), mais ces molécules sont plus de valeur industrielle de chimique. La fin de chaîne peut être attaché de façon similaire à des groupes différents functiuonal (via la borne de carbone hydrogéné), tels que des groupes hydroxyle obtenu dans des alcools télomères fluorés, sulfonate résultant en des sulfonates de télomères fluorés, etc.
Polym??res
Les polymères fluorés sont similaires à bien des égards avec des molécules plus petites; ajouter du fluor à un polymère affecte les propriétés de la même manière que dans les petites molécules (augmentation de la stabilité chimique, le point de fusion, réduction de l'inflammabilité, la solubilité, etc.). Chaque fluoropolymère a posséder des propriétés caractéristiques, cependant.
Le fluoroplastique plus simple est le polytétrafluoroéthylène (PTFE, Teflon marque DuPont), qui est un polymère simple chaîne linéaire avec la répétition de motif structural: -CF 2 -. PTFE a une épine dorsale de carbones seule collées dans une longue chaîne, avec toutes les obligations secondaires à atomes de fluor. Il ne contient pas d'atomes d'hydrogène et peut être considéré comme la perfluoro analogique de polyéthylène (unité structurelle: -CH 2 -). PTFE a une stabilité chimique et thermique élevée, comme prévu pour un perfluorocarbone, beaucoup plus forte que le polyéthylène. Sa résistance aux forces de van der Waals fait PTFE la surface seulement connue à laquelle un gecko ne peut pas coller. Le composé, cependant, n'a pas une capacité à transformer lors de la fusion, ce qui est un problème pour les divers deratives de PTFE, à savoir FEP ( éthylène propylène fluoré, avec des atomes de fluor remplacés par le groupe -CF 3 groupe) ou PFA ( perfluoroalcoxy, certains remplacés par des atomes de fluor - OCF 3 ). Ils partagent la plupart des propriétés de PTFE, mais il ya encore des différences, la température maximale d'utilisation à savoir (le plus élevé pour le PTFE non flexible).
Il existe d'autres plastiques fluorés autres que perfluoré. fluorure de polyvinylidène (PVDF, unité structurale: -CF 2 CH 2 -), est un analogue de PTFE avec les atomes de fluor moitié. PVF ( fluorure de polyvinyle, le motif de structure: -CH 2 CHF-) contient une seule quatrième les atomes de fluor de PTFE. Malgré cela, il a encore beaucoup de propriétés des composés plus fluorés. PCTFE ( polychlorotrifluoroéthylène, unité structurelle: -CF 2 CFCl-) est un autre composé importante. Elle diffère de PTFE en ayant un quart de fluor remplacé par chlore, mais cette différence apporte encore plus grande dureté, résistance au fluage, et de l'humidité persistance.
Fluoration de polyéthylène légère donne ne font pas tous du plastique perdre ses hydrogènes pour le fluor; seulement une couche mince (0,01 mm au maximum) est ensuite affecté. Ceci est quelque peu semblable à la passivation des métaux: les propriétés en vrac ne sont pas affectés, mais les propriétés de surface sont, notamment, une plus grande barrière à la vapeur. Par conséquent, ils sont une alternative moins chère aux plastiques perfluorés si seule surface est important.
Nafion est un polymère structurellement compliqué. Il a un squelette de PTFE en forme, mais qui contient également des chaînes latérales d'éther perfluoro qui se terminent par un acide sulfonique (-SO 2 OH) des groupes. Il possède également une grande stabilité chimique, tandis que les propriétés exactes varient en fonction de la morphologie. Toutefois, en raison de la structure chimique difficile, il est également relativement facilement converti en un ionomère (montre conductivité) en ajoutant des cations tels que Na + ou par conversion en l'acide sulfonique au lieu de le fluorure de sulfonyle donné. La conductivité est due à ce que la chaîne carbonée principale sépare des chaînes latérales, formant ainsi des régions polaires et non polaires. Ce formulaire est aussi très hygroscopique.
Fluoroélastomères, comme d'autres élastomères (caoutchoucs artificiels), sont constitués de chaînes polymères désordonnés connectés en trois dimensions. Les principaux défis sont fluoroélastomères faisant réticulation (réaction des polymères non réactifs), ainsi que la suppression de la HF formé pendant le durcissement. Il existe trois grandes familles de fluoroelasters. VDF / HFP est un système de copolymère de fluorure de vinylidène et (au moins 20%) d'hexafluoropropylène. TFE / propylène est un autre système de copylymer avec une meilleure résistance aux produits chimiques de certains solvants. TFE / PMVE (éther perfluoro) est un système copolymère qui crée un élastomère fluoré perfluoré.



