
M??tal alcalin
?? propos de ce ??coles s??lection Wikipedia
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. M??res SOS chaque regard apr??s une une famille d'enfants parrain??s .
| M??taux alcalins | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ P??riode | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 |  3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 |  11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 |  19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 |  37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 |  55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Francium (Fr) 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L??gende
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Les m??taux alcalins sont un groupe dans le tableau p??riodique constitu?? de l' ??l??ments chimiques lithium (Li), le sodium (Na), potassium (K), rubidium (Rb), le c??sium (Cs) et le francium (Fr). Ce groupe se situe dans la s-bloc de la classification p??riodique des ??l??ments comme les m??taux alcalins ont leur ??lectron externe dans un s-orbital. Les m??taux alcalins fournissent le meilleur exemple de les tendances du groupe de propri??t??s dans le tableau p??riodique, avec des ??l??ments pr??sentant bien caract??ris??s comportement homologue.
Les m??taux alcalins ont des propri??t??s tr??s similaires: ils sont tous brillants, doux, tr??s des m??taux r??actifs ?? temp??rature et pression normales et perdent leur facilement ??lectrons ext??rieure pour former des cations avec la charge 1. Ils peuvent tous ??tre coup??s facilement avec un couteau en raison de leur douceur, l'exposition d'une surface brillante qui ternit rapidement dans l'air en raison de l'oxydation. En raison de leur forte r??activit??, ils doivent ??tre entrepos??s dans l'huile pour emp??cher une r??action avec de l'air, et se trouvent naturellement que dans des sels et jamais comme l'??l??ment libre. Dans le moderne Nomenclature IUPAC, les m??taux alcalins comprennent le groupe 1 ??l??ments, en excluant un atome d'hydrog??ne (H), qui est nominalement un ??l??ment du groupe 1, mais ne est normalement pas consid??r?? comme un m??tal alcalin car il pr??sente rarement comportement comparable ?? celle des m??taux alcalins. Tous les m??taux alcalins r??agissent avec l'eau, avec les m??taux alcalins lourds r??agir plus vigoureusement que les plus l??gers.
Tous les m??taux alcalins d??couvertes se produisent dans la nature: dans l'ordre de abondance, le sodium est le plus abondant, suivi par le potassium, le lithium, le rubidium, le c??sium, le francium et enfin, ce qui est tr??s rare en raison de sa tr??s haute radioactivit?? et donc ne se produit que dans traces en raison de sa pr??sence dans naturelle cha??nes de d??sint??gration. Des exp??riences ont ??t?? men??es pour tenter la synth??se de Ununennium (Uue), qui est susceptible d'??tre le prochain membre du groupe, mais ils ont tous rencontr?? l'??chec comme de 2012. Toutefois, Ununennium peut ne pas ??tre un m??tal alcalin en raison de effets relativistes, qui sont pr??vus pour avoir une grande influence sur les propri??t??s chimiques de ??l??ments super-lourds; m??me si elle ne se r??v??ler ??tre un m??tal alcalin, il est pr??vu d'avoir des diff??rences dans les propri??t??s physiques et chimiques de ses homologues plus l??gers.
La plupart des m??taux alcalins ont de nombreuses applications diff??rentes. Deux des applications les plus connues des ??l??ments purs sont rubidium et le c??sium horloges atomiques, dont c??sium horloges atomiques sont la repr??sentation la plus pr??cise du temps connu sous le nom de 2013. Une application courante des compos??s du sodium est la Lampe ?? vapeur de sodium, qui ??met une lumi??re tr??s efficace. Le sel de table ou chlorure de sodium, a ??t?? utilis??e depuis l'Antiquit??. Le sodium et le potassium sont ??galement ??l??ments essentiels, ayant des r??les majeurs que biologiques ??lectrolytes, et bien que les autres m??taux alcalins ne sont pas essentiels, ils ont aussi des effets diff??rents sur le corps, ?? la fois b??n??fiques et n??fastes.
Caract??ristiques
Chimique

Comme d'autres groupes, les membres connus de ce spectacle de la famille des mod??les dans son configuration ??lectronique, en particulier les coquilles ultrap??riph??riques, r??sultant des tendances dans le comportement chimique:
| Z | ??l??ment | Nombre de ??lectrons / shell | ??lectron configuration |
|---|---|---|---|
| 3 | lithium | 2, 1 | [ Il ] 2s 1 |
| 11 | sodium | 2, 8, 1 | [ Ne ] 3s 1 |
| 19 | potassium | 2, 8, 8, 1 | [ Ar ] 4s 1 |
| 37 | rubidium | 2, 8, 18, 8, 1 | [ Kr ] 5s 1 |
| 55 | c??sium | 2, 8, 18, 18, 8, 1 | [ Xe ] 6s 1 |
| 87 | francium | 2, 8, 18, 32, 18, 8, 1 | [ Rn ] 7s 1 |
La plupart de la chimie a ??t?? observ??e seulement pour les cinq premiers membres du groupe. La chimie de francium ne est pas bien ??tablie en raison de son extr??me la radioactivit??; Ainsi, la pr??sentation de ses propri??t??s ici est limit??.
Tous les m??taux alcalins sont tr??s r??actifs et ne sont jamais trouv??s dans les formes ??l??mentaires de la nature. De ce fait, ils sont g??n??ralement stock??s dans une huile min??rale ou k??ros??ne (huile de paraffine). Ils r??agissent agressivement avec les halog??nes pour former le des halog??nures de m??taux alcalins, qui sont blanches compos??s cristallins ioniques qui sont tous solubles dans l'eau, sauf le fluorure de lithium ( Li F ). Les m??taux alcalins r??agissent ??galement avec l'eau pour former fortement alcalines hydroxydes et donc doivent ??tre manipul??s avec beaucoup de soin. Les m??taux alcalins lourds r??agissent plus vigoureusement que les plus l??gers; par exemple, en cas de chute dans l'eau, produit une explosion c??sium plus grand que le potassium. Les m??taux alcalins ont la premi??re plus bas les ??nergies d'ionisation dans leurs p??riodes respectives de la classification p??riodique des ??l??ments en raison de leur faible charge nucl??aire effective et la capacit?? d'atteindre un gaz noble configuration en perdre un seul ??lectron . La seconde ??nergie d'ionisation de l'ensemble des m??taux alcalins est tr??s ??lev??e car elle est dans une enveloppe compl??te qui est ??galement plus pr??s du noyau; ainsi, ils perdent presque toujours un seul ??lectron, formant cations. Le alkalides sont une exception: ils sont compos??s instables qui contiennent des m??taux alcalins dans un ??tat d'oxydation de -1, ce qui est tr??s inhabituel comme avant la d??couverte des alkalides, les m??taux alcalins ne ??taient pas cens??s ??tre en mesure de former des anions et ont ??t?? pens??s pour ??tre en mesure ?? appara??tre dans des sels seulement comme cations. Les anions ont rempli alkalide s-sous-couches, ce qui leur donne plus de stabilit?? et leur permet d'exister. Tous les m??taux alcalins stables ?? l'exception de lithium sont connus pour ??tre capables de former alkalides, et les alkalides avoir beaucoup d'int??r??t en raison de leur th??orique inhabituel stoechiom??trie et basse potentiels d'ionisation. Alkalides sont chimiquement similaire ?? la electrides, qui sont des sels avec pi??g??s ??lectrons agissant comme anions. Un exemple particuli??rement frappant d'une alkalide est "inverse l'hydrure de sodium ", H + Na -, par opposition ?? l'hydrure de sodium habituel, Na + H -: elle est instable dans l'isolement, en raison de sa haute ??nergie r??sultant du d??placement de deux ??lectrons de l'hydrog??ne de sodium, bien que plusieurs d??riv??s sont pr??dites ??tre m??tastable ou stable.
La chimie de lithium montre plusieurs diff??rences par rapport ?? celle du reste du groupe que le petit cation Li + polarise anions et donne une plus ses compos??s caract??re covalente. Le lithium et le magn??sium ont un relation diagonale: ?? cause de cela, le lithium a quelques similitudes avec le magn??sium. Par exemple, le lithium constitue une ??table nitrure, une propri??t?? commune ?? tous les m??taux alcalino-terreux (Groupe d'magn??sium), mais unique parmi les m??taux alcalins. En outre, parmi leurs groupes respectifs, ne lithium et le magn??sium forme covalente les compos??s organom??talliques (par exemple Li Moi et MgMe 2). Le fluorure de lithium est le seul halog??nure de m??tal alcalin qui ne est pas soluble dans l'eau, et l'hydroxyde de lithium est le seul hydroxyde de m??tal alcalin qui ne est pas d??liquescente. Francium est ??galement pr??dit montrent quelques diff??rences en raison de sa haute poids atomique, provoquant ses ??lectrons de voyager ?? des fractions consid??rables de la vitesse de la lumi??re et donc de rendre effets relativistes plus important. Contrairement ?? la tendance ?? la baisse ??lectron??gativit??s et les ??nergies d'ionisation de m??taux alcalins, ??lectron??gativit?? ionisation et l'??nergie de francium sont pr??vus pour ??tre plus ??lev?? que le c??sium est d?? ?? la stabilisation relativiste des ??lectrons 7s; aussi, sa rayon atomique devrait ??tre anormalement bas.
Les compos??s et r??actions
La r??action avec de l'eau (hydroxydes de m??taux alcalins)

Tous les m??taux alcalins r??agissent violemment ou explosivement avec de l'eau froide, la production d'un solution aqueuse de l'fortement base de m??tal alcalin de l'hydroxyde et de lib??rer de l'hydrog??ne gazeux. Cette r??action devient plus vigoureuse descendre le groupe: le lithium r??agit de fa??on constante avec effervescence, mais sodium et de potassium peuvent se enflammer et rubidium et le c??sium couler dans l'eau et de g??n??rer de l'hydrog??ne gazeux si rapidement que les ondes de choc se forment dans l'eau qui peuvent briser des r??cipients en verre. Quand un m??tal alcalin tombe dans l'eau, elle produit une explosion, dont il existe deux ??tapes distinctes. Le m??tal r??agit avec l'eau en premier, brisant les liaisons hydrog??ne dans l'eau et la production de l'hydrog??ne gazeux; Ceci a lieu plus rapide pour les m??taux alcalins lourds plus r??actifs. En second lieu, la chaleur g??n??r??e par la premi??re partie de la r??action se enflamme souvent l'hydrog??ne gazeux, l'amenant ?? br??ler de mani??re explosive dans l'air environnant. Cette secondaire explosion de gaz d'hydrog??ne produit la flamme visible au-dessus du bol d'eau, un lac ou autre ??tendue d'eau, pas la r??action initiale du m??tal avec de l'eau (qui tend ?? se produire plus souvent sous l'eau).
La r??action chimique de m??taux alcalins avec de l'eau est:
- 2 M (s) + 2 H 2 O (l) → 2 MOH (aq) + H 2 (g) (o?? M repr??sente un m??tal alcalin)
La r??action avec de l'azote (nitrures de m??taux alcalins)

Le lithium, le plus l??ger des m??taux alcalins, est le seul m??tal alcalin qui r??agit avec l'azote ?? des conditions standard, et son le nitrure est le nitrure seulement de m??tal alcalin stable. L'azote est un gaz non r??actif parce briser la forte triple liaison dans le diazote mol??cule (N 2) n??cessite beaucoup d'??nergie. La formation d'un nitrure de m??tal alcalin ne consommer de l'??nergie d'ionisation du m??tal alcalin (formant M + ions), l'??nergie n??cessaire pour rompre la triple liaison en N 2 et la formation de N 3- ions, et toute l'??nergie lib??r??e par le formation d'un nitrure de m??tal alcalin est de la ??nergie du r??seau de nitrure de m??tal alcalin. L'??nergie de r??seau est maximis??e avec de petits ions, fortement charg??s; les m??taux alcalins ne forment pas des ions hautement charg??s, seulement former des ions avec une charge de 1, de sorte que le lithium, le plus petit m??tal alcalin, peut lib??rer suffisamment d'??nergie du r??seau pour faire la r??action avec de l'azote exothermique, formant le nitrure de lithium. Les r??actions des autres m??taux alcalins avec de l'azote ne lib??rent suffisamment d'??nergie de treillis et seraient donc endothermique, de sorte qu'ils ne forment pas nitrures dans les conditions normales. ( le nitrure de sodium (Na 3 N) et du nitrure de potassium (K 3 N), tout en existant, sont extr??mement instables, ??tant sujettes ?? la d??composition en arri??re en leurs ??l??ments constitutifs, et ne peut ??tre produit en faisant r??agir les uns avec les autres ??l??ments dans des conditions standard).
La r??action chimique du lithium avec de l'azote est la suivante:
- 6 Li (s) + N 2 (g) → 2 Li 3 N (s)
La r??action avec l'oxyg??ne (oxydes de m??taux alcalins)
 |  | |
Rb 9 O 2 cluster, compos?? de deux r??guli??re octa??dres reli?? ?? l'autre par une face | Cs 11 O 3 cluster, compos?? de trois octa??dres r??guliers o?? chaque octa??dre est reli?? ?? aux deux autres par une face chacun. Tous les trois octa??dres ont un bord en commun. |
Tous les m??taux alcalins r??agissent vigoureusement avec l'oxyg??ne dans des conditions normales. Ils forment divers types d'oxydes simples, tels que oxydes (contenant l'ion O 2-), peroxydes (contenant le 2- O
Ion 2, o?? il ya un une simple liaison entre les deux atomes d'oxyg??ne), superoxydes (contenant le O -
Deux ions), et bien d'autres. Lithium br??le dans l'air pour former oxyde de lithium, sodium, mais r??agit avec l'oxyg??ne pour former un m??lange de oxyde de sodium et le peroxyde de sodium. Le potassium se forme un m??lange de le peroxyde de potassium et superoxyde de potassium, le rubidium et le c??sium tandis que la superoxyde forment exclusivement. Leurs augmentations de r??activit?? descendant le groupe: tout le lithium, le sodium et le potassium br??lent simplement dans l'air, le rubidium et le c??sium sont pyrophorique (se enflammer spontan??ment dans l'air).
Les m??taux alcalins plus petits ont tendance ?? polariser les anions plus complexes (le peroxyde et superoxydes) en raison de leur petite taille. Ceci attire les ??lectrons dans les anions complexes ?? l'??gard l'un de ses atomes constituants de l'oxyg??ne, formant un ion d'oxyde et un atome d'oxyg??ne. Cela provoque lithium pour former l'oxyde exclusivement par r??action avec de l'oxyg??ne ?? la temp??rature ambiante. Cet effet devient consid??rablement plus faible pour la plus grande sodium et de potassium, ce qui leur permet de former des peroxydes moins stables. Le rubidium et le c??sium, en bas du groupe, sont si grandes que m??me les superoxydes moins stables peuvent se former. Parce que la superoxyde lib??re le plus d'??nergie lorsqu'il est form??, le superoxyde est pr??f??rentiellement form?? par les m??taux alcalins plus grands o?? les anions plus complexes ne sont pas polaris??es. (Les oxydes et peroxydes de m??taux alcalins de ces existent, mais ne forment pas lors de la r??action directe du m??tal avec de l'oxyg??ne dans des conditions standard).
La r??action chimique de m??taux alcalins avec de l'oxyg??ne qui forme l'oxyde est:
- 4 M (s) + O 2 (g) → 2 H 2 O (s) (dans laquelle M repr??sente un m??tal alcalin)
La r??action chimique qui forme le peroxyde est:
- 2 M (s) + O 2 (g) → M 2 O 2 (s) (dans laquelle M repr??sente un m??tal alcalin)
La r??action chimique qui forme la superoxyde est la suivante:
- M (s) + O 2 (g) → MO 2 (s) (dans laquelle M repr??sente un m??tal alcalin)
Rubidium et le c??sium peuvent former m??me oxydes plus complexes que les superoxydes. Le rubidium Rb peuvent former 6 O 9 et Rb 2 O lors de l'oxydation ?? l'air, tandis que le c??sium forme une immense vari??t?? d'oxydes, tel que le ozonide CsO 3 et plusieurs couleurs vives sous-oxydes, tels que 7 O Cs, Cs O 4, Cs 11 3 O, Cs 3 O (vert fonc??), CSO, Cs 2 O 3, ainsi que de Cs 2 O 7. Ce dernier peut ??tre chauff?? sous vide pour g??n??rer Cs 2 O.
La r??action avec les atomes d'halog??ne (halog??nures de m??tal alcalin)

Les m??taux alcalins sont parmi les plus ??l??ments ??lectropositifs sur le tableau p??riodique et ont donc tendance ?? liaison ionique au plus ??lectron??gatifs ??l??ments du tableau p??riodique, les halog??nes , formant des sels connus comme les halog??nures de m??taux alcalins. Cela comprend le chlorure de sodium , autrement connu sous le nom de sel commun. La r??activit?? du lithium devient sup??rieure ?? c??sium et passe de fluor ?? l'iode . Toutes les halog??nures de m??taux alcalins ont la formule MX o?? M est un m??tal alcalin et X est un halog??ne. Ils sont tous des solides cristallins blancs ioniques. Tous les halog??nures de m??taux alcalins sont solubles dans l'eau ?? l'exception de le fluorure de lithium (LiF), qui est insoluble dans l'eau en raison de ses tr??s ??lev?? enthalpie treillis. L'enthalpie de r??seau ??lev?? de fluorure de lithium est en raison de la petite taille des Li + et F - ions, provoquant les interactions ??lectrostatiques entre eux pour ??tre forte.
La r??action chimique de m??taux alcalins avec les halog??nes est:
- M + 2 X → 2 MX 2 (o?? M repr??sente un m??tal alcalin et X repr??sente un atome d'halog??ne)
Physique
Les m??taux alcalins sont tous de couleur argent ?? l'exception de c??sium, qui a une teinte dor??e. Tous sont doux et ont de faibles densit??s , des points de fusion et les points d'??bullition .
Le tableau ci-dessous est un r??sum?? des propri??t??s physiques et atomiques cl??s de m??taux alcalins. Les donn??es marqu??es de points d'interrogation sont soit incertain ou sont bas??es sur des estimations partiellement tendances p??riodiques plut??t que observations.
| M??tal alcalin | Standard masse atomique ( u) | Point de fusion | Point d'??bullition | Densit?? (G / cm 3) | ??lectron??gativit?? ( Pauling) | Premi??re ??nergie d'ionisation ( kJ ?? mol -1) | Rayon atomique ( h) | Couleur test flamme | |
|---|---|---|---|---|---|---|---|---|---|
| Lithium | 6,94 (1) | 453,69 K , 180,54 ?? C , 356,97 ?? F | 1615 K, 1342 ?? C, 2448 ?? F | 0,534 | 0,98 | 520,2 | 152 | Rouge | |
| Sodium | 22.98976928 (2) | 370,87 K, 97,72 ?? C, 207,9 ?? F | 1156 K, 883 ?? C, 1621 ?? F | 0,968 | 0,93 | 495,8 | 186 | Forte d'orange ou jaune persistante | |
| Potassium | 39,0983 (1) | 336,53 K, 63,38 ?? C, 146,08 ?? C | 1032 K, 759 ?? C, 1398 ?? F | 0,89 | 0,82 | 418,8 | 227 | Lilas ou rose | |
| Rubidium | 85,4678 (3) | 312,467 K, 39,31 ?? C, 102,76 ?? C | 961 K, 688 ?? C, 1270 ?? F | 1,532 | 0,82 | 403,0 | 248 | Rouge ou rouge-violet | |
| C??sium | 132.9054519 (2) | 301,59 K, 28,44 ?? C, 83.19 ?? F | 944 K, 671 ?? C, 1240 ?? F | 1,93 | 0,79 | 375,7 | 265 | Bleue ou violette | |
| Francium | [223] | ? 300 K, ? 27 ?? C, ? 80 ?? F | ? 950 K, ? 677 ?? C, ? 1250 ?? F | ? 1,87 | ? 0,7 | 380 | ? | ? | |
Nucl??aire
| Z | M??tal alcalin | Stable | D??sint??grations | instables: italiques isotopes impairs-impairs roses couleur | ||
|---|---|---|---|---|---|---|
| 3 | lithium | 2 | - | 7 Li | 6 Li | |
| 11 | sodium | 1 | - | 23 Na | ||
| 19 | potassium | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | rubidium | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | c??sium | 1 | - | 133 Cs | ||
| 87 | francium | - | - | Aucun isotopes primordiaux | ||
Tous les m??taux alcalins ont un num??ro atomique impair; par cons??quent, leurs isotopes doivent ??tre soit impair impair (deux protons et nombre de neutrons sont impairs) ou , m??me impair ( nombre de protons est ??trange, mais le nombre de neutrons est encore). Odd-noyaux impairs ont m??me nombres de masse, tout en noyaux impairs-m??me ont des num??ros impairs de masse. Odd-odd nucl??ides primordiaux sont rares car les noyaux les plus impair impairs sont tr??s instables par rapport ?? d??sint??gration b??ta, parce que les produits de d??sint??gration sont encore-m??me, et sont donc plus fortement li??s, en raison de effets d'appariement nucl??aires: sur les 254 stables nucl??ides ou observationnellement stables, seulement cinq ont ?? la fois un nombre impair de protons et de nombre impair de neutrons: hydrog??ne-2 ( deuterium), lithium-6, bore-10, l'azote-14, et tantale 180m. Le quatre de ces premiers ont une faible masse, pour lesquels la modification d'un proton en neutron ou vice versa conduirait ?? un ratio proton-neutron tr??s d??s??quilibr??e; la derni??re, le tantale-180m, est le seul primordiale isom??re nucl??aire, qui n'a pas encore ??t?? observ?? ?? la pourriture en d??pit des tentatives exp??rimentales et les pr??dictions th??oriques qu'il ne peut pas vraiment ??tre stable (sa d??cadence est fortement inhib??e par sa haute spin). En outre, quatre nucl??ides impair impair radioactifs ?? vie longue ( potassium-40, vanadium-50, lanthane-138, et lut??cium-176) se produisent naturellement.
En raison de la grande raret?? des noyaux impair impairs, presque tous les isotopes primordiaux des m??taux alcalins sont impairs-m??me (les exceptions ??tant la lumi??re isotope stable lithium-6 et la longue dur??e de vie radio-isotope de potassium-40). Pour un certain nombre de masse ??trange ??tant donn??, il peut y avoir une seule b??ta-nucl??ide stable, car il n'y a pas une diff??rence de l'??nergie de liaison entre les pair-impair et pair-impair comparable ?? celle entre pair-pair et impair impair, laissant les autres nucl??ides du m??me nombre de masse ( isobares) gratuits ?? d??sint??gration b??ta vers le nucl??ide le plus faible masse. Un effet de l'instabilit?? d'un nombre impair de chaque type de nucl??ons est que les ??l??ments impairs, tels que les m??taux alcalins, ont tendance ?? avoir moins d'isotopes stables que les ??l??ments paires. Sur les 26 monoisotopiques ??l??ments qui ne ont qu'un seul isotope stable, tous sauf un ont un num??ro atomique impair - la seule exception ?? la fois aux r??gles ??tant b??ryllium . Tous ces ??l??ments ont ??galement un nombre pair de neutrons, ?? la seule exception ??tant nouveau b??ryllium.
Tous les m??taux alcalins ?? l'exception du lithium et du c??sium ont au moins un ??tat naturel radio-isotope: sodium-22 et sodium-24 sont des radio-isotopes en traces produites cosmogenically, le potassium-40 et rubidium-87 ont de tr??s longues demi-vies et ainsi se produisent naturellement, et tout isotopes de francium sont radioactifs. Le c??sium a ??galement ??t?? pens?? pour ??tre radioactifs dans le d??but du 20e si??cle, m??me si elle a naturellement pas de radio-isotopes se produire. (Francium ne avait pas ??t?? encore d??couvert ?? ce moment.) La radio-isotope naturel de potassium, le potassium 40, repr??sente environ 0,012% de potassium naturel, et le potassium donc naturel est faiblement radioactifs. Le scientifique sovi??tique DK Dobroserdov observ?? ce faible radioactivit?? dans un ??chantillon de potassium en 1925 et a suppos?? ?? tort que eka-c??sium (actuellement connu pour ??tre le francium) contaminait l'??chantillon. Il a ensuite affirm?? avoir d??couvert eka-c??sium et pr??dit ses propri??t??s, le nommant russium apr??s son pays d'origine. Peu de temps apr??s, Dobroserdov a commenc?? ?? se concentrer sur sa carri??re d'enseignant ?? l'Institut Polytechnique de Odessa, et il n'a pas poursuivi l'autre ??l??ment.

Le c??sium-137, avec une demi-vie de 30,17 ann??es, est l'un des deux principaux dur??e moyenne des produits de fission, ainsi que strontium-90, qui sont responsables de la majeure partie de la de radioactivit?? combustible nucl??aire us?? apr??s plusieurs ann??es de refroidissement, jusqu'?? plusieurs centaines d'ann??es apr??s l'utilisation. Il constitue l'essentiel de la radioactivit?? encore ?? gauche de la catastrophe de Tchernobyl . 137 Cs beta se d??sint??gre en baryum 137m (une courte dur??e isom??re nucl??aire), qui se d??sint??gre alors non radioactif baryum-137. Il est fortement ??metteur de rayonnement gamma. 137 Cs a un taux de capture de neutrons tr??s faible et ne peut pas ??tre faisable dispos?? de cette mani??re, mais doit ??tre autoris?? ?? se d??sint??grer. 137 Cs a ??t?? utilis?? en tant que traceur dans les ??tudes hydrologiques, analogue ?? l'utilisation de 3 H. De petites quantit??s de le c??sium 134 et le c??sium 137 ont ??t?? lib??r??s dans l'environnement pendant la quasi-totalit?? les essais d'armes nucl??aires et certains accidents nucl??aires, notamment le Accident de Goi??nia et de la catastrophe de Tchernobyl . En 2005, le c??sium-137 est la principale source de rayonnement dans le zone d'ali??nation autour de la Tchernobyl centrale nucl??aire. Avec le c??sium-134, l'iode-131, et strontium 90, le c??sium 137 a ??t?? parmi les isotopes distribu??s par l'explosion du r??acteur qui constituent le plus grand risque pour la sant??. La mauvaise manipulation du c??sium-137 sources de rayons gamma peut provoquer le d??gagement de cette radio-isotopes et rayonnement blessures. Peut-??tre le cas le plus connu est l'accident de Goi??nia de 1987, dans lequel un mal-dispos??-du syst??me de th??rapie par rayonnement ?? partir d'une clinique abandonn??e dans la ville de Goi??nia, Br??sil , a ??t?? r??cup??r?? dans un d??potoir, et l'??clatante sel de c??sium vendu ?? curieux, acheteurs incultes. Cela a conduit ?? quatre d??c??s et de blessures graves de l'exposition aux rayonnements.
Tendances p??riodiques
Les m??taux alcalins sont plus similaires les uns aux autres que les ??l??ments de tout autre groupe sont ?? l'autre. Par exemple, lorsque l'on descend de la table, tous les m??taux alcalins connus montrent de plus en plus rayon atomique, diminuant ??lectron??gativit??, augmentant la r??activit??, et la diminution des points de fusion et d'??bullition. En g??n??ral, les densit??s augmentent lors du d??placement vers le bas de la table, ?? l'exception que le potassium est moins dense que le sodium.
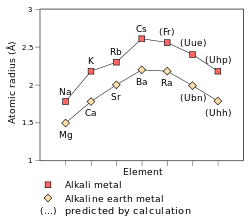
Rayons atomiques et ioniques

Le rayon atomique des m??taux alcalins augmenter descendant le groupe. ?? cause de la blindage effet, lorsqu'un atome a plus d'un coquille ??lectrons, chaque ??lectron sent r??pulsion ??lectrique des autres ??lectrons ainsi que l'attraction ??lectrique du noyau. Dans les m??taux alcalins, le ??lectronique ext??rieure ne se sent une charge nette de 1, comme certains de la charge nucl??aire (qui est ??gal au nombre atomique ) est annul?? par les ??lectrons interne; le nombre d'??lectrons interne d'un m??tal alcalin est toujours une de moins que la charge nucl??aire. Par cons??quent, le seul facteur qui affecte le rayon atomique des m??taux alcalins est le nombre de couches ??lectroniques. Depuis ce nombre augmente sur le groupe, le rayon atomique doit ??galement augmenter sur le groupe.
Le rayons ioniques des m??taux alcalins sont beaucoup plus petites que leur rayon atomique. Ce est parce que l'??lectron le plus ext??rieur des m??taux alcalins est dans une autre coquille d'??lectrons que les ??lectrons internes, et donc quand il est retir?? de l'atome r??sultant pr??sente une couche ??lectronique est plus petit et moins. En outre, le charge nucl??aire effective a augment??, et donc les ??lectrons sont attir??s plus fortement vers le noyau et les ioniques diminue rayon.
Premi??re ??nergie d'ionisation

La premi??re ??nergie d'ionisation d'un ??l??ment ou mol??cule est l'??nergie n??cessaire pour d??placer ??lectronique le plus l??chement d'un en moles d'atomes de l'??l??ment gazeux ou des mol??cules pour former une mole d'ions gazeux avec une charge ??lectrique 1. Les facteurs qui influent sur la premi??re ??nergie d'ionisation sont la charge nucl??aire, la quantit?? de blindage par les ??lectrons internes et la distance entre l'??lectron plus l??chement du noyau, ce qui est toujours un ??lectron externe dans principaux ??l??ments du groupe. Les deux premiers facteurs changent la charge nucl??aire effective l'??lectron plus l??chement sent. Depuis l'??lectron le plus ext??rieur de m??taux alcalins sens toujours la m??me charge nucl??aire effective (1), le seul facteur qui affecte la premi??re ??nergie d'ionisation est la distance entre l'??lectron le plus ext??rieur vers le noyau. Depuis cette distance augmente vers le bas du groupe, l'??lectron le plus ext??rieur se sent moins attraction du noyau et donc la premi??re ??nergie d'ionisation diminue. (Cette tendance est cass?? dans le francium en raison de la stabilisation relativiste et la contraction des 7s orbitales, apportant plus pr??s du noyau que celui qui serait attendu de calculs non-relativistes la ??lectron de valence de francium. Cela rend plus ?? l'ext??rieur de francium ??lectrons sentir plus d'attraction du noyau, augmentant l??g??rement sa premi??re ??nergie d'ionisation au-del?? de c??sium.)
La seconde ??nergie d'ionisation des m??taux alcalins est beaucoup plus ??lev??e que la premi??re comme la deuxi??me plus l??chement ??lectronique fait partie d'un enti??rement rempli shell ??lectron et est donc difficile ?? enlever.
R??activit??
Les r??activit??s des m??taux alcalins augmentent la descente du groupe. Ceci est le r??sultat d'une combinaison de deux facteurs: le premier ??nergies d'ionisation et les ??nergies d'atomisation de m??taux alcalins. Parce que la premi??re ??nergie d'ionisation des m??taux alcalins diminue vers le bas du groupe, il est plus facile pour l'??lectron le plus ext??rieur d'??tre retir?? de l'atome et de participer ?? des r??actions chimiques , ce qui augmente la r??activit?? du groupe vers le bas. L'??nergie d'atomisation mesure la force de la liaison d'un ??l??ment m??tallique, qui tombe le groupe que les atomes augmentent en rayon et donc la liaison m??tallique doit augmenter en longueur, ce qui rend les ??lectrons d??localis??s plus loin de l'attraction des noyaux de m??taux alcalins lourds. Ajout d'atomisation et les ??nergies d'ionisation premi??re donne une quantit?? ??troitement li??e ?? (mais pas ??gal ??) l' ??nergie d'activation de la r??action d'un m??tal alcalin avec une autre substance. Cette quantit?? diminue descendre le groupe, et il en va de l'??nergie d'activation; Ainsi, les r??actions chimiques peuvent se produire des augmentations plus rapides et la r??activit?? du groupe vers le bas.
??lectron??gativit??

??lectron??gativit?? est un propri??t?? chimique qui d??crit la tendance d'un atome ou un groupe fonctionnel pour attirer les ??lectrons (ou la densit?? d'??lectrons) en direction de lui-m??me. Si la liaison entre le sodium et le chlore dans le chlorure de sodium ??taient covalente, la paire d'??lectrons partag??s serait attir?? par le chlore parce que la charge nucl??aire effective sur les ??lectrons externes est 7 en chlore, mais est seulement une en sodium. La paire d'??lectrons est attir?? si proche de l'atome de chlore qu'elles sont pratiquement transf??r??s sur l'atome de chlore (e liaison ionique). Toutefois, si l'atome de sodium a ??t?? remplac?? par un atome de lithium, les ??lectrons ne seront pas attir??s plus pr??s de l'atome de chlore comme avant parce que l'atome de lithium est plus petite, ce qui rend la paire d'??lectrons plus fortement attir??s par la charge nucl??aire rapprocher efficace de lithium. Ainsi, les plus grandes des atomes de m??tal alcalin (en aval du groupe) seront moins ??lectron??gatif que la paire de liaison est moins fortement attir?? vers eux.
En raison de l'??lectron??gativit?? ??lev??e de lithium, certains de ses compos??s ont un caract??re plus covalent. Par exemple, l'iodure de lithium ( Li I ) se dissout dans les solvants organiques , une propri??t?? de la plupart des compos??s covalents. Le fluorure de lithium (Li F ) est le seul halog??nure de m??tal alcalin qui ne est pas soluble dans l'eau, et l'hydroxyde de lithium (Li OH ) est le seul hydroxyde de m??tal alcalin qui ne est pas d??liquescente.
Les points de fusion et d'??bullition
Le secteur des m??taux alcalins fusion et d'??bullition M??tal alcalin Point de fusion Point d'??bullition Lithium 453,69 K (180,54 ?? C) 1615 K (1342 ?? C) Sodium 370,87 K (97,72 ?? C) 1156 K (883 ?? C) Potassium 336,53 K (63,38 ?? C) 1032 K (759 ?? C) Rubidium 312,46 K (39,31 ?? C) 961 K (688 ?? C) C??sium 301,59 K (28,44 ?? C) 944 K (671 ?? C) Francium 300 K (? 27 ?? C) 950 K (? 677 ?? C)
Le point d'une substance de fusion est le point o?? il change ??tat de solide ?? liquide tandis que le point d'??bullition d'une substance (?? l'??tat liquide) est le point o?? le la pression de vapeur du liquide est ??gale ?? la pression de l'environnement entourant le liquide et toutes les modifications de l'??tat liquide ?? gaz . En tant que m??tal est chauff?? ?? son point de fusion, le liaisons m??talliques gardant les atomes en place affaiblissent de sorte que les atomes peuvent se d??placer, et les liaisons m??talliques finissent par ??clater compl??tement ?? point d'??bullition du m??tal. Par cons??quent, les points de fusion et d'??bullition relevant des m??taux alcalins indiquent que la r??sistance des liaisons m??talliques des m??taux alcalins diminue vers le bas du groupe. Ce est parce que les atomes m??talliques sont maintenus ensemble par l'attraction ??lectromagn??tique, des ions positifs ?? ??lectrons d??localis??s. Comme les atomes augmentent en taille descendant du groupe (en raison de leur rayon augmente atomiques), les noyaux des ions se d??placent plus loin des ??lectrons d??localis??s et donc la liaison m??tallique devient plus faible de sorte que le m??tal peut plus facilement faire fondre et faire bouillir, abaissant ainsi les points de fusion et d'??bullition. (La charge nucl??aire accrue ne est pas un facteur pertinent en raison de l'effet de blindage.)
Densit??
Les m??taux alcalins ont tous la m??me la structure cristalline ( cubique centr??) et donc les seuls facteurs pertinents comprennent le nombre d'atomes qui peuvent entrer dans un certain volume et la masse de l'un des atomes, ??tant donn?? que la densit?? est d??finie comme la masse par unit?? de volume. Le premier facteur d??pend du volume de l'atome et donc le rayon atomique, ce qui augmente en descendant le groupe; Ainsi, le volume d'un alcali augmente d'atomes de m??tal qui descendent du groupe. La masse d'un atome de m??tal alcalin augmente ??galement la descente du groupe. Ainsi, la tendance pour les densit??s des m??taux alcalins d??pend de leurs poids atomiques et des rayons atomiques; si les chiffres pour ces deux facteurs sont connus, les rapports entre les densit??s des m??taux alcalins peuvent alors ??tre calcul??es. La tendance r??sultante est que les densit??s des m??taux alcalins augmentent en bas de la table, avec une exception au potassium. En raison de la masse atomique ayant la plus basse de tous les ??l??ments dans leur p??riode et ayant le plus grand rayon atomique de leurs p??riodes, les m??taux alcalins sont les m??taux les moins denses dans le tableau p??riodique. Le lithium, le sodium et le potassium sont les trois seuls m??taux de la classification p??riodique qui sont moins denses que l'eau.
Extensions
Bien que le francium est le plus lourd m??tal alcalin qui a ??t?? d??couvert, il ya eu quelques travaux th??oriques pr??dire les caract??ristiques physiques et chimiques des m??taux alcalins lourds hypoth??tiques. ??tre le premier p??riode de 8 ??l??ment, l'??l??ment ?? d??couvrir Ununennium (??l??ment 119) est pr??vu pour ??tre la prochaine m??tal alcalin apr??s francium et se comporter un peu comme leur briquet cong??n??res; Cependant, il est ??galement pr??vu pour diff??rer des m??taux alcalins l??gers dans certaines propri??t??s. Sa composition chimique est pr??vu pour ??tre plus proche de celle de potassium ou de rubidium ou de c??sium au lieu de francium. Ce est inhabituel que tendances p??riodiques, en ignorant les effets relativistes seraient pr??dire Ununennium d'??tre encore plus r??actif que le c??sium et le francium. Ce r??duit réactivité est due à la stabilisation relativiste de l'électron de valence de Ununennium, augmentant première énergie d'ionisation de Ununennium et en diminuant le m??tallique et rayon ionique; cet effet est déjà vu pour le francium. Cela suppose que Ununennium se comportera chimiquement comme un métal alcalin, qui, bien que probable, peut ne pas être vrai en raison des effets relativistes. La stabilisation relativiste de l'orbitale 8s augmente également de Ununennium l'affinité électronique bien au-delà de césium et le francium; en effet, Ununennium devrait avoir une affinité électronique supérieure à celle de tous les métaux alcalins légers que lui. Effets relativistes provoquent également une très forte baisse de la polarisabilité de Ununennium. D'autre part, Ununennium est prévu de poursuivre la tendance des points de fusion baisse descendre le groupe, étant prévu d'avoir un point de fusion entre 0 ° C et 30 ° C.
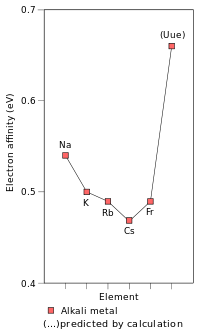
La stabilisation de l'électron de valence de Ununennium et donc la contraction de la cause orbital 8s son rayon atomique d'être abaissée à 240 pm, très proche de celle de rubidium (247 pm), de sorte que la composition chimique de Ununennium à l'état d'oxydation +1 soit plus proche de la chimie de rubidium que de celle de francium. D'autre part, le rayon ionique de la Uue + ion est prévu pour être supérieur à celui de Rb + , parce que les 7p orbitales sont déstabilisées et ne sont donc plus grands que les orbitales p des coquilles inférieures. Ununennium peut également montrer la 3 l'état d'oxydation , qu'on ne voit pas en tout autre métal alcalin, en plus de l'état 1 à l'oxydation qui est caractéristique des autres métaux alcalins et est également l'état de tous les métaux alcalins connus d'oxydation principale: cela est dû à la déstabilisation et l'expansion de la 7p 3/2 spinoriel, provoquant ses électrons ultrapériphériques ont une énergie d'ionisation inférieure à ce que l'on pourrait attendre.

Pas aussi beaucoup de travail a été fait prédire les propriétés des métaux alcalins delà Ununennium. Bien que d'une simple extrapolation de la table périodique mettrait élément 169, unhexennium, sous Ununennium, calculs Dirac-Fock prédisent que la prochaine métal alcalin après Ununennium peut effectivement être l'élément 165, unhexpentium, qui est supposé avoir la configuration électronique [Uuo] 5g 18 6f 14 7d 10 8s 2 8p 1/2 2 9s 1 . D'autres calculs montrent que unhexpentium suivrait la tendance à l'augmentation de l'énergie d'ionisation au-delà de césium, ayant une énergie d'ionisation comparable à celui du sodium, et qu'elle devrait également poursuivre la tendance à la baisse rayons atomiques au-delà de césium, ayant un rayon atomique comparable à celle du potassium . Cependant, les électrons 7d de unhexpentium peuvent également être en mesure de participer à des réactions chimiques avec l'électron 9s, permettant éventuellement états d'oxydation au-delà de +1 et peut-être même faire unhexpentium se comporter davantage comme un élément du groupe du bore à un métal alcalin.
Les propriétés probables de métaux alcalins au-delà unhexpentium ont pas encore été exploré à partir de 2012. Dans les périodes 8 et au-dessus de la table périodique, les effets relativistes et la coque de structure deviennent si forte que des extrapolations à partir des congénères plus légers deviennent tout à fait inexact. En outre, les effets relativistes et la coque de structure (qui stabilisent les s-orbitales et déstabilisent et élargissent la d-, f-, et G-orbitales de coquillages élevés) ont des effets opposés, causant encore plus grande différence entre relativiste et non relativiste calculs des propriétés des éléments ayant les numéros atomiques tels élevées. En raison des alcalins et de métaux alcalino-terreux deux étant des éléments de blocs, ces prédictions pour les tendances et les propriétés de Ununennium et unhexpentium appliquent aussi surtout pour les métaux alcalino-terreux correspondant unbinilium (UBN) et unhexhexium (Euh).
Autres substances similaires
Hydrogène

L'élément de l'hydrogène , avec un électron par atome neutre, est généralement placé à la tête du groupe 1 de la classification périodique pour plus de commodité, mais pas un atome d'hydrogène est normalement considéré comme étant un métal alcalin; quand il est considéré comme un métal alcalin, il est en raison de ses propriétés atomiques et pas ses propriétés chimiques. Dans des conditions normales, l'hydrogène pur existe sous forme d'un gaz diatomique constitué de deux atomes de carbone par molécule (H 2 ); Cependant, les métaux alcalins ne forment qu'une molécules diatomiques (tels que dilithium, Li 2 ) à des températures élevées, lorsqu'ils sont dans la gazeux état.
Hydrogène, comme les métaux alcalins, a un électron de valence et réagit facilement avec les halogènes , mais les similitudes finissent là. Son emplacement au-dessus de lithium est principalement en raison de sa configuration électronique et non ses propriétés chimiques. Il est parfois placé au-dessus de carbone en raison de leurs électronégativités ou similaires fluor en raison de leurs propriétés chimiques semblables.
La premi??re ??nergie d'ionisation de l'hydrog??ne (1312,0 kJ / mol) est beaucoup plus élevé que celui des métaux alcalins. Comme un seul électron supplémentaire est nécessaire pour remplir l'enveloppe la plus externe de l'atome d'hydrogène, l'hydrogène se comporte souvent comme un halogène, formant le négatif ion hydrure, et est parfois considéré comme un halogène. (Les métaux alcalins peuvent également former des ions négatifs, appelés alkalides, mais ceux-ci ne sont guère plus que des curiosités de laboratoire, étant instable.) sous très haute pression, tels que ceux trouvés dans les noyaux de Jupiter et de Saturne , l'hydrogène ne devient métallique et se comporte comme un métal alcalin; dans cette phase, il est connu que l'hydrogène métallique.

Ammonium
Le ion ammonium ( NH +
4 ) a des propriétés très similaires à celles des métaux alcalins lourds, agissant comme un métal alcalin intermédiaire entre le potassium et le rubidium, et est souvent considéré comme un proche parent. Par exemple, métaux alcalins plupart des sels sont solubles dans l'eau, une propriété qui sels d'ammonium action. Ammonium devrait se comporter comme un métal (NH +
4 ions dans une mer d'électrons) à des pressions très élevées, comme à l'intérieur des géants de glace Uranus et Neptune .
Thallium

Thallium affiche l'une état ??????d'oxydation que tout l'affichage connu de métaux alcalins, et les composés du thallium avec thallium dans son 1 'état d'oxydation ressemblent étroitement aux potassium ou correspondantes d'argent composés en raison de la rayons ioniques similaire du Tl + (164 pm), K + ( 152 h) et Ag + (129 h) ions. Il a parfois été considéré comme un métal alcalin en Europe continentale (mais pas en Angleterre) dans les années immédiatement après sa découverte, et a été placé juste après le césium comme le sixième métal alcalin dans Dmitri Mendeleev de 1869 tableau périodique et 1868 tableau périodique de Julius Lothar Meyer . (1871 tableau périodique de Mendeleïev et 1870 tableau périodique de Meyer mis thallium dans sa position actuelle dans le groupe de bore et laissent l'espace ci-dessous césium vierge.) Toutefois, le thallium affiche également l'état d'oxydation +3, qui ne sait affiche de métaux alcalins (bien Ununennium, le septième métal alcalin inconnue, est prévu pour afficher éventuellement de l'état d'oxydation +3). Le sixième métal alcalin est maintenant considéré comme le francium.
Histoire
??tymologie
Les métaux alcalins sont appelés ainsi parce que leurs hydroxydes sont tous fortsalcalis dissous dans l'eau.
D??couverte
Lithium

Petalite ( Li Al Si 4 O 10 ) a été découvert en 1800 par le brésilien chimiste José Bonifácio Andrada dans une mine sur l'île de Utö, Suède. Cependant, il n'a pas jusqu'en 1817 que Johan Août Arfwedson, qui travaillait alors dans le laboratoire du chimiste Jöns Jacob Berzelius, a détecté la présence d'un nouvel élément, tout en analysant minerai de pétalite. Ce nouvel élément formé des composés semblables à ceux de sodium et de potassium, bien que son carbonate et hydroxyde étaient moins solubles dans l'eau et plus alcaline que les autres métaux alcalins. Berzelius a donné le matériau inconnu le nom " lithion / Lithina ", du grec mot ??????o?? (translittéré comme lithos , ce qui signifie «pierre»), afin de refléter sa découverte dans un solide minéral, par opposition au potassium, qui avait été découvert dans les cendres végétales , et le sodium, qui était connu pour sa partie haute abondance dans le sang des animaux. Il a nommé le métal à l'intérieur du «matériel de lithium ".
Sodium

Composés de sodium ont été connus depuis l'Antiquité; sel ( chlorure de sodium ) a été un produit important dans les activités humaines, comme en témoigne le mot anglais salaire , se référant à salarium , les plaquettes de sel parfois donnés aux soldats romains avec leurs autres salaires. En médiévale en Europe un composé du sodium avec l' latine nom de sodanum a été utilisé comme un remède des maux de tête. Sodium pur n'a pas été isolé jusqu'à 1807 par Humphry Davy à travers le électrolyse de soude caustique (maintenant appelé d'hydroxyde de sodium), un procédé très similaire à celui utilisé pour isoler potassium plus tôt que année.
Potassium

Alors que la potasse a été utilisé depuis les temps anciens, il n'a pas été entendu pour la plupart de son histoire pour être une substance fondamentalement différente de sels minéraux de sodium. Georg Ernst Stahl a obtenu des preuves expérimentales qui l'a amené à suggérer la différence fondamentale de sels de sodium et de potassium en 1702 et Henri Louis Duhamel du Monceau a été en mesure de prouver cette différence en 1736. La composition chimique exacte de composés de potassium et de sodium, et le statut comme un élément chimique de potassium et de sodium, on ne savait pas alors, et donc Antoine Lavoisier a inclus l'alcali dans sa liste des éléments chimiques en 1789. Pur potassium a été isolé pour la première en 1807 en Angleterre par Sir Humphry Davy , qui provient de la potasse caustique (KOH, l'hydroxyde de potassium) par l'utilisation de l'électrolyse du sel fondu avec le nouvellement inventé pile voltaïque . Le potassium est le premier métal qui a été isolé par électrolyse. Plus tard cette même année, Davy a rapporté extraction de sodium de la substance similaire soude caustique (NaOH, lessive) par une technique similaire, ce qui démontre les éléments, et donc les sels, d'être différent.
Rubidium

Rubidium a été découvert en 1861 à Heidelberg, en Allemagne par Robert Bunsen et Gustav Kirchhoff, les premiers à suggérer de trouver de nouveaux éléments par analyse du spectre , dans le minéral lepidolite grâce à l'utilisation d'un spectroscope. Parce que des lignes rouges lumineuses dans son spectre d'émission, ils ont choisi un nom dérivé du latin mot rubidus , signifiant rouge foncé. La découverte de rubidium a succédé à celui du césium, a découvert aussi par Bunsen et Kirchhoff par spectroscopie.
Césium
En 1860, Robert Bunsen et Gustav Kirchhoff découvert césium dans l' eau minérale de Dürkheim, Allemagne. En raison des lignes bleu vif dans son spectre d'émission, ils ont choisi un nom dérivé du mot latin caesius , signifiant bleu ciel. Le césium est le premier élément à être découvert par spectroscopie , un an seulement après l'invention du spectroscope par Bunsen et Kirchhoff.
Francium
Il y avait au moins quatre découvertes erronées et incomplètes avant Marguerite Perey de l' Institut Curie à Paris, la France découvre francium en 1939 par purification d'un échantillon de l'actinium-227, qui avait été signalé à avoir une énergie de désintégration de 220 ??????keV. Cependant, Perey remarqué particules de désintégration avec un niveau d'énergie inférieure à 80 keV. Perey pensait cette activité de décroissance pourrait avoir été causé par un produit de désintégration non identifiés auparavant, celui qui a été séparé pendant la purification, mais a émergé à nouveau sur le pur actinium -227. Différents essais ont éliminé la possibilité de l'élément inconnu étant thorium , radium , le plomb , le bismuth , ou le thallium . Le nouveau produit a montré des propriétés chimiques d'un métal alcalin (comme coprécipitant avec des sels de césium), qui ont conduit Perey à croire qu'il était l'élément 87, causée par la désintégration alpha de l'actinium-227. Perey a ensuite tenté de déterminer la proportion de la désintégration bêta à la désintégration alpha dans l'actinium-227. Son premier test mis l'alpha ramification à 0,6%, un chiffre qui plus tard, elle a révisé à 1%. Il a été découvert le dernier élément dans la nature , plutôt que par synthèse.
Eka-francium
Le prochain élément ci-dessous francium ( eka-francium) est très susceptible d'être Ununennium (Uue), l'élément 119, bien que ce soit pas complètement certaine en raison de effets relativistes. la synthèse de Ununennium a été tentée en 1985 en bombardant une cible de einsteinium -254 avec calcium -48 ions à l'accélérateur superHILAC à Berkeley, en Californie. Aucun atomes ont été identifiés, ce qui conduit à un rendement de limitation de 300 nb.
- 254
99Es+ 48
20Ca???302
119UUE* ???pas d'atomes
Il est hautement improbable que cette réaction sera en mesure de créer des atomes de Ununennium dans un proche avenir, compte tenu de la tâche extrêmement difficile de faire des quantités suffisantes de 254 Es, qui est favorisée pour la production d' éléments ultraheavy en raison de sa grande masse, relativement longue demi- -La vie de 270 jours, et la disponibilité en quantités significatives de plusieurs microgrammes, de faire une large cible assez pour augmenter la sensibilité de l'expérience au niveau requis; einsteinium n'a pas été trouvée dans la nature et n'a été produite dans les laboratoires. Cependant, étant donné que Ununennium est que la première période de 8 élément sur ??????la table périodique prolongée, il pourrait bien être découvert dans un proche avenir par d'autres réactions; en effet, une autre tentative de synthétiser Ununennium en bombardant une berkelium cible avec titane ions est en cours au Centre Helmholtz GSI pour Heavy Ion Research in Darmstadt, Allemagne . Actuellement, aucun de la période 8 éléments ont été encore découvert, et il est également possible, en raison de goutter instabilités, que seule la période inférieure 8 éléments, jusqu'à autour de l'élément 128, sont physiquement possible. Aucune tentative de synthèse ont été pris pour des métaux alcalins lourds, tels que unhexpentium, en raison de leur nombre atomique extrêmement élevé.
Occurrence
Dans le système solaire

Le Règle Oddo-Harkins détient même que les éléments avec des numéros atomiques sont plus fréquents que ceux qui ont des numéros atomiques impairs, à l'exception de l'hydrogène. Cette règle fait valoir que les éléments ayant les numéros atomiques impairs ont un proton non apparié et sont plus susceptibles de capturer un autre, augmentant ainsi leur numéro atomique. Dans les éléments ayant un numéro atomique de même, les protons sont appariés, avec chaque élément de la paire compenser la rotation de l'autre, l'amélioration de la stabilité. Tous les métaux alcalins ont des numéros atomiques impairs et ils ne sont pas aussi communs que les éléments ayant les numéros atomiques adjacentes, même à eux (les gaz nobles et les métaux alcalino-terreux ) dans le système solaire. Les métaux alcalins lourds sont moins abondantes que les plus légers comme les métaux alcalins du rubidium en avant ne peuvent être synthétisés en supernovae et non dans nucléosynthèse stellaire. Lithium est également beaucoup moins abondant que le sodium et le potassium car il est mal synthétisé à la fois dans Big Bang nucléosynthèse et dans les étoiles: le Big Bang ne pouvait produire que des traces de lithium, le béryllium et le bore en raison de l'absence d'un noyau stable avec 5 ou 8 nucléons, et la nucléosynthèse stellaire ne pouvaient passer ce goulot d'étranglement par la réaction triple alpha, fusionnant trois noyaux d'hélium pour former carbone , et en sautant sur ??????ces trois éléments.
Sur Terre

La Terre formé à partir du même nuage de matière qui a formé le Soleil, mais les planètes différentes compositions acquis pendant la formation et l'évolution du système solaire. À son tour, l' histoire naturelle de la Terre causé parties de cette planète à avoir des concentrations différentes des éléments. La masse de la Terre est d'environ 5,98 × 10 24 kg. Il est composé principalement de fer (32,1%), d'oxygène (30,1%), silicium (15,1%), magnésium (13,9%), du soufre (2,9%), nickel (1,8%), de calcium (1,5%), et l'aluminium ( 1,4%); avec le 1,2% restant consistant en des traces d'autres éléments. En raison de ségrégation de masse, la région de base est censé être principalement composé de fer (88,8%), avec de petites quantités de nickel (5,8%), le soufre (4,5%), et moins de 1% d'oligo-éléments.
Les métaux alcalins, en raison de leur forte réactivité, ne se produisent pas naturellement à l'état pur dans la nature. Ils sont lithophiles et restent donc à proximité de la surface de la Terre, car ils combinent facilement avec l'oxygène et ainsi associent fortement avec la silice , formant relativement minéraux à faible densité qui font pas enfoncer dans le noyau de la Terre. Potassium, le rubidium et le césium sont également des éléments incompatibles en raison de leur faible rayons ioniques.
Le sodium et le potassium sont très abondants dans la terre, les deux étant parmi les dix éléments les plus communs dans la croûte terrestre; sodium représente environ 2,6% de la Terre croûte mesurée en poids, ce qui en fait le sixième élément le plus abondant globale et le métal alcalin le plus abondant. Potassium représente environ 1,5% de la croûte terrestre et est le septième élément le plus abondant. Le sodium se trouve dans de nombreux minéraux différents, dont le plus commun est le sel ordinaire (chlorure de sodium), qui se produit dans de grandes quantités dissous dans l'eau de mer. Autres dépôts solides comprennent halite, amphibole, cryolithe, nitratine et zéolite.
Lithium, en raison de sa réactivité relativement faible, peut être trouvée dans l'eau de mer en grandes quantités; il est estimé que l'eau de mer est d'environ 0,14 à 0,25 parties par million (ppm) ou 25 micromolaire.
Rubidium est environ aussi abondant que le zinc et le plus abondant que le cuivre. Il se produit naturellement dans les minerais leucite, pollucite, carnallite, zinnwaldite et lépidolite. Le césium est plus abondante que certains éléments couramment connus, tels que l'antimoine , le cadmium , l'étain et de tungstène , mais est beaucoup moins abondant que le rubidium.
Francium-223, l'isotope naturellement que de francium, est le produit de la désintégration alpha de l'actinium-227 et peut être trouvé dans l'état de traces dans l'uranium et de thorium minéraux. Dans un échantillon donné de l'uranium, il est estimé à un seul atome d'francium pour 10 18 atomes d'uranium. Il a été calculé qu'il ya au plus 30 g de francium dans la croûte terrestre , à tout moment, en raison de sa très courte demi-vie de 22 minutes.
Production


La production de métaux alcalins purs est difficile en raison de leur extrême réactivité avec des substances couramment utilisés, tels que l'eau. Les métaux alcalins sont très réactifs qui ne peuvent pas être déplacés par d'autres éléments et doivent être isolées par électrolyse.
Les sels de lithium doivent être extrait de l'eau de sources minérales, les lacs de saumure, et les dépôts de saumure. Le métal est produit par électrolyse à partir d'un mélange fondu de chlorure de lithium et le chlorure de potassium.
Potassium se produit dans de nombreux minéraux, tels que sylvinite ( chlorure de potassium). Il est parfois produite par la séparation du potassium du chlore dans le chlorure de potassium, mais est le plus souvent produit par électrolyse de l'hydroxyde de potassium, a trouvé largement dans des endroits tels que le Canada , la Russie , la Biélorussie , l'Allemagne , Israël , États-Unis , et la Jordanie , dans un méthode similaire à la façon dont le sodium a été produit à la fin des années 1800 et au début des années 1900. Il peut également être produit à partir d' eau de mer . Le sodium se produit la plupart du temps dans l'eau de mer et on sèche les fonds marins, mais est maintenant produit par l'électrolyse de chlorure de sodium par l'abaissement du point de fusion de la substance au-dessous de 700 ° C par l'utilisation d'une cellule Downs. Extrêmement sodium pur peut être produit par la décomposition thermique de l'azoture de sodium.

Depuis plusieurs années, dans les années 1950 et 1960, un sous-produit de la production de potassium appelé Alkarb était une source principale pour le rubidium. Alkarb contenait 21% rubidium tandis que le reste était potassium et une petite fraction de césium. Aujourd'hui, les plus grands producteurs de césium, par exemple, la mine Tanco, Manitoba, Canada, produisent rubidium comme sous-produit de pollucite. Aujourd'hui, une méthode commune pour séparer le rubidium et le césium de potassium est la cristallisation fractionnée d'un rubidium et le césium alun ( Cs , Rb ) Al ( SO 4 ) 2 · 12 H 2 O , ce qui donne l'alun de rubidium pur après environ 30 réactions différentes. Les applications limitées et le manque d'un minéral riche en rubidium limite la production de composés de rubidium à 2 à 4 tonnes par an. Césium, cependant, n'a pas été produit à partir de la réaction ci-dessus. Au lieu de cela, l'extraction de minerai de pollucite est la principale méthode d'obtention de césium pur, extrait du minerai principalement par trois méthodes: digestion acide, décomposition alcaline, et de réduction directe.
Francium-223, l'isotope naturellement que de francium, est produit naturellement comme le produit de la désintégration alpha de l'actinium-227. Francium peut être trouvé dans l'état de traces dans l'uranium et de thorium minéraux; il a été calculé que tout au plus il ya 30 g de francium dans la croûte terrestre à un moment donné. En raison de son extrême rareté dans la nature, la plupart francium est synthétisé dans la réaction nucléaire 197 Au + 18 O ??? 210 Fr + 5 n , cédant francium-209, le francium-210, et le francium-211. La plus grande quantité de francium jamais réuni à ce jour est d'environ 300 000 atomes neutres, qui ont été synthétisés en utilisant la réaction nucléaire donnée ci-dessus.
Applications
Tous les métaux alcalins découverts à l'exclusion du francium ont de nombreuses applications. Le lithium est souvent utilisé dans les batteries, et de l'oxyde de lithium peut aider silice de procédé. Le lithium peut également être utilisé pour fabriquer des graisses lubrifiantes, traitement de l'air et de production d'aluminium.
Sodium pur a de nombreuses applications, y compris l'utilisation de lampes à vapeur de sodium, qui produisent une lumière très efficace par rapport à d'autres types d'éclairage, et peut aider à lisser la surface des autres métaux. Composés de sodium ont de nombreuses applications ainsi, le plus connu étant le composé sel de table. Le sodium est également utilisé dans le savon sous forme de sels d' acides gras .
composés de potassium sont souvent utilisés comme engrais que le potassium est un élément important pour la nutrition des plantes. D'autres ions de potassium sont souvent utilisés pour contenir des anions . l'hydroxyde de potassium est une base très forte, et est utilisé pour contrôler le pH de diverses substances.

Le rubidium et le césium sont souvent utilisés dans les horloges atomiques. Césium horloges atomiques sont extraordinairement précise; si une horloge avait été faite à l'époque des dinosaures, il serait hors de moins de quatre secondes (après 80 millions d'années). Pour cette raison, des atomes de césium sont utilisés comme la définition de la seconde. les ions rubidium sont souvent utilisés dans pourpre feu d'artifice, et césium est souvent utilisé dans des fluides de forage dans l'industrie pétrolière.
Francium n'a pas les applications commerciales, mais à cause de relativement simple de francium structure atomique , entre autres choses, il a été utilisé dans la spectroscopie expériences, conduisant à plus d'informations concernant les niveaux d'énergie et les constantes de couplage entre les particules subatomiques. Les études sur la lumière émise par le francium-210 ions laser piégés ont fourni des données précises sur les transitions entre les niveaux de l'énergie atomique, similaires à celles prédites par la théorie quantique .
R??le et pr??cautions biologique

Lithium ne se produit pas naturellement dans les systèmes biologiques et n'a aucun rôle biologique, mais ne avoir des effets sur le corps lorsqu'il est ingéré. Le carbonate de lithium est utilisé comme stabilisateur de l'humeur dans la psychiatrie pour traiter le trouble bipolaire ( maniaco-dépression) à des doses journalières d'environ 0,5 à 2 grammes, mais il ya des effets secondaires. L'ingestion excessive de lithium provoque la somnolence, troubles de l'élocution et de vomissements, entre autres symptômes, et poisons du système nerveux central, ce qui est dangereux, car la dose nécessaire de lithium pour traiter les troubles bipolaires est seulement légèrement inférieure à la dose toxique. Son biochimie, la façon dont il est traité par le corps humain et des études sur des rats et des chèvres suggèrent qu'il est un essentiel oligo-élément, bien que la fonction biologique naturelle du lithium chez les humains n'a pas encore été identifié.
Le sodium et le potassium se produisent dans tous les systèmes biologiques connues, fonctionne généralement comme des électrolytes à l'intérieur et à l'extérieur des cellules . Le sodium est un nutriment essentiel qui régule le volume sanguin, la pression sanguine, l'équilibre osmotique et le pH; l'exigence minimum de sodium physiologique est de 500 milligrammes par jour. Le chlorure de sodium (également connu sous le nom de sel commun) est la principale source de sodium dans l'alimentation, et est utilisé comme assaisonnement et agent de conservation, comme par décapage et séchée; la plus grande partie provient des aliments transformés. Le DRI pour le sodium est de 1,5 grammes par jour, mais la plupart des gens aux États-Unis consomment plus de 2,3 grammes par jour, le montant minimum qui favorise l'hypertension; à son tour, provoque 7,6 millions de décès prématurés dans le monde.
Le potassium est le principal cation (ion positif) à l'intérieur des cellules animales , tandis que le sodium est le principal cation à l'extérieur des cellules animales. Le différences de concentration de ces particules chargées provoque une différence de potentiel électrique entre l'intérieur et l'extérieur des cellules, connu sous le nom potentiel de membrane. L'équilibre entre le potassium et sodium est maintenue par des pompes ioniques dans la membrane cellulaire. Le potentiel de la membrane cellulaire est crée par des ions de potassium et de sodium permet à la cellule pour générer un potentiel d'action -a "pointe" de la décharge électrique. La capacité des cellules à produire une décharge électrique est essentiel pour les fonctions de l'organisme telles que la neurotransmission, la contraction musculaire et la fonction cardiaque.
Rubidium a pas connu rôle biologique, mais peut aider à stimulerle métabolisme, et, de façon similaire à césium, remplacer le potassium dans le corps causantune carence en potassium.
composés de césium sont rarement rencontrés par la plupart des gens, mais la plupart des composés de césium sont légèrement toxique à cause de la similarité chimique de césium au potassium, permettant au césium pour remplacer le potassium dans le corps, provoquant une carence en potassium. L'exposition à de grandes quantités de composés de césium peut provoquer hyperirritabilité et spasmes, mais que ces montants ne seraient pas normalement être rencontrés dans les sources naturelles, le césium est pas un grand polluant de l'environnement chimique. Le dose létale (DL médian 50 ) valeur pour le chlorure de césium chez la souris est de 2,3 g par kg, ce qui est comparable aux LD 50 valeurs de chlorure de potassium et chlorure de sodium . chlorure de césium a été promue comme une thérapie du cancer alternative, mais a été liée à la mort de plus de 50 patients, sur lesquels il a été utilisé dans le cadre d'un traitement du cancer scientifiquement non validés.
Francium n'a aucun rôle biologique et est plus susceptible d'être toxique à cause de son extrême radioactivité, provoquantl'empoisonnement de rayonnement, mais depuis la plus grande quantité de francium jamais réunie à ce jour est d'environ 300 000 atomes neutres, il est peu probable que la plupart des gens ne sera jamais rencontrer le francium.
