
S??l??nium
?? propos de ce ??coles s??lection Wikipedia
Cette s??lection se fait pour les ??coles par la charit?? pour enfants lire la suite . enfants SOS est le plus grand organisme de bienfaisance du monde en donnant des enfants orphelins et abandonn??s la chance de la vie familiale.
| S??l??nium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
34 Se | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
allotropes noir et rouge  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | s??l??nium, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s ɨ l Je n Je ə m / simul- LEE -neE-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | non m??talliques parfois consid??r?? comme un m??tallo??de | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (16) chalcog??nes, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 78,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 3d 10 4s 2 4p 4 2, 8, 18, 6  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | J??ns Jakob Berzelius et Johann Gottlieb Gahn (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | J??ns Jakob Berzelius et Johann Gottlieb Gahn (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | (Gris) 4,81 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | (Alpha) 4,39 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | (Vitreux) 4,28 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 3,99 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 494 K , 221 ?? C, 430 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 958 K, 685 ?? C, 1265 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 1766 K, 27,2 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (Gris) 6,69 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 95,48 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,363 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 6, 4, 2, 1, -2 (Fortement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,55 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 941,0 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 2045 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2973,7 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 120 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 120 ?? 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 190 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | (Amorphe) 0,519 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) (amorphe) 37 um ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 3,350 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 10 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 3,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 8,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7782-49-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes du s??l??nium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le s??l??nium est un ??l??ment chimique avec Se symbole et num??ro atomique 34. C'est un non m??tallique dont les propri??t??s sont interm??diaires entre celles de la table p??riodique colonne adjacente chalcog??ne ??l??ments soufre et le tellure . Il se produit rarement dans son ??tat ??l??mentaire dans la nature, ou des compos??s de minerai ?? l'??tat pur. S??l??nium ( grec σελήνη Selene sens "Moon") a ??t?? d??couvert en 1817 par J??ns Jacob Berzelius, qui a not?? la similitude du nouvel ??l??ment ?? l'pr??c??demment connu tellure (appel?? pour la Terre).
Le s??l??nium est pr??sent dans le m??tal impurement minerais sulfur??s, o?? il remplace partiellement le soufre. Commercialement, le s??l??nium est produit comme sous-produit dans le raffinage de ces minerais, le plus souvent pendant la production de cuivre. Min??raux qui sont s??l??niure ou s??l??nate compos??s purs sont connus, mais sont rares. Les usages commerciaux principaux pour le s??l??nium sont aujourd'hui dans la verrerie et des pigments . Le s??l??nium est un semi-conducteur et est utilis?? dans photocellules. Utilisations dans l'??lectronique , jadis important, la plupart ont ??t?? supplant?? par silicium dispositifs semi-conducteurs. Le s??l??nium continue d'??tre utilis?? dans quelques types d'alimentation en courant continu parasurtenseurs et un type de fluorescente point quantique.
sels de s??l??nium sont toxiques en grandes quantit??s, mais l'??tat de traces sont n??cessaires pour la fonction cellulaire dans de nombreux organismes, y compris tous les animaux. Le s??l??nium est un composant des enzymes antioxydantes le glutathion peroxydase et thior??doxine r??ductase (qui r??duisent indirectement certaines mol??cules oxyd??es chez les animaux et certaines plantes). Il se trouve aussi dans trois d??iodinases enzymes qui convertissent une hormone de la thyro??de ?? l'autre. exigences de s??l??nium dans les plantes diff??rent selon les esp??ces, avec quelques plantes n??cessitant des quantit??s relativement importantes, et d'autres apparemment n??cessitant aucun.
Caract??ristiques
Propri??t??s physiques
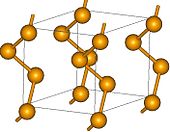
Le s??l??nium existe sous plusieurs formes allotropiques interconvertissent que lors d'un chauffage et un refroidissement effectu?? ?? diff??rentes temp??ratures et les taux. Tel que pr??par?? dans des r??actions chimiques, le s??l??nium est habituellement , poudre de brique rouge amorphe. Lorsqu'il est fondu rapidement, il constitue la forme vitreuse noir, qui est habituellement vendu industriellement comme des perles. La structure du s??l??nium noir est irr??guli??re et complexe et se compose de bagues polym??res avec jusqu'?? 1000 atomes par cycle. Se Noir est un cassants, solide brillant qui est l??g??rement soluble dans CS 2. Lors du chauffage, il se ramollit ?? 50 ?? C et se transforme en s??l??nium gris ?? 180 ?? C; la temp??rature de transformation est r??duite par la pr??sence d'atomes d'halog??ne et les amines .
Les formes α, β et γ de couleur rouge sont produites ?? partir de solutions de s??l??nium noire en faisant varier les taux d'??vaporation du solvant (en g??n??ral CS 2). Ils ont tous relativement faible, sym??tries cristallines monocliniques et contiennent presque identiques pliss??es Se huit anneaux dispos??s en diff??rents modes, comme dans le soufre . L'emballage est le plus dense dans la forme de α. Dans les huit Se anneaux, la distance Se-Se est 233,5 h et l'angle Se-Se-Se est 105,7 degr??s. D'autres formes allotropiques du s??l??nium peuvent contenir 6 Se ou Se et sept anneaux.
La forme la plus stable et dense de s??l??nium a une couleur gris et hexagonale r??seau cristallin constitu?? de cha??nes polym??res h??lico??daux, dans lequel la distance Se-Se est 237,3 h et l'angle Se-Se-Se est 130,1 degr??s. La distance minimale entre les cha??nes est 343,6 h. Se gris est form?? par chauffage mod??r?? d'autres formes allotropiques, par refroidissement lent de fondu Se, ou par condensation de vapeurs de Se juste en dessous du point de fusion. Alors que d'autres formes de Se sont des isolants, gris Se est un semi-conducteur montrant sensible photoconductivit??. Contrairement ?? d'autres formes allotropiques, ce est insoluble dans CS 2. Il r??siste ?? l'oxydation par l'air et ne est pas attaqu?? par les acides non-oxydants. Avec des agents r??ducteurs forts, il forme polyselenides. Le s??l??nium ne pr??sente pas les changements inhabituels dans la viscosit?? que le soufre subit lorsqu'il est chauff?? progressivement.
Isotopes
Le s??l??nium a six naturellement isotopes , dont cinq sont stables: 74 Se, 76 Se, 77 Se, 78 Se et 80 Se. Les trois derniers se produisent aussi produits de fission, ainsi que 79 Se, qui a une demi-vie de 327.000 ann??es. L'isotope naturel finale, 82 Se, a une demi-vie tr??s longue (~ 10 20 ans, en d??composition par la double d??sint??gration b??ta ?? 82 Kr ), qui, pour des raisons pratiques, peut ??tre consid??r??e comme stable. Vingt-trois autres isotopes instables ont ??t?? caract??ris??s.
Voir ??galement Selenium-79 pour plus d'informations sur les changements r??cents dans la demi-vie mesur??e de ce produit de fission ?? vie longue, importants pour les calculs de dose effectu??s dans le cadre du stockage g??ologique ?? vie longue d??chets radioactifs.
Les compos??s chimiques
compos??s de s??l??nium existent g??n??ralement dans les ??tats d'oxydation -2, 2, 4, et 6.
Compos??s chalcog??nes
Le s??l??nium forme deux oxydes: dioxyde de s??l??nium (SEO 2) et trioxyde de s??l??nium (SeO 3). Le dioxyde de s??l??nium est form?? par la r??action de s??l??nium ??l??mentaire avec de l'oxyg??ne:
- Se 8 + 8 O 2 → 8 SeO 2

C'est un solide polym??re qui forme des mol??cules monom??res SeO 2 dans la phase gazeuse. Il se dissout dans l'eau pour former l'acide s??l??nieux, H 2 SeO 3. L'acide s??l??nieux peut ??galement ??tre faite directement par oxydation du s??l??nium ??l??mentaire avec l'acide nitrique :
- 3 Se + 4 HNO 3 + H 2 O → H 2 SeO 3 + 4 NO 3
Contrairement soufre, qui forme une ??table le trioxyde de s??l??nium trioxyde est thermodynamiquement instable et se d??compose au-dessus de dioxyde 185 ?? C:
- 2 SeO 3 → 2 SeO 2 + O 2 (AH = -54 kJ / mol)
Le s??l??nium trioxyde est produit dans le laboratoire par la r??action de anhydre s??l??nate de potassium (K 2 de SeO 4) et de trioxyde de soufre (SO 3).
Les sels de l'acide s??l??nieux sont appel??s s??l??nites. Il se agit notamment s??l??nite de l'argent (Ag 2 SeO 3) et s??l??nite de sodium (Na 2 de SeO 3).
Le sulfure d'hydrog??ne r??agit avec l'acide s??l??nieux aqueux pour produire le disulfure de s??l??nium:
- H 2 SeO 3 + 2 H 2 S → SeS 2 + 3 H 2 O
Le disulfure de s??l??nium est compos?? de cycles ?? 8 cha??nons d'une distribution pratiquement statistique d'atomes de soufre et de s??l??nium. Il a une composition approximative de SES 2, avec des anneaux individuels variant en composition, comme Se 4 S 4 et S 6 Se 2. Le disulfure de s??l??nium est une utilisation dans un shampooing anti- Agent antipelliculaire, un inhibiteur de la chimie des polym??res, un colorant de verre, et un agent r??ducteur dans feux d'artifice.
Le s??l??nium trioxyde peut ??tre synth??tis?? par d??shydratation l'acide s??l??nique, H 2 SeO 4, qui est lui-m??me produit par l'oxydation du dioxyde de s??l??nium avec le peroxyde d'hydrog??ne :
- SeO 2 + H 2 O 2 → H 2 SeO 4
L'acide s??l??nique ?? chaud, concentr??e est capable de dissoudre l'or, formant or (III) s??l??nate.
compos??s halog??nes
Iodures de s??l??nium ne sont pas bien connus. La seule stable est le chlorure de monochlorure s??l??nium (Se 2 Cl 2), ce qui pourrait ??tre mieux connu comme le s??l??nium (I) le chlorure; le correspondant bromure est ??galement connue. Ces esp??ces sont structurellement analogue au correspondant bichlorure. Le s??l??nium est un dichlorure r??actif important dans la pr??paration de compos??s de s??l??nium (par exemple, la pr??paration de s??l??nium 7). Il est pr??par?? par traitement avec du s??l??nium le chlorure de sulfuryle (SO 2 Cl 2). Le s??l??nium r??agit avec le fluor pour former l'hexafluorure de s??l??nium:
- Se 8 F 24 + 2 → 8 SeF 6
En comparaison avec son homologue de soufre ( l'hexafluorure de soufre), l'hexafluorure de s??l??nium (SEF 6) est plus r??actif et est un toxique irritant pulmonaire. Certains des oxyhalog??nures de s??l??nium, tels que s??l??nium oxyfluorure (SEOF 2) et l'oxychlorure de s??l??nium (SeOCl 2) ont ??t?? utilis??s comme solvants sp??ciaux.
S??l??niures
Analogue au comportement d'autres chalcog??nes, le s??l??nium forme un dihydrure de H 2 Se. Ce est un tr??s odiferous gaz, toxique et incolore. Il est plus acide que le H 2 S. En solution, il se ionise ?? HSe -. Le s??l??niure dianion Se 2- forme une vari??t?? de compos??s, y compris les min??raux s??l??nium ?? partir de laquelle est obtenu dans le commerce. S??l??niures illustratifs comprennent le s??l??niure de mercure (HgSe), le s??l??niure de plomb (PbSe) le s??l??niure de zinc (ZnSe), et cuivre indium et de gallium dis??l??niure (Cu (Ga, In) Se 2). Ces mat??riaux sont des semi-conducteurs . Avec des m??taux ??lectropositifs hautement tels que l'aluminium, ces s??l??niures sont sujettes ?? une hydrolyse:
- Al 2 Se 3 + 6 H 2 O → Al 2 O 3 + 6 H 2 Se
S??l??niures de m??taux alcalins r??agissent avec le s??l??nium pour former polyselenides, Se 2-
x, qui existent sous forme de cha??nes.
D'autres compos??s
Tetraselenium t??tranitrure, Se 4 N 4, est un compos?? d'orange explosive analogue ?? T??tranitrure de t??trasoufre (S 4 N 4). Il peut ??tre synth??tis?? par la r??action de le t??trachlorure de s??l??nium (LECS 4) avec [((CH 3) 3 Si) 2 N] 2 Se.
Le s??l??nium r??agit avec cyanures pour donner des s??l??niocyanates:
- 8 KCN + Se → 8 8 KSeCN
Compos??s organos??l??ni??s
Le s??l??nium, en particulier dans l'??tat d'oxydation II, forme des liaisons stables du carbone, qui sont structurellement analogues au correspondant des compos??s organo-soufr??s. Surtout commune sont s??l??niures (R 2 Se, les analogues de thio??thers), dis??l??niures (R 2 Se 2, les analogues de disulfures), et s??l??nols (RSeH, des analogues de thiols). Les repr??sentants des s??l??niures, dis??l??niures et s??l??nols comprennent respectivement s??l??nom??thionine, dis??l??niure de diph??nyle, et Benz??nes??l??nol. Le sulfoxyde en chimie du soufre est repr??sent?? par la chimie du s??l??nium dans les selenoxides formule (RSe (O) R), qui sont des interm??diaires dans la synth??se organique, comme l'illustre le r??action d'??limination s??l??noxyde. Conform??ment aux tendances indiqu??es par le r??gle de la double liaison, selenoketones, R (C = Se) R, et selenaldehydes, R (C = Se) H, sont rarement observ??s.
Histoire
S??l??nium ( grec σελήνη Selene sens "Moon") a ??t?? d??couvert en 1817 par J??ns Jakob Berzelius et Johan Gottlieb Gahn. Les deux chimistes poss??daient une usine de chimie proximit?? Gripsholm, Su??de produire de l'acide sulfurique par le processus de chambre plomb. La pyrite de la Falun mienne cr???? un pr??cipit?? rouge dans les chambres de plomb qui ??tait pr??sum?? ??tre un compos?? de l'arsenic, et ainsi l'utilisation de la pyrite ?? fabriquer de l'acide a ??t?? abandonn??e. Berzelius et Gahn voulaient utiliser la pyrite et ils ont ??galement observ?? que le pr??cipit?? rouge d??gageait une odeur de raifort lorsqu'il est br??l??. Cette odeur ne ??tait pas typique de l'arsenic, mais une odeur similaire a ??t?? connu du tellure compos??s. Par cons??quent, la premi??re lettre de Berzelius ?? Alexander Marcet a d??clar?? que ce ??tait un compos?? de tellure. Toutefois, l'absence de compos??s du tellure dans la Falun min??raux de la mine a finalement conduit Berzelius ?? r??analyser le pr??cipit?? rouge, et en 1818 il a ??crit une seconde lettre ?? Marcet d??crivant un ??l??ment nouvellement trouv?? semblable ?? du soufre et de tellure. En raison de sa ressemblance avec le tellure, du nom de la Terre, Berzelius nomm?? le nouvel ??l??ment apr??s la Lune .
En 1873, Willoughby Smith a constat?? que la r??sistance ??lectrique de s??l??nium gris ??tait d??pendante de la lumi??re ambiante. Cela a conduit ?? son utilisation en tant que cellule pour d??tecter la lumi??re. La premi??re des produits commerciaux utilisant le s??l??nium ont ??t?? d??velopp??s par Werner Siemens au milieu des ann??es 1870. La cellule de s??l??nium a ??t?? utilis?? dans la photophone d??velopp?? par Alexander Graham Bell en 1879. Le s??l??nium transmet un courant ??lectrique proportionnel ?? la quantit?? de lumi??re tombant sur sa surface. Ce ph??nom??ne a ??t?? utilis?? dans la conception de m??tres l??g??res et de dispositifs similaires. Les propri??t??s semi-conductrices de s??l??nium ont trouv?? de nombreuses autres applications dans l'??lectronique. Le d??veloppement de redresseurs de s??l??nium ont commenc?? au d??but des ann??es 1930, et ceux-ci remplac??s redresseurs d'oxyde de cuivre en raison de leur efficacit?? sup??rieures. Ces dur?? dans des applications commerciales jusqu'?? ce que les ann??es 1970, apr??s quoi ils ont ??t?? remplac??s par des moins co??teux et encore plus efficace redresseurs au silicium.
Le s??l??nium est venu ?? l'avis m??dical tard en raison de sa toxicit?? pour les ??tres humains qui travaillent dans les industries. Le s??l??nium a ??galement ??t?? reconnu comme une toxine v??t??rinaire importante, que l'on voit chez les animaux qui ont mang?? des plantes de haute s??l??nium. En 1954, les premiers signes de fonctions biologiques sp??cifiques de s??l??nium ont ??t?? d??couverts dans micro-organismes. Son caract??re essentiel pour la vie des mammif??res a ??t?? d??couvert en 1957. Dans les ann??es 1970, il a ??t?? montr?? pour ??tre pr??sent dans deux ensembles ind??pendants de enzymes. Ceci a ??t?? suivi par la d??couverte de s??l??nocyst??ine dans les prot??ines. Pendant les ann??es 1980, il a ??t?? montr?? que la s??l??nocyst??ine est cod??e par le codon UGA . Le m??canisme de recodage a travaill?? d'abord dans les bact??ries , puis dans les mammif??res (voir ??l??ment SECIS).
Occurrence

Natif (c.-??-??l??mentaire) le s??l??nium est un min??ral rare, qui ne fait pas habituellement de bons cristaux, mais, quand il le fait, ils sont rhombo??dres raide ou minuscule aciculaire des cristaux (ressemblant ?? des cheveux). Isolement de s??l??nium est souvent compliqu??e par la pr??sence d'autres compos??s et ??l??ments.
Le s??l??nium est naturellement pr??sent dans un certain nombre de formes inorganiques, y compris selenide-, selenate-, et s??l??nite-contenant des min??raux, mais ces min??raux sont rares. Le min??ral commun s??l??nite est pas un min??ral de s??l??nium, et ne contient pas de ion s??l??nite, mais est plut??t un type de gypse (sulfate de calcium hydrat??) nomm?? comme le s??l??nium pour la lune bien avant la d??couverte de s??l??nium. Le s??l??nium est le plus souvent trouv?? assez impure, le remplacement d'une petite partie du soufre dans les minerais de sulfure de nombreux m??taux.
Dans les syst??mes biologiques, le s??l??nium se trouve dans les acides amin??s s??l??nom??thionine, s??l??nocyst??ine, et m??thyls??l??nocyst??ine. Dans ces compos??s, le s??l??nium joue un r??le analogue ?? celui du soufre. Une autre origine naturelle organos??l??nium compos?? est le s??l??niure de dim??thyle.
Certains solides sont riches en s??l??nium et le s??l??nium peuvent ??tre bioconcentr?? par certaines plantes. Dans les sols, le s??l??nium se produit le plus souvent dans des formes solubles comme s??l??niate (analogues au sulfate), qui sont lessiv??s dans les rivi??res tr??s facilement par le ruissellement. L'eau de mer contient des quantit??s importantes de s??l??nium.
Les sources anthropiques de s??l??nium comprennent la combustion du charbon et de l'extraction et de la fusion des minerais sulfur??s.
Production
Le s??l??nium est le plus souvent produit ?? partir de dans de nombreux s??l??niure sulfure minerais, tels que ceux de cuivre , d'argent , ou plomb . Raffinage ??lectrolytique de m??tal est particuli??rement favorable ?? la production de s??l??nium en tant que sous-produit, et il est obtenu ?? partir de la la boue d'anode de raffineries de cuivre. Une autre source a ??t?? la boue de la chambres de plomb acide sulfurique plantes mais cette m??thode pour produire de l'acide sulfurique ne est plus utilis??. Ces boues peuvent ??tre trait??s par un certain nombre de moyens pour obtenir du s??l??nium. Cependant, le s??l??nium ??l??mentaire est plus comme sous-produit de cuivre de raffinage ou de produire de l'acide sulfurique . Depuis l'invention de extraction par solvant et par voie ??lectrolytique (SX / EW) pour la production de cuivre Cette m??thode prend une part croissante de la production de cuivre large du monde. Cela modifie la disponibilit?? de s??l??nium, car seule une petite partie comparable du s??l??nium dans le minerai est lixivi?? avec le cuivre.
La production industrielle de s??l??nium implique g??n??ralement l'extraction de le dioxyde de s??l??nium ?? partir de r??sidus obtenus au cours de la purification de cuivre. Production commune ?? partir du r??sidu commence alors par oxydation avec le carbonate de sodium pour produire du dioxyde de s??l??nium. Le dioxyde de s??l??nium est ensuite m??lang?? avec de l'eau et la solution est acidifi??e pour former l'acide s??l??nieux ( ??tape d'oxydation). Acide s??l??nieux est mis ?? barboter avec le dioxyde de soufre ( ??tape de r??duction) pour donner s??l??nium ??l??mentaire.
Environ 2.000 tonnes de s??l??nium a ??t?? produit en 2011 ?? travers le monde, principalement en Allemagne (650 t), le Japon (630 t), la Belgique (200 t) et la Russie (140 t), et le total des r??serves ont ??t?? estim??es ?? 93 000 tonnes. Toutefois, ces donn??es excluent les deux principaux producteurs, les ??tats-Unis et la Chine. Le prix a ??t?? relativement stable au cours de 2004-2010 ?? ~ $ 30 par livre (100 livres par beaucoup), mais a augment?? ?? 65 $ / lb en 2011. Une forte augmentation a ??t?? observ??e pr??c??dente en 2004 4-5 ?? 27 $ / kg. La consommation en 2010 a ??t?? divis?? comme suit: m??tallurgie - 30%, la fabrication de verre - 30%, l'agriculture - 10%, les produits chimiques et des pigments - 10%, de l'??lectronique - 10%. La Chine est le consommateur dominante de s??l??nium ?? 1500-2000 tonnes / an.
Applications
??lectrolyse Mangan??se
Au cours de l'??lectro gagner de mangan??se un ajout de dioxyde de s??l??nium diminue la puissance n??cessaire pour faire fonctionner le des cellules d'??lectrolyse. La Chine est le plus grand consommateur de dioxyde de s??l??nium ?? cet effet. Pour chaque tonne de mangan??se en moyenne de 2 kg d'oxyde de s??l??nium est utilis??.
La production de verre
La plus grande utilisation commerciale de Se, qui repr??sente environ 50% de la consommation, est pour la production de verre. Se compos??s conf??rent une couleur rouge au verre. Cette couleur annule les teintes vertes ou jaunes qui se posent des impuret??s de fer qui sont typiques pour la plupart verre. A cet effet, divers sels de s??l??nite et s??l??niate sont ajout??s. Pour d'autres applications, la couleur rouge peut ??tre souhaitable, dans lequel cas des m??langes de CdSe et CdS sont ajout??s.
Alliages
Le s??l??nium est utilis?? avec du bismuth dans laitons pour remplacer plus toxiques de plomb . Le r??glement du plomb dans les applications d'eau potable avec le Loi sur la salubrit?? de l'eau potable de 1974 fait une r??duction du plomb en laiton n??cessaire. Le nouveau laiton est commercialis?? sous le nom EnviroBrass. Comme le plomb et le soufre, le s??l??nium permet d'am??liorer l'usinabilit?? de l'acier ?? des concentrations de 0,15%. La m??me am??lioration est ??galement observ??e dans les alliages de cuivre et donc s??l??nium est ??galement utilis?? dans les alliages de cuivre usinables.
Cellules solaires
Cuivre gallium s??l??niure d'indium est un mat??riau utilis?? dans la production de cellules solaires.
D'autres utilisations
De petites quantit??s de compos??s organos??l??ni??s sont utilis??s pour modifier la des catalyseurs de vulcanisation utilis??s dans la fabrication de caoutchouc.
La demande pour le s??l??nium par l'industrie de l'??lectronique est en baisse, malgr?? un certain nombre de demandes de continuation. En raison de sa photovolta??que et propri??t??s photoconductrices, le s??l??nium est utilis?? dans photocopie, cellules photo??lectriques, m??tres l??gers et cellules solaires. Son utilisation comme photoconducteur dans les photocopieurs ?? papier ??tait une fois une application de premier plan, mais dans les ann??es 1980, la demande a diminu?? de photoconducteur (m??me se il ??tait encore un grand-utilisation finale) que de plus en plus copieurs mis ?? l'utilisation de photoconducteurs organiques. Il ??tait une fois largement utilis?? dans redresseurs de s??l??nium. Ces utilisations ont pour la plupart ??t?? remplac??s par des dispositifs ?? base de silicium ou sont en cours de remplacement. L'exception la plus notable est au pouvoir DC protection contre les surtensions, lorsque les capacit??s ??nerg??tiques sup??rieurs de suppresseurs de s??l??nium les rendent plus souhaitables que varistances d'oxyde m??tallique.
S??l??niure de zinc ??tait le premier mat??riau pour le bleu LED mais nitrure de gallium domine le march?? aujourd'hui. S??l??niure de cadmium a r??cemment jou?? un r??le important dans la fabrication de points quantiques. Feuilles de converti de s??l??nium amorphe images aux rayons X pour les mod??les de charge de x??roradiographie et ?? l'??tat solide, ?? ??cran plat cam??ras x-ray.
Le s??l??nium est un catalyseur dans certaines r??actions chimiques, mais elle ne est pas largement utilis?? en raison de probl??mes de toxicit??. En Cristallographie aux rayons X, l'incorporation d'un ou plusieurs atomes de s??l??nium en place du soufre contribue ?? Multi-longueur d'onde dispersion anormale et Longueur d'onde unique dispersion anormale de phasage.
Le s??l??nium est utilis?? dans le tonification des tirages photographiques, et il est vendu comme un toner par de nombreux fabricants photographiques. Son utilisation se intensifie et se ??tend la gamme de tons des images photographiques en noir et blanc et am??liore la stabilit?? des tirages.
75 Se est utilis?? comme source de rayons gamma dans la radiographie industrielle.
R??le biologique
| NFPA 704 |
|---|
 0 2 0 |
| diamant incendie pour s??l??nium ??l??mentaire |
M??me se il est toxique ?? fortes doses, le s??l??nium est un ??l??ment essentiel micronutriments pour les animaux. Dans les usines, il se produit comme un min??ral du spectateur, parfois dans des proportions toxiques dans fourrage (certaines plantes peut se accumuler le s??l??nium comme une d??fense contre ??tre mang?? par les animaux, mais d'autres plantes telles que locoweed n??cessite s??l??nium, et leur croissance indique la pr??sence de s??l??nium dans le sol). En savoir plus sur la nutrition des plantes ci-dessous.
Le s??l??nium est un composant de l'insolite acides amin??s s??l??nocyst??ine et s??l??nom??thionine. Chez l'homme, s??l??nium est un oligo-??l??ments en ??l??ments nutritifs qui fonctionne comme cofacteur r??duction des antioxydants tels que des enzymes, glutathion peroxydases et certaines formes de thior??doxine r??ductase trouv?? chez les animaux et certaines plantes (cette enzyme se produit dans tous les organismes vivants, mais pas toutes les formes de celui-ci dans les plantes exigent s??l??nium).
Le glutathion peroxydase famille d'enzymes (GSH-Px) catalyser certaines r??actions qui ??liminent les esp??ces r??actives de l'oxyg??ne tels que le peroxyde d'hydrog??ne et organique hydroperoxydes:
- 2 GSH + H 2 O 2 ---- GSH-Px → GSSG + 2 H 2 O
Le s??l??nium joue ??galement un r??le dans le fonctionnement du glande thyro??de et dans chaque cellule qui utilise l'hormone thyro??dienne, en participant en tant que cofacteur pour trois des quatre types connus de l'hormone thyro??dienne d??siodases, qui activent et d??sactivent alors diverses hormones thyro??diennes et leurs m??tabolites: la d??siodases iodothyronine sont la sous-famille d'enzymes qui utilisent d??iodinases s??l??nium sous forme d'acide amin?? rare autrement s??l??nocyst??ine. (Seul le d??iodinase d??iodinase iodotyrosine, qui travaille sur les derniers produits de d??gradation de l'hormone thyro??dienne, ne pas utiliser le s??l??nium).
Le s??l??nium peut inhiber La maladie de Hashimoto, dans lequel les cellules de la thyro??de propres de l'organisme sont attaqu??s comme ??tranger. Une r??duction de 21% sur les anticorps de TPO a ??t?? signal?? avec l'apport alimentaire de 0,2 mg de s??l??nium.
L'apport de s??l??nium alimentaire accru r??duire les effets de la toxicit?? du mercure et il est maintenant reconnu que le m??canisme mol??culaire de la toxicit?? du mercure implique inhibition irr??versible de s??l??noenzymes qui sont n??cessaires pour pr??venir et inverser les dommages oxydatifs dans les tissus c??r??braux et endocriniens.
Evolution en biologie
De il ya environ trois milliards d'ann??es, les familles de s??l??noprot??ines procaryotes voiture l'??volution de la s??l??nocyst??ine. Le s??l??nium est incorpor?? dans plusieurs familles de s??l??noprot??ines procaryotes dans des bact??ries, arch??es et eucaryotes comme s??l??nocyst??ine, o?? peroxyr??doxines de s??l??noprot??ines prot??gent les cellules bact??riennes et eucaryotes contre les dommages oxydatifs. familles de s??l??noprot??ine de GSH-Px et les d??siodases de cellules eucaryotes semblent avoir une infection bact??rienne origine phylog??n??tique. Le formulaire contenant s??l??nocyst??ine-produit dans esp??ces aussi diverses que les algues vertes, les diatom??es, oursin, poisson et le poulet. enzymes de s??l??nium sont impliqu??s dans l'utilisation des petites mol??cules r??ductrices le glutathion et thior??doxine. Une famille de mol??cules contenant du s??l??nium (la glutathion peroxydases) d??truisent les membranes cellulaires endommag??es peroxyd??s de peroxyde et de r??paration, en utilisant le glutathion. Une autre enzyme contenant du s??l??nium dans certaines plantes et chez les animaux ( thior??doxine r??ductase) g??n??re thior??doxine r??duite, un dithiol qui sert de source d'??lectrons pour les peroxydases et r??duisant ??galement l'enzyme importante ribonucl??otide r??ductase qui rend pr??curseurs de l'ADN ?? partir de pr??curseurs d'ARN.
Les oligo-??l??ments impliqu??s dans la GSH-Px et activit??s des enzymes superoxyde dismutase, ce est ?? dire le s??l??nium, le vanadium , le magn??sium , le cuivre et le zinc , peut-??tre fait d??faut dans certaines zones mini??res d??ficient terrestres. Les organismes marins conserv??s et parfois ??largi leurs s??l??no-prot??omes, alors que les s??l??no-prot??omes de certains organismes terrestres ont ??t?? r??duits ou compl??tement perdus. Ces r??sultats sugg??rent que, ?? l'exception des vert??br??s , la vie aquatique soutient l'utilisation de s??l??nium, alors que les habitats terrestres conduisent ?? une utilisation r??duite de cet oligo-??l??ment. Poissons marins et les glandes thyro??diennes vert??br??s ont la plus forte concentration de s??l??nium et l'iode. D'environ 500 Mya, d'eau douce et des plantes terrestres optimis??e lentement la production de ??nouveaux?? antioxydants endog??nes comme l'acide ascorbique (vitamine C), polyph??nols (flavono??des y compris), tocoph??rols, etc. Quelques-uns d'entre eux sont apparus plus r??cemment, dans les 50-200000000 derni??res ann??es, dans les fruits et les fleurs de plantes angiospermes. En fait, les angiospermes (le type dominant de l'usine d'aujourd'hui) et la plupart de leurs pigments antioxydants ont ??volu?? au cours de la fin du Jurassique p??riode.
Le d??iodinase isoenzymes constituent une autre famille de s??l??noprot??ines eucaryotes avec fonction enzyme identifi??e. D??siodases sont capables d'extraire les ??lectrons des iodures et iodures de iodothyronines. Ils sont, par cons??quent, impliqu??s dans la r??gulation de la thyro??de hormone, en participant ?? la protection des thyrocytes des dommages caus??s par H 2 O 2 produits pour la thyro??de biosynth??se des hormones. Environ 200 Mya, nouvelles s??l??noprot??ines ont ??t?? d??velopp??s comme mammif??res enzymes GSH-Px.
esp??ces v??g??tales de l'indicateur
Certaines esp??ces de plantes sont consid??r??es comme des indicateurs ?? forte teneur en s??l??nium du sol, car ils n??cessitent des niveaux ??lev??s de s??l??nium pour prosp??rer. Les principales plantes indicatrices de s??l??nium sont Astragalus esp??ces (y compris certains locoweeds), plume de prince ( Sp Stanleya.), Asters ligneuses ( Xylorhiza sp.), Et faux goldenweed ( Oonopsis sp.)
L'usage m??dical
La substance vaguement appel?? le sulfure de s??l??nium (formule approximative SeS 2) est l'ingr??dient actif dans certains shampooings antipelliculaires. Le compos?? de s??l??nium tue le champignon du cuir chevelu Malassezia, ce qui provoque la perte de fragments de peau s??che. L'ingr??dient est ??galement utilis?? dans les lotions pour le corps ?? traiter Pityriasis versicolor due ?? une infection par une esp??ce diff??rente de Malassezia champignon.
D??tection dans des fluides biologiques
Le s??l??nium peut ??tre mesur??e dans le sang, le plasma, le s??rum ou l'urine de suivre l'exposition environnementale ou professionnelle excessive, confirmer un diagnostic d'empoisonnement chez les victimes hospitalis??s ou pour aider ?? une enqu??te m??dico-l??gale dans un cas de surdosage fatal. Certaines techniques analytiques sont capables de distinguer organique des formes inorganiques de l'??l??ment. Les deux formes organiques et inorganiques de s??l??nium sont en grande partie convertis en monosaccharide conjugu??s (selenosugars) dans le corps avant d'??tre ??limin?? dans les urines. Les patients canc??reux recevant des doses orales quotidiennes de selenothionine peuvent atteindre des concentrations tr??s ??lev??es de plasma et l'urine s??l??nium.
Toxicit??
Bien que le s??l??nium est un ??l??ment essentiel oligo-??l??ment, il est toxique se il est pris en exc??s. Le d??passement de la Apport maximal tol??rable de 400 microgrammes par jour peut conduire ?? s??l??nose. Cette 400 microgrammes ( ug) apport maximal tol??rable est fond??e principalement sur une ??tude de 1986 de cinq patients chinois qui pr??sentaient des signes manifestes de s??l??nose et un suivi ??tude sur les m??mes cinq personnes en 1992. L'??tude de 1992 fait trouv?? l'alimentaire sans danger maximale Se apport ?? environ 800 microgrammes par jour (15 microgrammes par kilogramme de poids corporel), mais il a sugg??r?? de 400 microgrammes par jour pour ??viter non seulement toxicit??, mais aussi pour ??viter de cr??er un d??s??quilibre des nutriments dans l'alimentation et pour tenir compte des donn??es provenant d'autres pays. En Chine, les gens qui ont ing??r?? du ma??s cultiv??s dans extr??mement riche en s??l??nium du charbon de pierre (carbon??e schiste) ont souffert de la toxicit?? du s??l??nium. Ce charbon a ??t?? montr?? pour avoir teneur en s??l??nium aussi ??lev?? que 9,1%, la plus forte concentration dans le charbon jamais enregistr??e dans la litt??rature.
Les sympt??mes de s??l??nose comprennent une odeur d'ail sur le souffle, troubles gastro-intestinaux, perte de cheveux, des ongles desquamation, fatigue, irritabilit??, et des dommages neurologiques. Les cas extr??mes de s??l??nose peuvent entra??ner la cirrhose du foie, ??d??me pulmonaire, et la mort. S??l??nium ??l??mentaire et plus m??tallique s??l??niures ont des toxicit??s relativement faibles en raison de leur faible biodisponibilit??. Par contre, s??l??niates et s??l??nites sont tr??s toxiques, ayant un mode d'oxydant d'action similaire ?? celle du trioxyde d'arsenic. La dose toxique de s??l??nite chronique pour l'homme est d'environ 2400 ?? 3000 microgrammes de s??l??nium par jour pendant une longue p??riode. S??l??niure d'hydrog??ne est un gaz extr??mement toxique corrosive. Le s??l??nium se produit ??galement dans des compos??s organiques, tels que le s??l??niure de dim??thyle, s??l??nom??thionine, s??l??nocyst??ine et m??thyls??l??nocyst??ine, qui ont tous ??lev?? biodisponibilit?? et sont toxiques ?? fortes doses.
Le 19 Avril 2009, 21 poneys de polo sont morts peu de temps avant un match aux Etats-Unis Polo Ouvrir. Trois jours plus tard, une pharmacie a publi?? un communiqu?? expliquant que les chevaux avaient re??u une dose incorrecte de l'un des ingr??dients utilis??s dans un compos?? de suppl??ment de vitamine / min??ral qui avaient ??t?? incorrectement aggrav?? par une compoundage pharmacie. Analyse des taux sanguins des compos??s inorganiques dans le suppl??ment indiqu?? les concentrations de s??l??nium ??taient dix ?? quinze fois plus ??lev?? que la normale dans les chevaux ' des ??chantillons de sang et de 15 ?? 20 fois plus ??lev?? que la normale dans les ??chantillons de foie. Il a ??t?? confirm?? plus tard que le s??l??nium ??tait l'ingr??dient en question.
intoxication s??l??nium des syst??mes d'eau peut entra??ner chaque fois de nouveaux cours de ruissellement agricoles, par le biais de terrains non am??nag??s normalement s??ches. Ce processus se infiltre compos??s solubles naturelles de s??l??nium (comme s??l??niates) dans l'eau, qui peut ensuite ??tre concentr?? dans les nouvelles ??zones humides??, comme l'eau se ??vapore. Des niveaux ??lev??s de s??l??nium produites de cette fa??on ont ??t?? trouv??s pour avoir caus?? certains troubles cong??nitaux chez les oiseaux des zones humides.

Chez les poissons et d'autres animaux sauvages, les faibles niveaux de s??l??nium causer une carence alors que les niveaux ??lev??s causent la toxicit??. Par exemple, dans le saumon, la concentration optimale de s??l??nium dans les tissus de poissons (corps) est d'environ 1 microgramme s??l??nium par gramme de tissu (poids sec). ?? des niveaux nettement inf??rieurs que la concentration, les jeunes saumons meurent de carence en s??l??nium; bien au-dessus de ce niveau, ils meurent de l'exc??s toxique.
Carence
La carence en s??l??nium est rare en bonne sant??, les individus bien nourris. Il peut survenir chez les patients s??v??rement compromise la fonction intestinale, ceux subissant nutrition parent??rale totale, et dans celles d'un ??ge avanc?? (plus de 90). Aussi, les personnes d??pendantes sur les aliments cultiv??s ?? partir du sol en s??l??nium d??ficiente sont ?? risque. Bien que la Nouvelle-Z??lande a de faibles niveaux de s??l??nium dans son sol, les effets n??fastes sur la sant?? ne ont pas ??t?? d??tect??s.
Une d??ficience en s??l??nium tel que d??fini par faible (<60% de la normale) des niveaux d'activit?? de selenoenzyme dans les tissus du cerveau et le syst??me endocrinien se produit uniquement lorsque l'??tat bas de s??l??nium est li??e ?? un stress suppl??mentaire, tel que de fortes expositions au mercure ou ?? la suite d'une augmentation du stress oxydant d?? de carence en vitamine E.
Il existe des interactions entre le s??l??nium et d'autres ??l??ments nutritifs, tels que l'iode et la vitamine E. L'effet de la carence en s??l??nium sur la sant?? demeure incertain, en particulier en ce qui concerne La maladie de Kashin-Beck.
Dans certaines r??gions (par exemple diverses r??gions en Am??rique du Nord), o?? de faibles niveaux de s??l??nium disponibles en plomb du sol ?? de faibles concentrations en mati??re s??che des plantes, la carence Se chez certaines esp??ces animales peuvent se produire ?? moins alimentaire (ou inject??) la suppl??mentation en s??l??nium est fait. Ruminants sont particuli??rement sensibles. En g??n??ral, l'absorption de s??l??nium alimentaire chez les ruminants est plus faible que chez les non-ruminants, et est plus faible que des fourrages de grain. Ruminants broutant certains fourrages, par exemple, certaines vari??t??s de tr??fle blanc contenant des glucosides cyanog??n??tiques, peuvent avoir des exigences de s??l??nium plus ??lev??es, probablement en raison de cyanure de l'aglycone lib??r?? par activit?? glucosidase dans le rumen et l'inactivation de glutathion peroxydases raison de l'effet de cyanure absorb??e sur le glutathion fragment. Ruminants nouveau-n??s ?? risque des ADM (maladie du muscle blanc) peuvent ??tre administr??s ?? la fois le s??l??nium et la vitamine E par injection; certains des myopathies ADM r??pondent uniquement aux s??l??nium, certains ne en vitamine E, et certains soit.
Effets sur la sant?? controvers??s
Un certain nombre d'études épidémiologiques corrélatifs ont impliqué une carence en sélénium (telle que mesurée par les niveaux sanguins) dans un certain nombre de maladies graves ou chroniques, comme le cancer, le diabète , le VIH / sida et la tuberculose . En outre, la supplémentation en sélénium a été trouvé pour être un chimiopréventif pour certains types de cancer dans certains types de rongeurs. Cependant, dans, aveuglés, essais prospectifs randomisés chez l'homme, la supplémentation en sélénium n'a pas réussi à réduire l'incidence d'une maladie, ni a une méta-analyse de ces études de supplémentation en sélénium détecté une diminution de la mortalité globale.

