
Scandium
Contexte des ??coles Wikip??dia
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
| Scandium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
21 Sc | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | scandium, Sc, 21 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s k ?? n r?? Je ə m / SKAN -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 3, 4, r?? | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 44.955912 (6) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 3d 1 4s 2 2, 8, 9, 2 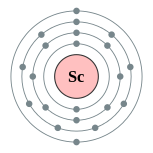 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pr??diction | Dmitri Mendeleev (1871) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Lars Fredrik Nilson (1879) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Lars Fredrik Nilson (1879) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 2,985 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 2,80 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1814 K , 1541 ?? C, 2806 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3109 K, 2836 ?? C, 5136 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 14,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 332,7 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,52 J ?? mol -1 .K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 (Oxyde amphot??re) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,36 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 633,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1235,0 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2388,6 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 162 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 170 ?? 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 211 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (α, le poly) calc. 562 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 15,8 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, le poly) 10,2 um / (m ?? K) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 74,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 29,1 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 56,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,279 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 750 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-20-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de scandium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Le scandium est un ??l??ment chimique avec le symbole Sc et de num??ro atomique 21. Un m??tallique blanc argent?? m??tal de transition , il a toujours ??t?? parfois class??e comme une ??l??ment des terres rares, ainsi que l'yttrium et les lanthanides . Il a ??t?? d??couvert en 1879 par analyse spectrale des min??raux eux??nite et gadolinite partir Scandinavie.
Scandium est pr??sent dans la plupart des d??p??ts de terre rares et uranium compos??s, mais il est extrait de ces minerais en seulement quelques mines dans le monde entier. En raison de la faible disponibilit?? et les difficult??s dans la pr??paration de scandium m??tallique, qui a ??t?? fait en 1937, il a fallu attendre les ann??es 1970, avant les demandes de scandium ont ??t?? d??velopp??s. Les effets positifs de scandium sur aluminium alliages ont ??t?? d??couverts dans les ann??es 1970, et son utilisation dans de tels alliages reste sa seule application majeure. Le commerce mondial du m??tal pur est d'environ une centaine de livres par an en moyenne.
Les propri??t??s des compos??s de scandium sont interm??diaires entre celles de l'aluminium et de l'yttrium. Un relation diagonale existe entre le comportement de magn??sium et le scandium, tout comme il est entre le b??ryllium et d'aluminium. Dans les compos??s chimiques des ??l??ments indiqu??s dans le groupe 3, ci-dessus, l'??tat d'oxydation pr??dominant est trois.
Propri??t??s
Les caract??ristiques chimiques de l'??l??ment
Scandium est un m??tal mou avec un aspect argent??. Il d??veloppe une fonte l??g??rement jaun??tre ou ros??tre lorsqu'il est oxyd?? par l'air. Il est sensible aux intemp??ries et se dissout lentement dans la plupart des acides dilu??s. Il ne r??agit pas avec un m??lange 1: 1 d' acide nitrique (HNO 3) et acide fluorhydrique (HF), ??ventuellement en raison de la formation d'un imperm??able couche passive.
Isotopes
Scandium existe naturellement exclusivement comme isotope Sc 45, qui a un spin nucl??aire de 7/2. Treize des radio-isotopes ont ??t?? caract??ris??s par le plus stable ??tant Sc 46 avec une demi-vie de 83,8 jours, 47 Sc avec une demi-vie de 3,35 jours, et 48 Sc, avec une demi-vie de 43,7 heures. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 4 heures, et la majorit?? d'entre eux ont des demi-vies qui sont moins de 2 minutes. Cet ??l??ment a ??galement cinq m??ta Etats avec plus stable Sc l'??tre de 44m (t ?? = 58,6 h).
Les isotopes de gamme de scandium Sc de 36 ?? 60 Sc. Le primaire mode de d??sint??gration ?? des masses plus faibles que le seul isotope stable, 45 Sc, est capture d'??lectrons, et le premier mode au-dessus des masses, il est ??missions beta. Le primaire produits de d??sint??gration ?? poids atomiques ci-dessous 45 Sc sont calcium isotopes et les produits primaires de poids atomiques ??lev??s sont titane isotopes.
Occurrence
Sur le plan de la cro??te terrestre, le scandium est pas particuli??rement rare. Les estimations varient de 18 ?? 25 ppm, ce qui est comparable ?? l'abondance de cobalt (20-30 ppm). Scandium est seulement le 50e ??l??ment le plus commun sur terre (35e le plus abondant dans la cro??te), mais ce est la 23e ??l??ment le plus commun dans le Sun . Toutefois, le scandium est distribu?? peu et se produit dans l'??tat de traces dans de nombreux min??raux . Min??raux rares en provenance de Scandinavie et de Madagascar tels que Thortveitite, euxenite, et gadolinite sont concentr??es seulement les sources connues de cet ??l??ment. Thortveitite peut contenir jusqu'?? 45% de scandium dans la forme de scandium (III) oxyde.
La forme stable de scandium est cr???? dans supernovas via le r-processus.
Production
La production mondiale de scandium est de l'ordre de 2 tonnes par an sous forme de l'oxyde de scandium. La production primaire est de 400 kg tandis que le reste est ?? partir des stocks de la Russie g??n??r??s au cours de la guerre froide . En 2003, seulement trois mines ont produit scandium: les mines d'uranium et de fer dans Zhovti Vody en Ukraine , les mines de terres rares Bayan Obo, la Chine et les mines d'apatite dans le P??ninsule de Kola, en Russie . Dans chaque cas, le scandium est un sous-produit de l'extraction d'autres ??l??ments et est vendu sous forme d'oxyde de scandium.
La production de scandium m??tallique est de l'ordre de 10 kg par an. L'oxyde est transform?? en le fluorure de scandium et m??tallique r??duit avec du calcium .
Madagascar et Iveland- Evje r??gion en Norv??ge ont les seuls gisements de min??raux ?? haute teneur en scandium, Thortveitite (Sc, Y) 2 (Si 2 O 7) et kolbeckite BPSC 4 ?? 2H 2 O, mais ceux-ci ne sont pas exploit??es.
L'absence de production fiable, s??r, stable et ?? long terme a limit?? les applications commerciales de scandium. Malgr?? ce faible niveau d'utilisation, le scandium offre des avantages significatifs. Particuli??rement prometteuse est le renforcement des alliages d'aluminium avec aussi peu que 0,5% de scandium. zircone Scandium stabilis?? b??n??ficie d'une demande croissante du march?? pour l'utilisation comme un ??lectrolyte ?? haute efficacit?? dans les piles ?? combustible ?? oxyde solide.
Compos??s
La chimie est presque enti??rement domin?? par l'ion trivalent, Sc 3+. Les rayons des ions M de la table ci-dessous indiquent que, en termes de propri??t??s chimiques, les ions de scandium sont plus proches de ceux de l'yttrium que pour celles de l'aluminium. Dans le cadre de cette similarit??, scandium est souvent consid??r?? comme un ??l??ment lanthanide-like.
Oxydes et hydroxydes
L'oxyde Sc 2 O 3 et l'hydroxyde Sc (OH) 3 sont amphot??re:
- Sc (OH) 3 + 3 OH - → Sc (OH) 3-
6 - Sc (OH) 3 + 3 + H + 3 H 2 O → [Sc (H 2 O) 6] 3+
Les formes α- et γ- d'hydroxyde de l'oxyde de scandium (OCS (OH)), sont avec leur isostructural homologues d'oxyhydroxyde d'aluminium. Solutions de Sc 3+ dans l'eau sont acide ?? cause de hydrolyse.
Halog??nures et pseudohalog??nures
Le SCX halog??nures 3 (X = Cl, Br, I) sont tr??s solubles dans l'eau, mais ScF 3 est insoluble. Dans les quatre halog??nures scandium est 6-coordonn??s. Les halog??nures sont Acides de Lewis; par exemple, ScF 3 dissout une solution contenant un exc??s de fluorure pour former [ScF 6] 3-. L'indice de coordination 6 est typique de Sc (III). Dans les grandes Y 3+ et La 3+, nombres de coordination de 8 et 9 sont communs. Scandium (III) le triflate est parfois utilis??e en tant que Catalyseur acide de Lewis dans la chimie organique .
D??riv??s organiques
Scandium forme une s??rie de compos??s organom??talliques avec ligands cyclopentadi??nyle (Cp), similaire au comportement des lanthanides. Un exemple est le dim??re pont?? de chlore, [SCCP 2 Cl] 2 et de d??riv??s apparent??s pentam??thylcyclopentadi??nyl ligands.
??tats d'oxydation rares
Compos??s qui comportent scandium dans l'??tat d'oxydation autre que trois sont rares, mais bien caract??ris??e. Le compos?? bleu-noir CsScCl 3 est l'un des plus simple. Ce mat??riau adopte une structure en forme de feuille qui pr??sente une grande liaison entre les centres de scandium (II). D'hydrure de scandium est pas bien comprise, mais il ne semble pas ??tre un saline hydrure de Sc (II). Comme cela est observ?? pour la plupart des ??l??ments, un hydrure de scandium diatomique a ??t?? observ?? par spectroscopie ?? haute temp??rature dans la phase gazeuse. borures et carbures sont Scandium non-stoechiom??trique, ce qui est typique pour les ??l??ments voisins.
Histoire
Dmitri Mendele??ev , cr??ateur de la table p??riodique , pr??dit l'existence d'un ??l??ment ekaboron, avec un masse atomique entre 40 et 48 en 1869. Lars Fredrik Nilson et son ??quipe d??tect??e cet ??l??ment dans les min??raux eux??nite et gadolinite. Nilson pr??par?? deux grammes de l'oxyde de scandium d'une grande puret??. Il a nomm?? le scandium de l'??l??ment, du latin Scandia signifiant "Scandinavia". Nilson ??tait apparemment pas au courant de la pr??diction de Mendele??ev, mais Par Teodor Cleve reconnu la correspondance et notifi??e Mendele??ev.
Scandium m??tallique a ??t?? produite pour la premi??re fois en 1937 par ??lectrolyse d'un m??lange eutectique, ?? 700-800 ?? C , de potassium , de lithium , et chlorures de scandium. Le premier livre de 99% de scandium m??tal pur a ??t?? produit en 1960. L'utilisation des alliages d'aluminium a commenc?? en 1971, ?? la suite d'un brevet am??ricain. Alliages aluminium-scandium ont ??galement ??t?? d??velopp??s dans le URSS .
Cristaux de gadolinium-scandium-grenat de gallium (GSGG) laser ont ??t?? utilis??s dans des applications de d??fense strat??giques ??labor??s dans le Initiative de d??fense strat??gique (IDS) dans les ann??es 1980 et les ann??es 1990.
Applications

L'addition de scandium ?? l'aluminium limite la croissance excessive des grains qui se produit dans la zone affect??e par la chaleur de composants en aluminium soud??s. Cela a deux effets b??n??fiques: le pr??cipit?? Al 3 Sc formes de petits cristaux sont form??s dans d'autres alliages d'aluminium et le volume des zones exemptes pr??cipit?? qui existent normalement dans les limites de grains d'alliages d'aluminium ?? durcissement structural est r??duite. Ces deux effets augmentent l'utilit?? de l'alliage. Cependant, des alliages de titane, qui sont similaires ?? la l??g??ret?? et la r??sistance, sont moins co??teux et beaucoup plus largement utilis??.
La principale application de scandium en poids est dans les alliages aluminium-scandium pour mineurs composants de l'industrie a??rospatiale. Ces alliages contiennent entre 0,1% et 0,5% de scandium. Ils ont ??t?? utilis??s dans l'avion militaire russe, en particulier la MiG-21 et MiG-29.
Certaines pi??ces d'??quipement de sport, qui se appuient sur les mat??riaux de haute performance, ont ??t?? r??alis??s avec des alliages aluminium-scandium, y compris b??tons de baseball, et v??lo cadres et composants. b??tons de crosse sont ??galement r??alis??s avec des alliages de titane-scandium pour profiter de la force de titane. La soci??t?? am??ricaine de fabrication des armes ?? feu Smith & Wesson revolvers produit avec des cadres compos??s d'un alliage de scandium et les cylindres de titane ou d'acier au carbone.
Les dentistes utilisent erbium, le chrome: yttrium-scandium-grenat de gallium (Er, Cr: YSGG) lasers pour la pr??paration de la cavit?? et en endodontie.
Environ 20 kg (Sc 2 O 3) du scandium est utilis?? chaque ann??e dans le ??tats-Unis pour faire des lampes ?? d??charge ?? haute intensit??. L'iodure de scandium, de m??me que l'iodure de sodium, lorsqu'il est ajout?? ?? une forme modifi??e de Lampe ?? vapeur de mercure, produit une forme de Lampe ?? halog??nure de m??tal. Cette lampe est une source de lumi??re blanche ?? haute Indice de rendu de couleur qui ressemble ?? la lumi??re du soleil suffisante pour permettre une bonne reproduction des couleurs avec TV cam??ras. Environ 80 kg de scandium est utilis?? dans les lampes ?? halog??nures m??talliques / ampoules par an ?? l'??chelle mondiale. Les premi??res lampes aux halog??nures m??talliques ?? base de scandium-ont ??t?? brevet??es par General Electric et fabrique en Am??rique du Nord, mais ils sont maintenant produites dans tous les grands pays industrialis??s. Le isotope radioactif 46 Sc est utilis?? dans les raffineries de p??trole comme un agent de tra??age. Triflate de scandium est un catalyseur L'acide de Lewis utilis?? dans la chimie organique .
La sant?? et la s??curit??
Scandium ??l??mentaire est consid??r?? comme l'exp??rimentation animale non toxique et peu de compos??s de scandium a ??t?? fait. Le dose l??tale moyenne (DL 50) des niveaux de scandium (III) chlorure de rats ont ??t?? d??termin??es comme 4 mg / kg pour intrap??riton??ale et 755 mg / kg pour l'administration orale. ?? la lumi??re de ces r??sultats compos??s de scandium doivent ??tre manipul??s comme des compos??s de toxicit?? mod??r??e.
