??tat d'oxydation
Saviez-vous ...
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
L'??tat d'oxydation est un indicateur du degr?? de oxydation d'un atome en un compos?? chimique . L'??tat d'oxydation formel est l'hypoth??tique responsable qu'un atome aurait si tous les liaisons ?? des atomes de diff??rents ??l??ments ??taient de 100% ionique. ??tats d'oxydation sont g??n??ralement repr??sent??s par des nombres entiers , qui peut ??tre positif, n??gatif, ou z??ro. Dans certains cas, l'??tat d'oxydation moyen d'un ??l??ment est une fraction, par exemple 8/3 de fer dans la magn??tite (Fe 3 O 4). L'??tat d'oxydation plus connu est 8 dans les t??troxydes de ruth??nium, x??non, osmium, iridium , et hassium , et certains complexes impliquant du plutonium , tandis que l'??tat d'oxydation le plus bas connu est -4 pour certains ??l??ments de la groupe de carbone.
L'augmentation de l'??tat d'un atome d'oxydation par une r??action chimique est connue comme une oxydation; une diminution de l'??tat d'oxydation est connu en tant que r??duction. Ces r??actions impliquent le transfert formel des ??lectrons, un gain net en ??lectrons ??tant une r??duction et une perte nette d'??lectrons ??tant une oxydation. Pour les ??l??ments purs, l'??tat d'oxydation est z??ro.
La d??finition de l'??tat d'oxydation r??pertori??s par IUPAC est la suivante:
??tat d'oxydation: une mesure du degr?? d'oxydation d'un atome dans une substance. Il est d??fini comme la charge d'un atome peut ??tre imagin?? d'avoir quand les ??lectrons sont compt??s selon un ensemble convenu de r??gles:Par exemple, les ??tats d'oxydation de soufre dans H 2 S, S 8 (de soufre ??l??mentaire), SO 2, SO 3, et H 2 SO 4 sont, respectivement: -2, 0, 4, 6 et 6. Plus le degr?? d'oxydation d'un atome donn?? la plus grande de son degr?? d'oxydation; plus le degr?? d'oxydation plus son degr?? de r??duction.
- (1) l'??tat d'un d'oxydation ??l??ment libre (??l??ment non combin??e) est ??gal ?? z??ro
- (2) pour une simple (monoatomique) ion, l'??tat d'oxydation est ??gale ?? la charge nette sur l'ion
- (3) un atome d'hydrog??ne a un ??tat d'oxydation de 1 'oxyg??ne et a un ??tat d'oxydation de -2 quand ils sont pr??sents dans la plupart des compos??s. (Des exceptions ?? cette r??gle sont que l'hydrog??ne a un ??tat d'oxydation de -1 dans des hydrures de m??taux actifs, par exemple, LiH , et de l'oxyg??ne a un ??tat d'oxydation de -1 ?? les peroxydes, par exemple H 2 O 2
- (4) la somme alg??brique des ??tats d'oxydation de tous les atomes dans une mol??cule neutre doit ??tre z??ro, tandis que dans ions la somme alg??brique des ??tats d'oxydation des atomes constitutifs doit ??tre ??gale ?? la charge de l'ion.
Quelques r??gles g??n??rales pour d??terminer les ??tats d'oxydation sans l'utilisation de structures de Lewis
Voici les r??gles g??n??rales pour les compos??s simples, sans formules structurelles:
- Tout ??l??ment pur (m??me se il forme des mol??cules diatomiques comme le chlore, Cl 2) a la tate d'une o xidation (OS) de z??ro. Des exemples en sont le Cu ou O 2.
- Pour ions monoatomiques, le syst??me d'exploitation est la m??me que la charge de l'ion. Par exemple, S 2- a un OS de -2, tandis que Li + a un syst??me d'exploitation de 1.
- La somme des syst??mes d'exploitation de tous les atomes dans une mol??cule ou un ion polyatomique est ??gale ?? la charge de la mol??cule ou d'un ion, de sorte que le syst??me d'exploitation d'un ??l??ment peut ??tre calcul?? ?? partir du syst??me d'exploitation des autres ??l??ments. Par exemple, dans SO 2-
3 ( ions sulfite), la charge totale de l'ion est de -2, et chacun l'oxyg??ne est suppos?? avoir son ??tat d'oxydation habituelle de -2. La somme des syst??mes d'exploitation est alors OS (S) + 3 (-2) = OS (S) - 6 = -2, de sorte que OS (S) = 4.
Pour r??sumer: la somme alg??brique des ??tats d'oxydation de tous les atomes dans un neutre mol??cule doit ??tre ?? z??ro, tandis que dans polyatomique ions la somme alg??brique des ??tats d'oxydation des atomes constitutifs doit ??tre ??gale ?? la charge de l'ion. Ce fait, combin?? avec le fait que certains ??l??ments ont presque toujours certains ??tats d'oxydation (en raison de leur tr??s haute ??lectropositivit?? ou ??lectron??gativit??), permet de calculer les ??tats d'oxydation des atomes restants (tels que les m??taux de transition) en compos??s simples.
Les r??gles suivantes qui sont utilis??es pour attribuer initialement ??tats d'oxydation pour certains ??l??ments, en compos??s simples:
- Le fluor a un ??tat d'oxydation de -1 lorsqu'il est li?? ?? ne importe quel autre ??l??ment, car il a le plus haut ??lectron??gativit?? de tous les ??l??ments r??actifs.
- Les halog??nes autres que le fluor ont un ??tat d'oxydation de -1 sauf quand ils sont li??s ?? l'oxyg??ne, l'azote ou un autre (plus ??lectron??gatif) halog??ne. Par exemple, l'??tat d'oxydation du chlore dans monofluorure de chlore (CLF) est une. Toutefois, dans le bromure de chlore (ou de chlorure de brome) (BrCl) l'??tat d'oxydation de Cl est -1.
- L'hydrog??ne a une l'??tat d'oxydation de +1, sauf lorsqu'ils sont li??s ?? des ??l??ments plus ??lectropositifs tels que le sodium , l'aluminium et le bore , en tant que NaH, NaBH 4, LiAlH 4 , o?? chaque M a un ??tat d'oxydation de -1.
- Dans les compos??s, l'oxyg??ne a g??n??ralement un ??tat d'oxydation de -2, mais il ya des exceptions qui sont r??pertori??s ci-dessous . Un exemple est les peroxydes (par exemple peroxyde d'hydrog??ne H 2 O 2) quand il a un syst??me d'exploitation de -1.
- Les m??taux alcalins ont un ??tat d'oxydation de 1 dans pratiquement tous leurs compos??s (?? l'exception, voir alkalide).
- M??taux alcalino-terreux ont un ??tat d'oxydation de +2 dans la quasi-totalit?? de leurs compos??s.
Exemple pour un sel complexe: Dans Cr (OH) 3, l'oxyg??ne a un ??tat d'oxydation de -2 (pas de liaisons de fluor ou O-O pr??sents), et de l'hydrog??ne a un ??tat de 1 (li?? ?? l'oxyg??ne). Donc, chacune des trois hydroxyde groupes a un ??tat de -2 + 1 = -1 oxydation. Comme le compos?? est neutre, Cr a un ??tat d'oxydation de +3.
Pour des mol??cules avec des atomes non ??quivalents d'un m??me ??l??ment, le proc??d?? de somme alg??brique donne seulement un ??tat d'oxydation moyen. Nous allons examiner ci-dessous comment trouver l'??tat de chaque atome d'oxydation ?? l'aide d'une structure de Lewis.
??tat d'oxydation et de charge formelle
L'??tat d'un atome d'oxydation est souvent diff??rente de la accusation formelle souvent inclus dans les structures de Lewis (quand il est non nul). L'??tat d'oxydation est calcul??e en supposant que chaque liaison chimique (sauf entre les atomes identiques) est ionique de sorte que les deux ??lectrons sont affect??s ?? l'atome li?? plus ??lectron??gatif. En revanche, la charge formelle est calcul?? en supposant que chaque obligations est covalente de telle sorte que un ??lectron est attribu?? ?? chaque atome li??. Par exemple, dans l'ion ammonium (NH 4 +) de l'??tat d'oxydation de l'azote est -3, comme tous les huit ??lectrons de valence sont affect??s ?? l'atome d'azote qui est plus ??lectron??gatif que l'hydrog??ne. Cependant la charge formelle est une, calcul??e en affectant seulement quatre ??lectrons de valence (une par obligation) ?? l'azote. A titre de comparaison, l'azote dans l'ammoniac (NH 3) a un ??tat d'oxydation -3 ??galement, mais une accusation formelle de z??ro. Sur protonation d'ammoniac de l'accusation formelle sur les changements d'azote, mais son ??tat d'oxydation ne est pas.
Calcul des ??tats d'oxydation formels avec une structure de Lewis
Il ya deux fa??ons communes de calcul de l'??tat d'un atome d'oxydation dans un compos??. Le premier est la technique de la somme alg??brique simple ci-dessus, utilis??s dans les compos??s qui ne n??cessitent pas un Structure de Lewis. La seconde est utilis?? pour les mol??cules quand on a un Structure de Lewis.
Il convient de rappeler que l'??tat d'un atome d'oxydation ne repr??sente pas la charge "r??elle" sur cet atome: Cela est particuli??rement vrai des ??tats d'oxydation ??lev??s, o?? la ??nergie d'ionisation n??cessaire pour produire un ion positif de multiplication sont beaucoup plus grandes que les ??nergies disponibles dans des r??actions chimiques. L'affectation des ??lectrons entre les atomes dans le calcul un ??tat d'oxydation est purement un formalisme, mais est un utile pour la compr??hension de nombreuses r??actions chimiques.
Pour plus sur les questions de calcul charges atomiques, voir charge partielle.
La structure de Lewis
Lorsqu'un La structure d'une mol??cule de Lewis est disponible, les ??tats d'oxydation peuvent ??tre affect??s par le calcul de la diff??rence entre le nombre de les ??lectrons de valence qu'un atome neutre de cet ??l??ment auraient et le nombre d'??lectrons qui "appartiennent" ?? elle dans la structure de Lewis. Aux fins du calcul des ??tats d'oxydation, des ??lectrons dans une liaison entre les atomes de diff??rents ??l??ments appartiennent ?? la plus atome ??lectron??gatif; ??lectrons dans une liaison entre les atomes d'un m??me ??l??ment sont divis??s de mani??re ??gale et les ??lectrons dans un seule paire appartient seulement ?? l'atome avec la paire solitaire.
Par exemple, consid??rons l'acide ac??tique :
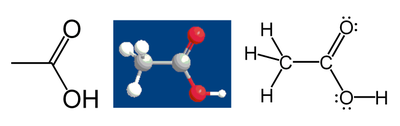
Le m??thyle atome de carbone du groupe a six ??lectrons de valence ?? ses liaisons ?? des atomes d'hydrog??ne parce que le carbone est plus ??lectron??gatif que l'hydrog??ne. En outre, une ??lectrons est obtenue ?? partir de sa liaison avec l'autre atome de carbone parce que la paire d'??lectrons dans la Liaison C-C est r??parti ?? parts ??gales, soit un total de 7 ??lectrons. Un atome de carbone neutre aurait quatre ??lectrons de valence, car le carbone est en groupe 14 du tableau p??riodique. La diff??rence, 4-7 = -3, est l'??tat de cet atome de carbone d'oxydation. Autrement dit, si l'on suppose que toutes les liaisons ont ??t?? de 100% ionique (qui en fait, ils ne sont pas), le carbone serait d??crit comme C 3.
Suivant les m??mes r??gles, l' acide carboxylique atome de carbone a un ??tat d'oxydation de +3 (il obtient un seul ??lectron de valence de la liaison C-C; les atomes d'oxyg??ne obtenir tous les autres ??lectrons parce que l'oxyg??ne est plus ??lectron??gatif que le carbone). Les deux atomes d'oxyg??ne ont un ??tat d'oxydation de -2; ils obtiennent 8 ??lectrons chacune (4 ?? partir des paires seules et 4 des obligations), tandis qu'un atome neutre d'oxyg??ne aurait 6. Les atomes d'hydrog??ne ont tous ??tat d'oxydation +1, parce qu'ils se rendent leur ??lectrons aux atomes plus ??lectron??gatifs ?? laquelle ils sont li??s.
In??quivalentes atomes d'un ??l??ment

Un exemple d'une mol??cule non ??quivalents des atomes d'un m??me ??l??ment est le ion thiosulfate (S 2 O 3 2-), pour lequel la r??gle de somme alg??brique donne la valeur moyenne des deux pour le soufre, o?? les deux ??lectrons ionisants sont affect??s ?? l'atome de soufre terminal. Cependant, l'utilisation d'une structure ??lectronique et Lewis comptage montre que les deux atomes de soufre sont diff??rents. Le soufre central est affect?? un seul ??lectron de valence de la liaison SS et pas d'??lectrons de valence des liaisons SO, comparativement ?? six ??lectrons de valence d'un atome de soufre libre, de sorte que l'??tat de la centrale d'oxydation du soufre est 5. L'atome de soufre terminal est assign?? l'autre ??lectron de la liaison SS et trois paires libres pour un total de sept ??lectrons de valence, de sorte que son ??tat d'oxydation est de -1.
Les r??actions d'oxydor??duction
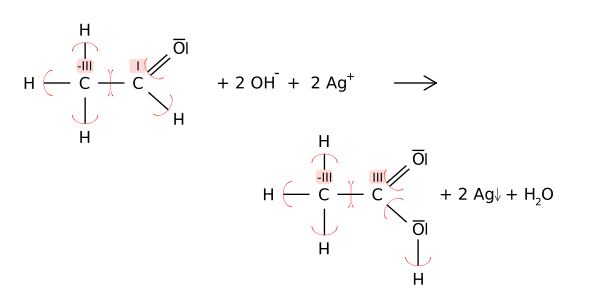
les ??tats d'oxydation peut ??tre utile pour ??quilibrer les ??quations chimiques pour oxydor??duction (ou redox) r??actions, parce que les changements dans les atomes oxyd??s doivent ??tre pond??r??es par les changements dans les atomes r??duits. Par exemple, dans la r??action de l'ac??tald??hyde avec le R??action de Tollens de l'acide ac??tique (ci-dessous), l'atome de carbone du carbonyle change son ??tat d'oxydation de 1 ?? 3 (oxydation). Cette oxydation est compens??e par la r??duction de deux ??quivalents d' argent Ag de Ag + ?? 0.
Dans de tels sch??mas structurels de la chimie organique, des ??tats d'oxydation sont repr??sent??s par des chiffres romains pour les distinguer accusations formelles (calcul?? avec toutes liaisons covalentes).
??l??ments avec de multiples ??tats d'oxydation
La plupart des ??l??ments ont plus d'un ??tat d'oxydation possible. Le carbone a neuf ??tats d'oxydation enti??re, et il existe ??galement des mol??cules dans lesquelles le degr?? d'oxydation moyen de plusieurs atomes de carbone est fractionn??e.
??tats d'oxydation entiers de carbone avec des exemples
- -4: CH 4
- -3: C 2 H 6
- -2: CH 3 Cl
- -1: C 2 H 2
- 0: CH 2 Cl 2
- 1: CHCl 2 - CHCl 2
- 2: CHCl 3
- 3: C 2 Cl 6
- 4: CCl 4
Des exemples d'??tats d'oxydation fractionnaires pour le carbone
- - (5.6): C 5 H 5 -
- - (6/7): C 7 H 7 +
- - (4.5): C 8 H 8 2-
L'oxyg??ne a 8 ??tats d'oxydation diff??rents
- -2 ?? des oxydes, par exemple, ZnO, CO 2 , H 2 O
- -1 ?? les peroxydes, par exemple H 2 O 2
- - (1/2) dans superoxydes, par exemple KO 2
- - (03/01) dans inorganique ozonides, par exemple RBO 3
- 0 en O 2
- + (1/2) dans dioxyg??nyle, par exemple dioxyg??nyle hexafluoroars??nate O 2 + [AsF 6] -
- Dans une F 2 O 2
- 2 dans DE 2
On notera que, ??tant donn?? que le fluor est plus ??lectron??gatif que l'oxyg??ne, O 2 F 2 et D 2 sont consid??r??s comme les fluorures, au lieu de, respectivement, un peroxyde et un oxyde.
??tats d'oxydation fractionnaires
??tats d'oxydation fractionnaires sont souvent utilis??s pour repr??senter les ??tats d'oxydation moyens de plusieurs atomes dans une structure. Par exemple, dans KO 2, le ion superoxyde a une charge de -1 divis?? entre deux atomes ??quivalents, de sorte que chaque oxyg??ne est affect?? d'un ??tat d'oxydation de -??, Cet ion est d??crit comme un hybride de r??sonance des deux structures de Lewis, et chaque oxyg??ne a l'??tat d'oxydation 0 ?? une structure et -1 dans l'autre.
Pour le ion cyclopentadi??nyle C 5 H 5 -, C de l'??tat d'oxydation est (-1) + (-1/5) = -6/5. Le -1 se produit parce que chaque C est li?? ?? une moins H ??lectron??gatif, et -1/5 parce que la charge ionique totale est r??partie entre cinq ??quivalent C.
Si la moyenne se r??f??re ?? des atomes qui ne sont pas ??quivalentes, l'??tat d'oxydation moyen peut ne pas ??tre repr??sentative de chacun des atomes. Cela est vrai dans magn??tite Fe 3 O 4, dont la formule conduit ?? un ??tat d'oxydation moyen de +8/3. En fait, les deux tiers des ions de fer sont Fe 3+, et un tiers de Fe 2+.
De m??me, la ozonide ions O 3 - a un ??tat d'oxydation moyenne de -1/3. Ce est avec un ion central d'oxyg??ne, ce qui ne est pas ??quivalent aux deux autres et ne peuvent pas ??tre suppos??s avoir le m??me ??tat d'oxydation en forme de V.
Nombre d'oxydation
L'??tat termes d'oxydation et d'oxydation sont souvent utilis??s indiff??remment. Cependant, nombre d'oxydation est utilis?? dans chimie de coordination avec une signification l??g??rement diff??rente. Dans la chimie de coordination, les r??gles utilis??es pour compter les ??lectrons sont diff??rents: Chaque ??lectron dans une liaison m??tal-ligand appartient ?? la ligand, quel que soit ??lectron??gativit??. En outre, nombre d'oxydation sont classiquement repr??sent??s par des chiffres romains, tandis que les ??tats d'oxydation utilisent chiffres indo-arabes.
Histoire
Le concept actuel de "l'??tat d'oxydation" a ??t?? introduit par WM Latimer en 1938. L'oxydation se ??tait d'abord ??tudi?? par Antoine Lavoisier , qui croyait que l'oxydation ??tait toujours le r??sultat de r??actions avec l'oxyg??ne , d'o?? le nom. Bien que l'id??e de Lavoisier a ??t?? montr?? pour ??tre incorrect, le nom qu'il a propos?? est encore utilis??, mais plus g??n??ralement.
??tats d'oxydation ont ??t?? l'un des intellectuels ??tremplins?? Mendele??ev utilis??es pour obtenir le tableau p??riodique moderne.
??tats formelles d'oxydation inhabituelles
Des ??tats d'oxydation formels inhabituelles de m??taux sont importants dans les processus biochimiques, les notables ??tant ceux Fe (IV) et Fe (V) en Cytochrome P450 syst??mes contenant.