
Acide ac??tique
?? propos de ce ??coles s??lection Wikipedia
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. Parrainage d'enfants aide les enfants du monde en d??veloppement ?? apprendre aussi.
| Acide ac??tique | |
|---|---|
 |  |
L'acide ac??tique, l'acide ??thano??que | |
Autres noms Ac??tyle hydroxyde (AcOH), l'ac??tate d'hydrog??ne (HAC), l'acide Ethylic, l'acide Methanecarboxylic | |
| Identificateurs | |
| Num??ro CAS | 64-19-7 |
| PubChem | 176 |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | CH 3 COOH |
| Masse molaire | 60,05 g / mol |
| Apparence | Liquide ou de cristaux incolores |
| Densit?? | 1,049 g ?? cm -3 ( l ) 1,266 g ?? cm -3 ( s ) |
| Point de fusion | 16,5 ?? C (289,6 K, 61,6 ?? F) |
| Point d'??bullition | 118,1 ?? C (391,2 K, 244,5 ?? F) |
| Solubilit?? dans l'eau | Enti??rement miscible |
| Acidit?? (p K a) | 4,76 ?? 25 ?? C |
| Viscosit?? | 1,22 mPa.s ?? 25 ?? C |
| Structure | |
| Moment de dip??le | 1,74 D (gaz) |
| Risques | |
| FS | MSDS externe |
| Phrases-R | R10, R35 |
| Phrases S | (S1 / 2), S23, S26, S45 |
| NFPA 704 |  2 2 2 |
| Point d'??clair | 43 ?? C |
| Des compos??s apparent??s | |
| Connexes acide carboxylique | l'acide formique , l'acide propionique, l'acide butyrique |
| Des compos??s apparent??s | ac??tamide, l'ac??tate d'??thyle, le chlorure d'ac??tyle, l'anhydride ac??tique, l'ac??tonitrile, l'ac??tald??hyde, de l'??thanol , l'acide thioac??tique, l'ac??tylcholine, ac??tylcholinest??rase |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
De l'acide ac??tique, ??galement connu comme l'acide ??thano??que, est un compos?? chimique organique pour donner le mieux reconnu au vinaigre son go??t amer et une odeur ??cre. Sa formule d??velopp??e est repr??sent??e par CH 3 COOH. Pur, l'eau acide ac??tique exempt (acide ac??tique glacial) est un gaz incolore liquide qui attire l'eau de l'environnement ( hygrom??trie), et g??le en dessous de 16,7 ?? C (62 ?? F) ?? un incolore cristallin solide . Ac??tique acide est corrosif , et sa vapeur provoque une irritation des yeux, un nez sec et br??lant, maux de gorge et la congestion dans les poumons. C'est un acide faible car ?? temp??rature et de pression de la norme l'acide dissoci?? existe en ??quilibre avec la forme non dissoci??e dans aqueuses solutions , contrairement aux acides forts, qui sont totalement dissoci??s.
L'acide ac??tique est un des plus simples acides carboxyliques (le deuxi??me c??t?? de la plus simple, l'acide formique ). Il est important r??actif chimique et chimique industriel qui est utilis?? dans la production de poly??thyl??ne t??r??phtalate principalement utilis?? dans les bouteilles de boissons gazeuses; l'ac??tate de cellulose, essentiellement pour film photographique; et l'ac??tate de polyvinyle pour le bois colle, ainsi que des fibres et des tissus synth??tiques. Dans les m??nages acide ac??tique dilu?? est souvent utilis?? dans agents de d??tartrage. Dans le acide ac??tique de l'industrie alimentaire est utilis??e sous la Code additif alimentaire E260 comme une r??gulateur d'acidit??.
La demande mondiale d'acide ac??tique est d'environ 6,5 millions tonnes par an (Mt / a), dont environ 1,5 Mt / a est satisfaite par le recyclage; le reste est fabriqu?? ?? partir de mati??res premi??res p??trochimiques ou de sources biologiques.
Nomenclature
Le trivial acide ac??tique nom est le nom le plus couramment utilis?? et officiellement pr??f??r?? par le IUPAC. Ce nom d??rive de acetum, le latin mot pour vinaigre. L'acide synonyme ??thano??que est un nom syst??matique qui est utilis?? dans les introductions ?? nomenclature chimique.
L'acide ac??tique glacial est un nom trivial de l'acide ac??tique sans eau. Semblable ?? l' allemande nom Eisessig (litt??ralement, la glace de vinaigre), le nom provient des cristaux de glace qui se forment l??g??rement en dessous de la temp??rature ambiante ?? 16,7 ?? C (environ 62 ?? F).
L'abr??viation la plus commune et officielle de l'acide ac??tique est AcOH ou HOAc o?? Ac repr??sente le ac??tyl groupe CH 3 -C (= O) - ;. Dans le contexte des r??actions acide-base HAc l'abr??viation est souvent utilis?? ?? la place o?? Ac repr??sente pour le ac??tate anion (CH 3 COO -), bien que cet usage est consid??r?? par beaucoup comme trompeuse. Dans les deux cas, le secteur ne est pas ?? confondre avec l'abr??viation de l' ??l??ment chimique actinium .
L'acide ac??tique a la formule empirique CH 2 O et la formule mol??culaire est C 2 H 4 O 2 ou H 2 CH 3 O 2 (de souligner le r??le de l'hydrog??ne ??actif?? dans la formation de l'ac??tate de sodium et de sel). Afin de mieux refl??ter sa structure, l'acide ac??tique est souvent ??crit que CH 3 -CO 2 -H, CH 3 COOH, CH 3 CO 2 H, ou HOCOCH 3. L' ion r??sultant de la perte de H + de l'acide ac??tique est l'anion ac??tate. Le nom de l'ac??tate peut ??galement se r??f??rer ?? un sel contenant cet anion, ou un ester d'acide ac??tique.
Histoire

Le vinaigre est au moins aussi vieille que la civilisation. Bact??ries produisant de l'acide ac??tique sont pr??sents partout dans le monde, et les cultures pratiquant la brassage de la bi??re ou du vin in??vitablement d??couvert le vinaigre comme le r??sultat naturel de leur exposition ?? l'air.
L'utilisation d'acide ac??tique dans l'alchimie se ??tend dans l'antiquit??. Dans le 3??me si??cle avant JC, le grec philosophe Th??ophraste a d??crit comment le vinaigre a agi sur les m??taux pour produire des pigments utiles dans l'art, y compris la c??ruse ( carbonate de plomb) et vert de gris, un m??lange vert de cuivre , y compris des sels cuivre (II) ac??tate d'??thyle. Anciens Romains bouillie aigri vin dans des pots de plomb pour produire un sirop tr??s sucr?? appel?? sapa. Sapa a ??t?? riche en l'ac??tate de plomb, une substance sucr??e appel??e aussi du sucre de plomb ou de sucre de Saturn, qui a contribu?? ?? saturnisme chez l'aristocratie romaine.
Au 8??me si??cle, le Alchimiste musulman Jabir Ibn Hayyan (Geber) a ??t?? le premier ?? se concentrer ?? partir de l'acide ac??tique du vinaigre par distillation . Dans la Renaissance , a ??t?? pr??par?? l'acide ac??tique glacial ?? travers le distillation s??che des ac??tates de m??taux. Le 16??me si??cle allemand alchimiste Andreas Libavius d??crit une telle proc??dure, et il a compar?? l'acide ac??tique glacial produite par ce moyen au vinaigre. La pr??sence d'eau dans le vinaigre a un effet profond sur les propri??t??s de l'acide ac??tique que pendant des si??cles les chimistes croyaient que l'acide ac??tique glacial et l'acide pr??sent dans le vinaigre sont deux substances diff??rentes. Le chimiste fran??ais Pierre Adet eux se est av??r?? ??tre identiques.
En 1847, le chimiste allemand Hermann Kolbe synth??tis?? ?? partir de l'acide ac??tique inorganiques mat??riaux pour la premi??re fois. Cette s??quence de r??action est compos??e de chloration du disulfure de carbone pour le t??trachlorure de carbone , suivi par pyrolyse de t??trachloro??thyl??ne et chloration aqueuse ?? l'acide trichloroac??tique, et conclu avec ??lectrolytique r??duction de l'acide ac??tique.

En 1910, plus de l'acide ac??tique glacial a ??t?? obtenu ?? partir de la "liqueur pyroligneux" de la distillation du bois. L'acide ac??tique a ??t?? isol?? ?? partir de ce par traitement avec lait de chaux, et la r??sultante l'ac??tate de calcium a ensuite ??t?? acidifi??e avec de l' acide sulfurique pour r??cup??rer l'acide ac??tique. A cette ??poque, l'Allemagne produisait 10000 tonnes d'acide ac??tique glacial, environ 30% de ce qui a ??t?? utilis?? pour la fabrication de colorant indigo.
Propri??t??s chimiques
L'atome d'hydrog??ne (H) dans le groupe carboxyle (-COOH) dans des acides carboxyliques tels que l'acide ac??tique peut ??tre ??mis comme un ion H + ( protons ), en leur donnant leur caract??re acide. L'acide ac??tique est un faible, efficacement acide monoprotique en solution aqueuse, avec un pK a de 4,8. Son la base est conjugu?? ac??tate (CH 3 COO -). A 1,0 M solution (environ la concentration de vinaigre domestique) a un pH de 2,4, ce qui indique que seulement 0,4% des mol??cules d'acide ac??tique sont dissoci??es.

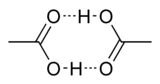
La structure cristalline de l'acide ac??tique montre que les mol??cules se accouplent en dim??res reli??s par des liaisons hydrog??ne. Les dim??res peuvent ??galement ??tre d??tect??s dans la vapeur ?? 120 ?? C. Ils produisent ??galement dans la phase liquide en solutions dilu??es dans des solvants non-liaison hydrog??ne, et dans une certaine mesure dans de l'acide ac??tique pur, mais sont perturb??s par des solvants formant des liaisons hydrog??ne. L'enthalpie de dissociation du dim??re est estim?? ?? 65,0 ?? 66,0 kJ / mol, et l'entropie de dissociation ?? 154 ?? 157 J mol -1 K -1. Ce probl??me de dim??risation est partag?? par d'autres acides carboxyliques inf??rieurs.
Liquide acide ac??tique est un hydrophile ( polaire) solvant protique, semblable ?? de l'??thanol et de l'eau . Avec un mod??r?? constante di??lectrique de 6,2, on peut dissoudre non seulement des compos??s polaires tels que des sels inorganiques et des sucres , mais ??galement des compos??s non polaires tels que des huiles et des ??l??ments tels que le soufre et l'iode . Il se m??lange facilement avec d'autres polaires et non-polaires solvants tels que l'eau, le chloroforme, et hexane. Cette propri??t?? dissolution et miscibilit?? de l'acide ac??tique, il est un produit chimique industriel largement utilis??.
Les r??actions chimiques
L'acide ac??tique est corrosif pour les m??taux , y compris le fer , le magn??sium et le zinc , la formation d' hydrog??ne et de gaz sels m??talliques appel??s les ac??tates. L'aluminium , lorsqu'il est expos?? ?? l'oxyg??ne, forme une mince couche d' oxyde d'aluminium sur sa surface qui est relativement r??sistant, de sorte que les r??servoirs en aluminium peuvent ??tre utilis??s pour le transport de l'acide ac??tique. les ac??tates de m??tal peuvent ??galement ??tre pr??par??s ?? partir d'acide ac??tique et d'un appropri?? de base, comme dans le populaire " bicarbonate de soude + vinaigre "r??action. Avec l'exception notable de chrome (II) ac??tate, presque tous les ac??tates solubles dans l'eau.
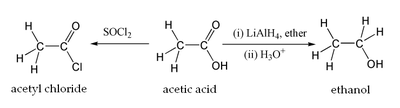
L'acide ac??tique est soumis ?? des types de r??actions chimiques d'un acide carboxylique , par exemple l'eau et produire un m??tal ??thanoate lorsqu'il r??agit avec alcalis, produisant un ??thanoate de m??tal lorsque mis ?? r??agir avec un m??tal, et la production d'un ??thanoate de m??tal, de l'eau et du dioxyde de carbone lorsqu'il r??agit avec les carbonates et hydrog??nocarbonates. Le plus notable de l'ensemble de ses r??actions est la formation d' ??thanol par r??duction, et la formation de d??riv??s tels que le chlorure d'ac??tyle par substitution nucl??ophile. D'autres d??riv??s de substitution comprennent l'anhydride ac??tique; cette anhydride est produite par la perte d'eau ?? partir de deux mol??cules de l'acide ac??tique. Esters d'acide ac??tique peuvent ??galement ??tre form??s par l'interm??diaire Est??rification de Fischer, et des amides peuvent ??galement ??tre form??s. Lorsqu'il est chauff?? au-dessus de 440 ?? C, l'acide ac??tique se d??compose pour produire du dioxyde de carbone et du m??thane , ou de produire c??t??ne et de l'eau.
L'acide ac??tique peut ??tre d??tect?? par son odeur caract??ristique. Un r??action de la couleur pour les sels de l'acide ac??tique est le fer (III) chlorure solution, qui donne une couleur rouge profond qui dispara??t apr??s acidification. Ac??tates lorsqu'il est chauff?? avec sous forme de trioxyde d'arsenic cacodyle oxyde, qui peut ??tre d??tect??e par sa vapeurs malodorantes.
Production

L'acide ac??tique est produit ?? la fois synth??tique et en bact??rienne fermentation. Aujourd'hui, le voie biologique ne repr??sente qu'environ 10% de la production mondiale, mais il demeure important pour la production de vinaigre, comme le monde lois de puret?? alimentaire stipulent que le vinaigre utilis?? dans les aliments doit ??tre d'origine biologique. Environ 75% d'acide ac??tique fait pour une utilisation dans l'industrie chimique se fait par carbonylation du m??thanol, expliqu??e ci-dessous. Des m??thodes alternatives repr??sentent le reste.
La production mondiale totale de l'acide ac??tique vierge est estim?? ?? 5 Mt / a (millions de tonnes par an), dont la moiti?? environ est produite dans le ??tats-Unis . europ??enne la production se ??l??ve ?? environ 1 Mt / a et est en d??clin, et 0,7 Mt / a est produit dans Japon . Un autre 1,5 Mt sont recycl??s chaque ann??e, ce qui porte le total du march?? mondial ?? 6,5 Mt / a. Les deux plus grands producteurs d'acide ac??tique sont vierge Celanese et BP Chemicals . D'autres grands producteurs comprennent Millennium Chemicals, Sterling Chemicals, Samsung, Eastman, et Svensk Etanolkemi.
Carbonylation du m??thanol
La plupart de l'acide ac??tique vierge est produit par carbonylation du m??thanol. Dans ce proc??d??, du methanol et du monoxyde de carbone r??agissent pour produire de l'acide ac??tique selon l'??quation chimique:
- CH 3 OH + CO → CH 3 COOH
Le processus implique iodom??thane comme produit interm??diaire, et se produit en trois ??tapes. Un catalyseur , habituellement un m??tal complexe, est n??cessaire pour la carbonylation (??tape 2).
- (1) CH 3 OH + HI → CH 3 I + H 2 O
- (2) CH 3 I + CO → CH 3 COI
- (3) CH 3 CI + H 2 O → CH 3 COOH + HI
En modifiant les conditions du proc??d??, l'anhydride ac??tique peut ??galement ??tre produit de la m??me plante. Parce que les deux methanol et de monoxyde de carbone sont des mati??res premi??res des mati??res premi??res, la carbonylation du m??thanol longue semble ??tre une m??thode int??ressante pour la production d'acide ac??tique. Henry Drefyus au British Celanese a d??velopp?? une carbonylation pilote usine de m??thanol d??s 1925. Toutefois, un manque de mat??riels pratiques qui pourraient contenir le m??lange r??actionnel corrosif ?? la haute pressions n??cessaires (200 atm ou plus) d??courager la commercialisation de ces routes. Le premier proc??d?? industriel de carbonylation du m??thanol, qui a utilis?? une de cobalt catalyseur, a ??t?? d??velopp?? par la soci??t?? allemande de produits chimiques BASF en 1963. En 1968, un rhodium catalyseur ?? base de (cis - [Rh (CO) 2 I 2] -) a ??t?? d??couverte qui pourrait fonctionner efficacement ?? une pression inf??rieure avec presque pas de sous-produits. La premi??re usine utilisant ce catalyseur a ??t?? construit par la soci??t?? am??ricaine de produits chimiques Monsanto en 1970, et le rhodium catalys??e carbonylation du m??thanol est devenu la principale m??thode de production d'acide ac??tique (voir Proc??d?? Monsanto). ?? la fin des ann??es 1990, la soci??t?? de produits chimiques BP Chemicals commercialis?? le catalyseur de Cativa ([Ir (CO) 2 I 2] -), qui est promu par du ruth??nium . Ce iridium processus est catalys??e plus verte et plus efficace et a largement supplant?? le processus Monsanto, souvent dans les m??mes usines de production.
oxydation de l'ac??tald??hyde
Avant la commercialisation du proc??d?? Monsanto, la plupart de l'acide ac??tique a ??t?? produit par oxydation de l'ac??tald??hyde. Cela reste le deuxi??me proc??d?? de fabrication le plus important, m??me se il ne est pas comp??titive avec la carbonylation du m??thanol. L'ac??tald??hyde peut ??tre produit par oxydation du butane ou naphta l??ger, ou par hydratation de l'??thyl??ne.
Quand butane ou la lumi??re naphta est chauff?? avec de l'air en pr??sence de divers m??taux ions , y compris ceux de mangan??se , cobalt et chrome ; peroxydes formulaire, puis se d??composent pour produire de l'acide ac??tique selon la ??quation chimique
- 2 C 4 H 10 + 5 O 2 → 4 CH 3 COOH + H 2 O 2
Typiquement, la r??action est conduite ?? une combinaison de temp??rature et de pression con??u pour ??tre aussi chaude que possible tout en gardant le butane liquide. Les conditions r??actionnelles typiques sont de 150 ?? C et 55 atm. produits secondaires peuvent ??galement se former, y compris butanone, l'ac??tate d'??thyle, l'acide formique , et l'acide propionique. Ces produits secondaires sont ??galement utiles dans le commerce, et les conditions de r??action peuvent ??tre modifi??es afin de produire plus d'entre eux si ce ne est ??conomiquement utile. Cependant, la s??paration de l'acide ac??tique ?? partir de ces sous-produits augmente le co??t du proc??d??.
Dans des conditions similaires et similaires en utilisant des catalyseurs que ceux utilis??s pour l'oxydation de butane, l'ac??tald??hyde peut ??tre oxyd?? par l' oxyg??ne dans l'air pour produire de l'acide ac??tique
- 2 CH 3 CHO + O 2 → 2 CH 3 COOH
Utilisation de catalyseurs modernes, cette r??action peut ??tre un acide ac??tique rendement sup??rieur ?? 95%. Les principaux produits secondaires sont l'ac??tate d'??thyle, l'acide formique , et le formald??hyde, qui ont tous des faibles points d'??bullition que l'acide ac??tique et sont ais??ment s??par??s par distillation .
oxydation d'??thyl??ne
L'ac??tald??hyde peut ??tre pr??par?? ?? partir d' ??thyl??ne via le Processus Wacker, puis oxyd?? comme ci-dessus. Plus r??cemment une conversion moins cher seule ??tape de l'??thyl??ne en acide ac??tique a ??t?? commercialis?? par la soci??t?? chimique Showa Denko, qui a ouvert une usine d'oxydation de l'??thyl??ne en Oita, Japon , en 1997. Le proc??d?? est catalys?? par un palladium catalyseur m??tallique support?? sur un h??t??ropolyacide comme l'acide tungstosilicique. Il est pens?? pour ??tre comp??titif avec carbonylation du m??thanol pour les plantes plus petites (de 100 ?? 250 kt / a), selon le prix local de l'??thyl??ne.
Fermentation oxydatif
Pour la plupart de l'histoire humaine, l'acide ac??tique, sous la forme de vinaigre, a ??t?? faite par bact??ries ac??tiques du genre Acetobacter. Compte tenu de suffisamment d'oxyg??ne, ces bact??ries peuvent produire du vinaigre d'une vari??t?? de denr??es alimentaires alcooliques. Aliments couramment utilis??s comprennent de cidre de pomme , du vin , et ferment?? grain , malt, de riz ou de pommes de terre mo??ts. La r??action chimique globale facilit??e par ces bact??ries est la suivante:
- C 2 H 5 OH + O 2 → CH 3 COOH + H 2 O
Une solution d'alcool dilu?? inocul??s avec Acetobacter et conserv?? dans un, spacieux endroit chaud deviendra vinaigre au cours de quelques mois. M??thodes de vinaigre-faire industriels acc??l??rer ce processus en am??liorant l'offre de l'oxyg??ne aux bact??ries.
Les premiers lots de vinaigre produits par la fermentation des erreurs dans le doute suivies processus de vinification. Si doit fermente ?? une temp??rature trop ??lev??e, acetobacter submergera le levure naturellement sur le raisins. Comme la demande pour le vinaigre ?? des fins culinaires, m??dicales et sanitaires accrus, les vignerons ont vite appris ?? utiliser d'autres mati??res organiques pour produire du vinaigre dans les mois chauds de l'??t?? avant que les raisins ??taient m??rs et pr??ts pour la transformation en vin. Cette m??thode a ??t?? lente, cependant, et pas toujours couronn??e de succ??s, que les vignerons ne ont pas compris le processus.
Un des premiers proc??d??s commerciaux modernes ??tait la "m??thode rapide" ou "m??thode allemande", d'abord pratiqu?? en Allemagne en 1823. Dans ce processus, la fermentation a lieu dans une tour remplie de copeaux de bois ou charbon de bois. L'alimentation contenant de l'alcool est coulait dans le haut de la tour, et frais l'air fourni par le bas soit naturelle ou forc??e convection. L'alimentation en air am??lior??e dans ce processus r??duit le temps de pr??parer le vinaigre de mois ?? quelques semaines.
La plupart du vinaigre aujourd'hui est faite dans r??servoir submerg?? la culture, d??crite pour la premi??re en 1949 par Otto Hromatka et Heinrich Ebner. Dans ce proc??d??, l'alcool est ferment?? dans un vinaigre ?? cuve agit??e en continu, et l'oxyg??ne est fourni en faisant barboter de l'air ?? travers la solution. Utilisation des applications modernes de cette m??thode, le vinaigre d'acide ac??tique de 15% peut ??tre pr??par?? en seulement 24 heures dans le processus de traitement par lots, m??me 20% en 60 h de processus fed-batch.
Fermentation ana??robie
Esp??ces de bact??ries ana??robies, y compris les membres du genre Clostridium, permet de convertir les sucres en acide ac??tique directement, sans utiliser l'??thanol comme produit interm??diaire. La r??action chimique globale r??alis??e par ces bact??ries peut ??tre repr??sent??e comme suit:
- C 6 H 12 O 6 → 3 CH3COOH
Plus int??ressant du point de vue d'un chimiste industriel, ces bact??ries ac??tog??nes peuvent produire de l'acide ac??tique ?? partir de compos??s ?? un carbone, notamment du m??thanol , du monoxyde de carbone , ou un m??lange de dioxyde de carbone et de l'hydrog??ne :
- 2 CO 2 + 4 H 2 → CH 3 COOH + H 2 O 2
Cette capacit?? de Clostridium d'utiliser directement les sucres, ou pour produire de l'acide ac??tique ?? partir d'intrants moins co??teux, signifie que ces bact??ries pourraient produire de l'acide ac??tique plus efficace que l'??thanol-oxydants comme Acetobacter. Cependant, les bact??ries Clostridium sont moins tol??rants ?? l'acide que Acetobacter. M??me les souches de Clostridium les plus tol??rantes aux acides peuvent produire du vinaigre de seulement un acide ac??tique quelques pour cent, par rapport ?? des souches d'Acetobacter qui peuvent produire de l'acide ac??tique du vinaigre de jusqu'?? 20%. ?? l'heure actuelle, il reste plus rentable pour produire du vinaigre ?? l'aide Acetobacter que de produire ?? l'aide de Clostridium puis le concentrer. En cons??quence, bien que les bact??ries ac??tog??nes sont connues depuis 1940, leur utilisation industrielle reste confin?? ?? quelques applications de niche.
Applications

L'acide ac??tique est un produit chimique R??actif pour la production de compos??s chimiques. La plus grande utilisation unique de l'acide ac??tique est dans la production d'ac??tate de vinyle monom??re, suivie de pr??s par l'anhydride ac??tique et de la production d'ester. Le volume d'acide ac??tique utilis?? dans le vinaigre est relativement faible.
monom??re d'ac??tate de vinyle
La principale utilisation de l'acide ac??tique est pour la production de ac??tate de vinyle monom??re (ACV). Cette application consomme environ 40% ?? 45% de la production mondiale d'acide ac??tique. La r??action est de l'??thyl??ne et de l'acide ac??tique avec de l'oxyg??ne sur une palladium catalyseur .
- 2 H 3 C-COOH + 2 C 2 H 4 + O 2 → 2 H 3 C-CO-O-CH = CH 2 + 2 H 2 O
L'ac??tate de vinyle peut ??tre polym??ris?? ?? l'ac??tate de polyvinyle ou une autre des polym??res, qui sont appliqu??s en peintures et les adh??sifs.
La production Ester
Le principal les esters d'acide ac??tique sont des solvants couramment utilis??s pour les encres, peintures et rev??tements. Les esters comprennent l'ac??tate d'??thyle, n- l'ac??tate de butyle, ac??tate d'isobutyle, et l'ac??tate de propyle. Ils sont typiquement produits par catalyse la r??action entre l'acide ac??tique et le correspondant alcool . : H 3 C-COOH + HO-R → H 3 C-CO-OR + H 2 O, o?? R = un grand groupe alkyle
La plupart des esters d'ac??tate, cependant, sont produites ?? partir de l'ac??tald??hyde en utilisant le R??action de Tishchenko. En outre, les ac??tates d'??ther sont utilis??s comme solvants pour nitrocellulose, laques acryliques, dissolvants de vernis et teintures pour le bois. Premi??res mono??thers de glycol sont produits ?? partir l'oxyde d'??thyl??ne ou l'oxyde de propyl??ne avec de l'alcool, qui sont ensuite est??rifi?? avec de l'acide ac??tique. Les trois produits principaux sont l'??thyl??ne glycol ac??tate de l'??ther mono??thylique (EEA), l'??thyl??ne glycol monobutyl ??ther ac??tate (EBA), le propyl??ne glycol et l'ac??tate d'??ther monom??thylique (PMA). Cette application consomme environ 15% ?? 20% d'acide ac??tique dans le monde entier. Ac??tates ??ther, par exemple l'EEE ont ??t?? montr??, de nuire ?? la reproduction humaine.
L'anhydride ac??tique
Le produit de condensation de deux mol??cules de l'acide ac??tique est l'anhydride ac??tique. La production mondiale d'anhydride ac??tique est une application importante, et utilise environ 25% ?? 30% de la production mondiale d'acide ac??tique. L'anhydride ac??tique peut ??tre produit directement par carbonylation du m??thanol en contournant l'acide, et Cativa centrales peuvent ??tre adapt??es pour la production de l'anhydride.
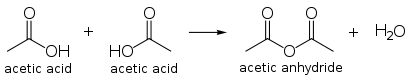
L'anhydride ac??tique est un solide agent d'ac??tylation. En tant que tel, son application est importante pour ac??tate de cellulose, un mat??riau synth??tique textile ??galement utilis?? pour film photographique. L'anhydride ac??tique est un r??actif pour la production de l'aspirine , h??ro??ne et d'autres compos??s.
Vinaigre
Sous la forme de vinaigre, solutions d'acide ac??tique (acide ac??tique typiquement de 5% ?? 18%, le pourcentage g??n??ralement calcul??es en masse) sont utilis??s directement en tant que condiment, et ??galement dans le d??capage de l??gumes et autres denr??es alimentaires. Vinaigre de table tend ?? ??tre plus dilu?? (acide ac??tique ?? 5% ?? 8%), tandis que le d??capage de la nourriture commerciale emploie g??n??ralement des solutions plus concentr??es. La quantit?? d'acide ac??tique utilis?? le vinaigre ?? l'??chelle mondiale ne est pas grande, mais historiquement, ce est de loin l'application la plus ancienne et la plus connue.
Utilisation solvant
L'acide ac??tique glacial est un excellent polar solvant protique, comme indiqu?? ci-dessus . Il est fr??quemment utilis?? en tant que solvant pour recristallisation pour purifier des compos??s organiques. Acide ac??tique pur fondu est utilis?? comme solvant dans la production de acide t??r??phtalique (TPA), la mati??re premi??re pour poly??thyl??ne t??r??phtalate (PET). Bien que repr??sentent actuellement 5% -10% de l'utilisation de l'acide ac??tique dans le monde entier, cette application sp??cifique devrait cro??tre de mani??re significative dans la prochaine d??cennie, que les augmentations de production de PET.
L'acide ac??tique est souvent utilis?? comme solvant pour les r??actions impliquant carbocations, tels que Alkylation de Friedel-Crafts. Par exemple, une ??tape dans la fabrication commerciale de synth??se camphre implique un R??arrangement de camph??ne ?? l'ac??tate d'isobornyle Wagner-Meerwein; ici l'acide ac??tique agit ?? la fois comme solvant et comme nucl??ophile pour pi??ger le carbocation r??arrang??. L'acide ac??tique est le solvant de choix lorsque la r??duction d'un aryle nitro-groupe ?? un aniline aide palladium sur charbon.
L'acide ac??tique glacial est utilis?? en chimie analytique pour le dosage de substances faiblement basiques tels que des amides organiques. L'acide ac??tique glacial est une beaucoup plus faible la base que de l'eau, de sorte que l'amide se comporte comme une base solide dans ce milieu. Il peut alors ??tre ajust??e en utilisant une solution dans l'acide ac??tique glacial d'un acide tr??s fort, tel que l'acide perchlorique.
D'autres applications
Les solutions dilu??es d'acide ac??tique sont ??galement utilis??s pour leur l??g??re acidit?? . Des exemples de la environnement domestique comprennent l'utilisation dans un bain d'arr??t au cours du d??veloppement de films photographiques, et agents de d??tartrage pour enlever calcaire des robinets et des bouilloires. L'acidit?? est ??galement utilis?? pour traiter la piq??re de la m??duse bo??te en d??sactivant les cellules urticantes de la m??duse, la pr??vention des blessures graves ou la mort si elle est appliqu??e imm??diatement et pour le traitement de infections de l'oreille externe chez les personnes dans des pr??parations telles que Vosol. De mani??re ??quivalente, l'acide ac??tique est utilis?? en tant que pulv??risation sur agent de conservation pour le b??tail ensilage, pour d??courager bact??rienne et fongique croissance. L'acide ac??tique glacial est ??galement utilis?? en tant que verrue et d??capant verrue.
Les sels organiques ou inorganiques sont produites ?? partir d'acide ac??tique, comprenant:
- L'ac??tate de sodium, utilis?? dans le textile et l'industrie alimentaire en tant que conservateur ( E262).
- Cuivre (II) ac??tate, utilis?? comme pigment et un fongicide.
- L'ac??tate d'aluminium et de fer (II) ac??tate d'??thyle utilis?? comme mordants pour des colorants.
- Palladium (II) ac??tate, utilis?? comme catalyseur pour des r??actions de couplage organiques tels que le R??action de Heck.
- Ac??tate d'argent, utilis?? en tant que pesticide.
Les acides ac??tiques substitu??s de produits suivants:
- L'acide monochlorac??tique (MCA), l'acide dichloroac??tique (consid??r?? comme un sous-produit), et l'acide trichloroac??tique. MCA est utilis?? dans la fabrication de colorant indigo.
- Bromoac??tique acide, qui est est??rifi?? pour produire le r??actif bromoac??tate d'??thyle.
- L'acide trifluorac??tique, ce qui est un r??actif commun ?? synth??se organique.
Quantit??s d'acide ac??tique utilis?? dans d'autres applications ensemble (?? part TPA) compte pour un autre 5% -10% de l'utilisation de l'acide ac??tique dans le monde entier. Ces applications sont, cependant, ne devraient pas se d??velopper autant que la production de TPA.
S??curit??
Acide ac??tique concentr?? est corrosif et doit donc ??tre manipul?? avec des soins appropri??s, car il peut provoquer des br??lures de la peau, des l??sions oculaires permanentes et irritation des muqueuses. Ces br??lures ou des cloques peuvent ne appara??tre que des heures apr??s l'exposition. Les gants en latex ne offrent aucune protection, des gants de mani??re sp??cialement r??sistants, tels que ceux en caoutchouc nitrile, doit ??tre port?? lors de la manipulation du compos??. Acide ac??tique concentr?? peut ??tre allum?? avec difficult?? dans le laboratoire. Il devient un risque inflammable si la temp??rature ambiante d??passe 39 ?? C (102 ?? F), et peut former des m??langes explosifs avec l'air au-dessus de cette temp??rature ( limites d'explosion: 5.4% -16%).
Les risques de solutions d'acide ac??tique d??pendent de la concentration. Le tableau suivant dresse la liste des Classification des solutions d'acide ac??tique de l'UE:

| Concentration en poids | Molarit?? | Classification | Phrases R |
|---|---|---|---|
| 10% -25% | 1,67 ?? 4,16 mol / L | Irritant (Xi) | R36 / 38 |
| 25% -90% | 4,16 ?? 14,99 mol / L | Corrosif (C) | R34 |
| > 90% | > 14,99 mol / L | Corrosif (C) | R10, R35 |
Solutions d'acide ac??tique ?? plus de 25% sont trait??s dans une hotte de laboratoire ?? cause de la piquant, vapeur corrosive. Diluer l'acide ac??tique, sous la forme de vinaigre, est inoffensif. Toutefois, l'ingestion de solutions plus fortes est dangereux pour la vie humaine et animale. Il peut causer de graves dommages ?? la le syst??me digestif, et un changement potentiellement mortelle en l'acidit?? du sang .
En raison d'incompatibilit??s, il est recommand?? de garder l'acide ac??tique loin de l'acide chromique, l'??thyl??ne glycol, l'acide nitrique , l'acide perchlorique, permanganates, les peroxydes et hydroxyles.

