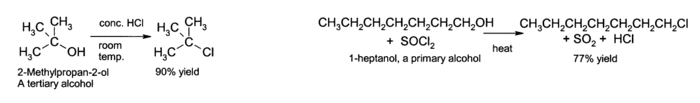Alcool
Saviez-vous ...
SOS Enfants, un organisme de bienfaisance de l'??ducation , a organis?? cette s??lection. enfants SOS est le plus grand don de charit?? du monde enfants orphelins et abandonn??s la chance de la vie familiale.

En chimie , un alcool est tout compos?? organique dans lequel un hydroxyle groupe (- O H ) est li?? ?? un carbone d'un atome un groupe alkyle ou un groupe alkyle substitu??. La formule g??n??rale pour une simple alcool acyclique est C n H 2n + 1 OH.
En termes simples, le mot alcool ( arabe : الكحل, "al-Kuhl") d??signe habituellement l'??thanol , aussi connu comme l'alcool de grain ou (plus) l'esprit de vin, ou ?? tout boisson alcoolis??e. L'??thanol est un liquide volatil incolore ?? odeur douce qui peut ??tre obtenu par le fermentation de sucres. (Industriellement, il est plus souvent obtenue par hydratation de l'??thyl??ne - la r??action de l' ??thyl??ne avec de l'eau en pr??sence d' acide phosphorique .) L'??thanol est le plus largement utilis?? d??presseur dans le monde, et a ??t?? pendant des milliers d'ann??es. Ce sentiment sous-tend le terme l'alcoolisme ( d??pendance ?? l'alcool).
D'autres alcools sont g??n??ralement d??crits avec un adjectif clarifier, comme dans alcool isopropylique (le propan-2-ol) ou l'alcool de bois (alcool de m??thyle ou le methanol ). Le ol suffixe appara??t dans la version "officielle" UICPA nom de tous les alcools chimique.
Il existe trois grands sous-ensembles d'alcools: primaires (1 ??), secondaire (2 ??) et tertiaire (3 ??), sur la base du nombre de atomes de carbone du carbone du groupe C-OH (en rouge) est li?? ??. L'??thanol est un alcool simple "primaire". L'alcool secondaire est plus simple l'alcool isopropylique (propane-2-ol), et un alcool tertiaire est simple l'alcool tert-butylique (2-m??thyl-2-ol).
Le ph??nols avec compos?? parent ph??nol ont un groupe hydroxyle (attach?? ?? un benz??ne anneau) comme les alcools, mais diff??rent suffisamment propri??t??s ?? justifier un traitement s??par??.
Les glucides (sucres) et des alcools de sucre sont une classe importante de compos??s contenant des groupes fonctionnels d'alcools multiple. Par exemple, le saccharose (sucre ordinaire) contient huit groupes hydroxyles par mol??cule et sorbitol en a six. La plupart des attributs de ceux-ci polyols, de nomenclature, ?? l'occurrence, l'utilisation et la toxicit??, sont suffisamment diff??rents parmi les alcools aliphatiques simples ?? exiger un traitement s??par??.
Des alcools simples
Les alcools les plus simples et les plus couramment utilis??s sont le m??thanol et l'??thanol . Le methanol a ??t?? pr??c??demment obtenue par la distillation du bois et appel?? "alcool de bois??. Il est maintenant un produit pas cher, le produit chimique de monoxyde de carbone r??agir avec l'hydrog??ne sous haute pression. Le m??thanol est enivrant mais pas directement toxique. C'est toxique par son ??chec ( intoxication) par le enzyme alcool d??shydrog??nase dans le foie en formant de l'acide formique et formald??hyde qui cause permanente la c??cit?? par la destruction de la nerf optique.
Outre son r??le familier les boissons alcoolis??es, de l'??thanol est ??galement utilis?? en tant que solvant industriel tr??s contr??l??e et de mati??res premi??res. Pour ??viter les taxes ??lev??es sur l'??thanol pour la consommation, des additifs sont ajout??s pour le rendre d??sagr??able (comme benzoate de d??natonium - "Bitrex") ou toxique (comme le m??thanol). ??thanol sous cette forme est g??n??ralement connu que alcool d??natur??; lorsque le methanol est utilis??, il peut ??tre nomm?? alcool ?? br??ler ("Meths??) ou ??esprits chirurgicales??.
Deux autres alcools dont les utilisations sont relativement r??pandu (mais pas autant que ceux de m??thanol et l'??thanol) sont propanol et butanol. Comme l'??thanol, ils peuvent ??tre produits par des proc??d??s de fermentation. (Cependant, l'agent de fermentation est une bact??rie, Clostridium acetobutylicum, qui se nourrit de la cellulose, les sucres non comme la levure Saccharomyces qui produit de l'??thanol.)
Nomenclature
Noms syst??matiques
Dans l' UICPA syst??me, le nom de la cha??ne alcane perd le terminal "e" et ajoute "ol", par exemple "m??thanol" et "??thanol". Lorsque cela est n??cessaire, la position du groupe hydroxyle est indiqu?? par un nombre entre l'alcane et le nom "ol": propan-1-ol de CH 3 CH 2 CH 2 OH, propan-2-ol pour CH 3 CH (OH) CH 3. Parfois, le num??ro de position est ??crite avant le nom IUPAC: 1-propanol et 2-propanol. Si un groupe de priorit?? plus ??lev??e est pr??sent (tel qu'un ald??hyde, c??tone ou acide carboxylique ), il est alors n??cessaire d'utiliser le pr??fixe "hydroxy", par exemple: 1-hydroxy-2-propanone (CH 3 COCH 2 OH).
Quelques exemples d'alcools simples et la fa??on de les nommer:
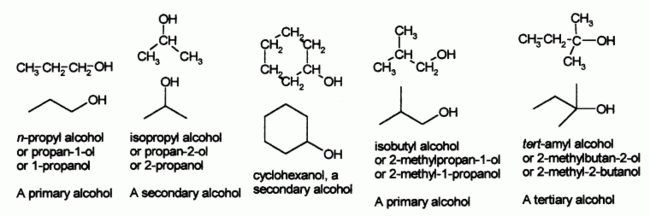
Noms communs pour les alcools prend g??n??ralement le nom du correspondant alkyle groupe et ajouter le mot ??alcool??, par exemple, l'alcool m??thylique, l'alcool ??thylique ou tert-butyl alcool. Alcool de propyle peut ??tre l'alcool n-propyle ou l'alcool isopropylique, selon que le groupe hydroxyle est li?? ?? la premi??re ou deuxi??me carbone sur la cha??ne de propane. L'alcool isopropylique est aussi parfois appel??e la consommation d'alcool de sec.
Comme mentionn?? ci-dessus sont consid??r??s comme des alcools primaire (1 ??), secondaire (2 ??) ou tertiaire (3 ??), et les noms communs indiquent souvent pr??sent dans le pr??fixe de groupe alkyle. Par exemple (CH 3) 3 COH est un alcool tertiaire est commun??ment connu sous le nom d'alcool de tert-butyle. Ce serait nomm?? 2-m??thylpropane-2-ol selon les r??gles de l'IUPAC, ce qui indique une cha??ne de propane avec des groupes m??thyle et hydroxyle attach?? ?? la fois au milieu (# 2) carbone.
Alcool primaire (1 ??) - ont des formules g??n??rales RCH 2 OH alcool secondaire (2 ??) - Avoir formules g??n??rales RR'CHOH alcool tertiaire (3 ??) - ont des formules g??n??rales RR'R COH de commande de la force de la liaison hydrog??ne: 1 ??> 2 ?? > 3 ?? Point d'??bullition pour: 1 ??> 2 ??> 3 ?? afin d'acidit??: 1 ??> 2 ??> 3 ??
??tymologie
Le mot d'alcool appara??t en anglais dans le 16??me si??cle, pr??t?? par l'interm??diaire de fran??ais m??dical latine , en fin de compte de l' arabe al-Kuhl. al est l'arabe pour la article d??finitif, le en anglais. Kuhl ??tait le nom donn?? ?? la poudre tr??s fine, produit par le sublimation du min??ral naturel Stibnite pour former l'antimoine sulfure Sb 2 S 3 (d'o?? l'essence ou de ??l'esprit?? de la substance), qui a ??t?? utilis?? comme un antiseptique et eyeliner.
L'introduction du mot ?? la terminologie europ??enne dans l'alchimie remonte au 12??me si??cle , par des traductions d'??uvres d'latine Rhazes (865-925), qui a d??crit l'art de la distillation . Barth??lemy Traheron dans sa traduction de 1543 Jean de Vigo introduit le mot comme un terme utilis?? par ??barbare?? ( Auteurs maures) pour "poudre fine":
- les barbares auctours consomment de l'alcool, ou (comme je fynde il sometymes wryten) alcofoll, pour Moost poudre bien.
William Johnson dans son Lexique 1657 Chymicum gloses le mot comme l'antimoine stibium sive. Par extension, le mot est venu de se r??f??rer ?? ne importe quel fluide obtenu par distillation, y compris "l'alcool de vin", l'essence distill??e de vin. Libavius dans Alchymia (1594) a de l'alcool vini vel vinum alcalisatum. Johnson (1657) passe sous silence l'alcool vini que quando omnis superfluitas vini un separatur vino, ita ut accensum ardeat donec totum consumatur, nihilque FAECUM aut phlegmatis in fundo remaneat. Le sens du mot se est limit?? ?? ??l'esprit de vin?? ( ??thanol ) dans le 18??me si??cle , et a de nouveau ??t?? ??tendue ?? la famille de substances que l'on appelle dans la chimie moderne de 1850.
Le nom arabe actuel de l'alcool est الكحول al-kuḥūl, r??introduit de l'usage de l'Ouest, tandis que le L'arabe classique mot est الغول al-Gawl (par exemple sourate 37:47), litt??ralement " esprit ??(le mot al-Gawl est aussi ?? l'origine de l' anglais mot " goule ", et le nom de l'??toile Algol ).
PROPRIETES physiques et chimiques
Le un groupe hydroxyle rend g??n??ralement la mol??cule d'alcool polaire. Ces groupes peuvent former des liaisons hydrog??ne les uns aux autres et ?? d'autres compos??s. Ce moyen de liaison hydrog??ne que des alcools peuvent ??tre utilis??s comme des solvants protiques. Deux tendances oppos??es de solubilit?? dans les alcools sont: la tendance de l'OH polaire pour promouvoir solubilit?? dans l'eau, et de la cha??ne de carbone lui r??sister. Ainsi, le m??thanol, l'??thanol, le propanol et sont miscibles dans l'eau parce que le groupe hydroxyle emporte sur la cha??ne carbon??e courte. Butanol, avec une cha??ne carbone-quatre, est mod??r??ment soluble ?? cause d'un ??quilibre entre les deux tendances. Alcools de cinq ou plusieurs atomes de carbone ( Pentanol et sup??rieur) sont effectivement insoluble dans l'eau en raison de la domination de la cha??ne hydrocarbon??e. Tous les alcools simples sont miscibles dans les solvants organiques.
?? cause de une liaison hydrog??ne, des alcools ont tendance ?? avoir des points d'??bullition plus ??lev??s que les comparable les hydrocarbures et les ??thers . Le but de l'??thanol ?? l'alcool d'??bullition est de 78,29 ?? C, par rapport ?? 69 ?? C pendant l'hydrocarbure Hexane (un constituant commun des essence) et 34,6 ?? C pendant L'??ther de di??thyle.
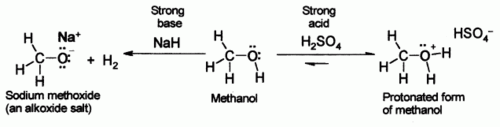
Alcools, comme l'eau, peuvent pr??senter des propri??t??s soit acides ou basiques au groupe OH. Avec un pK a de l'ordre de 16-19, ils sont g??n??ralement un peu plus faibles acides que l'eau , mais ils sont encore capables de r??agir avec des bases fortes telles que l'hydrure de sodium ou de m??taux r??actifs tels que le sodium . Le sels qui r??sultent sont appel??s les alcoxydes, de formule g??n??rale R O - M + de.
Pendant ce temps, l'atome d'oxyg??ne a paires d'??lectrons libres non li??s qui le rendent faiblement de base, en pr??sence d'acides forts tels que l'acide sulfurique . Par exemple, avec du methanol:
Alcools peuvent ??galement subir oxydation pour donner des ald??hydes, des c??tones ou des acides carboxyliques , ou ils peuvent ??tre d??shydrat??s pour les alc??nes . Ils peuvent r??agir pour former compos??s ester, et ils peuvent (si activ?? en premier) subir une substitution nucl??ophile r??actions. Les paires d'??lectrons c??libataires ?? l'oxyg??ne du groupe hydroxyle rend ??galement les alcools nucl??ophiles. Pour plus de d??tails voir les r??actions des alcools section ci-dessous.
Applications
Les alcools peuvent ??tre utilis??s en tant que boisson ( ??thanol seulement), en tant que combustible et de nombreux utilitaires scientifiques, m??dicales et industrielles. L'??thanol sous la forme de boissons alcoolis??es a ??t?? consomm?? par les humains depuis les temps pr??historiques. Une solution ?? 50% v / v de ??thyl??ne glycol dans l'eau est couramment utilis?? en tant que antigel.
Certains alcools, principalement de l'??thanol et le methanol , peuvent ??tre utilis??s en tant que carburant d'alcool. le rendement de carburant peut ??tre augment??e en induction forc??e moteurs ?? combustion interne en injectant l'alcool dans l'entr??e d'air apr??s le turbocompresseur ou suralimentation a l'air sous pression. Cela refroidit l'air sous pression, offrant une charge d'air plus dense, ce qui permet plus de carburant, et donc plus de puissance.
Alcools ont des applications dans l'industrie et la science que les r??actifs ou les solvants . En raison de sa faible toxicit?? et de sa capacit?? ?? dissoudre substances non polaires, l'??thanol peut ??tre utilis?? comme solvant dans m??dicaments, des parfums, des essences et v??g??tales telles que vanille . En synth??se organique, alcools servent comme interm??diaires polyvalents.
L'??thanol peut ??tre utilis?? comme antiseptique pour d??sinfecter la peau avant les injections sont faites, souvent avec l'iode. Savons ?? base d'??thanol sont de plus commun dans les restaurants et sont pratiques car ils ne n??cessitent pas de s??chage en raison de la volatilit?? du compos??. L'alcool est ??galement utilis?? en tant que Agent de conservation pour sp??cimens.
Production
Des alcools sont produits industriellement de plusieurs fa??ons:
- Par fermentation en utilisant le glucose produit ?? partir de sucre de la hydrolyse de l'amidon, en pr??sence de la levure et de la temp??rature inf??rieure ?? 37 ?? C pour produire de l'??thanol. Par exemple, la conversion de invertase de glucose et fructose ou la conversion de glucose ?? zymase et l'??thanol .
- En directe hydratation utilisant ??thyl??ne ( hydratation d'??thyl??ne ou d'autres alc??nes ?? partir de craquage de fractions de distill??e p??trole brut . On utilise habituellement un catalyseur de l'acide phosphorique sous la temp??rature et la pression de 50 ?? 120.
- Le methanol est produit ?? partir de gaz de synth??se, o?? le monoxyde de carbone et deux ??quivalents d'hydrog??ne gazeux sont combin??s pour produire du m??thanol utilisant un cuivre , l'oxyde de zinc et oxyde d'aluminium catalyseur, ?? 250 ?? C et une pression de 50-100 atm.
Endog??ne
Il est in??vitable que tous les humains ont toujours une certaine quantit?? d'alcool dans leur corps en tout temps, m??me si elles ne boivent jamais de boissons alcoolis??es dans leur vie. Ceci est d?? ?? un processus appel?? la production d'??thanol endog??ne. Un grand nombre de bact??ries dans les intestins utiliser l'alcool fermentation comme une forme de la respiration. Cette Proc??d?? m??tabolique produit alcool en tant que produit des d??chets, de la m??me mani??re que les r??sultats du m??tabolisme dans la formation de dioxyde de carbone et eau . Ainsi, le corps humain contiennent toujours une certaine quantit?? d'alcool produite par ces bact??ries b??nignes.
synth??se de laboratoire
Plusieurs proc??d??s existent pour la pr??paration d'alcools en laboratoire.
- Primaire des halog??nures d'alkyle r??agissent avec une solution aqueuse de NaOH ou KOH principalement ?? des alcools primaires ?? substitution aliphatique nucl??ophile . (Halog??nures d'alkyle secondaires et tertiaires en particulier donneront l'??limination (alc??ne) produit au lieu).
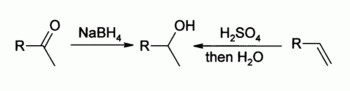
- Ald??hydes ou c??tones sont r??duit avec le borohydrure de sodium ou l'hydrure de lithium et d'aluminium (apr??s un traitement acide). Une autre r??duction par aluminumisopropylates est le R??duction Meerwein-Ponndorf-Verley.
- Alc??nes se engagent dans un acide catalys??e r??action d'hydratation en utilisant concentr??e d'acide sulfurique en tant que catalyseur qui donne g??n??ralement des alcools secondaires ou tertiaires. Le hydroboration-oxydation et oxymercuration-r??duction des alc??nes sont plus fiables en synth??se organique. Alc??nes r??agissent avec NBS et l'eau dans halohydrine r??action de formation
- Les r??actifs de Grignard r??agissent avec des groupes carbonyle en alcools secondaires et tertiaires
- Noyori hydrog??nation asym??trique est la r??duction asym??trique de β-c??to-esters
- Les amines peuvent ??tre converties en sels de diazonium qui sont ensuite hydrolys??.
La formation d'un alcool secondaire par la r??duction et l'hydratation est indiqu??:
R??actions
D??protonation
Alcools peuvent se comporter comme des acides faibles, subissant d??protonation. La r??action de d??protonation pour produire un alcoolate sel est soit effectu??e par une base forte telle que l'hydrure de sodium ou n-butyllithium, ou avec du sodium ou du potassium m??tallique.
- 2 R-OH + 2 NaH → 2 RO - Na + + 2 H 2 ↑
- 2 R-OH + 2 Na → 2R-O - Na + H 2
- Par exemple, 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 -CH 2 -O - Na + H 2
L'eau est similaire ?? pK a de nombreux alcools, donc avec l'hydroxyde de sodium il existe un ??quilibre mis en place qui se ??tend g??n??ralement vers la gauche:
- R-OH + NaOH <=> RO - Na + + H 2 O (??quilibre vers la gauche)
Il convient de noter, cependant, que les bases utilis??es pour d??protoner des alcools eux-m??mes sont solides. Les bases utilis??es et les alcoolates cr????s sont deux r??actifs chimiques hautement sensibles ?? l'humidit??.
L'acidit?? des alcools est ??galement affect??e par la stabilit?? globale de l'ion alcoolate. Groupes attach??s au carbone contenant le groupe hydroxyle servira ?? stabiliser l'alcoolate form?? lorsque, conduisant ainsi ?? une plus grande acidit?? ??lectron-attracteur. D'autre part, la pr??sence de groupe donneur d'??lectrons se traduira par un ion alcoxyde moins stable form??. Cela se traduira par un sc??nario dans lequel l'ion alcoolate instable form?? aura tendance ?? accepter un proton ?? r??former l'alcool d'origine.
Avec halog??nures d'alkyle alcoolates donnent lieu ?? des ??thers du Synth??se d'??ther de Williamson.
Substitution nucl??ophile
Le OH groupe ne est pas une bonne groupe partant ?? substitution nucl??ophile r??actions, de sorte que des alcools neutres ne r??agissent pas dans de telles r??actions. Cependant, si l'oxyg??ne est tout d'abord proton?? pour donner R-OH + 2, le groupe partant ( de l'eau ) est beaucoup plus stable, et la substitution nucl??ophile puisse avoir lieu. Par exemple, les alcools tertiaires r??agissent avec l'acide chlorhydrique pour produire tertiaire des halog??nures d'alkyle, o?? le un groupe hydroxyle est remplac?? par un chlore par atome substitution nucl??ophile unimol??culaire. Si alcools primaires ou secondaires doivent ??tre mis ?? r??agir avec de l'acide chlorhydrique , un activateur tel que le chlorure de zinc est n??cessaire. En variante, la conversion peut ??tre effectu??e directement en utilisant le chlorure de thionyle.
Les alcools peuvent ??galement ??tre convertis en les bromures d'alkyle en utilisant l'acide bromhydrique ou le tribromure de phosphore , par exemple:
- 3 R-OH + PBr 3 → 3 RBr + H 3 PO 3
Dans le Barton-McCombie d??soxyg??nation un alcool est d??soxyg??n??e ?? un alcane avec l'hydrure de tributyl??tain ou un trim??thylbore complexe dans l'eau dans une r??action de substitution radicalaire.
D??shydration
Alcools sont eux-m??mes nucl??ophile, donc R-OH + 2 peut r??agir avec ROH pour produire des ??thers et de l'eau dans un r??action de d??shydratation, bien que cette r??action est rarement utilis??, sauf dans la fabrication de ??ther di??thylique.
Plus utile est le E1 une r??action d'??limination d'alcools pour produire des alc??nes . La r??action a g??n??ralement ob??it R??gle de Zaitsev, qui stipule que le plus stable (habituellement le plus substitu??) alc??ne est form??. Alcools tertiaires ??liminent facilement juste au-dessus la temp??rature ambiante, mais alcools primaires n??cessitent une temp??rature plus ??lev??e.
Ce est un sch??ma d'acide catalys??e d??shydratation de l'??thanol pour produire de l'??thyl??ne :
Une r??action d'??limination est le plus contr??l??e ??limination Chugaev avec du disulfure de carbone et de l'iodom??thane.
Est??rification
Pour former une ester d'un alcool et d'un acide carboxylique de la r??action, connue sous le nom Est??rification de Fischer, est habituellement effectu??e au reflux avec un catalyseur de concentr?? acide sulfurique :
- R-OH + R'-COOH → R'-COOR + H 2 O
Afin de d??placer l'??quilibre vers la droite et de produire un bon rendement en ester, l'eau est g??n??ralement ??limin??e, soit par un exc??s de H 2 SO 4 ou en utilisant un Appareil de Dean-Stark. Les esters peuvent ??galement ??tre pr??par??s par r??action de l'alcool avec un chlorure d'acide en pr??sence d'une base telle que pyridine.
Autres types d'ester sont pr??par??s par exemple similarly- tosyle (tosylate) esters sont pr??par??s par r??action de l'alcool avec p le chlorure de tolu??nesulfonyle dans de la pyridine.
Oxydation
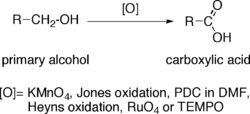
Les alcools primaires (R-CH 2 -OH) peuvent ??tre oxyd??s soit de des ald??hydes (R-CHO) ou ?? des acides carboxyliques (R-CO 2 H), tandis que l'oxydation des alcools secondaires (R 1 R??CH-OH) se termine normalement ?? la c??tone (R 1 R??C = O) ??tape. Les alcools tertiaires (R 1 R??R??C-OH) sont r??sistants ?? l'oxydation.
L'oxydation directe d'alcools primaires en acides carboxyliques se poursuit normalement par l'interm??diaire de l'ald??hyde correspondant, qui est transform?? par l'interm??diaire d'un hydrate d'ald??hyde (R-CH (OH) 2) par r??action avec de l'eau avant de pouvoir ??tre ensuite oxyd?? en l'acide carboxylique.
Souvent, il est possible d'interrompre l'oxydation d'un alcool primaire au niveau de l'ald??hyde en effectuant la r??action en l'absence d'eau, de sorte qu'aucune hydrate d'ald??hyde peut ??tre form??.
Les r??actifs utiles pour la transformation d'alcools primaires en ald??hydes sont normalement ??galement appropri??s pour l'oxydation d'alcools secondaires en c??tones. Ceux-ci comprennent:
- Des r??actifs ?? base de chrome, tels que Collins r??actif (CrO 3 ?? Py 2), PDC ou PCC.
- Activ?? DMSO, r??sultant de la r??action de DMSO avec des ??lectrophiles tels que Du chlorure d'oxalyle ( Oxydation de Swern), un carbodiimide ( Oxydation Pfitzner-Moffatt) ou le complexe SO 3 ?? Py ( Oxydation Parikh-Doering).
- Des compos??s d'iode hypervalent, tels que P??riodinane de Dess-Martin ou Acide 2-iodoxybenzo??que.
- Catalytique TPAP en pr??sence d'un exc??s de NMO ( Oxydation Ley).
- Catalytique TEMPO en pr??sence d'un exc??s l'eau de Javel ( NaOCl) ( L'oxydation de Anelli).
Allylique et des alcools benzyliques peuvent ??tre oxyd??s en pr??sence d'autres alcools en utilisant certains oxydants s??lectifs tels que du dioxyde de mangan??se (MnO 2).
Les r??actifs utiles pour l'oxydation d'alcools secondaires en c??tones, mais normalement inefficaces pour l'oxydation d'alcools primaires en ald??hydes comprennent, le trioxyde de chrome (CrO 3) dans un m??lange d' acide sulfurique et de l'ac??tone ( Oxydation) et certaines c??tones, telles que Jones la cyclohexanone, en pr??sence de l'isopropoxyde d'aluminium ( oxydation d'Oppenauer).
L'oxydation directe d'alcools primaires en acides carboxyliques peut ??tre effectu??e en utilisant:
- Le permanganate de potassium (KMnO 4).
- Oxydation de Jones.
- PDC DMF.
- Oxydation Heyns.
- T??troxyde de ruth??nium (RuO 4).
- TEMPO.
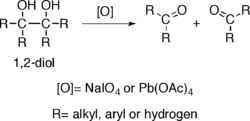
Les alcools poss??dant deux groupes hydroxy situ??s sur des carbones adjacents, -c'est-1,2- diols- subir une rupture par oxydation ?? une liaison carbone-carbone avec des oxydants tels que periodate de sodium (NaIO 4) ou tetraacetate de plomb (Pb (OAc 4)), r??sultant en la production de deux des groupes carbonyle.
Toxicit??
Alcools ont souvent une odeur d??crite comme ??mordant?? qui ??bloque?? dans les voies nasales. ??thanol sous forme de boissons alcoolis??es a ??t?? consomm?? par les humains depuis les temps pr??historiques, pour une vari??t?? de raisons d'hygi??ne, alimentaires, m??dicinales, religieuses et r??cr??atives. La consommation de grandes doses entra??n?? l'ivresse ou d'intoxication (ce qui peut conduire ?? un la gueule de bois que l'effet se dissipe) et, en fonction de la dose et de la r??gularit?? de l'utilisation, peut provoquer une insuffisance respiratoire aigu?? ou la mort et ?? l'utilisation chronique a des r??percussions m??dicales. Parce que l'alcool alt??re le jugement, il peut souvent ??tre un catalyseur pour comportement imprudent ou irresponsable. Le LD 50 chez le rat d'??thanol est 11 300 mg / kg. Ce ratio correspondrait ?? une 80 kg (?? 176,4) homme potable 65 coups de 80 ou 46 alcool ?? moiti?? bouteilles d'un litre de bi??re ?? 5% d'alcool par volume, bien que la DL 50 ne se traduit pas directement aux humains. Il est g??n??ralement admis qu'une dose mortelle chez l'homme serait d'environ un tiers celle des rats, soit environ 22 boissons toute consomm??e en une s??ance pour 80 kg (?? 176,4) homme.
D'autres alcools sont sensiblement plus toxique que l'??thanol, en partie parce qu'ils prennent beaucoup plus de temps ?? ??tre m??tabolis??s, et souvent leur m??tabolisme produit des substances encore plus toxiques. Le m??thanol ou l'alcool de bois, par exemple, est oxyd?? par alcool d??shydrog??nase les enzymes du foie toxique pour la formald??hyde, qui peut causer la c??cit?? ou la mort.
Un traitement efficace pour pr??venir la toxicit?? du formald??hyde apr??s ingestion de m??thanol est d'administrer l'??thanol. Alcool d??shydrog??nase a une plus grande affinit?? pour l'??thanol, le m??thanol emp??chant ainsi de se lier et d'agir comme un substrat. Toute methanol restant sera alors le temps de ??tre excr??t?? par les reins. Formald??hyde restant sera converti en acide formique et excr??t??.