
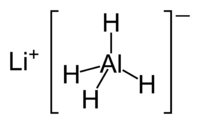
Hydrure de lithium aluminium
Contexte des ??coles Wikip??dia
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Hydrure de lithium aluminium | |
|---|---|
 | |
 | |
 | |
Hydrure de lithium aluminium | |
Autres noms LAH, l'alanate de lithium, | |
| Identificateurs | |
| Num??ro CAS | 16853-85-3 |
| Num??ro RTECS | BD0100000 |
| Propri??t??s | |
| Formule mol??culaire | LiAlH4 |
| Masse molaire | 37,95 g / mol |
| Apparence | cristaux blancs (??chantillons purs) poudre grise (mat??riel commercial) |
| Densit?? | 0,917 g / cm 3, solide |
| Point de fusion | 150 ?? C (423 K), d??composition |
| Solubilit?? dans l'eau | r??actif |
| Structure | |
| Crystal structure | monoclinique |
| Risques | |
| R / S d??claration | R: 15 S: 7/8, 24/25, 43 |
| Principal dangers | hautement inflammable |
| NFPA 704 |  2 3
2 |
| Des compos??s apparent??s | |
| Connexe hydrure | l'hydrure d'aluminium le borohydrure de sodium l'hydrure de sodium |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Hydrure de lithium aluminium ( Li Al H 4), g??n??ralement abr??g?? de LAH, est un agent r??ducteur utilis?? dans synth??se organique. Il est plus puissant que le connexes r??actif borohydrure de sodium en raison de la plus faible Al-H obligations, comparativement ?? la liaison BH. Il vous permet de convertir des esters, des acides carboxyliques et des c??tones correspondantes dans les alcools ; et amide, nitro, un nitrile, imine, oxime, et compos??s d'azides dans les amines .
Disponibilit?? et de manutention
LAH est un blanc ??chantillons solides, mais commerciales sont presque toujours gris en raison de la contamination par des traces d' aluminium m??tallique. Ce mat??riau peut ??tre purifi?? par recristallisation ?? partir de ??ther di??thylique. Purifications ?? grande ??chelle utilisent une Extracteur Soxhlet. Commun??ment, la mati??re grise impur est utilis?? dans la synth??se, car les impuret??s sont inoffensifs et facilement s??par?? des produits organiques. Le produit pur est pyrophore. Certains mat??riaux commerciaux contiennent huile min??rale pour inhiber les r??actions avec l'humidit?? atmosph??rique, mais le plus souvent il est emball?? dans des sacs en plastique ??tanches ?? l'humidit??.
LAH r??agit violemment avec l'eau , y compris l'humidit?? atmosph??rique. Le produit de r??action selon l'??quation suivante: id??alis??e
- LiAlH 4 + 4 H 2 O → LiOH + Al (OH) 3 + 4 H 2 ↑
Cette r??action fournit une m??thode utile pour produire de l'hydrog??ne dans le laboratoire. ??chantillons vieillis, expos??es ?? l'air apparaissent souvent blanc parce qu'ils ont absorb?? suffisamment d'humidit?? pour produire un m??lange des compos??s incolores l'hydroxyde de lithium et l'hydroxyde d'aluminium.
Pr??paration
LAH a ??t?? pr??par?? ?? partir de la r??action entre l'hydrure de lithium (LiH) et du chlorure d'aluminium :
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
En plus de ce proc??d??, la synth??se industrielle implique la pr??paration initiale d'aluminium hydrure de sodium ?? partir des ??l??ments sous haute pression et temp??rature:
- Na + Al + 2 H 2 → NaAlH4
LAH est ensuite pr??par?? par r??action de m??tath??se selon l':
- NaAlH4 + LiCl → LiAlH 4 + NaCl
dans laquelle un produit avec un rendement ??lev?? de LAH. LiCl est ??limin?? par filtration ?? partir d'un ??ther solution de LAH, avec pr??cipitation subs??quente de LAH pour donner un produit contenant environ 1% en poids / poids de LiCl.
Autres tetrahydridoaluminiumates
Une vari??t?? de sels analogues ?? LAH sont connus. NaH peut ??tre utilis?? pour produire efficacement de l'hydrure d'aluminium et de sodium (NaAlH4) par dans m??tath??se THF:
- LiAlH 4 + NaH → NaAlH4 + LiH
Hydrure d'aluminium et de potassium (KAlH 4) peut ??tre produit de mani??re similaire ?? diglyme comme solvant:
- LiAlH 4 + KH KAlH → 4 + LiH
L'inverse, ce est ?? dire, la production de LAH de l'hydrure de sodium soit d'aluminium ou l'hydrure d'aluminium potassium peut ??tre obtenu par r??action avec LiCl dans l'??ther di??thylique ou THF:
- NaAlH4 + LiCl → LiAlH 4 + NaCl
- KAlH 4 → + LiCl + LiAlH 4 KCl
"Magn??sium alanate" (Mg (AlH 4) 2) se pose m??me en utilisant MgBr 2:
- 2 LiAlH 4 + MgBr2 → Mg (AlH 4) 2 + 2 LiBr
Utilisation dans la chimie organique
Hydrure de lithium aluminium est largement utilis?? en chimie organique comme un agent r??ducteur. Malgr?? des probl??mes de manipulation associ??s ?? sa r??activit??, il est m??me utilis?? ?? la petite ?? l'??chelle industrielle, bien que pour les r??ductions d'??chelle bis r??actif au sodium connexes (2-m??thoxy??thoxy) aluminium, commun??ment connu sous le nom Red-Al, est plus souvent utilis??. A ces fins, il est g??n??ralement utilis?? en solution dans l'??ther di??thylique, et un traitement aqueux est g??n??ralement effectu??e apr??s la r??duction afin d'??liminer les sous-produits inorganiques.
LAH est le plus couramment utilis?? pour la r??duction de les esters et les acides carboxyliques en alcools primaires; avant l'av??nement de LiAlH4 ce ??tait une conversion difficile impliquant sodium m??tal dans bouillante ??thanol (la R??duction Bouveault-Blanc). Ald??hydes et c??tones peuvent ??galement ??tre r??duits en alcools par LAH, mais cela se fait g??n??ralement en utilisant des r??actifs plus douces telles que NaBH 4. α, β-c??tones insatur??s sont r??duits en alcools allyliques. Quand ??poxydes sont r??duits en utilisant LAH, le r??actif se attaque ?? la moins entrav?? extr??mit?? de l'??poxyde, produisant g??n??ralement un alcool secondaire ou tertiaire. Epoxycyclohexanes sont r??duits en alcools axiales pr??f??rentiellement.

Utilisation LAH, les amines peuvent ??tre pr??par??es par r??duction de la amides ,, oximes, des nitriles, des compos??s nitro ou des groupes alkyle azides.
Hydrure de lithium aluminium r??duit ??galement halog??nures d'alkyle ?? alcanes , m??me si cette r??action est rarement employ??e. iodures d'alkyle r??agissent le plus rapide, suivi par les bromures et chlorures alkyle puis alkyle. Halog??nures primaires sont le plus r??actif suivi par halog??nures secondaires. Halog??nures tertiaires ne r??agissent que dans certains cas.
Hydrure de lithium aluminium ne r??duit pas simples alc??nes , ar??nes, et alcynes ne sont r??duites que si un alcool groupe est ?? proximit??.
La chimie inorganique
LAS est largement utilis??e pour pr??parer des groupes principaux et des hydrures de m??taux de transition du m??tal correspondant halog??nures.
La d??composition thermique
?? la salle LAH de temp??rature est m??tastable. Pendant le stockage prolong??, il peut lentement se d??composer en trois Li AlH 6 et LiH. Ce proc??d?? peut ??tre acc??l??r?? par la pr??sence de catalyseurs , par exemple des ??l??ments Ti , Fe , V .
Lorsque LAH chauff??e se d??compose en trois ??tapes m??canisme de r??action.
- LiAlH 4 → ⅓ Li 3 AlH 6 ⅔ + Al + H 2 (R1)
- ⅓ Li 3 AlH 6 → LiH + ⅓ Al + ?? H 2 (R2)
- LiH + Al → LiAl + ?? H 2 (R3)
R1 est g??n??ralement initi??e par le fusion de LAH autour d'une temp??rature de 150-170 ?? C imm??diatement suivie par d??composition en solide Li 3 AlH 6. De 200 ?? 250 ?? C Li 3 AlH 6 d??composent en LiH (R2) qui se d??composent ensuite en LiAl au-dessus de 400 ?? C (R3). R1 est effectivement irr??versible, parce que LiAlH 4 est m??tastable. La r??versibilit?? de R2 n'a pas encore ??t?? ??tabli de fa??on concluante. R3 est r??versible avec une pression d'??quilibre d'environ 0,25 bar ?? 500 o C. R1 et R2 peuvent se produire ?? la temp??rature ambiante avec des catalyseurs appropri??s.
Selon les r??actions R1-R3 LiAlH 4 contient 10,6% en poids de l'hydrog??ne qui rend LAH un potentiel hydrog??ne support de stockage pour l'avenir pile ?? combustible aliment?? v??hicules. V??lo seulement R2 stockerait 5,6% en poids dans le mat??riau en une seule ??tape (comparables aux deux ??tapes de NaAlH4).
donn??es de solubilit??
LAH est soluble dans de nombreux ??th??r??s solutions. Toutefois, il peut se d??composer spontan??ment en raison de la pr??sence d'impuret??s catalytiques, cependant, il semble ??tre plus stable en THF. Ainsi, THF est pr??f??r?? par rapport par exemple l'??ther de di??thyle, m??me en d??pit de la faible solubilit??.
| Temp??rature (o C) | |||||
| Solvant | 0 | 25 | 50 | 75 | 100 |
| De l'??ther di??thylique | - | 5,92 | - | - | - |
| THF | - | 2,96 | - | - | - |
| Monoglyme | 1,29 | 1,80 | 2,57 | 3,09 | 3,34 |
| Diglyme | 0,26 | 1,29 | 1,54 | 2,06 | 2,06 |
| Triglyme | 0,56 | 0,77 | 1,29 | 1,80 | 2,06 |
| T??traglyme | 0,77 | 1,54 | 2,06 | 2,06 | 1,54 |
| Dioxane | - | 0,03 | - | - | - |
| l'??ther dibutylique | - | 0,56 | - | - | - |
Notez que l'hydrure de lithium et d'aluminium ne doit pas ??tre utilis?? avec de l'eau, qui r??agit violemment comme d??crit par l'??quation suivante.
- LiAlH 4 + 4 H 2 O → Li + + Al 3+ + 4 OH - + 4 H 2
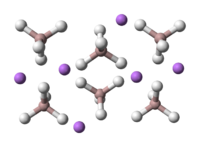
Crystal structure

Le structure cristalline de LAH appartient ?? la syst??me cristallin monoclinique et la groupe d'espace est P2 1 c. La structure cristalline de LAH est illustr??e ?? droite. La structure se compose de Li atomes entour??s par cinq AlH quatre t??tra??dres . Les centres Li + sont li??s ?? un atome d'hydrog??ne un atome de chacun des t??tra??dres entourant la cr??ation d'un arrangement bipyramide. Le cellule unitaire est d??finie comme suit: a = 4,82, b = 7,81, et c = 7,92 ??, α = γ = 90 ?? et β = 112 ??. A des pressions ??lev??es (> 2.2GPa) une transition de phase se produit pour donner β-LAH.
Donn??es thermodynamiques
Le tableau r??sume thermodynamiques donn??es pour LAH et r??actions impliquant LAH, sous la forme de norme enthalpie , entropie et ??nergie libre de Gibbs changement, respectivement.
| R??action | AH o (kJ / mol) | ΔS o (J / (mol K)) | Ag o (kJ / mol) | Commentaire |
| Li (s) + Al (s) + 2 H 2 (g) → LiAlH4 (s) | -116,3 | -240,1 | -44,7 | Formation standard ?? partir des ??l??ments. |
| LiH (s) + Al (s) + 3/2 H 2 (g) → LiAlH4 (s) | -25,6 | -170,2 | 23,6 | Utiliser AH o f (LIH) = -90,5, ΔS o f (LIH) = -69,9, et Ag o f (LIH) = -68,3. |
| LiAlH4 (s) → LiAlH 4 (l) | 22 | - | - | La chaleur de fusion. Valeur est probablement peu fiable. |
| LiAlH 4 (l) → ⅓ Li 3 AlH 6 (s) + ⅔ Al (s) + H 2 (g) | 3,46 | 104,5 | -27,68 | ΔS o calcul??e ?? partir de valeurs d??clar??es de AH o et Ag o. |

