
Alkane
Saviez-vous ...
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. Les enfants de parrainage aide les enfants du monde en d??veloppement ?? apprendre aussi.
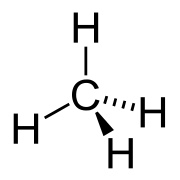
Les alcanes, ??galement connu sous le nom paraffines, sont des compos??s chimiques qui se composent seulement des ??l??ments de carbone (C) et hydrog??ne (H) (ce est ?? dire, des hydrocarbures), dans lequel ces atomes sont li??s entre eux exclusivement par des liaisons simples (ce est ?? dire, ils sont compos??s satur??s) sans structure cyclique (c.-?? boucles). Alcanes appartiennent ?? une s??rie homologue de compos??s organiques dans lesquels les membres diff??rent par une masse atomique relative constante de 14.
Chaque atome de carbone doit avoir quatre obligations (soit liaisons CH ou CC), et chaque atome d'hydrog??ne doit ??tre reli?? ?? un atome de carbone (obligations HC). Une s??rie d'atomes de carbone li??s est connu comme le squelette de carbone ou squelette de carbone. En g??n??ral, le nombre d'atomes de carbone est souvent utilis??e pour d??finir la taille de l'alcane (par exemple, C 2 alcane).
Un groupe alkyle est un groupe ou un groupe fonctionnel de cha??ne lat??rale qui, comme un alcane, est constitu?? uniquement de liaisons simples, li??s atomes de carbone et d'hydrog??ne, par exemple un m??thyle ou un groupe ??thyle.
Les hydrocarbures satur??s peuvent ??tre lin??aires (formule g??n??rale C n H 2 n 2), dans lequel les atomes de carbone sont joints en une structure en forme de serpent, ramifi?? (formule g??n??rale C n H 2 n 2, n> 3) dans lequel le squelette de carbone se s??pare en une ou plusieurs directions, ou cyclique (formule g??n??rale C n H 2 n, n> 2) dans lequel le squelette de carbone est li?? de mani??re ?? former une boucle. Selon la d??finition par IUPAC, les deux premiers sont des alcanes, tandis que le troisi??me groupe est appel?? cycloalcanes. En d'autres termes, les hydrocarbures satur??s sont divis??s en des alcanes et des cycloalcanes, en fonction de si oui ou non ils ont des structures cycliques, et, dans le sens technique, les cycloalcanes sont pas alcanes. Cependant, cycloalcanes sont parfois appel??s alcanes cycliques, ce qui peut ??tre source de confusion lorsque alcanes ??r??els?? sont appel??s alcanes acycliques. Les hydrocarbures satur??s peuvent aussi combiner l'une quelconque des lin??aire, cyclique (par exemple, polycyclique) et les structures de ramification, et ils sont encore alcanes (pas formule g??n??rale) aussi longtemps qu'ils sont acyclique (ie, ne ayant pas de boucles).
La plus simple possible alcane (la mol??cule m??re) est du m??thane , CH 4. Il n'y a pas de limite au nombre d'atomes de carbone qui peuvent ??tre reli??s entre eux, la seule limitation ??tant que la mol??cule est acyclique, est satur??, et est un hydrocarbure. Satur?? huiles et les cires sont des exemples de grandes alcanes dont le nombre d'atomes de carbone dans le squelette de carbone tend ?? ??tre sup??rieur ?? 10.
Alcanes ne sont pas tr??s r??actifs et ont peu activit?? biologique. Alcanes peuvent ??tre consid??r??s comme une masse mol??culaire ??chafaudage sur lequel peut se accrocher les portions biologiquement actives / r??actives int??ressantes ( des groupes fonctionnels de la mol??cule).
Isomerism

Les alcanes ayant plus de trois atomes de carbone peuvent ??tre dispos??s en un nombre multiple de moyens formant diff??rent isom??res structuraux. Un isom??re est comme un produit chimique anagramme, dans lequel les atomes d'un compos?? chimique ou joints sont dispos??s ensemble dans un ordre diff??rent. L'isom??re le plus simple d'un alcane est celui dans lequel les atomes de carbone sont dispos??s dans une seule cha??ne sans branches. Cet isom??re est parfois appel?? le n isom??re (n pour "normal", m??me si elle ne est pas n??cessairement le plus commun). Toutefois, la cha??ne d'atomes de carbone peut ??galement ??tre ramifi?? en un ou plusieurs points. Le nombre d'isom??res possibles augmente rapidement avec le nombre d'atomes de carbone (s??quence A000602 dans OEIS ). Par exemple:
- C 1: 1 d'isom??res - m??thane
- C 2: 1 d'isom??res - ??thane
- C 3: 1 isom??re - propane
- C 4: 2 isom??res - n butane, isobutane
- C 12: 355 isom??res
- C 32: 27711253769 isom??res
- C 60: 22.158.734.535.770.411.074.184 isom??res
En plus de ces isom??res, la cha??ne d'atomes de carbone peut former une ou plusieurs boucles. De tels compos??s sont appel??s cycloalcanes.
Nomenclature
Le Nomenclature IUPAC (de mani??re syst??matique de nommer les compos??s) pour alcanes est bas??e sur l'identification des cha??nes hydrocarbon??es. , Cha??nes hydrocarbon??es satur??s non ramifi??s sont nomm??s syst??matiquement avec un pr??fixe num??rique grec d??signant le nombre d'atomes de carbone et le suffixe "-ane".
Ao??t Wilhelm von Hofmann sugg??re syst??matiser nomenclature en utilisant toute la s??quence des voyelles a, e, i, o et u Pour cr??er suffixes -ane, -??ne, -ine (ou triple liaison), -one, Muin, pour les hydrocarbures. Les trois premiers hydrocarbures de nom avec des liaisons simples, doubles et triples; "One" repr??sente une c??tone ; "Ol" repr??sente un alcool ou un groupe OH; "-oxy-" D??signe un ??ther et fait r??f??rence ?? l'oxyg??ne entre deux atomes de carbone, de sorte que le m??thoxy-m??thane est le nom IUPAC de l'??ther dim??thylique.
Il est difficile, voire impossible, de trouver des compos??s avec plus d'un nom IUPAC. Ce est parce que des cha??nes plus courtes attach??es ?? des cha??nes plus longues sont les pr??fixes et la convention comprend des supports. Les chiffres entre le nom, se r??f??rant ?? un groupe dont le carbone est fix?? ??, devraient ??tre aussi faibles que possible, de sorte que 1- est implicite et g??n??ralement omis des noms de compos??s organiques avec un seul c??t??-groupe; "1-" est impliqu?? dans Nitro-octane. Compos??s sym??triques auront deux fa??ons d'arriver au m??me nom.
Les alcanes lin??aires
Alcanes ?? cha??ne droite sont parfois indiqu??s par le n- pr??fixe (pour normal) o?? un non-lin??aire isom??re existe. Bien que ce ne est pas strictement n??cessaire, l'utilisation est encore courante dans les cas o?? il ya une diff??rence importante dans les propri??t??s entre le lin??aire et des isom??res ?? cha??ne ramifi??e, par exemple, n-hexane ou 2- ou 3-m??thylpentane.
Les quatre premiers membres de la s??rie (en termes de nombre d'atomes de carbone) sont nomm??s comme suit:
Les alcanes ayant au moins cinq atomes de carbone sont d??sign??s par adjonction, suffixe -ane au pr??fixe de langue grecque appropri??e multiplicateur num??rique avec ??lision du ne importe quelle voyelle terminal (-a ou -o) du terme num??rique de base. De ce fait, pentane, C 5 H 12; hexane, C 6 H 14; heptane, C 7 H 16; octane, C 8 H 18; etc. Pour une liste plus compl??te, voir Liste des alcanes.
Alcanes ramifi??s

Les alcanes ramifi??s simples ont souvent un nom commun en utilisant un pr??fixe de les distinguer des alcanes lin??aires, par exemple n pentane, l'isopentane, et n??opentane.
UICPA conventions de nommage peuvent ??tre utilis??s pour produire un nom syst??matique.
Les principales ??tapes de la d??signation des alcanes ramifi??s plus complexes sont les suivantes:
- Identifier la plus longue cha??ne lin??aire d'atomes de carbone
- Nommez cette cha??ne racine plus longue en utilisant des r??gles d'appellation standard
- Nommer chaque cha??ne lat??rale en changeant le suffixe du nom de l'alcane de "-ane" ?? "-yl"
- Nombre la cha??ne racine, afin que la somme des num??ros attribu??s ?? chaque groupe de c??t?? sera aussi faible que possible
- Num??ro et le nom des cha??nes lat??rales avant le nom de la cha??ne racine
- Se il existe plusieurs cha??nes lat??rales du m??me type, utiliser des pr??fixes comme ??di?? et ??tri-?? pour indiquer comme tel, et chaque num??ro un.
| Nom commun | n -pentane | isopentane | n??opentane |
|---|---|---|---|
| Nom IUPAC | pentane | 2-m??thylbutane | 2,2-dim??thylpropane |
| Structure | | 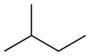 | 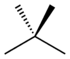 |
Les alcanes cycliques
Les soi-disant alcanes cycliques sont, au sens technique, pas alcanes, mais cycloalcanes. Ils sont les hydrocarbures comme les alcanes juste, mais contenant un ou plusieurs cycles.
Cycloalcanes simples ont un pr??fixe "cyclo-" pour les distinguer des alcanes. Les cycloalcanes sont nomm??s comme par leurs homologues acycliques par rapport au nombre d'atomes de carbone, par exemple, cyclopentane (C 5 H 10) est un cycloalcane ?? 5 atomes de carbone, tout comme pentane (C 5 H 12), mais ils sont reli??s dans un cycle ?? cinq cha??nons. D'une mani??re similaire, le propane et cyclopropane, butane et cyclobutane, etc.
Cycloalcanes substitu??s sont nomm??s similaire ?? alcanes substitu??s - l'anneau cycloalcane est d??clar??, et les substituants sont en fonction de leur position sur l'anneau, avec la num??rotation d??cid??e par R??gles de Cahn-Ingold-Prelog.
Noms triviaux
Le (non trivial syst??matique ) nom pour alcanes est " paraffines. "Ensemble, alcanes sont connus comme la s??rie de paraffine. noms triviaux pour les compos??s sont g??n??ralement des objets historiques. Ils ont ??t?? invent?? avant le d??veloppement de noms syst??matiques et ont ??t?? retenus en raison de l'usage familier dans l'industrie. Cycloalkanes sont aussi appel??s napht??nes.
Il est presque certain que le terme paraffine provient de l'industrie p??trochimique. Alcanes ?? cha??ne ramifi??e sont appel??s isoparaffines. L'utilisation du terme "paraffine" est un terme g??n??ral et souvent ne distingue pas entre un compos??s purs et m??langes de isom??res avec la m??me formule chimique (par exemple, comme un produit chimique anagramme), par exemple, le pentane et isopentane.
- Exemples
Les noms triviaux suivants sont retenus dans le syst??me IUPAC:
- isobutane pour 2-m??thylpropane
- isopentane pour le 2-m??thylbutane
- n??opentane 2,2-dim??thyl pour
Occurrence
Pr??sence d'alcanes dans l'Univers

Les alcanes constituent une partie importante de la atmosph??res des plan??tes gazeuses externes tels que Jupiter (0,1% de m??thane, 0,0002% d'??thane), Saturne (0,2% de m??thane, 0,0005% d'??thane), Uranus (1,99% de m??thane, 0,00025% d'??thane) et Neptune (1,5% de m??thane, 1,5 ppm d'??thane ). Titan (1,6% de m??thane), un satellite de Saturne, a ??t?? examin?? par la sonde Huygens, qui indiquent que l'atmosph??re de Titan pleut r??guli??rement m??thane liquide sur la surface de la lune. Aussi sur Titan, un volcan crachant de m??thane a ??t?? rep??r?? et ce volcanisme est consid??r?? comme une source importante de m??thane dans l'atmosph??re. Il semble aussi ??tre lacs de m??thane / ??thane de pr??s les r??gions polaires nord de Titan, d??couverte par l'imagerie radar de Cassini. Le m??thane et l'??thane ont ??galement ??t?? d??tect??s dans la queue de la com??te Hyakutake . L'analyse chimique a montr?? que les abondances d'??thane et de m??thane ??taient ?? peu pr??s ??gale, qui est pens?? pour laisser entendre que ses glaces form??s dans l'espace interstellaire, loin du Soleil, ce qui aurait ??vapor?? ces mol??cules volatiles. Les alcanes ont ??galement ??t?? d??tect??s dans tels que des m??t??orites chondrites carbon??es.
Pr??sence d'alcanes sur Terre
Des traces de m??thane (environ 0,0001% ou de 1 ppm) se produisent dans l'atmosph??re de la terre, produit principalement par les organismes tels que Archaea, a trouv?? par exemple dans l'intestin des vaches.

Les sources commerciales plus importantes pour les alcanes sont le gaz naturel et le p??trole . Le gaz naturel contient principalement du m??thane et de l'??thane, avec une certaine propane et butane: l'huile est un m??lange d'alcanes liquides et autres des hydrocarbures. Ces hydrocarbures ont ??t?? form??s lorsque les cadavres d'animaux et de plantes marines (zooplancton et phytoplancton) sont mortes et ont coul?? au fond des mers anciennes et ont ??t?? recouverts de s??diments dans un environnement anoxique et converti sur des millions d'ann??es ?? des temp??ratures ??lev??es et une forte pression sur leur forme actuelle. Le gaz naturel ainsi abouti par exemple ?? partir de la r??action suivante:
- C 6 H 12 O 6 → 3CH 4 + 2 3CO
Ces hydrocarbures dans des roches poreuses, situ?? sous une roche couverture imperm??able et ne sont donc pi??g??s. Contrairement m??thane, qui est constamment r??form?? en grandes quantit??s, la hausse des alcanes (alcanes avec 9 ou plusieurs atomes de carbone) d??veloppent rarement dans une mesure consid??rable dans la nature. Ces d??p??ts, par exemple, champs de p??trole, ont form?? au cours de millions d'ann??es et une fois ??puis??s ne peuvent pas ??tre facilement remplac??. L'??puisement de ces hydrocarbures est la base de ce qui est connu comme le crise de l'??nergie.
Alcanes solides sont connus en tant que goudrons et se forment lorsque des alcanes plus volatiles tels que les gaz et le p??trole ??vaporer de gisements d'hydrocarbures. Un des plus grands gisements naturels d'alcanes solides est dans le lac d'asphalte connu sous le nom Pitch Lake en Trinit??-et-Tobago .
Le m??thane est ??galement pr??sent dans ce qu'on appelle biogaz, produit par les animaux et les mati??res en d??composition, qui est une possible source d'??nergie renouvelable .
Alcanes ont une faible solubilit?? dans l'eau, de sorte que le contenu dans les oc??ans est n??gligeable; cependant, ?? des pressions ??lev??es et des temp??ratures basses (par exemple, au fond des oc??ans), le m??thane peut co-cristalliser avec de l'eau pour former un solide hydrate de m??thane. Bien que ce ne peut pas ??tre exploit?? commercialement ?? l'heure actuelle, la quantit?? d'??nergie combustible des champs d'hydrates de m??thane connus d??passe la teneur en ??nergie de tous les gisements de gaz naturel et de p??trole mis ensemble; le m??thane extrait de l'hydrate de m??thane est donc consid??r?? un candidat pour les combustibles futurs .
Occurrence biologique
Bien que les alcanes se produisent dans la nature dans diverses fa??on, ils ne se classent pas parmi les mat??riaux biologiquement essentiels. Des cycloalcanes ayant 14 ?? 18 atomes de carbone se produisent dans musc, extrait de cerfs de la famille Moschidae. Toutes les autres informations se r??f??re ?? (acycliques) alcanes.
- Les bact??ries et les arch??es

Certains types de bact??ries peuvent m??taboliser alcanes: ils pr??f??rent les cha??nes de carbone paires car ils sont plus faciles ?? d??grader que des cha??nes impaires.
D'autre part, certaines arch??es, le m??thanog??nes, de produire de grandes quantit??s de m??thane par le m??tabolisme du dioxyde de carbone ou autre des compos??s organiques oxyd??s. L'??nergie est lib??r??e par l'oxydation de l' hydrog??ne :
- CO 2 + 4H 2 → CH 4 + 2H 2 O
M??thanog??nes sont ??galement les producteurs de gaz des marais dans les zones humides, et lib??rent d'environ deux milliards de tonnes de m??thane par an - la teneur atmosph??rique de ce gaz est produit presque exclusivement par eux. La sortie de m??thane du b??tail et d'autres herbivores , qui peut lib??rer jusqu'?? 150 litres par jour, et des termites , est ??galement due ?? m??thanog??nes. Ils produisent ??galement cette simple de tous les alcanes dans le intestins des ??tres humains. Arch??es m??thanog??nes sont, par cons??quent, ?? la fin de la cycle du carbone, avec du carbone lib??r??e dans l'atmosph??re apr??s avoir ??t?? fix?? par la photosynth??se . Il est probable que nos d??p??ts actuels de gaz naturel ont ??t?? form??s de la m??me mani??re.
- Les champignons et les plantes

Alcanes jouent ??galement un r??le, si un r??le mineur, dans la biologie des trois eucaryotes groupes d'organismes: les champignons , les plantes et les animaux. Certaines levures sp??cialis??es, par exemple, Candida tropicale, Pichia sp., Rhodotorula sp., Des alcanes peut utiliser comme source de carbone et / ou d'??nergie. Le champignon Amorphotheca resinae pr??f??re les alcanes ?? longue cha??ne dans carburant d'aviation, et peut causer de graves probl??mes pour les a??ronefs dans les r??gions tropicales.
Chez les plantes, ce sont les alcanes ?? longue cha??ne solides qui se trouvent; ils forment une couche cabinet de cire, le cuticule, sur les zones de la plante expos??e ?? l'air. Cela prot??ge la plante contre la perte d'eau, tout en emp??chant la lessivage des min??raux importants par la pluie. Ce est aussi une protection contre les bact??ries, les champignons et les insectes nuisibles - ce dernier ??vier avec leurs jambes dans la substance cireuse douce et ont des difficult??s ?? bouger. La couche brillante sur les fruits tels que les pommes se compose d'alcanes ?? longue cha??ne. Les cha??nes carbon??es sont g??n??ralement compris entre vingt et trente atomes de carbone de longueur et sont effectu??s par les plantes ?? partir des acides gras . La composition exacte de la couche de cire ne est pas seulement selon l'esp??ce, mais aussi des changements avec la saison et ces facteurs environnementaux comme les conditions d'??clairage, de la temp??rature ou de l'humidit??.
- Animaux
Alcanes se trouvent dans les produits animaux, m??me se ils sont moins importants que les hydrocarbures insatur??s. Un exemple est l'huile de foie de requin, ce qui est environ 14% pristane (2,6,10,14-t??tram??thylpentad??cane, C 19 H 40). Leur survenue est plus important dans ph??romones, des mat??riaux de messager chimique, ?? laquelle tous les insectes ci-dessus d??pendent de la communication. Avec certains types, comme le dendroctone de soutien Xylotrechus colon, principalement pentacosane (C 25 H 52), 3-methylpentaicosane (C 26 H 54) et 9-methylpentaicosane (C 26 H 54), ils sont transf??r??s par contact corporel. Avec d'autres comme la mouche ts??-ts?? morsitans morsitans, la ph??romone contient les quatre alcanes 2-methylheptadecane (C 18 H 38), 17,21-dimethylheptatriacontane (C 39 H 80), 15,19-dimethylheptatriacontane (C 39 H 80) et 15,19,23-trimethylheptatriacontane (C 40 H 82), et agit par l'odeur sur de longues distances, une caract??ristique utile pour antiparasitaire.
Relations ??cologiques

Un exemple, dans lequel les deux alcanes animales et v??g??tales jouent un r??le, ce est la relation entre la ??cologique sable abeille ( Andrena nigroaenea) et le araign??e d??but orchid??e ( Ophrys araign??e); celle-ci est d??pendante de la pollinisation sur l'ancien. abeilles de sable utilisent les ph??romones afin d'identifier un compagnon; dans le cas de A. nigroaenea, les femelles ??mettent un m??lange de tricosane (C 23 H 48), pentacosane (C 25 H 52) et heptacosane (C 27 H 56) dans le rapport 3: 3: 1, et les m??les sont attir??s par cette odeur sp??cifique. L'orchid??e tire parti de cette disposition pour obtenir l'accouplement l'abeille m??le pour recueillir et diffuser son pollen; une partie de sa fleur ressemblent pas seulement l'apparition d'abeilles de sable, mais ??galement de produire de grandes quantit??s d'alcanes les trois dans le m??me rapport que les abeilles de sable femelles. En cons??quence de nombreux m??les sont attir??s vers les fleurs et tenter de se accoupler avec leur partenaire imaginaire: m??me si cet effort ne est pas couronn??e de succ??s pour l'abeille, il permet l'orchid??e de transf??rer son pollen, qui sera dispers??e apr??s le d??part de la frustration m??le diff??rentes fleurs.
Production
Le raffinage du p??trole

Comme indiqu?? pr??c??demment, la plus importante source d'alcanes est du gaz naturel et de p??trole brut . Alcanes sont s??par??s dans une raffinerie de p??trole par distillation fractionn??e et transform??s en de nombreux produits diff??rents
Fischer-Tropsch
Le Proc??d?? de Fischer-Tropsch est un proc??d?? pour synth??tiser des hydrocarbures liquides, y compris des alcanes, de l'oxyde de carbone et d'hydrog??ne. Cette m??thode est utilis??e pour produire des substituts pour les distillats de p??trole.
pr??paration de laboratoire
Il est g??n??ralement peu besoin d'alcanes ?? ??tre synth??tis??s dans le laboratoire, car ils sont g??n??ralement disponibles dans le commerce. En outre, les alcanes sont g??n??ralement non r??actif chimique ou biologique, et qu'ils ne subissent interconversions de groupes fonctionnels proprement. Lorsque les alcanes sont produites dans le laboratoire, il est souvent un sous-produit d'une r??action. Par exemple, l'utilisation de n-butyllithium en tant que solide une base donne l'acide conjugu??, le n-butane en tant que produit secondaire:
- C 4 H 9 Li + H 2 O → C 4 H 10 + LiOH
Cependant, parfois, il peut ??tre souhaitable d'effectuer une partie d'une mol??cule dans un alcane comme fonctionnalit?? ( alkyle en groupe) en utilisant les proc??d??s ci-dessus ou similaires. Par exemple, un un groupe ??thyle est un groupe alkyle; lorsque ce est attach?? ?? un un groupe hydroxy, il donne de l'??thanol , ce qui ne est pas un alcane. Pour ce faire, les m??thodes les plus connues sont l'hydrog??nation des alc??nes :
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alkyle )
Les alcanes ou les groupes alkyle peuvent ??galement ??tre pr??par??s directement ?? partir de des halog??nures d'alkyle dans le R??action Corey-Maison-Posner-Whitesides. Le Barton-McCombie d??soxyg??nation retire des groupes hydroxyle ?? partir d'alcools par exemple,
et le R??duction de Clemmensen ??limine des groupes carbonyle de c??tones et d'ald??hydes pour former des alcanes ou des compos??s alkyl-substitu??, par exemple:
Applications
Les applications d'un certain alcane peut ??tre d??termin??e tr??s bien en fonction du nombre d'atomes de carbone. Les quatre premiers alcanes sont utilis??s principalement ?? des fins de chauffage et de cuisson, et dans certains pays pour la production d'??lectricit??. Le m??thane et l'??thane sont les principaux composants de gaz naturel; ils sont normalement stock??s sous forme de gaz sous pression. Il est cependant plus facile de les transporter sous forme de liquides: Ceci n??cessite ?? la fois la compression et le refroidissement du gaz.
Propane et butane peut ??tre liqu??fi?? ?? assez basses pressions, et sont bien connus comme gaz de p??trole liqu??fi?? (GPL). Propane, par exemple, est utilis?? dans le br??leur ?? gaz propane, butane dans les briquets jetables. Les deux alcanes sont utilis??s comme propulseurs dans les a??rosols.
?? partir de pentane pour Octane les alcanes sont des liquides volatils raisonnable. Ils sont utilis??s comme combustibles dans moteurs ?? combustion interne, car ils se ??vaporent facilement sur l'entr??e dans la chambre de combustion sans formation de gouttelettes, qui porteraient atteinte ?? la unifomity de la combustion. Les alcanes ?? cha??ne ramifi??e sont pr??f??r??s, car ils sont beaucoup moins sujets ?? allumage pr??matur??, ce qui provoque frapper que leur homologue cha??ne droite. Cette propension ?? l'inflammation pr??matur??e est mesur??e par la l'indice d'octane du carburant, o?? 2,2,4-trim??thylpentane (isooctane) pr??sente une valeur arbitraire de 100, et heptane a une valeur de z??ro. Outre leur utilisation comme combustibles, les alcanes moyennes sont ??galement de bons solvants pour les substances non polaires.
Alcanes nonane, par exemple, hexad??cane (un alcane avec des atomes de carbone seize) sont des liquides de plus viscosit??, de moins en moins appropri??e pour une utilisation dans l'essence. Ils forment ?? la place la majeure partie des diesel et carburant d'aviation. Les carburants diesel sont caract??ris??s par leur l'indice de c??tane, c??tane ??tant l'ancien nom de l'hexad??cane. Toutefois, les points de fusion plus ??lev??s de ces alcanes peuvent poser des probl??mes ?? basse temp??rature et dans les r??gions polaires, o?? le combustible devient trop visqueux pour se ??couler correctement.
Les alcanes ?? partir de l'hexad??cane vers le haut forment des composants les plus importants de le mazout et huile de graissage. Dans cette derni??re fonction, ils fonctionnent ?? la fois comme agents anti-corrosifs, que leur nature hydrophobe signifie que l'eau ne peut pas atteindre la surface du m??tal. De nombreux alcanes solides trouvent une utilisation en tant que la cire de paraffine, par exemple, dans bougies. Cela ne devrait pas ??tre confondu avec toutefois vrai cire, qui se compose principalement de esters.
Les alcanes avec une longueur de cha??ne d'environ 35 ou plus atomes de carbone sont pr??sents dans bitume, utilis??es, par exemple, dans le rev??tement de routes. Cependant, les alcanes sup??rieurs ont peu de valeur et sont g??n??ralement divis??s en alcanes inf??rieurs par fissuration.
Certains synth??tique des polym??res tels que poly??thyl??ne et polypropyl??ne sont alcanes avec des cha??nes contenant des centaines de milliers d'atomes de carbone. Ces mat??riaux sont utilis??s dans d'innombrables applications, et des milliards de kilogrammes de ces mat??riaux sont fabriqu??s et utilis??s chaque ann??e.
Propri??t??s physiques
Point d'??bullition

Alcanes exp??rience inter-mol??culaires forces de van der Waals . Inter-mol??culaire forces de van der Waals fortes donnent naissance ?? des points d'??bullition sup??rieures d'alcanes.
Il existe deux d??terminants de la r??sistance des forces de van der Waals:
- le nombre d'??lectrons entourant la mol??cule, ce qui augmente avec le poids mol??culaire de l'alcane
- la surface de la mol??cule
Sous conditions standard, de CH 4 ?? C 4 H 10 alcanes sont gazeux; ?? partir de C 5 H 12 ?? C 17 H 36 ce sont des liquides; et apr??s C 18 H 38 ils sont solides. Comme le point d'??bullition des alcanes est principalement d??termin?? par le poids, il ne devrait pas ??tre une surprise que le point d'??bullition a presque une relation lin??aire avec la taille ( poids mol??culaire ) de la mol??cule. En r??gle g??n??rale, le point d'??bullition se ??l??ve de 20 ?? 30 ?? C pour chaque carbone ajout?? ?? la cha??ne; cette r??gle se applique ?? d'autres s??ries homologue.
Un alcane ?? cha??ne droite aura un point d'??bullition sup??rieur ?? un alcane ?? cha??ne ramifi??e en raison de la plus grande surface en contact, donc les plus van der Waals entre les mol??cules adjacentes. Par exemple, comparez isobutane et n-butane, qui bouillent ?? -12 et 0 ?? C, et le 2,2-dim??thylbutane et le 2,3-dim??thylbutane qui bouillent ?? 50 et 58 ?? C, respectivement. Pour ce dernier cas, deux mol??cules de 2,3-dim??thylbutane peut ??verrouiller?? dans l'autre mieux que le 2,2-dim??thylbutane en forme de croix, par cons??quent, les plus forces de van der Waals.
D'autre part, les cycloalcanes ont tendance ?? avoir des points d'??bullition plus ??lev??s que leurs homologues lin??aires dues aux conformations des mol??cules bloqu??es, ce qui donne un plan de contact intermol??culaire.
Point de fusion
Les points de fusion des alcanes suivent une tendance similaire ?? points d'??bullition pour la m??me raison que celle expos??e ci-dessus. Autrement dit, (toutes choses ??tant ??gales par ailleurs) plus la mol??cule plus le point de fusion. Il existe une diff??rence significative entre les points d'??bullition et points de fusion. Les solides ont une structure fixe et plus stri??e de liquides. Cette structure rigide n??cessite de l'??nergie ?? se d??composer. Ainsi, les mieux mis ensemble des structures solides forts auront besoin de plus d'??nergie pour briser. Pour alcanes, cela peut ??tre vu ?? partir du graphique ci-dessus (ce est ?? dire, la ligne bleue). Les alcanes impairs ont une tendance plus faible dans les points de fusion que m??me num??rot??s alcanes. Ce est parce que les alcanes paires emballent bien dans la phase solide, formant une structure bien organis??e, ce qui n??cessite plus d'??nergie pour briser. Les alcanes impaires emballent moins bien et donc le "l??che" organis?? structure de garnissage solide n??cessite moins d'??nergie pour briser.
Les points de fusion des alcanes ?? cha??ne ramifi??e peuvent ??tre soit sup??rieure ou inf??rieure ?? celles des alcanes lin??aires correspondant, ?? nouveau en fonction de la capacit?? de l'alcane en question ?? l'emballage et dans la phase solide: Ce est particuli??rement vrai pour les isoalcanes (2 isom??res m??thyl), qui ont souvent des points de fusion plus ??lev??s que ceux des analogues lin??aires.
Conductivit??
Alcanes ne conduisent pas l'??lectricit?? , ni qu'ils sont sensiblement polaris?? par un champ ??lectrique . Pour cette raison, ils ne forment pas des liaisons hydrog??ne et sont insolubles dans les solvants polaires tels que l'eau. Etant donn?? que les liaisons hydrog??ne entre les mol??cules d'eau individuels sont align??s en dehors d'un alcane mol??cule, la coexistence d'un alcane et de l'eau conduit ?? une augmentation de l'ordre mol??culaire (une r??duction de l'entropie ). Comme il n'y a pas de liaison significative entre les mol??cules d'eau et les mol??cules d'alcanes, la seconde loi de la thermodynamique indique que cette r??duction de l'entropie devrait ??tre minimis??e en minimisant le contact entre l'alcane et de l'eau: Les alcanes sont dits hydrophobe en ce qu'ils repoussent l'eau.
Leur solubilit?? dans les solvants non polaires est relativement bonne, une propri??t?? qui est appel?? lipophile. Diff??rents alcanes sont, par exemple, miscible en toutes proportions entre eux.
La densit?? des alcanes augmente en g??n??ral avec le nombre d'atomes de carbone croissante, mais reste inf??rieure ?? celle de l'eau. Par cons??quent, les alcanes forment la couche sup??rieure dans un m??lange d'alcanes-eau.
G??om??trie mol??culaire

La structure mol??culaire des alcanes affecte directement leurs caract??ristiques physiques et chimiques. Il est d??riv?? de la configuration ??lectronique de carbone , qui a quatre ??lectrons de valence. Les atomes de carbone dans les alcanes sont toujours sp 3 hybride, ce est-??-dire que les ??lectrons de valence sont dits en quatre orbitales ??quivalentes d??riv??s de la combinaison des orbitales 2s et les trois orbitales 2p. Ces orbitales, qui ont ??nergies identiques, sont dispos??s dans l'espace sous la forme d'un t??tra??dre, l'angle de cos -1 (-⅓) ≈ 109,47 ?? entre eux.
longueurs de liaison et angles de liaison
Une mol??cule alcane ne dispose que de C - H et C - C obligations simples. L'ancien r??sultat du chevauchement d'un sp??-orbital du carbone avec les orbitale 1s d'un hydrog??ne; celui-ci par le chevauchement de deux orbitales SP?? sur diff??rents atomes de carbone. Le longueurs de liaison montant ?? 1,09 ?? 10 -10 m pour une liaison C - H et 1,54 ?? 10 -10 m pour une liaison C - C.

La disposition spatiale des liaisons est similaire ?? celui des quatre SP?? orbitales - elles sont dispos??es t??tra??drique, avec un angle de 109,47 ?? entre eux. Formules structurels qui repr??sentent les obligations comme ??tant ?? angle droit par rapport ?? une autre, tout ?? la fois commune et utile, ne correspondent pas ?? la r??alit??.
Conformation
La formule d??velopp??e et le les angles de liaison sont g??n??ralement pas suffisante pour d??crire compl??tement la g??om??trie d'une mol??cule. Il existe un autre degr?? de libert?? pour chaque liaison carbone - carbone: la angle de torsion entre les atomes ou les groupes li??s ?? des atomes ?? chaque extr??mit?? de la liaison. L'arrangement spatial d??crite par les angles de torsion de la mol??cule est connue sous son conformation.
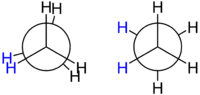

??thane forme le cas le plus simple pour l'??tude de la conformation des alcanes, car il ya seulement une liaison C - C. Si l'on regarde vers le bas l'axe de la liaison C - C, on verra ce qu'on appelle Projection de Newman. Les atomes d'hydrog??ne sur les deux atomes de carbone avant et arri??re ont un angle de 120 ?? entre eux, r??sultant de la projection de la base du t??tra??dre sur un plan plat. Toutefois, l'angle de torsion entre un atome d'hydrog??ne donn??e attach?? au carbone avant et un atome d'hydrog??ne donn??e attach?? au carbone arri??re peut varier librement entre 0 ?? et 360 ??. Ceci est une cons??quence de la rotation libre autour d'une liaison carbone - carbone unique. Malgr?? cette apparente libert??, seulement deux conformations limitant sont importants: conformation ??clips??e et conformation en quinconce.
Les deux conformations, ??galement appel??s rotam??res, diff??rent de l'??nergie: La conformation d??cal??e est de 12,6 kJ / mol moins d'??nergie (plus stable) que la conformation ??clips??e (le moins stable).
Cette diff??rence d'??nergie entre les deux conformations, connu sous le nom l'??nergie de torsion, est faible par rapport ?? l'??nergie thermique d'une mol??cule d'??thane ?? temp??rature ambiante. Il est constant rotation autour de la liaison CC. Le temps n??cessaire ?? une mol??cule d'??thane de passer d'une conformation en quinconce ?? l'autre, ce qui correspond ?? la rotation de l'un par CH 3 -group 120 ?? par rapport ?? l'autre, est de l'ordre de 10 -11 secondes.
Le cas des alcanes sup??rieurs est plus complexe, mais fond??e sur des principes similaires, avec la conformation antip??riplanaire ??tant toujours la plus favoris??e autour de chaque liaison carbone-carbone. Pour cette raison, les alcanes sont habituellement pr??sent??s dans un arrangement en zigzag dans les sch??mas ou dans les mod??les. La structure actuelle sera toujours diff??rer quelque peu de ces formes id??alis??es, que les diff??rences d'??nergie entre les conformations sont petites par rapport ?? l'??nergie thermique des mol??cules: mol??cules d'alcanes ont pas de forme structurelle fixe, quels que soient les mod??les peuvent sugg??rer.
propri??t??s spectroscopiques
Pratiquement tous les compos??s organiques contiennent du carbone - carbone et - des liaisons hydrog??ne, et ainsi montrent certaines des caract??ristiques d'alcanes en leurs spectres. Alcanes sont remarquables pour ne pas avoir d'autres groupes, et donc pour l'absence d'autres caract??ristiques spectroscopiques caract??ristiques.
La spectroscopie infrarouge
Le carbone - hydrog??ne mode d'??tirement donne une forte absorption entre 2850 et 2960 nanom??tres, tandis que le carbone - mode d'??tirement de carbone absorbe entre 800 et 1300 nm. Les modes de carbone - hydrog??ne flexion d??pendent de la nature du groupe: des groupes m??thyle montrent des bandes ?? 1450 nm et 1375 nm, tandis que des groupes m??thyl??ne montrent des bandes ?? 1465 nm et 1450 nm. cha??nes de carbone de plus de quatre atomes de carbone montrent une faible absorption ?? environ 725 nm.
Spectroscopie RMN
Les r??sonances de protons d'alcanes sont g??n??ralement trouv??s ?? δ H = 0,5 ?? 1,5. Les r??sonances du carbone 13 d??pendent du nombre d'atomes d'hydrog??ne li??s ?? l'atome de carbone: δ = C 8-30 (primaire, un groupe m??thyle, un groupe -CH 3), 15-55 (secondaire, un groupe m??thyl??ne, un groupe -CH 2 -), 20-60 (tertiaire, m??thyne, CH) et quaternaire. Le carbone 13 r??sonance d'atomes de carbone quaternaire est typiquement faible, en raison de l'absence de Effet Overhauser nucl??aire et la longue temps de relaxation, et peut ??tre manqu?? dans des ??chantillons faibles, ou de l'??chantillon qui ne ont pas ??t?? ex??cut??s pour un temps suffisamment long.
Spectrom??trie de masse
Alcanes ont une grande ??nergie d'ionisation et l'ion mol??culaire est g??n??ralement faible. Le motif de fragmentation peut être difficile à interpréter, mais, dans le cas d'alcanes à chaîne ramifiée, la chaîne carbonée est de préférence clivée au niveau atomes de carbone tertiaires ou quaternaires en raison de la stabilité relative des résultant radicaux libres. Le fragment résultant de la perte d'un seul groupe méthyle (M-15) est souvent absent, et l'autre fragment sont souvent espacées par des intervalles de quatorze unités de masse, correspondant à la perte successive de CH 2 -groupes.
Propri??t??s chimiques
En général, les alcanes montrent une réactivité relativement faible, parce que leurs liaisons CC sont relativement stables et ne peuvent pas être facilement cassées. Contrairement à la plupart des autres composés organiques, ils ne possèdent pas de groupes fonctionnels.
Ils ne réagissent que très mal avec des substances polaires ioniques ou autres. Le dissociation acide (PK constants une ) valeurs de tous les alcanes sont au-dessus de 60, d'où ils sont pratiquement inerte aux acides et bases (voir: acides de carbone). Cette inertie est la source de l'expression des paraffines (ici avec la signification de "manque d'affinité"). Dans pétrole brut les molécules d'alcanes sont restées chimiquement inchangées depuis des millions d'années.
Cependant réactions redox d'alcanes, en particulier avec l'oxygène et les atomes d'halogène, sont possibles comme les atomes de carbone sont dans un état ??????fortement réduite; dans le cas du méthane, de l'état le plus bas possible pour l'oxydation du carbone (-4) est atteinte. Réaction avec l'oxygène conduit à combustion sans fumée; avec des halogènes, substitution. En outre, les alcanes se sont révélés interagir avec et se lier à des complexes de métaux de transition certain dans (Voir: activation de liaison carbone-hydrogène).
Les radicaux libres, des molécules avec des électrons non appariés, jouent un rôle important dans la plupart des réactions des alcanes, tels que des fissures et de la réforme où alcanes à longue chaîne sont convertis en alcanes à chaîne courte et des alcanes linéaires en isomères à chaîne ramifiée.
Dans alcanes hautement ramifiés, l'angle de la liaison peut différer de manière significative de la valeur optimale (109,5 °) afin de permettre aux différents groupes de suffisamment d'espace. Cela provoque une tension dans la molécule, connue sous le nom empêchement stérique, et peut sensiblement augmenter la réactivité.
Les réactions avec l'oxygène
Tous les alcanes r??agissent avec l'oxyg??ne dans un réaction de combustion, mais elles deviennent de plus en plus difficile à enflammer que le nombre d'atomes de carbone augmente. L'équation générale pour une combustion complète est:
- CnH2n2+ (1,5n0,5) O2??? (n+ 1) H2+ OnCO2
En l'absence de suffisamment d'oxygène,le monoxyde de carboneou encoresuie peuvent être formées, comme indiqué ci-dessous:
par exemplele méthane:
- 2CH4+ 3O2??? 2CO + 4H2O
- CH4+ O2??? C + 2H2O
Voir la alcane chaleur de table de formation pour les données détaillées. Le de changement standard enthalpie de combustion, ?? c H o , pour les alcanes augmente d'environ 650 kJ / mol par CH 2 groupe. Les alcanes à chaîne ramifiée ont des valeurs plus faibles de ?? c H o que les alcanes à chaîne linéaire de même nombre d'atomes de carbone, et peuvent donc être considérés comme étant quelque peu plus stable.
Réactions avec les halogènes
Les alcanes réagissent avec les halogènes dans une dite halogénation radicalaire réaction. Les atomes d'hydrogène de l'alcane sont progressivement remplacés par des atomes d'halogène. Les radicaux libres sont des espèces réactives qui participent à la réaction, ce qui conduit généralement à un mélange de produits. La réaction est très exothermique et peut conduire à une explosion.
Ces réactions sont une voie industriel important pour les hydrocarbures halogénés. Il ya trois étapes:
- Initiation l'halogène radicaux se forment par homolyse. Habituellement, l'énergie sous forme de chaleur ou de lumière est nécessaire.
- Réaction en chaîne se produit alors - les résumés radicaux halogène un d'hydrogène à partir de l'alcane pour donner un radical alkyle. Celui-ci réagit en outre.
- «cessation de la chaîneoù STEP les radicaux se recombinent.
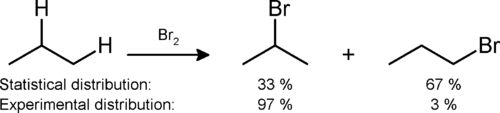
Des expériences ont montré que tous halogénation produit un mélange de tous les isomères possibles, ce qui indique que tous les atomes d'hydrogène sont sensibles à la réaction. Le mélange produit, cependant, est un mélange non statistique: des atomes d'hydrogène secondaires et tertiaires sont de préférence remplacés en raison de la plus grande stabilité des radicaux libres secondaires et tertiaires. Un exemple peut être vu dans la monobromation de propane:
Cracking
Cracking pauses plus grosses molécules en plus petites. Cela peut être fait avec un procédé thermique ou catalytique. Le procédé de craquage thermique suit un mécanisme homolytique avec formation de radicaux libres. Le procédé de craquage catalytique implique la présence d' acides de catalyseurs (en général des acides solides tels que la silice-alumine et les zeolites), qui favorisent une hétérolytique (asymétrique) rupture des liaisons donnant des paires d' ions de charges opposées, généralement un carbo cation et la très instable hydrure anion . Les radicaux libres et les cations carbone localisée sont à la fois très instable et subissent des processus de réarrangement de la chaîne, CC scission en position bêta (c.-à-fissuration) et intra et transfert d'hydrogène intermoléculaires ou transfert d'hydrure. Dans les deux types de procédés, les correspondants intermédiaires réactifs (radicaux, ions) sont régénérés de façon permanente, et ainsi on procède par un mécanisme en chaîne auto-propagation. La chaîne de réactions est éventuellement interrompue par recombinaison radicalaire ou ionique.
Isomérisation et la réforme
Isomérisation et la réforme sont des processus dans lequel des alcanes linéaires sont chauffés en présence d'une platine catalyseur. Dans l'isomérisation, les alcanes deviennent isomères à chaîne ramifiée. Dans la réforme, les alcanes deviennent cycloalcanes ou les hydrocarbures aromatiques, donnant de l'hydrogène comme sous-produit. Ces deux procédés soulèvent le nombre d'octane de la substance.
Autres réactions
Alcanes r??agiront avec la vapeur d'eau en présence d'un nickel catalyseur pour donner un atome d'hydrogène . Les alcanes peuvent par chlorosulfonés et nitré, bien que les deux réactions nécessitent des conditions particulières. Le fermentation d'alcanes en acides carboxyliques est d'une certaine importance technique. Dans le Reed réaction, le dioxyde de soufre, du chlore et des hydrocarbures à convertir la lumière des chlorures de sulfonyle.
Dangers
Le méthane est explosif lorsqu'il est mélangé à l'air (1 - 8% CH 4 ) et est un fort effet de serre gaz : Autres alcanes inférieurs peuvent également former des mélanges explosifs avec l'air. Les alcanes liquides légers sont très inflammables, bien que ce risque diminue avec la longueur de la chaîne carbonée. Pentane, hexane, octane et sont classés comme dangereux pour l'environnement et nuisibles . L'isomère à chaîne droite d'hexane est une neurotoxine, et donc rarement utilisé commercialement.


