
Alc??ne
Saviez-vous ...
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.

Dans la chimie organique , d'un alc??ne, de l'ol??fine ou l'ol??fine est une insatur?? compos?? chimique contenant au moins un carbone de la carbone double liaison. Les simples alc??nes acycliques, avec une seule double liaison et aucun autre des groupes fonctionnels, forment un s??rie homologue de des hydrocarbures ?? la formule g??n??rale C n H 2n.
L'alc??ne simple est l'??thyl??ne (C 2 H 4), qui a la Union internationale de chimie pure et appliqu??e (UICPA) ??thyl??ne. Alc??nes sont aussi appel??s ol??fines (un synonyme archa??que, largement utilis?? dans le industrie p??trochimique). Les compos??s aromatiques sont souvent dessin??s comme des alc??nes cycliques, mais leur structure et les propri??t??s sont diff??rentes et ne sont pas consid??r??s comme des alc??nes.
Structure
Collage
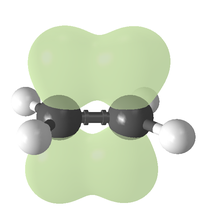
Comme seule des liaisons covalentes, des doubles liaisons peuvent ??tre d??crits en termes de chevauchement des orbitales atomiques, sauf que la diff??rence d'une simple liaison (qui est constitu??e d'un seul liaison sigma), une double liaison carbone-carbone consiste en une liaison sigma et une pi obligataire. Cette double liaison est plus fort qu'un seul liaison covalente (611 kJ / mole de C = C par rapport ?? 347 kJ / mol pour C-C) et ??galement plus court, avec une moyenne longueur de la liaison de 1,33 (133 Angstroms h).
Chaque carbone de la double liaison utilise ses trois sp?? orbitales hybrides pour former des liaisons sigma ?? trois atomes de carbone. Les orbitales atomiques non hybrid??es 2p, qui se situent perpendiculairement au plan cr???? par les axes des trois orbitales sp?? hybrides, se combinent pour former la liaison pi. Cette liaison se trouve en dehors de l'axe principal C-C, avec la moiti?? de la liaison d'un c??t?? et de l'autre moiti??.
Rotation autour de la double liaison carbone-carbone est limit??e parce qu'elle implique la rupture du lien de pi, ce qui n??cessite une grande quantit?? d'??nergie (264 kJ / mol dans de l'??thyl??ne). En cons??quence, il peut exister des alc??nes substitu??s comme l'un des deux isom??res appel?? isom??re cis et un isom??re trans, ou encore (pour alc??nes plus complexes) un Z et un isom??re E. Par exemple, dans cis but-2-??ne deux substituants m??thyle font face au m??me c??t?? de la double liaison trans et en but-2-??ne ils font face du c??t?? oppos??; Ces deux isom??res sont l??g??rement diff??rents dans leurs propri??t??s chimiques et physiques.
Il ne est certainement pas impossible de tordre une double liaison. En fait, une torsion de 90 ?? n??cessite une ??nergie approximativement ??gale ?? la moiti?? de la force d'un pi obligataire. Le d??salignement de la orbitales p sont inf??rieurs aux pr??visions en raison pyridalization a lieu (Voir: alc??ne pyramidale). trans -Cyclooctene est un alc??ne tendues stable et le d??salignement orbitale est seulement 19 ?? avec un di??dre de 137 ?? (120 ??) normales et un degr?? de pyramidalisation de 18 ??. Ceci explique la instant dip??le de 0,8 D pour ce compos?? ( cis-isom??re 0,4 D) o?? une valeur de z??ro est attendu. L'isom??re trans de cyclohept??ne ne est stable ?? basse temp??rature.
Forme
Comme pr??vu par la Mod??le VSEPR des ??lectrons paire de r??pulsion, le g??om??trie mol??culaire d'alc??nes comprend liaison sur chacun des angles de carbone dans une double liaison d'environ 120 ??. L'angle peut varier en raison des souche st??rique introduit par les interactions non li??es cr????es par des groupes fonctionnels attach??s ?? des atomes de carbone de la double liaison. Par exemple, l'angle de liaison de la CCC dans propyl??ne est 123,9 ??.
Propri??t??s physiques
Les propri??t??s physiques des alc??nes sont comparables avec des alcanes . Le ??tat physique d??pend de la masse mol??culaire (gaz d'??thyl??ne en but??ne - liquides du pent??ne partir). Le plus simple des alc??nes, d'??thyl??ne , propyl??ne et butyl??ne sont des gaz. Alc??nes lin??aires d'environ cinq ?? seize atomes de carbone sont des liquides, et alc??nes sup??rieurs sont solides cireux.
Propri??t??s chimiques
Les alc??nes sont des compos??s relativement stables, mais sont plus r??actifs que les alcanes en raison de la pr??sence d'un pi-liaison carbone-carbone. La majorit?? des r??actions des alc??nes implique la rupture de cette liaison pi, formant nouvelle des liaisons simples.
Les alc??nes servent de mati??re premi??re pour la industrie p??trochimique, car ils peuvent participer ?? une grande vari??t?? de r??actions.
r??actions d'addition
Alc??nes r??agissent dans de nombreux r??actions d'addition, qui se produisent en ouvrant le double liaison.
- Addition catalytique d'hydrog??ne : Catalytic hydrog??nation d'alc??nes correspondants produit les alcanes . La r??action est effectu??e sous pression en pr??sence d'un m??tal catalyseur . Catalyseurs industriels communs sont bas??s sur le platine , le nickel ou le palladium . Pour les synth??ses de laboratoire, Nickel Raney est souvent employ??. Il se agit d'un alliage de nickel et de l'aluminium . Un exemple de cette r??action est l'hydrog??nation catalytique de l'??thyl??ne pour produire de l'??thane :
- CH 2 = CH 2 + H 2 → CH 3 -CH 3
- Addition ??lectrophile: La plupart des r??actions d'addition ?? alc??nes suivent le m??canisme de addition ??lectrophile. Un exemple est le R??action de Prins o?? l'??lectrophile est un groupe carbonyle.
- Halog??nation: Ajout d'??l??mentaire de brome ou le chlore ?? alc??nes rendements dibromo- et dichloroalcanes vicinal, respectivement. La d??coloration d'une solution de brome dans l'eau est un essai analytique pour d??terminer la pr??sence d'alc??nes:
- CH 2 = CH 2 + Br 2 → BrCH 2 CH 2 Br
- Il est ??galement utilis?? comme test quantitatif d'insaturation, exprim??e en la indice de brome d'un compos?? unique ou un m??lange. La r??action fonctionne parce que la forte densit?? d'??lectrons ?? la double liaison provoque un d??calage temporaire des ??lectrons dans la liaison Br-Br provoquant un dip??le induit temporaire. Cela rend le Br plus proche de la double liaison l??g??rement positif et donc un ??lectrophile.
- Hydrohalog??nation: Ajout de les acides halohydriques tels que HCl ou HBr ?? alc??nes donne le correspondant haloalcanes.
- CH 3 -CH = CH 2 + HBr → Br CH 3 -CH 2 -CH - H
- Si les deux atomes de carbone ?? la double liaison sont reli??s ?? un nombre diff??rent d'atomes d'hydrog??ne, l'halog??ne se trouve de pr??f??rence au niveau du carbone avec moins de substituants hydrog??ne ( La r??gle de Markovnikov).
- Ce est le m??canisme de r??action pour hydrohalog??nation:
-

- L'addition d'un carb??ne ou carb??no??de donne le correspondant cyclopropane.
Oxydation
Alc??nes sont oxyd?? avec un grand nombre de agents oxydants.
- En pr??sence d' oxyg??ne , les alc??nes br??ler avec une flamme lumineuse pour produire du dioxyde de carbone et l'eau.
- Catalyseur d'oxydation avec de l'oxyg??ne ou la r??action avec percarboxyliques acides rendements ??poxydes
- La r??action avec l'ozone dans ozonolyse conduit ?? la rupture de la double liaison, ce qui donne deux des ald??hydes ou des c??tones
- R 1 -CH = CH-R + O 2 → 3 R 1 + R 2 -CHO -CHO + H 2 O
- Cette r??action peut ??tre utilis??e pour d??terminer la position d'une double liaison dans un alc??ne inconnu.
- Sharpless et le bishydroxylation Cis-hydroxylation Woodward donner diols
Polym??risation
La polym??risation d'alc??nes est une r??action qui donne une importance ??conomique des polym??res de valeur industrielle ??lev??e, tels que les mati??res plastiques poly??thyl??ne et polypropylene. Polym??risation peut soit proc??der via un libre un m??canisme radicalaire ou ionique.
Synth??se
M??thodes industrielles
La synth??se industrielle la plus courante d'alc??nes est bas??e sur fissuration du p??trole . Les grandes alcanes sont d??compos??s ?? des temp??ratures ??lev??es, souvent en pr??sence d'un catalyseur de z??olite, pour donner des alc??nes et alcanes plus petites, et le m??lange de produits est ensuite s??par?? par distillation fractionn??e. Elle est principalement utilis??e pour la fabrication de petits alc??nes (jusqu'?? six atomes de carbone).

Est li??e ?? ce catalytique d??shydrog??nation, o?? un alcane perd de l'hydrog??ne ?? des temp??ratures ??lev??es pour produire un alc??ne correspondant. Ce est l'inverse de l' hydrog??nation catalytique d'alc??nes.

Ces deux processus sont endothermique, mais ils sont entra??n??s vers l'alc??ne ?? des temp??ratures ??lev??es par entropie (la partie de l'??quation TΔS AG = AH - TΔS domine pour la haute T).
Catalyseur de synth??se α-alc??nes sup??rieurs (du type RCH = CH 2) peut ??galement ??tre obtenu par une r??action de l'??thyl??ne avec compos?? organom??tallique tri??thylaluminium en pr??sence de nickel , cobalt ou le platine .
r??actions d'??limination
L'un des principaux proc??d??s de synth??se d'alc??ne en laboratoire est la ??limination des halog??nures d'alkyle, des alcools et des compos??s similaires. La plus commune est la -??limination par le m??canisme E2 ou E1, mais -??liminations sont ??galement connus.
Le m??canisme E2 fournit une m??thode d'??limination -plus fiable que E1 pour la plupart des synth??ses d'alc??nes. La plupart des ??liminations E2 commencent avec un ester sulfonate ou un groupe alkyle ?? l'halog??nure d'alkyle (tel qu'un tosylate ou triflate). Lorsque l'halog??nure d'alkyle est utilis??, la r??action est appel??e d??shydrohalog??nation. Pour les produits non sym??triques les alc??nes substitu??s plus (avec moins de ces atomes d'hydrog??ne attach??s ?? la C = C) ont tendance ?? pr??dominer (voir La r??gle de Saytzeff). Un exemple typique est indiqu?? ci-dessous; noter que le H qui doit ??tre anti laisse au groupe partant, m??me si cela conduit ?? l'isom??re Z ?? peu pr??s stable.
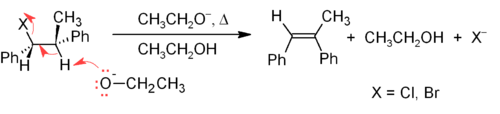
Alc??nes peuvent ??tre synth??tis??s ?? partir des alcools via la d??shydratation, dans laquelle l'eau est perdue par cas le m??canisme E1. Par exemple, la d??shydratation de l'??thanol produit ??th??ne:
- CH 3 CH 2 OH + H 2 SO 4 → H 2 C = CH 2 H 3 O + + + HSO 4 -
Un alcool peut aussi ??tre converti en un groupe mieux partant (par exemple, xanthate), de mani??re ?? permettre un syn -??limination plus doux tels que le Et l'??limination Chugaev ??limination Grieco. R??actions connexes comprennent ??liminations par β-halo??thers (les Boord de synth??se ol??fine) et les esters ( pyrolyse ester).
Alc??nes peuvent ??tre pr??par??s indirectement de alkyle amines . L'amine ou l'ammoniac ne est pas un groupe partant convenable, de sorte que la premi??re amine est soit alkyle (comme dans le ??limination de Hofmann) ou oxyd??e ?? un oxyde d'amine (le R??action de Cope) pour rendre une ??limination en douceur possible. ??limination de Hofmann est inhabituel en ce que le moins substitu?? (non Saytseff) alc??ne est g??n??ralement le produit principal. La r??action est la vie est un -??limination syn qui se produit au niveau ou en dessous de 150 ?? C, par exemple:
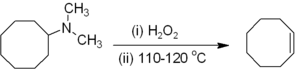
Alc??nes sont g??n??r??s ?? partir α-halo sulfones de la R??action Ramberg-B??cklund, via un sulfone de cycle ?? trois cha??nons interm??diaires.
Synth??se de compos??s carbonyl??s
Une autre m??thode importante pour la synth??se alc??ne comprend la construction d'un nouveau double liaison carbone-carbone par couplage d'un compos?? carbonyle (comme un ald??hyde ou c??tone ) ?? un carbanion ??quivalent. Ces r??actions sont parfois appel??s olefinations. La plus connue de ces m??thodes est la r??action de Wittig, mais d'autres m??thodes connexes sont connus.
La r??action implique la r??action de Wittig d'un ald??hyde ou d'une c??tone avec un R??actif de Wittig (ou phosphorane) du type Ph 3 P = CHR pour produire un alc??ne et Ph 3 P = O. Le r??actif de Wittig est lui-m??me pr??par?? facilement ?? partir de la triph??nylphosphine et d'un halog??nure d'alkyle. La r??action est tr??s g??n??rale et beaucoup de groupes fonctionnels sont tol??r??s, voire des esters, comme dans cet exemple:
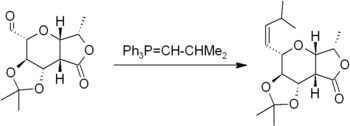
Li??e ?? la r??action de Wittig est le Ol??fination de Peterson. Celui-ci utilise un r??actif ?? base de silicium moins accessible ?? la place du phosphorane, mais il permet la s??lection de produits E ou Z. Si une E-produit est souhait??e, une autre alternative est le Ol??fination de Julia, qui utilise le carbanion engendr?? ?? partir d'un ph??nyle sulfone. Un compos?? du titane, Le r??actif de Tebbe, est utile pour la synth??se de compos??s de m??thyl??ne; dans ce cas, m??me les esters et amides r??agissent.
Une paire de compos??s carbonyle peut ??galement ??tre coupl?? de fa??on r??ductrice ensemble (avec r??duction) pour g??n??rer un alc??ne. Alc??nes sym??triques peuvent ??tre pr??par??s ?? partir d'un couplage de l'ald??hyde ou de la c??tone unique avec elle-m??me, en utilisant la r??duction de m??tal Ti (la McMurry r??action). Si deux c??tones sont diff??rentes pour ??tre coupl??, un proc??d?? indirect plus complexe tel que le Barton-r??action de Kellogg peut ??tre utilis??.
Un seul c??tone peut ??galement ??tre converti en l'alc??ne correspondant via son tosylhydrazone, en utilisant m??thoxyde de sodium (le R??action Bamford-Stevens) ou un alkyllithium (la R??action Shapiro).
M??tath??se d'ol??fines
Les alc??nes peuvent ??tre pr??par??s par ??change avec d'autres alc??nes, dans une r??action connue sous le nom m??tath??se d'ol??fines. Fr??quemment perte de gaz de l'??thyl??ne est utilis?? pour entra??ner la r??action vers le produit souhait??. Dans de nombreux cas, on obtient un m??lange d'isom??res g??om??triques, mais la r??action tol??re de nombreux groupes fonctionnels. Le proc??d?? est particuli??rement efficace pour la pr??paration d'alc??nes cycliques, comme dans cette synth??se de muscone:

L'utilisation de r??actions de couplage catalys??es par le palladium
R??actions de couplage, notamment ceux catalys??e par le palladium , les compos??s sont devenus populaires pour la synth??se des alc??nes. Le R??action de Heck fournit un proc??d?? de couplage d'un halog??nure d'aryle ?? un alc??ne, par exemple dans la synth??se du produit pharmaceutique naprox??ne:

D'autres couplages, comme le Stille, Suzuki et Negishi implique la r??action d'un groupe alc??nyle, un groupe allyle ou un halog??nure d'aryle (ou triflate) avec un groupe alc??nyle, un groupe alkyle (pas de Stille) ou un d??riv?? aryle d'un m??tal ou m??tallo??de. Par exemple, un couplage de Suzuki a ??t?? utilis?? sur un d??riv?? citronellal pour la synth??se du capparatriene, un produit naturel qui est tr??s active contre la leuc??mie:
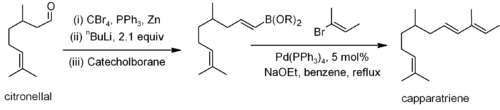
De alcynes
R??duction de alcynes est une m??thode utile pour la synth??se stereoselective d'alc??nes disubstitu??s. Si l'alc??ne cis est d??sir??, hydrog??nation en pr??sence de Catalyseur de Lindlar est couramment utilis??e, bien hydroboration suivie d'une hydrolyse fournit une approche alternative. R??duction de l'alcyne par sodium m??tallique dans un liquide ammoniac donne l'alc??ne trans.

Pour la pr??paration multisubstitu??s alc??nes, carbometalation d'alcynes peut donner lieu ?? une grande vari??t?? de d??riv??s d'alc??nes.
Alc??nes peuvent ??tre synth??tis??s ?? partir d'autres alc??nes par r??actions de r??arrangement. Outre m??tath??se d'ol??fine (d??crite ci-dessus ), un grand nombre de p??ricycliques r??actions peuvent ??tre utilis??s tels que la et la r??action ??ne Cope.

Dans le R??action de Diels-Alder, un d??riv?? cyclohex??ne est pr??par?? ?? partir d'un di??ne et d'un alc??ne r??actif ou pauvre en ??lectrons.
Nomenclature
UICPA noms
Pour former la racine des UICPA noms pour alc??nes, il suffit de changer l'infixe -an- du parent -FR-. Par exemple, CH 3 CH 3 est l' alcane ??thane. Le nom de CH 2 = CH 2 est donc ??th??ne.
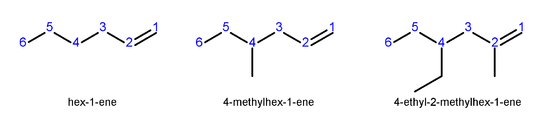
Dans alc??nes sup??rieurs, o?? isom??res qui diff??rent exister en position de la double liaison, le syst??me de num??rotation suivant est utilis??:
- Num??roter la plus longue cha??ne de carbone qui contient la double liaison dans le sens qui donne les atomes de carbone de la double liaison les num??ros les plus bas possibles.
- Indiquez l'emplacement de la double liaison par l'emplacement de son premier carbone
- Nom alc??nes ramifi??s ou substitu??s d'une mani??re similaire ?? alcanes .
- Nombre des atomes de carbone, et les groupes localiser nom substituants, localiser la double liaison, et le nom de la cha??ne principale
La notation Cis-Trans
Dans le cas particulier d'alc??nes disubstitu??s o?? les deux atomes de carbone ont un substituant chacune, Cis-trans notation peut ??tre utilis??e. Si les deux substituants sont sur le m??me c??t?? de la liaison, il est d??fini comme (cis). Si les substituants sont de chaque c??t?? de la liaison, il est d??fini comme (trans).


Le E, Z notation
Quand un alc??ne poss??de plus d'un substituant (en particulier n??cessaire avec trois ou quatre substituants), la g??om??trie de la double liaison est d??crite en utilisant les ??tiquettes E et Z. Ces ??tiquettes proviennent de la mots allemands "entgegen?? qui signifie ??face?? et ??zusammen" qui signifie "ensemble". Alc??nes avec les groupes les plus prioritaires (tel que d??termin?? par R??gles CIP) sur le m??me c??t?? de la double liaison ont ces groupes ensemble et sont d??sign??s Z. Alc??nes avec les groupes les plus prioritaires sur les c??t??s oppos??s sont d??sign??s E. Un moyen mn??motechnique pour se en souvenir: la notation Z a les groupes prioritaires plus ??lev??s sur "ze zame zide".

Les groupes contenant C = C doubles liaisons
UICPA reconna??t deux noms pour les groupes d'hydrocarbures contenant du carbone-carbone doubles liaisons, les groupe vinyle et la un groupe allyle. .

