
Aluminium
Saviez-vous ...
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . SOS enfants parrainage est cool!
| Aluminium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
13 Al | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
m??tallique gris argent??  Raies spectrales de l'aluminium | |||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||
| Nom, symbole, nombre | aluminium, Al, 13 | ||||||||||||||||||||||||
| Prononciation | Royaume-Uni / ˌ ?? LJ ʉ m ɪ n Je ə m / AL MIN -ee-əm; ??tats-Unis / ə LJ U m ɨ n əm / | ||||||||||||||||||||||||
| Cat??gorie Metallic | post-m??tal de transition | ||||||||||||||||||||||||
| Groupe, p??riode, bloc | 13, 3, p | ||||||||||||||||||||||||
| Poids atomique standard | 26,981 5 386 (13) | ||||||||||||||||||||||||
| Configuration ??lectronique | [ Ne ] 3s 2 3p 1 2, 8, 3 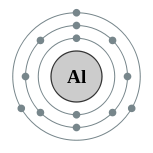 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Pr??diction | Antoine Lavoisier (1787) | ||||||||||||||||||||||||
| Premier isolement | Friedrich W??hler (1827) | ||||||||||||||||||||||||
| Nomm?? par | Humphry Davy (1807) | ||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 2,70 g ?? cm -3 | ||||||||||||||||||||||||
| Liquid densit?? au mp | 2,375 g ?? cm -3 | ||||||||||||||||||||||||
| Point de fusion | 933,47 K , 660,32 ?? C, 1220,58 ?? F | ||||||||||||||||||||||||
| Point d'??bullition | 2792 K, 2519 ?? C, 4566 ?? F | ||||||||||||||||||||||||
| La chaleur de fusion | 10,71 kJ ?? mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 294,0 kJ ?? mol -1 | ||||||||||||||||||||||||
| Capacit?? thermique molaire | 24,200 J ?? mol -1 .K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 ( l'oxyde amphot??re) | ||||||||||||||||||||||||
| ??lectron??gativit?? | 1,61 (??chelle de Pauling) | ||||||||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1er: 577,5 kJ ?? mol -1 | ||||||||||||||||||||||||
| 2??me: 1816,7 kJ ?? mol -1 | |||||||||||||||||||||||||
| 3??me: 2744,8 kJ ?? mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 143 h | ||||||||||||||||||||||||
| Rayon covalente | 121 ?? 16 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 184 h | ||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | ||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 28,2 nΩ ?? m | ||||||||||||||||||||||||
| Conductivit?? thermique | 237 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 23,1 um ?? m -1 ?? K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (lamin??s) 5000 m ?? s -1 | ||||||||||||||||||||||||
| Le module d'Young | 70 GPa | ||||||||||||||||||||||||
| Module de cisaillement | 26 GPa | ||||||||||||||||||||||||
| Module Bulk | 76 GPa | ||||||||||||||||||||||||
| Coefficient de Poisson | 0,35 | ||||||||||||||||||||||||
| Duret?? Mohs | 2,75 | ||||||||||||||||||||||||
| Duret?? Vickers | 167 MPa | ||||||||||||||||||||||||
| Duret?? Brinell | 245 MPa | ||||||||||||||||||||||||
| Num??ro de registre CAS | 7429-90-5 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'aluminium | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Aluminium (ou d'aluminium) est un ??l??ment chimique dans la groupe de bore avec le symbole Al et de num??ro atomique 13. Il est blanc argent??, et il ne est pas soluble dans l'eau dans des conditions normales.
L'aluminium est le troisi??me ??l??ment le plus abondant (apr??s oxyg??ne et du silicium ), et le la plupart des m??taux abondants, dans la Terre de la cro??te . Il repr??sente environ 8% en poids de la surface solide de la Terre. m??tallique en aluminium est si r??actif chimiquement que les sp??cimens indig??nes sont rares et limit??s ?? l'extr??me r??duire environnements. Au lieu de cela, on trouve plus de 270 combin??s dans diff??rents minerais . Le chef le minerai d'aluminium est bauxite.
L'aluminium est remarquable pour le m??tal de faible densit?? et pour sa capacit?? ?? r??sister ?? la corrosion due au ph??nom??ne de passivation. Composants structurels en aluminium et son alliages sont essentiels ?? la l'industrie de l'a??rospatiale et sont importantes dans d'autres domaines de transport et de mat??riaux de construction. Les compos??s les plus utiles de l'aluminium, au moins sur une base pond??rale, sont les oxydes et les sulfates.
Malgr?? sa pr??valence dans l'environnement, les sels d'aluminium ne sont pas connus pour ??tre utilis?? par toute forme de vie. Conform??ment ?? son omnipr??sence, l'aluminium est bien tol??r?? par les plantes et les animaux. En raison de leur pr??valence, b??n??fiques (ou non) les r??les biologiques potentiels des compos??s d'aluminium sont d'un int??r??t continu.
Caract??ristiques

Physique
L'aluminium est un relativement souple, durable, l??ger, et ductile mall??able m??tal avec une apparence allant de l'argent?? au gris terne, en fonction de la rugosit?? de surface. Il est non magn??tique et ne se enflamme pas facilement. Un nouveau film d'aluminium est un bon r??flecteur (environ 92%) de la lumi??re visible et un excellent r??flecteur (jusqu'?? 98%) de rayonnement infrarouge moyen et lointain. Le limite d'??lasticit?? de l'aluminium pur est 7-11 MPa, tandis que les alliages d'aluminium ont une limite d'??lasticit?? allant de 200 MPa ?? 600 MPa. L'aluminium a environ un tiers de la densit?? et rigidit?? de l'acier . Il est facilement usin??e, exprim??s, dessin?? et extruder.
des atomes d'aluminium sont dispos??s dans une cubique ?? faces centr??es (cfc) structure. L'aluminium a une ??nergie empilement faute d'environ 200 MJ / m 2.
L'aluminium est un bon thermique et conducteur ??lectrique, ayant 59% de la conductivit?? du cuivre, ?? la fois thermique et ??lectrique, tout en ayant seulement 30% de la densit?? de cuivre. L'aluminium est capable d'??tre un supraconducteur , ayant une temp??rature critique supraconductrice de 1,2 Kelvin et un champ magn??tique critique d'environ 100 gauss (10 milliteslas).
Chimique
Corrosion r??sistance peut ??tre excellent en raison d'une mince couche de surface d' oxyde d'aluminium qui se forme lorsque le m??tal est expos?? ?? l'air, emp??chant encore l'oxydation. Les plus fortes alliages d'aluminium sont moins r??sistants ?? la corrosion due ?? r??actions galvaniques avec alli?? cuivre . Cette r??sistance ?? la corrosion est ??galement souvent fortement r??duite par les sels aqueux, en particulier en pr??sence de m??taux diff??rents.
En raison de sa r??sistance ?? la corrosion, l'aluminium est l'un des rares m??taux qui conservent r??flectance argent?? en forme de poudre fine, ce qui en fait un ??l??ment important de peintures de couleur argent. finition miroir en aluminium a le plus haut r??flectance de ne importe quel m??tal dans le 200-400 nm ( UV ) et la 3,000-10,000 nm (mesure IR) r??gions; 400 ?? 700 nm dans le spectre visible, il est l??g??rement d??pass?? par l'??tain et argent et dans le 700-3000 (proche IR) par l'argent, l'or et le cuivre.
L'aluminium est oxyd?? par l'eau pour produire de l'hydrog??ne et de la chaleur:
- 2 Al + 3 H 2 O → Al 2 O 3 + 3 H 2
Cette conversion est d'un int??r??t pour la production d'hydrog??ne. Ces d??fis incluent contourner la couche d'oxyde form??e qui inhibe la r??action et les frais li??s au stockage de l'??nergie par r??g??n??ration du m??tal Al.
Isotopes
L'aluminium a de nombreuses connus isotopes , dont le nombre de masse varier de 21 ?? 42; Toutefois, seulement 27 Al ( isotope stable ) et 26 Al ( isotope radioactif, t 1/2 = 7,2 ?? 10 5 y) l'??tat naturel. 27 Al a une abondance naturelle au-dessus de 99,9%. 26 Al est produit ?? partir de l'argon dans l' atmosph??re par caus??e par spallation rayons cosmiques protons . isotopes de l'aluminium ont trouv?? une application pratique dans datant marins s??diments, nodules de mangan??se, de glace glaciaire, quartz dans la roche expositions, et m??t??orites. Le rapport de 26 ?? 10 Al Be a ??t?? utilis??e pour ??tudier le r??le du transport, d??p??t, les s??diments de stockage, les temps de s??pulture, et l'??rosion des ??chelles de temps 10 mai au 10 juin de l'ann??e. Cosmog??nique 26 Al a ??t?? appliqu??e pour la premi??re dans les ??tudes de la Lune et de m??t??orites. Fragments de m??t??orites, apr??s le d??part de leurs organes de tutelle, sont expos??s ?? un bombardement intense de rayons cosmiques au cours de leur Voyage ?? travers l'espace, entra??nant 26 substantielle Al production. Apr??s ??tre tomb?? ?? terre, blindage atmosph??rique r??duit consid??rablement la production 26 Al et son d??clin peut ensuite ??tre utilis??e pour d??terminer l'??ge terrestre de la m??t??orite. M??t??orite recherche a ??galement montr?? que 26 Al ??tait relativement abondante au moment de la formation de notre syst??me plan??taire. La plupart des scientifiques de m??t??orites croient que l'??nergie lib??r??e par la d??sint??gration du 26 Al ??tait responsable de la fusion et la diff??renciation de certains ast??ro??des apr??s leur formation il ya 4,55 milliards ann??es.
Occurrence naturelle
Stable aluminium est cr???? lorsque l'hydrog??ne fusionne avec le magn??sium soit dans les grandes ??toiles ou supernovae .
Dans la cro??te terrestre , l'aluminium est (8,3% en poids) de l'??l??ment m??tallique le plus abondant et le troisi??me plus abondant de tous les ??l??ments (apr??s l'oxyg??ne et le silicium). En raison de sa forte affinit?? pour l'oxyg??ne, il ne est presque jamais trouv?? ?? l'??tat ??l??mentaire; au lieu de cela se trouve dans les oxydes ou des silicates. feldspaths , le groupe le plus commun de min??raux de la cro??te de la Terre, sont des aluminosilicates. Aluminium m??tal natif ne peut ??tre trouv??e que dans une phase mineure faible teneur en oxyg??ne environnements de fugacit??, comme les int??rieurs de certains volcans. Aluminium natif a ??t?? rapport??e dans suintements froids dans le nord talus continental de la mer de Chine m??ridionale et Chen et al. (2011) ont propos?? une th??orie de son origine comme r??sultant par r??duction de tetrahydroxoaluminate Al (OH) 4 - de l'aluminium m??tallique par des bact??ries .
Il se produit ??galement dans les min??raux b??ryl, cryolite, grenat, spinelle et turquoise . Les impuret??s dans Al 2 O 3, tels que le chrome ou le fer rendement le pierres pr??cieuses Ruby et saphir, respectivement.
Bien que l'aluminium est un ??l??ment extr??mement commune et r??pandue, les min??raux d'aluminium communs ne sont pas sources ??conomiques du m??tal. La quasi-totalit?? de l'aluminium m??tallique est produit ?? partir de la minerai de bauxite (AlO x (OH) 3-2 x). La bauxite se produit en intemp??ries produit de faible teneur en fer et la roche de silice dans des conditions climatiques tropicales. De grands gisements de bauxite se produisent en Australie, Br??sil , Guin??e et la Jama??que et les zones mini??res primaires pour le minerai sont en Australie , le Br??sil, la Chine , l'Inde , la Guin??e, l'Indon??sie , la Jama??que, la Russie et le Suriname .
Production et raffinement

formes en aluminium forts de liaisons chimiques avec l'oxyg??ne. Par rapport ?? la plupart des autres m??taux, il est difficile d'extraire ?? partir de minerais, tels que la bauxite, en raison de la forte r??activit?? de l'aluminium et le point de fusion ??lev?? de la plupart de ses minerais. Par exemple, la r??duction directe avec le carbone , comme cela est utilis?? pour produire du fer , ne est pas chimiquement possible parce que l'aluminium est un agent r??ducteur plus fort que le carbone. R??duction carbothermique indirecte peut ??tre effectu??e en utilisant du charbon et Al 2 O 3, qui forme un produit interm??diaire Al 4 C 3, ce qui peut en outre produire de l'aluminium m??tallique ?? une temp??rature de 1900-2000 ?? C. Ce processus est encore en cours de d??veloppement; elle n??cessite moins d'??nergie et produit moins de CO 2 que le Proc??d?? Hall-H??roult, le processus industriel majeur pour l'extraction de l'aluminium. Fusion ??lectrolytique de l'alumine ??tait ?? l'origine un co??t prohibitif en partie parce que du point de fusion ??lev?? de l'alumine ou oxyde d'aluminium, (environ 2000 ?? C (3600 ?? F)). De nombreux min??raux, cependant, se dissolvent dans une seconde min??rale d??j?? fondu, m??me si la temp??rature de la masse fondue est sensiblement inf??rieure au point de la premi??re min??ral de fusion. Fondu cryolithe a ??t?? d??couvert pour dissoudre l'alumine ?? des temp??ratures nettement inf??rieure au point de fusion de l'alumine pure sans interf??rer dans le processus de fusion. Dans le Processus-H??roult Hall, l'alumine est d'abord dissous en fusion cryolite avec calcium fluorure et ensuite r??duit par voie ??lectrolytique ?? l'aluminium ?? une temp??rature comprise entre 950 et 980 ?? C (1740 ?? 1800 ?? F). La cryolite est un compos?? chimique de l'aluminium et de sodium fluorures: (Na 3 AlF 6). Bien cryolithe est trouv?? comme un min??ral dans Groenland , sa forme synth??tique est utilis?? dans l'industrie. L'oxyde d'aluminium lui-m??me est obtenu par raffinage dans la bauxite Proc??d?? Bayer.
Le proc??d?? ??lectrolytique a remplac?? le Proc??d?? W??hler, qui implique la r??duction du chlorure d'aluminium anhydre avec du potassium . Les deux de la ??lectrodes utilis??es dans l'??lectrolyse de l'oxyde d'aluminium sont du carbone. Une fois l'alumine raffin??e est dissous dans l'??lectrolyte, il dissocie et ses ions sont libres de se d??placer. La r??action ?? la la cathode est la suivante:
- Al 3+ + 3 e - → Al
Ici, l'ion aluminium est en cours r??duite. Le m??tal d'aluminium puis coule vers le bas et est soutir??, habituellement jet?? dans de grands blocs appel??s billettes d'aluminium pour un traitement ult??rieur.
Au anode, l'oxyg??ne est form??e:
- 2 O 2 → O 2 + 4 e -
Dans une certaine mesure, l'anode de carbone est consomm??e par la r??action subs??quente avec l'oxyg??ne pour former du dioxyde de carbone. Les anodes dans une cellule de r??duction doivent donc ??tre remplac??es r??guli??rement, car ils sont consomm??s dans le processus. Les cathodes ne se d??t??riorent, principalement en raison de processus ??lectrochimiques et mouvement de m??tal. Apr??s cinq ?? dix ans, en fonction du courant utilis?? dans l'??lectrolyse, une cellule doit ??tre reconstruit ?? cause de l'usure de la cathode.
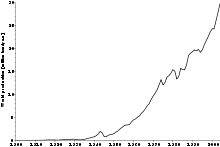
??lectrolyse de l'aluminium avec le Proc??d?? Hall-H??roult consomme beaucoup d'??nergie, mais des proc??d??s alternatifs ont toujours trouv?? ?? ??tre moins viable ??conomiquement et / ou ??cologiquement. La consommation mondiale d'??nergie sp??cifique moyenne est d'environ 15 ?? 0,5 kilowatts-heures par kilogramme d'aluminium produite (52 ?? 56 MJ / kg). Les usines d'??lectrolyse les plus modernes atteindre environ 12,8 kW ?? h / kg (46,1 MJ / kg). (Comparez cela ?? la chaleur de r??action, 31 MJ / kg, et l' ??nergie libre de la r??action, 29 MJ / kg). courants de ligne de r??duction pour les technologies plus anciennes sont g??n??ralement de 100 ?? 200 kiloamp??res; fonderies ??tat de l'art fonctionnent ?? environ 350 kA. Des essais ont ??t?? rapport??s avec 500 cellules kA.
Le proc??d?? Hall-H??roult produit de l'aluminium d'une puret?? sup??rieure ?? 99%. Une purification suppl??mentaire peut ??tre effectu??e par la Hoope processus. Le proc??d?? implique l'??lectrolyse de l'aluminium fondu avec un sel de sodium, de baryum et le fluorure d'aluminium ??lectrolytique. L'aluminium obtenu pr??sente une puret?? de 99,99%.
L'??nergie ??lectrique repr??sente environ 20% ?? 40% du co??t de production d'aluminium, selon l'emplacement de la fonderie. La production d'aluminium consomme environ 5% de l'??lectricit?? produite dans les fonderies am??ricaines ont tendance ?? ??tre situ?? l?? o?? l'??nergie ??lectrique est ?? la fois abondante et bon march??, comme les ??mirats arabes unis avec exc??s fournitures de gaz naturel et l'Islande et la Norv??ge avec ??nergie produite ?? partir de sources renouvelables. Plus grand du monde fonderies d'alumine sont la R??publique populaire de Chine, la Russie et Qu??bec et Colombie-Britannique Canada .
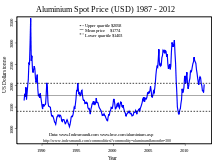
En 2005, la R??publique populaire de Chine ??tait le premier producteur d'aluminium avec presque un cinqui??me part du monde, suivie par la Russie, le Canada et les ??tats-Unis, rapporte le British Geological Survey.
Au cours des 50 derni??res ann??es, l'Australie est devenue un important producteur de minerai de bauxite et un important producteur et exportateur d'alumine (avant d'??tre d??pass??e par la Chine en 2007). L'Australie a produit 68 millions de tonnes de bauxite en 2010. Les d??p??ts australiens avoir quelques probl??mes de raffinage, certains ??tant ??lev?? en silice, mais ont l'avantage d'??tre peu profonde et relativement facile ?? la mienne.
Recyclage

Aluminium est th??oriquement recyclable ?? 100% sans aucune perte de ses qualit??s naturelles. Selon le International des ressources du Groupe sp??cial Stocks de m??taux dans les rapport de la Soci??t??, le global habitant stock d'aluminium en usage dans la soci??t?? par (dans les voitures, les b??timents, l'??lectronique etc.) est de 80 kg. Beaucoup de ceci est dans les pays les plus d??velopp??s (350-500 kg par habitant) plut??t que les pays moins d??velopp??s (35 kg par habitant). Sachant stocks par habitant et leur dur??e de vie approximative est important pour le recyclage de planification.
R??cup??ration du m??tal via le recyclage est devenu une utilisation importante de l'industrie de l'aluminium. Recyclage ??tait une activit?? ?? faible profil jusqu'?? la fin des ann??es 1960, lorsque l'utilisation croissante de l'aluminium cannettes port??es ?? la sensibilisation du public.
Recyclage implique la fusion de la ferraille, un processus qui ne requiert que 5% de l'??nergie utilis??e pour produire de l'aluminium ?? partir du minerai, si une part importante (jusqu'?? 15% de la mati??re d'entr??e) est perdu que scories (oxyde comme de la cendre). Les scories peut subir un autre proc??d?? pour extraire l'aluminium.
En Europe de l'aluminium subit un taux ??lev?? de recyclage, allant de 42% des bo??tes de boisson, 85% des mat??riaux de construction et de 95% des v??hicules de transport.
L'aluminium recycl?? est connu que l'aluminium secondaire, mais conserve les m??mes propri??t??s physiques que l'aluminium primaire. Aluminium secondaire est produit dans un large ??ventail de formats et est utilis?? dans 80% des injections en alliage. Une autre utilisation importante est pour l'extrusion.
??cume blanche de la production d'aluminium de premi??re fusion et des op??rations de recyclage secondaire contient encore des quantit??s utiles d'aluminium qui peuvent ??tre extraites industriellement. Le proc??d?? produit des billettes d'aluminium, avec un mat??riau de d??chets hautement complexe. Ces d??chets sont difficiles ?? g??rer. Il r??agit avec l'eau, lib??rant un m??lange de gaz (y compris, entre autres, l'hydrog??ne , l'ac??tyl??ne , et de l'ammoniac ), qui se enflamme spontan??ment au contact de l'air; contacter avec des r??sultats de l'air humide dans la lib??ration de grandes quantit??s d'ammoniac gazeux. Malgr?? ces difficult??s, les d??chets ont trouv?? une utilisation comme charge dans asphalte et b??ton.
Compos??s
??tat d'oxydation 3
La grande majorit?? des compos??s, y compris tous les min??raux contenant Al-et tous les compos??s d'aluminium commercialement importantes, disposent d'aluminium ?? l'??tat d'oxydation 3+. Le nombre de coordination de ces compos??s varie, mais en g??n??ral, Al 3+ est de six ou de coordonn??es t??tracoordonn??. Presque tous les compos??s de l'aluminium (III) sont incolores.
Halog??nures
Tous les quatre trihalog??nures sont bien connus. Contrairement aux structures des trois trihalog??nures plus lourds, fluorure d'aluminium (AlF 3) dispose de six coordonn??es Al. L'environnement de coordination octa??drique de AlF 3 est li??e ?? la compacit?? de ion fluorure, dont six peuvent se adapter autour de la petite Al 3+ centre. AlF 3 sublimes (avec fissuration) ?? 1291 ?? C (2356 ?? F). Avec des halog??nures lourds, les nombres de coordination sont plus faibles. Les autres sont des trihalog??nures dim??re ou polym??re avec des centres Al t??tra??driques. Ces mat??riaux sont pr??par??s par traitement de l'aluminium m??tallique avec l'atome d'halog??ne, bien que d'autres m??thodes existent. L'acidification des oxydes ou hydroxydes offre hydrates. En solution aqueuse, les halog??nures forment souvent des m??langes contenant g??n??ralement de six centres coordonner Al, qui sont tous deux fonction halog??nure et ligands aquo. Lorsque l'aluminium et le fluorure sont ensemble en solution aqueuse, ils forment facilement des ions complexes tels que [AlF (H 2 O) 5] 2+, AlF 3 (H 2 O) 3, et [AlF 6] 3-. Dans le cas d'un chlorure, un amas de polyaluminium sont form??s tel que [Al 13 O 4 (OH) 24 (H 2 O) 12] 7+.
Oxyde et hydroxydes
Aluminium forme un oxyde stable, connu par son nom de min??ral corindon . Sapphire et rubis sont corindon impur contamin?? par des traces d'autres m??taux. Les deux oxydes-hydroxydes, AlO (OH), sont boehmite et diaspore. Il ya trois trihydroxydes: bayerite, gibbsite, et nordstrandite, qui diff??rent par leur structure cristalline ( polymorphes). La plupart sont fabriqu??s ?? partir de minerais par une vari??t?? de proc??d??s par voie humide utilisant de l'acide et la base. Le chauffage des hydroxydes conduit ?? la formation de corindon. Ces mat??riaux sont d'une importance centrale ?? la production d'aluminium et sont eux-m??mes extr??mement utile.
carbure d'aluminium (Al 4 C 3) est r??alis??e en chauffant un m??lange des ??l??ments ci-dessus 1000 ?? C (1832 ?? F). Les cristaux jaune p??le constitu??s de centres d'aluminium t??tra??driques. Il r??agit avec l'eau ou les acides dilu??s pour donner du m??thane . Le ac??tylure, Al 2 (C 2) 3, est r??alis??e en faisant passer de l'ac??tyl??ne sur aluminium chauff??.
du nitrure d'aluminium (AlN) est le seul connu pour le nitrure d'aluminium. Contrairement aux oxydes il dispose d'Al centres t??tra??driques. Il peut ??tre fabriqu?? ?? partir des ??l??ments ?? 800 ?? C (1472 ?? F). Il est stable ?? l'air avec un mat??riau utile ??lev??e conductivit?? thermique. phosphure d'aluminium (ALP) est r??alis??e de mani??re similaire, et hydrolyse pour donner phosphine:
- AlP + 3 H 2 O → Al (OH) 3 + 3 PH
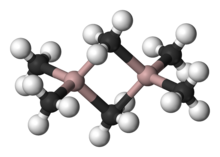
Une vari??t?? de compos??s de formule empirique AlR 3 AlR et 1,5 Cl 1,5 existent. Ces esp??ces comprennent g??n??ralement des centres Al t??tra??driques, par exemple " trim??thylaluminium "a la formule Al 2 (CH 3) 6 (voir figure). Avec de grands groupes organiques, triorganoaluminium existe en tant que monom??res trois coordonn??es, tels que triisobutylaluminium. Ces compos??s sont largement utilis??s dans l'industrie chimique, en d??pit du fait qu'ils sont souvent hautement pyrophore. Quelques analogues existent entre les compos??s organoaluminiques et organo-bore sauf pour les grands groupes organiques.
L'hydrure d'aluminium important est l'hydrure de lithium-aluminium (LiAlH 4), qui est utilis?? en tant qu'agent r??ducteur dans la chimie organique . Il peut ??tre produit ?? partir de l'hydrure de lithium et de trichlorure d'aluminium:
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
Plusieurs d??riv??s utiles de LiAlH4 sont connus, par exemple, de sodium bis (2-m??thoxy??thoxy) dihydridoaluminate. L'hydrure simple, hydrure d'aluminium ou Alane, reste une curiosit?? de laboratoire. Ce est un polym??re de formule (AlH 3) n, ?? la diff??rence de l'hydrure de bore correspondant ?? la formule (BH 3) 2.
??tats d'oxydation 1 et 2
Bien que la grande majorit?? des compos??s de l'aluminium Al 3+ disposent centres, compos??s avec des ??tats d'oxydation inf??rieurs sont connus et parfois de l'importance en tant que pr??curseurs aux esp??ces Al 3+.
Aluminium (I)
AlF, et AlCl AlBr existent dans la phase gazeuse lorsque le trihalog??nure est chauff?? avec de l'aluminium. La composition Ali est instable ?? temp??rature ambiante par rapport ?? la triiodure:
- 3 AlI → AlI 3 + 2 Al
Un d??riv?? stable de l'aluminium est le monoiodide cyclique produit d'addition form?? avec tri??thylamine, Al 4 I 4 (NET 3) 4. ??galement d'int??r??t th??orique, mais seulement de l'existence ??ph??m??re sont Al 2 O et Al 2 S. Al 2 O est effectu?? en chauffant l'oxyde normale, Al 2 O 3, avec du silicium ?? 1800 ?? C (3272 ?? F) dans un vide. De tels mat??riaux rapidement dismute pour les mati??res de d??part.
Aluminium (II)
Compos??s tr??s simples Al (II) sont invoqu??s ou observ??s dans les r??actions de Al m??tallique avec les oxydants. Par exemple, monoxyde d'aluminium, AlO, a ??t?? d??tect??e dans la phase gazeuse et apr??s explosion dans les spectres d'absorption stellaire. Plus enqu??tes approfondies sont des compos??s de formule Al 2 R 4 o?? R est un grand organique ligand.
Analyse
La pr??sence d'aluminium peut ??tre d??tect??e en utilisant l'analyse qualitative aluminon.
Applications
Utilisation g??n??rale
L'aluminium est le plus largement utilis?? la m??taux non ferreux. La production mondiale d'aluminium en 2005 ??tait de 31,9 millions de tonnes. Il a d??pass?? celle de tout autre m??tal sauf fer (837,5 millions de tonnes). Pr??visions pour 2012 est de 42 ?? 45.000.000 tonnes, gr??ce ?? la hausse la production chinoise.
L'aluminium est presque toujours alli??, ce qui am??liore nettement ses propri??t??s m??caniques, en particulier lorsque tremp??. Par exemple, la commune des feuilles d'aluminium et les canettes sont des alliages de 92% ?? 99% d'aluminium. Le principal des agents d'alliage sont le cuivre, le zinc , le magn??sium , le mangan??se et le silicium (par exemple, duralumin) et les niveaux de ces autres m??taux sont de l'ordre de quelques pour cent en poids.



Parmi les nombreuses utilisations de l'aluminium m??tallique sont en:
- Transport ( voitures , avions, camions, voitures de chemin de fer, les navires, bicyclettes , etc.) que feuilles, de tubes, pi??ces moul??es, etc.
- Emballage ( bo??tes, feuilles, etc.)
- Construction ( fen??tres, portes, bardage, fil de b??timent, etc.).
- Une large gamme d'articles m??nagers, de ustensiles pour la cuisine battes de baseball, montres.
- ??clairage p??les, bateau ?? voile m??ts, b??tons de marche, etc.
- Coques ext??rieures de l'??lectronique grand public, aussi les cas pour l'??quipement par exemple ??quipement photographique.
- Lignes de transmission ??lectriques pour la distribution de puissance
- MKM et l'acier Aimants Alnico
- Super aluminium de puret?? (SPA, 99,980% ?? 99,999% Al), utilis?? dans l'??lectronique et les CD .
- dissipateurs de chaleur pour les appareils ??lectroniques tels que transistors et processeurs .
- Mat??riau de substrat de cuivre plaqu??s stratifi??s m??tal de base utilis??s dans une luminosit?? ??lev??e ??clairage LED.
- L'aluminium en poudre est utilis?? dans peindre, et pyrotechniques tels que combustibles solides pour fus??es et thermite.
- L'aluminium peut ??tre mis ?? r??agir avec de l'acide chlorhydrique ou de l'hydroxyde de sodium pour produire du gaz d'hydrog??ne.
- Une vari??t?? de pays, y compris France , l'Italie , la Pologne , la Finlande , la Roumanie , Isra??l , et l'ex -Yougoslavie , ont publi?? des pi??ces de monnaie frapp??es dans les alliages d'aluminium ou en aluminium-cuivre.
- Certains mod??les de guitare sportives diamant en aluminium plaques sur la surface des instruments, g??n??ralement chrome ou noir. Kramer et Travis Bean sont tous deux connu pour avoir guitares produites avec cous fait d'aluminium, ce qui donne ?? l'instrument un son tr??s distinct.
L'aluminium est g??n??ralement alli?? - il est utilis?? comme m??tal pur seulement lorsque la r??sistance et / ou la maniabilit?? corrosion est plus importante que la force ou la duret??. Une fine couche d'aluminium peut ??tre d??pos?? sur une surface plane par d??p??t en phase vapeur physique ou (tr??s rare) d??p??t chimique en phase vapeur chimique ou d'un autre moyen pour former rev??tements optiques et miroirs.
Les compos??s d'aluminium
Parce que l'aluminium est abondante et la plupart de ses d??riv??s pr??sentent une faible toxicit??, les compos??s de l'aluminium b??n??ficient applications ?? grande ??chelle et parfois larges.
Alumine
L'oxyde d'aluminium (Al 2 O 3) et les oxy-hydroxydes associ??s et trihydroxydes sont produites ou extraites de min??raux sur une grande ??chelle. La grande majorit?? de ce mat??riel est converti ?? l'aluminium m??tallique. Environ 10% de la capacit?? de production est utilis?? pour d'autres applications. Une utilisation principale est comme absorbant, par exemple l'alumine sera ??liminer l'eau ?? partir d'hydrocarbures, pour permettre les processus ult??rieurs qui sont empoisonn??s par l'humidit??. oxydes d'aluminium sont des catalyseurs communs pour les proc??d??s industriels, par exemple la Proc??d?? Claus pour la conversion du sulfure d'hydrog??ne en soufre en les raffineries et pour la l'alkylation d' amines . De nombreux catalyseurs industriels sont "Support??", ce qui signifie en g??n??ral que d'un catalyseur co??teux (par exemple, le platine ) est dispers?? sur un mat??riau de surface sp??cifique ??lev??e tel que l'alumine. ??tre un mat??riau tr??s dur ( duret?? Mohs 9), l'alumine est largement utilis?? comme un abrasif et la production d'applications qui exploitent son inertie, par exemple, dans lampes au sodium haute pression.
Sulfates
Plusieurs sulfates d'aluminium trouvent des applications. Sulfate d'aluminium (Al 2 (SO 4) 3 (H 2 O) 18) est produite sur l'??chelle annuelle de plusieurs milliards de kg. Environ la moiti?? de la production est consomm??e dans traitement de l'eau. La prochaine application importante est la fabrication de papier. Il est ??galement utilis?? comme mordant, dans extincteur, comme additif alimentaire, dans l'ignifugation, et dans le tannage du cuir. Aluminium sulfate d'ammonium, qui est aussi appel?? alun d'ammonium, (NH 4) Al (SO 4) 2 ?? 12H 2 O, est utilis?? en tant que mordant et le tannage du cuir. Sulfate de potassium aluminium ([Al (K)] (SO 4) 2) (H 2 O) 12 est utilis?? de mani??re similaire. La consommation de deux aluns est en baisse.
Chlorures
Le chlorure d'aluminium (AlCl 3) est utilis?? en p??trole raffinage et de la production de synth??se caoutchouc et polym??res. M??me si elle a un nom similaire, le chlorhydrate d'aluminium et a moins tr??s diff??rentes applications, par exemple comme agent de durcissement et un anti-transpirant. Ce est un interm??diaire dans la production de l'aluminium m??tallique.
compos??s de niche
??tant donn?? l'ampleur des compos??s de l'aluminium, une petite application ?? grande ??chelle pourrait encore entra??ner des milliers de tonnes. L'un des nombreux compos??s utilis??s ?? ce niveau interm??diaire comprennent l'ac??tate d'aluminium, un sel utilis?? en solution en tant que astringent. borate d'aluminium (Al 2 O 3 ?? B 2 O 3) est utilis?? dans la production de verre et c??ramiques. fluorosilicate d'aluminium (Al 2 (SiF 6) 3) est utilis?? dans la production de synth??se pierres pr??cieuses, verre et c??ramique. phosphate d'aluminium (AlPO 4) est utilis?? dans la fabrication: de verre et de c??ramique, p??tes et papiers, cosm??tiques, peintures et vernis et en faisant dentaire ciment. L'hydroxyde d'aluminium (Al (OH) 3) est utilis?? comme un antiacide, comme mordant, dans l'eau de purification, pour la fabrication de verre et de c??ramique et dans l'imperm??abilisation de tissus. l'hydrure de lithium-aluminium est un puissant agent r??ducteur utilis?? dans la chimie organique . Sont utilis??s comme Organoaluminiums Des acides de Lewis et des co-catalyseurs. Par exemple, un cocatalyseur du m??thylaluminoxane est de Ziegler-Natta ol??fine polym??risation pour produire les polym??res vinyliques tels que poly??thyl??ne.
Les alliages d'aluminium dans les applications structurelles

Les alliages d'aluminium ayant un large ??ventail de propri??t??s sont utilis??es dans les ouvrages d'art. syst??mes d'alliage sont class??s par un syst??me de num??ro ( ANSI) ou par des noms indiquant leurs principaux constituants d'alliage ( DIN et ISO).
La r??sistance et la durabilit?? des alliages d'aluminium sont tr??s variables, non seulement en raison des composants de l'alliage sp??cifique, mais ??galement en raison de traitements thermiques et des proc??d??s de fabrication. Un manque de connaissance de ces aspects a de temps ?? autre conduit ?? mal con??ue et structures en aluminium gagn?? une mauvaise r??putation.
Une limitation importante de structure en alliages d'aluminium est leur r??sistance ?? la fatigue. Contrairement aciers, alliages d'aluminium ont bien d??finie limite de fatigue, ce qui signifie que la rupture par fatigue se produit ??ventuellement, en vertu m??me de tr??s petites sollicitations cycliques. Cela implique que les ing??nieurs doivent ??valuer ces charges et design pour un la vie fixe plut??t que d'une dur??e de vie infinie.
Une autre propri??t?? importante des alliages d'aluminium est leur sensibilit?? ?? la chaleur. proc??dures de l'atelier impliquant pas de chauffage sont compliqu??es par le fait que l'aluminium, contrairement ?? l'acier, fond sans d'abord rouge incandescent. Les op??rations de formage o?? chalumeau est utilis?? donc n??cessiter une certaine expertise, puisque aucun signe visuel r??v??lent ?? quel point le mat??riel est ?? la fusion. Les alliages d'aluminium, comme tous les alliages structuraux, sont ??galement soumis ?? des contraintes internes suivantes op??rations de chauffage tels que le soudage et le moulage. Le probl??me avec les alliages d'aluminium ?? cet ??gard est leur faible point de fusion , ce qui les rend plus sensibles ?? des distorsions de la chaleur induite par le soulagement du stress. Contr??l??e, le soulagement du stress peut ??tre effectu?? en cours de fabrication par traitement thermique de pi??ces dans un four, suivi d'un refroidissement en effet graduel recuit des contraintes.
Le point de fusion bas des alliages d'aluminium n'a pas emp??ch?? leur utilisation dans les fus??es; m??me pour une utilisation dans la construction de chambres de combustion o?? les gaz peuvent atteindre 3500 K. Le Agena moteur de l'??tage sup??rieur a utilis?? un design en aluminium refroidi par r??g??n??ration pour certaines parties de la buse, y compris la r??gion de la gorge thermiquement critique.
Un autre alliage d'une certaine valeur est bronze d'aluminium (Cu-Al alliage).
Histoire

Anciens Grecs et Romains utiliser des sels d'aluminium comme mordants de teinture et que astringents pour panser les plaies; alun est encore utilis?? comme un h??mostatique. En 1761, Guyton de Morveau sugg??r?? d'appeler l'alumine d'alun de base. En 1808, Humphry Davy a identifi?? l'existence d'une base de m??tal de l'alun, qu'il a qualifi?? au premier alumium et de l'aluminium plus tard (voir section ??tymologie , ci-dessous).
Le m??tal a ??t?? la premi??re fois en 1825 dans une forme impure par danoise physicien et chimiste Hans Christian ??rsted. Il a r??agi anhydre du chlorure d'aluminium avec du potassium amalgame, ce qui donne un morceau de métal à la recherche semblable à l'étain. Friedrich Wöhler était au courant de ces expériences et de leur cité, mais après de refaire les expériences de Ørsted il a conclu que ce métal était potassium pur. Il a mené une expérience similaire en 1827 en mélangeant du chlorure d'aluminium anhydre avec du potassium et d'aluminium cédé. Wöhler est généralement crédité d'isoler l'aluminium ( latins alumen , alun), mais aussi orsted peut être répertorié comme son découvreur. En outre, Pierre Berthier découvert aluminium dans le minerai de bauxite et extrait avec succès. Français Henri Etienne Sainte-Claire Deville amélioré la méthode de Wöhler en 1846, et décrit ses améliorations dans un livre en 1859, le chef parmi eux étant la substitution de sodium pour le potassium considérablement plus cher. Deville susceptibles également conçu l'idée de l' électrolyse de l'oxyde d'aluminium dissous dans la cryolite; Charles Martin Hall et Paul Héroult auraient développé le processus plus pratique après Deville.
Avant le Procédé Hall-Héroult a été développé à la fin des années 1880, l'aluminium était extrêmement difficile d'extraire de ses différents minerais. Ce fait aluminium pur plus précieux que l'or. Bars de l'aluminium ont été exposées à l' Exposition Universelle de 1855. Napoléon III de la France est réputée pour avoir donné un banquet où les invités les plus honorés ont reçu des ustensiles en aluminium, tandis que les autres se sont contentés de l'or.
Aluminium a été choisi comme le matériau à être utilisé pour le couronnement 100 onces (2,8 kg) du Monument de Washington en 1884, une époque où une once (30 grammes) coûte le salaire journalier d'un travailleur commune sur le projet. La clé de voûte, qui a été mis en place le 6 Décembre 1884, lors d'une cérémonie de dédicace élaborée, était le plus grand morceau de fonte d'aluminium à l'époque, où l'aluminium était plus cher que l'argent.
Le Entreprises Cowles fournis alliage d'aluminium en quantité dans les États-Unis et l'Angleterre en utilisant les fonderies comme la fournaise de Carl Wilhelm Siemens par 1886. Charles Martin Hall de l'Ohio aux États-Unis et de Paul Héroult France indépendamment développé le procédé électrolytique Hall-Héroult qui a fait extraire l'aluminium à partir de minéraux moins cher et est maintenant la principale méthode utilisée dans le monde entier. Le processus de Hall, en 1888 avec le soutien financier de Alfred E. Hunt, a commencé la Pittsburgh Reduction Company aujourd'hui connu comme Alcoa. Le processus de Héroult a été en production par 1889 à la Suisse au Aluminium Industrie, maintenant Alcan, et au British Aluminium, maintenant Luxfer Group et Alcoa, en 1896 à l'Ecosse .
En 1895, le métal était utilisé comme un matériau de construction aussi loin queSydney, en Australie dans le dôme du bâtiment de la secrétaire en chef.
Beaucoup de marines ont utilis?? un alliage d'aluminium superstructure pour leurs navires; le feu ?? bord de 1975 USS Belknap qui a ravag?? sa superstructure en aluminium, ainsi que l'observation des dommages de combat aux navires britanniques pendant la Guerre des Malouines, a conduit ?? de nombreuses marines de commutation ?? tous acier superstructures. Le Classe Arleigh Burke ??tait le premier navire am??ricain, construit enti??rement en acier.
Fil d'aluminium a ??t?? autrefois largement utilis?? pour le c??blage ??lectrique domestique. En raison de faillites provoqu??s par corrosion, un certain nombre d'incendies a entra??n??.
??tymologie
Deux variantes du nom de m??tal sont en cours d'utilisation, de l'aluminium et de l'aluminium (en dehors de l'alumium obsol??te). Le Union internationale de chimie pure et appliqu??e (UICPA) a adopt?? le nom de l'aluminium comme norme internationale pour l'??l??ment en 1990, mais, trois ans plus tard, reconnu aluminium comme une variante acceptable. D'o?? leur tableau p??riodique comprend ?? la fois. IUPAC pr??f??re l'utilisation de l'aluminium dans ses publications internes, bien que presque autant de publications UICPA utilisent l'orthographe aluminium.
La plupart des pays utilisent l'orthographe aluminium. Aux ??tats-Unis, l'orthographe aluminium pr??domine. Le Canadian Oxford Dictionary pr??f??re l'aluminium, alors que l'Australien Macquarie Dictionnaire pr??f??re aluminium. En 1926, le American Chemical Society a officiellement d??cid?? d'utiliser l'aluminium dans ses publications; Dictionnaires am??ricains qualifient g??n??ralement l'orthographe aluminium comme une variante britannique.
Le nom aluminium provient de son statut de base du alun. C'est emprunt?? ?? Vieux fran??ais; sa source ultime, alumen, ?? son tour, est une latine mot qui signifie litt??ralement ??sel amer??.
La premi??re citation donn??e dans le Oxford English Dictionary for tout mot utilis?? comme un nom pour cet ??l??ment est alumium, qui chimiste et inventeur britannique Humphry Davy employ?? en 1808 pour le m??tal qu'il essayait d'isoler ??lectrolytique du min??ral alumine . La citation est de la revue Philosophical Transactions de la Royal Society de Londres: "Si je avais eu le bonheur d'avoir obtenu plus de certaines preuves ?? ce sujet, et d'avoir procur?? les substances m??talliques, je ??tais ?? la recherche de, je aurais propos?? pour les noms de silicium, alumium, le zirconium et glucium ".
Davy réglé sur l'aluminium par le temps, il a publié son livre 1812 Philosophie chimique : «Cette substance semble contenir un métal particulier, mais encore en aluminium n'a pas été obtenue dans un état ??????parfaitement libre, bien que les alliages de ce avec d'autres substances Metalline ont été achetés suffisamment distincts pour indiquer la nature probable de l'alumine ". Mais la même année, un contributeur anonyme à la revue trimestrielle, un journal politico-littéraire britannique, dans une critique du livre de Davy, est opposé à l'aluminium et a proposé le nom d'aluminium , "pour que nous allons prendre la liberté de vous écrire le mot, dans de préférence l'aluminium, qui a un son moins classique ".
Le -ium suffixe conforme à la précédent établi dans les autres éléments nouvellement découvertes de l'époque: le potassium, le sodium, le magnésium, le calcium et de strontium (tous Davy lui isolé). Néanmoins, -UM orthographes pour les éléments ne sont pas inconnus à l'époque, comme par exemple le platine , connu des Européens depuis le 16ème siècle, le molybdène , découvert en 1778, et le tantale , découvert en 1802. Le -um suffixe est compatible avec l'orthographe universelle alumine pour la oxydes, comme l'oxyde de lanthane est l'oxyde de lanthane et la magn??sie, l'oxyde de cérium et l'oxyde de thorium sont les oxydes de magnésium , le cérium , et thorium respectivement.
L'orthographe utilisée tout au long du 19e siècle par la plupart des chimistes américains était l'aluminium , mais l'usage commun est moins claire. L' aluminium orthographe est utilisée dans le dictionnaire Webster de 1828. Dans son prospectus de publicité pour sa nouvelle méthode électrolytique de production de métal 1892, Charles Martin Hall a utilisé le -um orthographe, malgré son utilisation constante de l' -ium orthographe dans tous les brevets qu'il déposée entre 1886 et 1903. Il a donc été suggéré que l'orthographe reflète une plus facile mot à prononcer avec un de moins syllabe, ou que l'orthographe sur le dépliant était une erreur. La domination de Temple de la production du métal veillé à ce que l'orthographe aluminium est devenu la norme en Amérique du Nord; l' Unabridged Dictionnaire Webster de 1913, cependant, a continué à utiliser le -ium la version.
Les problèmes de santé
| NFPA 704 |
|---|
 0 0 0 |
| diamant feu pour tir d'aluminium |
Malgré son abondance naturelle, l'aluminium n'a pas de fonction connue en biologie. Il est remarquablement non toxique, le sulfate d'aluminium ayant une DL50 de 6207 mg / kg (voie orale, souris), ce qui correspond à 500 grammes pour une personne de 80 kg. Malgré la très faible toxicité aiguë, les effets sur la santé de l'aluminium sont d'intérêt en vue de la présence répandue de l'élément dans l'environnement et dans le commerce.
Certains toxicité peut être attribuée à un dépôt dans les os et le système nerveux central, ce qui est particulièrement augmenté chez les patients ayant une fonction rénale réduite. Parce que l'aluminium est en concurrence avec le calcium pour l'absorption, l'augmentation des quantités d'aluminium alimentaire peuvent contribuer à la minéralisation osseuse réduite (ostéopénie) observée chez les prématurés et les nourrissons souffrant de retard de croissance. Dans de très fortes doses, l'aluminium peut provoquer une neurotoxicité, et est associée à une fonction altérée de la barrière hémato-encéphalique. Un petit pourcentage de gens sont allergiques à l'aluminium et de l'expérience dermatite de contact, des troubles digestifs, des vomissements ou d'autres symptômes lors d'un contact ou l'ingestion de produits contenant de l'aluminium, comme les déodorants ou des antiacides. Dans ceux sans allergies, l'aluminium est moins toxique que les métaux lourds, mais il existe des preuves d'une certaine toxicité si elle est consommée en quantités excessives. Bien que l'utilisation de l'aluminium n'a pas été démontré ustensiles de conduire à la toxicité de l'aluminium en général, la consommation excessive d' antiacides contenant de composés de l'aluminium et de l'utilisation excessive d'antitranspirants contenant de l'aluminium prévoit plusieurs niveaux d'exposition importants. Des études ont montré que la consommation d'aliments acides ou des liquides avec de l'aluminium augmente de façon significative l'absorption d'aluminium, et de maltol a été montré pour augmenter l'accumulation d'aluminium dans les tissus nerveux et osseus. En outre, l'aluminium augmente des ??strogènes expression des gènes humains dans des cellules de cancer du sein en culture en laboratoire. Les effets de l'oestrogène-like de ces sels ont conduit à leur classification comme metalloestrogen.
Les effets de l'aluminium dans les antisudorifiques a été examinée au cours de plusieurs décennies avec peu de preuves d'irritation de la peau. Néanmoins, sa présence dans les antisudorifiques, les colorants (tels que l'aluminium lac), et les additifs alimentaires est controversée dans certains milieux. Bien qu'il y ait peu de preuves que l'exposition normale à l'aluminium présente un risque pour les adultes en bonne santé, certaines études soulignent les risques associés à une exposition accrue au métal. Aluminium dans les aliments peut être absorbé plus que l'aluminium dans l'eau. Certains chercheurs ont exprimé des préoccupations que l'aluminium dans les antisudorifiques peut augmenter le risque de cancer du sein, et de l'aluminium a été controversée impliqué comme facteur dans la maladie d'Alzheimer . Le Camelford pollution de l'eau de l'incident en cause un certain nombre de personnes qui consomment du sulfate d'aluminium. Les enquêtes sur les effets sur la santé à long terme sont toujours en cours, mais les concentrations cérébrales élevées d'aluminium ont été trouvés dans les examens post-mortem des victimes, et d'autres recherches pour déterminer si il ya un lien avec l'angiopathie amyloïde cérébrale a été commandée.
Selon le Société d'Alzheimer, l'avis médical et scientifique est que des études ont démontré de façon convaincante pas un lien de causalité entre l'aluminium et la maladie d'Alzheimer. Néanmoins, certaines études, tels que ceux sur la cohorte PAQUID, citent exposition à l'aluminium en tant que facteur de risque de la maladie d'Alzheimer . Certains plaques du cerveau ont été trouvés à des niveaux accrus de contenir le métal. La recherche dans ce domaine a été concluants; accumulation d'aluminium peut être une conséquence de la maladie plutôt que d'un agent causal. En tout cas, si il ya une toxicité de l'aluminium, il doit être par un mécanisme très spécifique, puisque l'exposition humaine totale à l'élément sous la forme d'origine naturelle de l'argile dans le sol et la poussière est extrêmement grande sur toute une vie. Existe un consensus scientifique pas encore savoir si l'exposition d'aluminium pourrait augmenter directement le risque de la maladie d'Alzheimer.
Effet sur ??????les plantes
L'aluminium est primaire parmi les facteurs qui réduisent la croissance des plantes sur les sols acides. Bien qu'il soit généralement inoffensif pour la croissance des plantes dans les sols de pH neutre, la concentration dans les sols acides toxiques de Al 3+ cations augmente et perturbe la croissance et la fonction racine.
La plupart des sols acides sont saturés avec de l'aluminium plutôt que des ions hydrogène. L'acidité du sol est donc un résultat de l'hydrolyse de composés de l'aluminium. Ce concept de «potentiel de chaux corrigée" pour définir le degré de saturation de base dans les sols est devenue la base pour les procédures actuellement utilisés dans les laboratoires d'analyse des sols pour déterminer le " besoin de chaux "des sols.
Blé d ' adaptation pour permettre la tolérance d'aluminium est telle que l'aluminium provoque un dégagement de composés organiques qui se lient aux nuisibles aluminium cations . Sorghum est censé avoir le même mécanisme de tolérance. Le premier gène de tolérance d'aluminium a été identifié dans le blé. Il a été montré que la tolérance d'aluminium de sorgho est contrôlé par un seul gène, comme pour le blé. Cela ne veut pas le cas dans toutes les plantes.
