Ammoniac
Contexte des ??coles Wikip??dia
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Parrainage d'enfants aide les enfants du monde en d??veloppement ?? apprendre aussi.
| Ammoniac | |
|---|---|
 | |
 |  |
Azane | |
Autres noms Hydrog??ne nitrure Trihydrogen nitrure | |
| Identificateurs | |
| Num??ro CAS | 7664-41-7 |
| PubChem | 222 |
| ChemSpider | 217 |
| UNII | 5138Q19F1X |
| Num??ro CE | 231-635-3 |
| Num??ro ONU | 1005 |
| KEGG | D02916 |
| MeSH | Ammoniac |
| ChEBI | CHEBI: 16134 |
| ChEMBL | CHEMBL1160819 |
| Num??ro RTECS | BO0875000 |
| Beilstein R??f??rence | 3587154 |
| Gmelin R??f??rence | 79 |
| 3DMet | B00004 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | NH 3 |
| Masse molaire | 17,031 g / mol |
| Apparence | Gaz incolore avec une forte odeur ??cre |
| Densit?? | 0,86 kg / m 3 (1,013 bar au point d'??bullition) 0,73 kg / m 3 (1,013 bar ?? 15 ?? C) 681,9 kg / m 3 ?? -33,3 ?? C (liquide) 817 kg / m 3 ?? -80 ?? C (transparent solide) |
| Point de fusion | -77,73 ?? C, 195 K, -108 ?? F |
| Point d'??bullition | -33,34 ?? C, 240 K, -28 ?? F |
| Solubilit?? dans l'eau | 47% (0 ?? C) 31% (25 ?? C) 28% (50 ?? C) |
| Acidit?? (p K a) | 32,5 (-33 ?? C), 10,5 (DMSO) |
| Basicit?? (p K b) | 4,75 |
| Structure | |
| Forme mol??culaire | Pyramide Trigonal |
| Moment de dip??le | 1,42 R?? |
| Thermochimie | |
| Std enthalpie de formation Δ f H | -46 KJ ?? mol -1 |
| Molaire standard entropie S | 193 J ?? mol -1 ?? K -1 |
| Risques | |
| FS | MSDS externe |
| Pictogrammes SGH |     |
| Mentions de danger du SGH | H221, H280, H314, H331, H400 |
| SGH conseils de prudence | P210, P261, P273, P280, P305 + 351 + 338, P310 |
| Indice de l'UE | 007-001-00-5 (anhydre) 007-001-01-2 (solutions) |
| Classification UE | |
| Phrases-R | R10, R23, R34, R50 |
| Phrases S | (S1 / 2), S9, S16, S26, S36 / 37/39, S45, S61 |
| NFPA 704 |  1 3 0 |
| Point d'??clair | gaz inflammable (voir le texte) |
| D'auto-inflammation temp??rature | 651 ?? C |
| Limites d'explosivit?? | 15-28% |
| ??tats-Unis Permis limite d'exposition (PEL) | 50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
| Des compos??s apparent??s | |
| D'autres cations | Phosphine Arsine Stibine |
| Des hydrures d'azote li??s | Hydrazine L'acide hydrazo??que |
| Des compos??s apparent??s | L'hydroxyde d'ammonium |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
L'ammoniac ou Azane est un compos?? de l'azote et de l'hydrog??ne avec la formule NH 3. Ce est un gaz incolore gaz avec une caract??ristique ??cre l'odorat. L'ammoniac contribue de mani??re significative aux nutritionnels besoins des organismes terrestres en servant comme un pr??curseur de la nourriture et des engrais . L'ammoniac, soit directement, soit indirectement, est aussi un ??l??ment constitutif pour la synth??se de nombreux produits pharmaceutiques et est utilis?? dans de nombreux produits de nettoyage commercial. Bien que largement utilis??, l'ammoniac est ?? la fois caustique et dangereux. La production mondiale d'ammoniac pour 2012 est pr??vu pour ??tre 198 millions de tonnes, une augmentation de 35% par rapport ?? l'estim?? 2006 la production mondiale de 146,5 millions de tonnes.
L'ammoniac, tel qu'il est utilis?? dans le commerce, est souvent appel?? ammoniac anhydre. Ce terme souligne l'absence d'eau dans le mat??riau. Parce que NH 3 bout ?? -33,34 ?? C (-28,012 ?? F) ?? une pression de 1 atmosph??re, le liquide doit ??tre stock?? sous haute pression ou ?? basse temp??rature. l'ammoniac ou des m??nages l'hydroxyde d'ammonium est une solution de NH 3 dans l'eau. La concentration de ces solutions est mesur?? en unit??s de la ??chelle Baum?? ( densit?? ), avec 26 degr??s Baum?? (environ 30% (en poids) de l'ammoniac ?? 15,5 ?? C) ??tant le produit commercial de haute concentration typique.
Occurrence naturelle
L'ammoniac se trouve ?? l'??tat de traces dans l'atmosph??re, ??tant produite ?? partir de la putr??faction (processus de d??composition) de l'animal azot??es et mati??res v??g??tales. les sels d'ammoniac et d'ammonium sont ??galement pr??sents en petites quantit??s dans l'eau de pluie, alors que chlorure d'ammonium (sel ammoniac), et sulfate d'ammonium se trouvent dans les districts volcaniques; cristaux de le bicarbonate d'ammonium ont ??t?? trouv??es dans Patagonie guano. Les reins s??cr??tent NH 3 pour neutraliser l'exc??s d'acide. Les sels d'ammonium sont ??galement trouv??s distribu??s par tous les sols fertiles et en eau de mer. Substances contenant de l'ammoniac, ou ceux qui sont semblable ?? elle, sont appel??s ammoniacal. L'ammoniac se trouve sur Pluton , Jupiter et, en petites quantit??s, sur Uranus .
Propri??t??s
L'ammoniac est un gaz incolore gaz avec une odeur piquante caract??ristique. C'est plus l??ger que l'air, sa densit?? ??tant 0,589 fois celle de l'air . Il est facile ?? liqu??fier en raison de la forte liaison hydrog??ne entre les mol??cules; le liquide qui bout ?? -33,3 ?? C et g??le ?? -77,7 ?? C en cristaux blancs.
L'ammoniac peut ??tre commod??ment d??sodoris??e en la faisant r??agir avec soit du bicarbonate de sodium ou l'acide ac??tique. Ces deux r??actions former un sel d'ammonium inodore.
- Solide
- La sym??trie du cristal est cubique, Pearson symbole CP16, groupe d'espace P2 1 3 No.198, constante de r??seau 0,5125 nm.
- Liquide
- Liquid ammoniac poss??de de fortes ionisants pouvoirs refl??tant sa haute ε de 22 ammoniac liquide a une tr??s haute changement enthalpie standard de vaporisation (23,35 kJ / mol, cf. l'eau 40,65 kJ / mol, le m??thane 8,19 kJ / mol, phosphine 14,6 kJ / mol) et peut donc ??tre utilis?? dans les laboratoires dans les vaisseaux non isol??s sans r??frig??ration suppl??mentaire. Voir ??galement la section de l'ammoniac liquide comme solvant .
- Propri??t??s de solvant
- L'ammoniac est miscible ?? l'eau. Dans une solution aqueuse, il peut ??tre chass?? par ??bullition. Le aqueuse est une solution d'ammoniaque de base. La concentration maximale d'ammoniac dans l'eau (a solution satur??e) a une densit?? de 0,880 g / cm 3 et est souvent appel?? ??ammoniac 0,880. L'ammoniac ne br??le pas facilement ou soutenir combustion, sauf dans des m??langes carburant-air ??troites de 15-25% d'air.
- Combustion
- Lorsque m??lang?? avec l'oxyg??ne , il br??le avec une flamme jaune-vert p??le. A haute temp??rature et en pr??sence d'un catalyseur appropri??, de l'ammoniaque est d??compos?? en ses ??l??ments constitutifs. Allumage se produit lorsque le chlore est pass?? dans l'ammoniac, l'azote et former le chlorure d'hydrog??ne; si le chlore est pr??sent en exc??s, le tr??s explosif trichlorure d'azote (NCl 3) est ??galement form??.
Structure
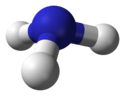
La mol??cule d'ammoniac a un forme de pyramide trigonale avec un angle de liaison de 107,8 ??, comme pr??vu par la valence ??lectronique shell th??orie paire de r??pulsion (th??orie VSEPR). L'atome d'azote central a cinq ??lectrons externes avec un ??lectron suppl??mentaire de chaque atome d'hydrog??ne. Cela donne un total de huit ??lectrons ou quatre paires d'??lectrons qui sont dispos??s t??tra??drique. Trois de ces paires d'??lectrons sont utilis??s comme paires d'obligations, ce qui laisse une paire d'??lectrons. La paire d'??lectrons repousser plus fortement que les paires d'obligations, donc l'angle de la liaison ne est pas 109,5 ??, comme pr??vu pour un arrangement t??tra??drique r??guli??re, mais est mesur??e ?? 107,8 ??. L'atome d'azote dans la mol??cule a une paire ??lectron c??libataire, ce qui rend l'ammoniac une base, d'un accepteur de protons. Cette forme donne la mol??cule un moment dipolaire et rend polaire. La polarit?? de la mol??cule et, surtout, sa capacit?? ?? former des liaisons hydrog??ne, de l'ammoniac rend hautement miscible avec l'eau . L'ammoniac est mod??r??ment basique, une solution aqueuse ?? 1,0 M ayant un pH de 11,6 et, si un acide fort est ajout?? ?? cette solution jusqu'?? ce que la solution soit neutre (pH = 7), 99,4% des mol??cules d'ammoniac sont proton??e. Temp??rature et salinit?? affecte ??galement la proportion de NH 4 +. Ce dernier a la forme d'un r??guli??re t??tra??dre et est iso??lectronique avec le m??thane . Il est connu pour avoir la plus grande la capacit?? de chaleur sp??cifique d'une substance.
La mol??cule d'ammoniac subit facilement inversion d'azote ?? la temp??rature ambiante; une analogie utile est un parapluie se tournant ?? l'int??rieur dans un vent fort. La barri??re d'??nergie ?? cette inversion est de 24,7 kJ / mol, et la fr??quence de r??sonance est 23,79 GHz, correspondant ?? d'un rayonnement micro-ondes longueur d'onde de 1,260 cm. L'absorption ?? cette fr??quence ??tait la premi??re spectre de micro-ondes ?? observer.
Basicit??
Une des propri??t??s les plus caract??ristiques de l'ammoniac est sa basicit??. Il se combine avec les acides pour former des sels ; ainsi avec de l'acide chlorhydrique qu'elle forme chlorure d'ammonium (sel ammoniac); avec l'acide nitrique , nitrate d'ammonium, etc. Cependant, l'ammoniac parfaitement sec ne sera pas combiner avec parfaitement sec le chlorure d'hydrog??ne; l'humidit?? est n??cessaire pour provoquer la r??action. Comme exp??rience de d??monstration, ouvert bouteilles de l'ammoniaque concentr??e et chlorhydrique nuages de chlorure d'ammonium, produisent des acides qui semblent appara??tre "?? partir de rien??, comme les formes de sel o?? les deux nuages de diffusion de mol??cules se rencontrent, quelque part entre les deux bouteilles.
- NH 3 + HCl → NH 4 Cl
Les sels obtenus par action d'ammoniac sur des acides sont connus comme le les sels d'ammonium et contiennent tous le ion ammonium (NH 4 +). Diluer l'ammoniaque aqueuse peut ??tre appliqu??e sur la peau pour att??nuer les effets des venins d'animaux, tels que les acides des insectes et m??duses.
La basicit?? de l'ammoniac est ??galement la base de sa toxicit?? et de son utilisation en tant que nettoyeur .
- En cr??ant une solution avec un pH beaucoup plus ??lev?? que une solution aqueuse neutre, des prot??ines ( enzymes) se d??naturer, conduisant ?? des dommages cellulaires, la mort de la cellule, et finalement la mort de l'organisme.
- La salet?? se compose souvent de graisses et d'huiles, qui sont peu solubles dans l'eau. Ammoniac les met en solution aqueuse. L'eau restante, contenant ??galement un exc??s d'ammoniac, se ??vapore compl??tement, laissant une surface propre.
Acidit??
Bien que l'ammoniac est bien connu comme une base faible, il peut aussi agir comme un acide extr??mement faible. Ce est une substance protique et est capable de formation de amides (qui contiennent le NH 2 - ion). Par exemple, le lithium se dissout dans de l'ammoniac liquide pour obtenir une solution de amide de lithium:
- Li 2 + 2 NH 3 → 2 LiNH 2 + H 2
Auto-dissociation
Comme l'eau, de l'ammoniac subit autoionisation mol??culaire pour former ses acides et de bases conjugu??s:
- 2 NH 3 (aq)
 NH +
NH +
4 (aq) + NH -
2 (aq)
?? pression et temp??rature standard, K = [NH +
4] [NH -
2] = 10 -30
Combustion
La combustion de l'ammoniac en azote et en eau est exothermique:
- 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 O (g) ( Δ H ?? r = -1267,20 kJ / mole)
Le changement enthalpie standard de la combustion, Δ H ?? c, exprim??e par mole d'ammoniac et la condensation de l'eau form??e, est de -382,81 kJ / mol. Diazote est le produit thermodynamique de la combustion: tous les oxydes d'azote sont instables par rapport ?? l'azote et l'oxyg??ne , qui est le principe de la convertisseur catalytique. Cependant, les oxydes d'azote peuvent ??tre form??s en tant que produits de cin??tique en pr??sence de catalyseurs appropri??s, une r??action de grande importance industrielle dans la production d' acide nitrique :
- 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Une r??action ult??rieure conduit ?? l'eau et NO 2
- 2 NO + O 2 → 2 NO 2
La combustion de l'ammoniac dans l'air est tr??s difficile, en l'absence d'un catalyseur (tel que le platine gaze), lorsque la temp??rature de la flamme est g??n??ralement inf??rieure ?? la temp??rature d'inflammation du m??lange air-ammoniac. La plage d'inflammabilit?? de l'ammoniac dans l'air est de 16 ?? 25%.
Formation d'autres compos??s
Dans la chimie organique , de l'ammoniac peut agir comme un nucl??ophile en substitution des r??actions. Les amines peuvent ??tre form??s par la r??action de l'ammoniac avec des halog??nures d'alkyle, bien que le groupe -NH 2 en r??sulte est aussi nucl??ophile et secondaires et les amines tertiaires sont souvent form??s comme sous-produits. Un exc??s d'ammoniac contribue ?? minimiser substitution multiple, et neutralise la l'halog??nure d'hydrog??ne form??. La m??thylamine est pr??par?? industriellement par la r??action de l'ammoniac avec chlorom??thane, et la r??action de l'ammoniac avec de l'acide 2-bromopropanoic a ??t?? utilis?? pour pr??parer rac??mique alanine dans un rendement de 70%. L'??thanolamine est pr??par?? par une r??action d'ouverture de cycle avec oxyde d'??thyl??ne: la r??action est parfois autoris?? ?? aller plus loin pour produire la di??thanolamine et tri??thanolamine.
Les amides peuvent ??tre pr??par??s par la r??action d'ammoniac avec un certain nombre d' acides carboxyliques d??riv??s. des chlorures d'acyle sont le plus r??actif, mais l'ammoniac doivent ??tre pr??sents dans au moins un double exc??s pour neutraliser la le chlorure d'hydrog??ne form??. Esters et anhydrides r??agissent ??galement avec l'ammoniac pour former des amides. Les sels d'ammonium d'acides carboxyliques peuvent ??tre d??shydrat?? pour amides tant qu'il n'y a pas thermiquement groupes sensibles pr??sents: des temp??ratures de 150 ?? 200 ?? C sont n??cessaires.
L'hydrog??ne en ammoniac est capable de remplacement par des m??taux , ainsi magn??sium br??le dans le gaz avec formation de nitrure de magn??sium Mg 3 N 2, et lorsque le gaz est pass?? sur chauff??e sodium ou de potassium , sodamide, NaNH2 et potassamide, KNH2, sont form??s. Lorsque cela est n??cessaire nomenclature substitutive , Recommandations IUPAC pr??f??rent le nom "Azane" ?? l'ammoniac: donc chloramine serait nomm?? "chloroazane" dans la nomenclature de substitution, pas "chloroammonia".
Ammoniac pentavalent est connu comme λ 5 amine, ou plus commun??ment, ammonium hydrure. Ce solide cristallin ne est stable sous haute pression, et se d??compose de nouveau dans trivalent ammoniaque et de l'hydrog??ne gazeux dans des conditions normales. Cette substance a ??t?? ??tudi??e une fois comme un possible carburant de fus??e solide en 1966.
L'ammoniac comme ligand
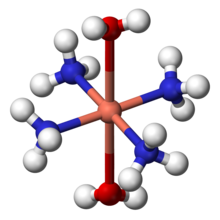
L'ammoniac peut agir en tant que ligand ?? m??tal de transition complexes. Il se agit d'un donneur σ-pure, au milieu de la spectrochimique s??rie, et montre interm??diaire comportement dur-mou. Pour des raisons historiques, l'ammoniac est nomm?? ammine dans la nomenclature de compos??s de coordination. Certains complexes d'ammine notables comprennent tetraamminediaquacopper (II) ([Cu (NH 3) 4 (H 2 O) 2] 2+), un complexe bleu fonc?? form?? par addition d'ammoniac ?? la solution de sels de cuivre (II). Il est connu que Le r??actif de Schweizer. Diamminesilver (I) ([Ag (NH 3) 2] +) est l'esp??ce active dans R??action de Tollens. Formation de ce complexe peut ??galement aider ?? distinguer entre les pr??cipit??s des diff??rents halog??nures d'argent: chlorure d'argent (AgCl) est soluble dans une solution dilu??e (2M) d'ammoniac, bromure d'argent (AgBr) ne est soluble dans une solution d'ammoniaque concentr??e, alors que l'iodure d'argent (AgI) est insoluble dans l'ammoniaque aqueuse.
complexes ammine de chrome (III) ont ??t?? connus ?? la fin du 19??me si??cle, et ont form?? la base de Th??orie r??volutionnaire de Werner Alfred sur la structure des compos??s de coordination. Werner a not?? que deux isom??res (fac - et mer -) du complexe [CrCl 3 (NH 3) 3] pourrait ??tre form??, et a conclu les ligands doivent ??tre dispos??s autour de l'ion m??tallique ?? la sommets d'un octa??dre . Cette proposition a ??t?? confirm??e depuis par Cristallographie aux rayons X.
Un ligand ammine li?? ?? un ion m??tallique est nettement plus acide que une mol??cule d'ammoniac libre, bien que la d??protonation en solution aqueuse est encore rare. Un exemple est le r??action de calomel, dans lequel le compos?? r??sultant amidomercury (II) est fortement insoluble.
- Hg 2 Cl 2 + 2 NH 3 → Hg + HgCl (NH 2) + NH 4 + + Cl -
D??tection et de d??termination
les sels d'ammoniac et d'ammonium peuvent ??tre facilement d??tect??es, sous forme de traces infimes, par l'addition de La solution de Nessler, ce qui donne une coloration jaune distincte en pr??sence de la moindre trace de sels d'ammonium ou d'ammonium. b??tons de soufre sont br??l??s pour d??tecter de petites fuites dans les syst??mes de r??frig??ration d'ammoniaque industrielle. De plus grandes quantit??s peuvent ??tre d??tect??es en chauffant les sels avec un alcali caustique ou avec la chaux vive, lorsque l'odeur caract??ristique de l'ammoniac sera ?? la fois apparente. La quantit?? d'ammoniac dans les sels d'ammonium peut ??tre estim?? quantitativement par distillation des sels form??s avec le sodium ou l'hydroxyde de potassium, l'ammoniac d??gag?? est absorb?? dans un volume connu de type acide sulfurique et l'exc??s d'acide d??termine ensuite volum??trique; ou l'ammoniac peut ??tre absorb?? dans l'acide chlorhydrique et le chlorure d'ammonium ainsi form?? pr??cipite sous forme hexachloroplatinate d'ammonium, (NH 4) 2 PtCl 6.
Azote ammoniacal (NH 3 -N)
Azote ammoniacal (NH 3 -N) est une mesure couramment utilis??e pour tester la quantit?? de Les ions ammonium, d'origine naturelle parmi l'ammoniac, l'ammoniac et renvoy??s ?? travers des processus biologiques, dans des liquides de l'eau ou des d??chets. Ce est une mesure utilis??e principalement pour quantifier les valeurs dans le traitement des d??chets et des syst??mes de purification d'eau, ainsi que d'une mesure de la sant?? des r??serves d'eau naturelles ou d'origine humaine. Il est mesur?? en unit??s de mg / L ( milligramme par litre).
Histoire

Les Romains appelaient les d??p??ts de chlorure d'ammonium qu'ils ont recueillis ?? partir pr??s du temple de Amon ( grec Ἄμμων Ammon) dans ancienne Libye 'ammoniacus sal (sel d'Amon) en raison de la proximit?? du temple ?? proximit??. Les sels d'ammoniac ont ??t?? connus depuis tr??s longtemps; d'o?? le terme Hammoniacus sal appara??t dans les ??crits de Pline, m??me si on ne sait pas si le terme est identique avec le sel ammoniac plus moderne ( le chlorure d'ammonium).
Dans la forme de sel ammoniac (N??SHADIR) ammoniac ??tait important pour les Alchimistes musulmans d??s le 8??me si??cle, d'abord mentionn?? par le chimiste Persique Jabir Ibn Hayyan, et les europ??ens alchimistes depuis le 13??me si??cle, ??tant communiqu??e par Albertus Magnus. Il a ??galement ??t?? utilis?? par teinturiers dans les Moyen-Age sous la forme d'ferment?? urine de modifier la couleur des colorants v??g??taux. Au 15??me si??cle, Basile Valentin a montr?? que l'ammoniac peut ??tre obtenu par action de bases sur le sel ammoniac. A une p??riode plus tard, quand le sel ammoniac a ??t?? obtenue par distillation les sabots et les cornes de b??ufs et de neutraliser le carbonate r??sultant avec de l'acide chlorhydrique , le nom "esprit de corne de cerf" a ??t?? appliqu??e ?? l'ammoniac.
L'ammoniac gazeux a d'abord ??t?? isol?? par Joseph Priestley en 1774 et a ??t?? appel?? par lui ??l'air alcaline". Onze ans plus tard en 1785, Claude Louis Berthollet d??termin?? sa composition.
Le Proc??d?? Haber-Bosch ammoniac pour produire de l'azote de l'air a ??t?? d??velopp?? par Fritz Haber et Carl Bosch en 1909 et brevet?? en 1910. Il a ??t?? utilis?? pour la premi??re ?? l'??chelle industrielle par les Allemands pendant la Premi??re Guerre mondiale , suite au blocus alli?? qui a coup?? l'alimentation en nitrates ?? partir de Chili . L'ammoniac a ??t?? utilis?? pour produire des explosifs pour soutenir leur effort de guerre.
Avant la disponibilit?? du gaz naturel pas cher, de l'hydrog??ne comme un pr??curseur de la production d'ammoniac a ??t?? produit par la ??lectrolyse de l'eau ou en utilisant le processus de chlore-alcali.
Utilisations
Engrais
Environ 83% (en 2004) de l'ammoniac est utilis?? comme engrais soit que ses sels, solutions ou anhydres. Lorsqu'il est appliqu?? sur le sol, il permet d'obtenir des rendements accrus de cultures telles que le ma??s et le bl??. 30% de l'azote agricole appliqu??e aux Etats-Unis est sous la forme d'ammoniac anhydre et ?? travers le monde 110m tonnes sont appliqu??es chaque ann??e.
Pr??curseur de compos??s azot??s
L'ammoniac est directement ou indirectement le pr??curseur de la plupart des compos??s contenant de l'azote. Pratiquement tous les compos??s azot??s synth??tiques sont d??riv??s de l'ammoniac. Un d??riv?? important est l'acide nitrique . Ce mat??riau cl?? est g??n??r??e via le Proc??d?? Ostwald par oxydation de l'ammoniac avec de l'air sur une platine catalyseur ?? 700-850 ?? C, ~ 9 atm. L'oxyde nitrique est un interm??diaire dans cette conversion:
- NH 3 + O 2 → 2 HNO 3 + H 2 O
L'acide nitrique est utilis?? pour la production d' engrais , explosifs, et de nombreux compos??s organiques azot??s.
Nettoyeur
ammoniac des m??nages est une solution de NH 3 dans l'eau (ce est ?? dire, l'hydroxyde d'ammonium) utilis?? comme un nettoyant ?? usage g??n??ral pour de nombreuses surfaces. Parce que les r??sultats d'ammoniac dans un ??clat relativement sans laisser de traces, l'une de ses utilisations les plus courantes consiste ?? nettoyer le verre, la porcelaine et en acier inoxydable. Il est ??galement fr??quemment utilis?? pour le nettoyage des fours et le trempage articles pour desserrer cuite sur la crasse. l'ammoniac est compris dans des m??nages concentration en poids de 5 ?? 10% d'ammoniac.
Fermentation
Solutions d'ammoniac allant de 16% ?? 25% sont utilis??s dans la industrie de la fermentation comme source d'azote pour les micro-organismes et ?? ajuster le pH pendant la fermentation.
Agent antimicrobien pour les produits alimentaires
D??j?? en 1895, il ??tait connu que l'ammoniac ??tait ??fortement antiseptique ... il faut 1,4 grammes par litre de pr??server boeuf th??. "L'ammoniac anhydre a ??t?? montr?? efficace comme agent antimicrobien pour l'alimentation animale et qui est actuellement utilis?? commercialement pour r??duire ou ??liminer la contamination microbienne des boeuf . Le New York Times a rapport?? en Octobre 2009 sur une soci??t?? am??ricaine, Beef Products Inc., qui tourne gras parures de b??uf, avec une moyenne entre 50 et 70 pour cent de mati??res grasses, en sept millions de livres par semaine de b??uf maigre finement textur??e (??slime rose") en enlevant la graisse utilisant la chaleur et centrifugation, puis d??sinfecter le produit maigre avec de l'ammoniac; le processus a ??t?? ??valu??e par la US Department of Agriculture aussi efficace et s??re sur la base d'une ??tude (financ??e par Beef Products) qui a r??v??l?? que le traitement r??duit E. coli ?? des niveaux ind??tectables. Une enqu??te plus pouss??e par le New York Times publi?? en D??cembre 2009 a r??v??l?? des probl??mes de s??curit?? sur le processus ainsi que les plaintes des consommateurs concernant le go??t et l'odeur de la viande bovine trait??e ?? des niveaux optimaux d'ammoniac. La semaine suivante, le journal a publi?? un ??ditorial, "Plus p??rils de la viande hach??e", r??it??rant les pr??occupations pos??es dans l'article de nouvelles. Plusieurs jours plus tard, l'??ditorial a ??t?? ajout?? avec une r??traction, pr??cisant qu'elle avait erron??ment d??clar?? qu'il y avait eu deux rappels de viande hach??e en raison de ce processus, et "Pas de viande produite par Beef Products Inc. a ??t?? li??e ?? des maladies ou des ??pid??mies."
Utilisations mineures et ??mergents
R??frig??ration - R717
En raison des propri??t??s de vaporisation de l'ammoniac, il est utile une r??frig??rant. Il a ??t?? couramment utilis?? avant la popularisation de chlorofluorocarbones (fr??on). L'ammoniac anhydre est largement utilis?? dans les applications de r??frig??ration industrielle et les patinoires de hockey en raison de sa haute l'efficacit?? ??nerg??tique et un faible co??t. Cependant, il souffre des inconv??nients de toxicit??, qui limitent son utilisation ?? l'??chelle nationale et petite. En plus de son utilisation dans moderne la r??frig??ration ?? compression de vapeur, il a ??t?? utilis?? en m??lange avec de l'hydrog??ne et de l'eau dans les r??frig??rateurs ?? absorption. Le Cycle de Kalina, qui est d'une importance croissante pour les centrales g??othermiques, d??pend de la plage d'??bullition large du m??lange ammoniac-eau.
Comme carburant


L'ammoniac a ??t?? utilis?? pendant la Seconde Guerre mondiale aux autobus ??lectriques en Belgique, et dans des applications de moteur et de l'??nergie solaire avant 1900. ammoniac liquide a ??galement aliment?? la R??action moteur-fus??e Motors XLR99, qui a aliment?? la X-15 avions de recherche hypersonique. Bien que pas aussi puissant que d'autres combustibles, il n'a laiss?? aucune suie dans le moteur-fus??e r??utilisable et sa densit?? correspond approximativement ?? la densit?? de l'oxydant, l'oxyg??ne liquide, qui a simplifi?? la conception de l'avion.
L'ammoniac a ??t?? propos??e comme une alternative pratique ?? combustible fossile pour moteurs ?? combustion interne. Le pouvoir calorifique de l'ammoniac est de 22,5 MJ / kg (9690 BTU / lb), ce qui est environ la moiti?? de celle du diesel. Dans un moteur normale, dans lequel la vapeur d'eau ne est pas condens??e, la valeur calorifique de l'ammoniac sera d'environ 21% inf??rieure ?? ce chiffre. Il peut ??tre utilis?? dans les moteurs existants, avec seulement des modifications mineures de carburateurs / injecteurs.
Pour r??pondre ?? ces exigences, un capital important serait n??cessaire pour augmenter les niveaux de production actuels. Bien que le deuxi??me produit chimique le plus, l'??chelle de production d'ammoniac est une petite fraction de la consommation de p??trole du monde. Il peut ??tre fabriqu?? ?? partir de sources d'??nergie renouvelables, ainsi que du charbon ou de l'??nergie nucl??aire. Il est, cependant, nettement moins efficaces que les batteries. Le barrage de 60 MW dans Rjukan Telemark, Norv??ge produit de l'ammoniac par ??lectrolyse de l'eau pour de nombreuses ann??es ?? partir de 1913 la production d'engrais pour une grande partie de l'Europe. Si produite ?? partir du charbon, du CO 2 peut ??tre facilement s??questr?? (les produits de combustion sont l'azote et de l'eau). En 1981, une entreprise canadienne a converti une Chevrolet Impala 1981 ?? fonctionner en utilisant l'ammoniac comme combustible.
moteurs d'ammoniac ou des moteurs d'ammoniac, en utilisant l'ammoniac comme fluide de travail, ont ??t?? propos??es et utilis??es occasionnellement. Le principe est similaire ?? celui utilis?? dans un locomotive sans feu, mais avec de l'ammoniac comme fluide de travail, plut??t que de la vapeur ou de l'air comprim??. moteurs d'ammoniac ont ??t?? utilis??s exp??rimentalement dans le 19??me si??cle par Goldsworthy Gurney au Royaume-Uni et tramways dans la Nouvelle-Orl??ans.
En tant que stimulant

L'ammoniac a trouv?? une utilisation importante dans divers sports - en particulier les sports de force de halt??rophilie et Halt??rophilie comme un stimulant respiratoire. L'ammoniac est couramment utilis?? dans la fabrication illicite de m??thamph??tamine ?? travers un R??duction de Birch, le proc??d?? de fabrication Birch m??thamph??tamine est dangereuse parce que le m??tal alcalin et l'ammoniac liquide sont tous deux extr??mement r??actif, et la temp??rature de l'ammoniac liquide rend sensibles ?? ??bullition explosive lorsque des r??actifs sont ajout??s.
Textile
Ammoniaque liquide est utilis?? pour le traitement de mat??riaux de coton, donnent une biens similaires mercerisage utilisant alcalis. En particulier, il est utilis?? pour le pr??lavage de la laine.
Gaz de levage
A temp??rature et pression normales, l'ammoniac est moins dense que l'atmosph??re, et a environ 60% de la puissance de levage de l'hydrog??ne ou de l'h??lium. L'ammoniac a parfois ??t?? utilis?? pour remplir des ballons m??t??orologiques comme un gaz de gonflage. En raison de son point d'??bullition relativement ??lev?? (par rapport ?? l'h??lium et de l'hydrog??ne), de l'ammoniaque pourrait ??tre r??frig??r?? et liqu??fi?? ?? bord d'un a??ronef pour r??duire la portance et ajouter ballast (et retourn?? ?? un gaz d'ajouter ascenseur et r??duire ballast).
Travail du bois
L'ammoniac a ??t?? utilis?? pour assombrir ch??ne blanc quartersawn dans Arts & Crafts et des meubles de style Mission. Les vapeurs d'ammoniac r??agissent avec les tanins naturels dans le bois et l'amener ?? changer les couleurs.
Consignes de s??curit??
Les ??.U S??curit?? et administration de la sant?? au travail (OSHA) a fix?? une limite d'exposition de 15 minutes pour l'ammoniac gazeux de 35 ppm en volume dans l'air ambiant et une limite d'exposition de 8 heures de 25 ppm en volume. NIOSH a r??cemment r??duit l'IDLH 500-300 bas??e sur des interpr??tations plus conservatrices r??cents de la recherche originale en 1943. DIVS (danger imm??diat pour la vie et la sant??) est le niveau auquel un travailleur en bonne sant?? peut ??tre expos?? pendant 30 minutes sans souffrir d'effets irr??versibles sur la sant??. D'autres organisations ont diff??rents niveaux d'exposition. Normes US Navy [US Bureau of Ships 1962] concentrations maximales admissibles (CMA): exposition continue (60 jours): 25 ppm / 1 heure: 400 vapeur ppm d'ammoniac a un irritant, odeur ??cre, piquante qui agit comme un avertissement de potentiellement dangereux exposition. Le seuil d'odeur moyenne est de 5 ppm, bien en dessous de tout danger ou de dommages. L'exposition ?? des concentrations tr??s ??lev??es d'ammoniac gazeux peut entra??ner des l??sions pulmonaires et la mort. Bien que l'ammoniac est r??glement??e dans les ??tats-Unis comme un gaz non inflammable, il r??pond toujours ?? la d??finition d'un mat??riau qui est toxique par inhalation et n??cessite un permis de s??curit?? dangereux lorsqu'il est transport?? en quantit??s sup??rieures ?? 13 248 L (3500 gallons).
Toxicit??
La toxicit?? des solutions d'ammoniac ne provoque g??n??ralement pas de probl??mes pour l'homme et d'autres mammif??res, comme il existe un m??canisme sp??cifique pour ??viter son accumulation dans le sang. L'ammoniac est converti en carbamoyl phosphate par l'enzyme carbamoyle synth??tase phosphate, puis p??n??tre dans la cycle de l'ur??e, soit d'??tre incorpor??s dans des acides amin??s ou excr??t??e dans l'urine. Cependant, les poissons et amphibiens manquent de ce m??canisme, car ils peuvent habituellement ??liminer l'ammoniac ?? partir de leur corps par l'excr??tion directe. Ammoniac m??me ?? des concentrations dilu??es est hautement toxique pour les animaux aquatiques, et pour cette raison il est class??es comme dangereuses pour l'environnement.
Stockage de l'information
Similaire ?? propane , l'ammoniac anhydre ??bullition inf??rieur ?? la temp??rature ambiante. Un r??cipient de stockage apte ?? 250 psi est adapt?? pour contenir le liquide. Les compos??s d'ammonium ne devraient jamais ??tre autoris??s ?? entrer en contact avec bases (moins que dans une r??action pr??vu et contenu), quantit??s dangereuses de gaz d'ammoniac pourraient ??tre lib??r??s.
l'utilisation des m??nages
Solutions d'ammoniac (5-10% en poids) sont utilis??s comme produits d'entretien m??nager, en particulier pour le verre. Ces solutions sont irritantes pour les yeux et muqueuses (respiratoires et digestives), et dans une moindre mesure la peau. La prudence devrait ??tre utilis?? que le produit chimique ne est jamais m??lang?? dans ne importe quelle eau de Javel liquide ou un gaz toxique peut entra??ner. Le m??lange avec du chlore produits -containing ou oxydants forts, tels que m??nage l'eau de Javel, peut conduire ?? des compos??s dangereux tels que chloramines.
l'utilisation en laboratoire de solutions d'ammoniac

Les risques de solutions d'ammoniac d??pend de la concentration: "diluer" des solutions d'ammoniac sont g??n??ralement de 5 ?? 10% en poids (<5,62 mol / L); Solutions ??concentr???? sont habituellement pr??par??s ??> 25% en poids. A 25% (en poids) de la solution a une densit?? de 0,907 g / cm 3, et une solution qui a une densit?? plus faible sera plus concentr??. Le Classement Union europ??enne de solutions d'ammoniac est donn??e dans le tableau.
| Concentration en poids (p / p) | Molarit?? | Concentration masse / volume (p / v) | Classification | Phrases R |
|---|---|---|---|---|
| 5-10% | 2,87 ?? 5,62 mol / L | De 48,9 ?? 95,7 g / L | Irritant (Xi) | R36 / 37/38 |
| 10 ?? 25% | 5,62 ?? 13,29 mol / L | De 95,7 ?? 226,3 g / L | Corrosif (C) | R34 |
| > 25% | > 13,29 mol / L | > 226,3 g / L | Corrosif (C) Dangereux pour l'environnement (N) | R34, R50 |
- S-Phrases: (S1 / 2), S16, S36 / 37/39, S45, S61.
La vapeur d'ammoniac ?? partir de solutions concentr??es d'ammoniac est s??v??rement irritante pour les yeux et les voies respiratoires, et ces solutions devraient uniquement ??tre manipul??s dans une hotte. Solutions satur??es ("0,880") peuvent d??velopper une pression importante ?? l'int??rieur d'une bouteille ferm??e par temps chaud, et la bouteille doit ??tre ouvert avec soin; ce ne est g??n??ralement pas un probl??me pour 25% des solutions ("0,900").
Les solutions d'ammoniac ne doivent pas ??tre m??lang??s avec les halog??nes , comme des produits toxiques et / ou explosives sont form??s. Un contact prolong?? de solutions d'ammoniac avec l'argent , le mercure ou sels d'iodure peuvent ??galement conduire ?? des produits explosifs: ces m??langes sont souvent form??s dans analyse qualitative inorganique, et devrait ??tre l??g??rement acidifi??e mais pas concentr?? (<6% p / v) avant leur ??limination une fois que le test est termin??.
utilisation en laboratoire de l'ammoniac anhydre (gaz ou liquide)
L'ammoniac anhydre est class?? comme toxique (T) et dangereux pour l'environnement (N). Le gaz est inflammable ( la temp??rature d'auto-inflammation: 651 ?? C) et peut former des m??langes explosifs avec l'air (16-25%). Le limite d'exposition admissible (PEL) aux ??tats-Unis est de 50 ppm (35 mg / m 3), tandis que le IDLH est estim?? ?? 300 ppm. L'exposition r??p??t??e ?? l'ammoniac diminue la sensibilit?? ?? l'odeur du gaz: normalement l'odeur est d??tectable ?? des concentrations inf??rieures ?? 50 ppm, mais les individus d??sensibilis??es peut pas le d??tecter, m??me ?? des concentrations de 100 ppm. L'ammoniac anhydre corrode le cuivre - et de zinc -d'une alliages, etc. des raccords en laiton ne doivent pas ??tre utilis??s pour le traitement du gaz. Ammoniac liquide peut aussi attaquer le caoutchouc et certains plastiques.
L'ammoniac r??agit violemment avec les halog??nes. Triiodure d'azote, un primaire explosif, est form?? lorsque l'ammoniac entre en contact avec de l'iode . L'ammoniac provoque l'explosif polym??risation de l'oxyde d'??thyl??ne. Il forme aussi explosive fulminante compos??s avec des compos??s de l'or , l'argent , le mercure , le germanium ou du tellure , et avec stibine. R??actions violentes ont ??galement ??t?? rapport??s avec l'ac??tald??hyde, solutions d'hypochlorite, ferricyanure de potassium et peroxydes.
Synthèse et production
En raison de ses nombreuses applications, l'ammoniac est l'un des produits chimiques inorganiques les plus hautement produites. Des dizaines d' usines chimiques dans le monde entier produire de l'ammoniac. Consommer plus de 1% de toute la puissance de l'homme, la production d'ammoniac est une composante importante du budget mondial de l'énergie. rapports de recherche de marché total de la production d'ammoniac en 2012 est de 198 millions de tonnes et devrait augmenter d'environ 35 millions de tonnes en 2019. La Chine a produit 28,4% de la production mondiale (de plus en plus à partir de charbon dans le cadre de l'urée de synthèse), suivie par l'Inde avec 8,6%, la Russie avec 8,4%, et le Royaume-Unis avec 8,2%. Environ 80% ou plus de l'ammoniac produit est utilisé pour la fertilisation de cultures agricoles.
Avant le début de la Première Guerre mondiale , la plupart de l'ammoniac a été obtenue par la distillation sèche de produits végétaux et de déchets d'origine animale azotés, y compris chameau bouse, où il a été distillé par la réduction de l'acide nitreux et des nitrites avec de l'hydrogène; en outre, il a été produit par la distillation du charbon , et aussi par la décomposition des sels d'ammonium par des hydroxydes alcalins tels que la chaux vive, le sel le plus généralement utilisé est le chlorure ( sel ammoniac) ainsi:
- NH 24Cl + CaCl 2 ??? CaO2+ Ca (OH)22 + NH3
L'hydrogène pour la synthèse de l'ammoniac peut également être produit de façon économique à l'aide de la réaction de gaz à l'eau suivie de la réaction de déplacement du gaz à l'eau, produit en faisant passer la vapeur à travers au rouge coke, pour donner un mélange de gaz d'hydrogène et de dioxyde de carbone, suivie de l'élimination du carbone dioxyde "lavage", le mélange de gaz avec de l'eau sous pression (25 atmosphères standard (2500 kPa)); ou en utilisant d'autres sources comme le charbon ou la gazéification du coke.
Usines d'ammoniac production modernes dépendent industriel de production d'hydrogène pour la réaction avec de l'azote atmosphérique en utilisant une magnétite catalyseur ou sur un catalyseur Fe promu sous haute pression (100 atmosphères normales (10 000 kPa)) et la température (450 ° C) pour former de l'ammoniac liquide anhydre. Cette étape est connue comme la boucle de synthèse d'ammoniac (également dénommé procédé Haber-Bosch):
- H 32N +2??? NH 23
L'hydrogène nécessaire à la synthèse de l'ammoniac peut aussi être produit en utilisant économiquement d'autres sources comme le charbon ou la gazéification du coke ou moins économiquement de l'électrolyse de l'eau en oxygène + hydrogène et d'autres solutions de rechange qui sont actuellement peu pratique à grande échelle. À une certaine époque, la plupart des ammoniaque de l'Europe a été produite à partir de l'usine Hydro au Vemork, par voie d'électrolyse. Diverses sources d'électricité renouvelables d'énergie sont aussi potentiellement applicable.
L'ammoniac liquide en tant que solvant
L'ammoniaque liquide est le solvant ionisant non aqueux plus connu et le plus largement étudié. Sa propriété la plus remarquable est sa capacité à dissoudre les métaux alcalins pour former des solutions très colorées, conductrices de l'électricité contenant électrons solvatés. En dehors de ces solutions remarquables, une grande partie de la composition chimique dans l'ammoniac liquide peuvent être classées par analogie avec des réactions apparentées dans des solutions aqueuses. Comparaison des propriétés physiques de NH 3 avec celles de l'eau montre NH 3 a le point de fusion inférieur, point d'ébullition, la densité, la viscosité, la constante diélectrique et la conductivité électrique; cela est dû au moins en partie à la plus faible en liaison H NH 3 et parce qu'une telle liaison ne peut pas former des réseaux réticulés, NH puisque chaque 3 molécule ne dispose que d'une seule paire d'électrons par rapport aux deux H pour chaque 2 molécule d'O. L'auto-ionique constante de dissociation de NH liquide 3 à -50 ° C est d'environ 10 -33 mol 2 · l -2 .
Solubilité des sels
| Solubilité (g de sel par 100 g de liquide NH3) | |
|---|---|
| L'acétate d'ammonium | 253,2 |
| Le nitrate d'ammonium | 389,6 |
| nitrate de lithium | 243,7 |
| Le nitrate de sodium | 97,6 |
| Le nitrate de potassium | 10,4 |
| Le fluorure de sodium | 0,35 |
| Le chlorure de sodium | 157,0 |
| bromure de sodium | 138,0 |
| L'iodure de sodium | 161,9 |
| thiocyanate de sodium | 205,5 |
L'ammoniaque liquide est un solvant ionisant, mais moins que l'eau, et se dissout une gamme de composés ioniques, y compris de nombreux nitrates , nitrites, cyanures et thiocyanates. La plupart des sels d'ammonium sont solubles et agissent comme des acides dans des solutions d'ammoniac liquide. La solubilité des sels d'halogénure augmente à partir de fluorure de iodure. Une solution saturée de nitrate d'ammonium contient soluté 0,83 mole par mole d'ammoniac et a une pression de vapeur inférieure à 1 bar, même à 25 ° C (77 ° F) .
Solutions de métaux
L'ammoniac liquide va se dissoudre les métaux alcalins et les autres métaux électropositifs tels que magnésium , calcium , strontium , baryum , l'europium et l'ytterbium . A de faibles concentrations (<0,06 mol / l), les solutions sont formés d'un bleu profond: ceux-ci contiennent des cations métalliques et des électrons solvatés électrons libres, qui sont entourés par une cage de molécules d'ammoniac.
Ces solutions sont très utiles comme agents réducteurs forts. A des concentrations plus élevées, les solutions sont d'aspect métallique et la conductivité électrique. A basse température, les deux types de solutions peuvent coexister comme phases non miscibles.
Propriétés redox de l'ammoniac liquide
| E° (V, ammoniac) | E° (V, de l'eau) | |
|---|---|---|
| Li++ e- ???Li | -2,24 | -3.04 |
| K++ e- ???K | -1.98 | -2.93 |
| Na++ e- ???Na | -1.85 | -2,71 |
| Zn2++ 2e- ???Zn | -0.53 | -0.76 |
| NH4 ++ e- ???½ H2+ NH3 | 0,00 | - |
| Cu2++ 2e- ???Cu | 0,43 | 0,34 |
| Ag++ e- ???Ag | 0,83 | 0,80 |
La gamme de stabilité thermodynamique des solutions d'ammoniac liquide est très étroite, que le potentiel d'oxydation de diazote, E ° (N 2 + 6NH 4 + + 6e - ??? 8NH 3 ), est seulement 0,04 V. Dans la pratique, à la fois à l'oxydation de diazote et de la réduction de dihydrogène sont lents. Ceci est particulièrement vrai pour réduire solutions: les solutions de métaux alcalins mentionnés ci-dessus sont stables pendant plusieurs jours, à décomposer lentement à la amide de métal et le dihydrogénophosphate. La plupart des études portant sur ??????des solutions d'ammoniac liquide sont effectués dans des conditions réductrices; Bien que l'oxydation de l'ammoniac liquide est généralement lente, il ya toujours un risque d'explosion, en particulier si des ions de métaux de transition sont présents en tant que catalyseurs possibles.
Le rôle de l'ammoniac dans les systèmes biologiques et les maladies humaines
L'ammoniac est une importante source d'azote pour les systèmes vivants. Bien que l'azote atmosphérique abonde (plus de 75%), quelques créatures vivantes sont capables d'utiliser cet azote. L'azote est nécessaire pour la synthèse d'acides aminés, qui sont les éléments constitutifs des protéines . Certaines plantes comptent sur ??????l'ammoniac et d'autres déchets azotés incorporés dans le sol par décomposition de la matière. D'autres, comme la fixation de l'azote des légumineuses, de bénéficier de relations symbiotiques avec les rhizobiums qui créent ammoniac à partir de l'azote atmosphérique.
Biosynth??se
Dans certains organismes, l'ammoniac est produit à partir de l'azote atmosphérique par des enzymes appelées nitrogénases. L'ensemble du processus est appelé fixation de l'azote . Bien qu'il soit peu probable que les méthodes biomimétiques qui sont compétitifs avec le procédé Haber seront développés, effort intense a été dirigée vers la compréhension du mécanisme de la fixation biologique de l'azote. L'intérêt scientifique de ce problème est motivé par la structure inhabituelle du site actif de l'enzyme, qui est constitué d'un alliage Fe 7 MoS 9 ensemble.
L'ammoniac est également un produit métabolique de l'acide aminé désamination catalysée par des enzymes telles que la glutamate déshydrogénase 1. L'ammoniac est commun excrétion chez les animaux aquatiques. Chez l'homme, il est rapidement converti en urée , qui est beaucoup moins toxique, en particulier moins de base . Cette urée est un composant majeur du poids sec de l'urine. La plupart des reptiles, oiseaux, insectes, escargots et excrètent de l'acide urique uniquement comme déchets azotés.
En physiologie
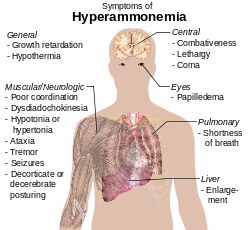
Ammoniac joue également un rôle à la fois animal normal et anormal physiologie. Il est biosynthétisé par le métabolisme d'acides aminés normale et est toxique à des concentrations élevées. Le foie convertit l'ammoniac en urée à travers une série de réactions connues comme le cycle de l'ur??e. dysfonctionnement du foie, telles que celle observée dans la cirrhose, peut conduire à des quantités élevées d'ammoniac dans le sang ( de Hyperammonemia ). De même, des défauts dans les enzymes responsables de cycle de l'urée, tels que l'ornithine transcarbamylase, conduisent à une hyperammoniémie. Hyperammoniémie contribue à la confusion et le coma de l'encéphalopathie hépatique, ainsi que la maladie neurologique fréquente chez les personnes présentant des défauts de cycle de l'urée et aciduries organiques.
L'ammoniac est important pour l'équilibre acide animaux / de base normale. Après formation de l'ammonium à partir de la glutamine, la ??-cétoglutarate peut être dégradé pour produire deux molécules de bicarbonate, qui sont alors disponibles sous forme de tampons pour les acides alimentaires. Ammonium est excrété dans l'urine, résultant en une perte nette d'acide. L'ammoniac peut se diffuser à travers les tubules rénaux, combiner avec un ion d'hydrogène, et permettre ainsi de plus l'excrétion d'acide.
Excrétion
Les ions ammonium sont un produit de déchets toxiques du métabolisme dans les animaux . Chez les poissons et les invertébrés aquatiques, il est excrété directement dans l'eau. Chez les mammifères, les amphibiens et les requins, il est converti dans le cycle de l'urée à l'urée , car il est moins toxique et peut être stocké de manière plus efficace. Chez les oiseaux, les reptiles, et les escargots terrestres, ammonium métabolique est converti en acide urique, qui est solide, et peut donc être excrété avec la perte d'eau minimale.
En astronomie
L'ammoniac a été détecté dans les atmosphères des géantes gazeuses , y compris les planètes Jupiter , ainsi que d'autres gaz comme le méthane, l'hydrogène et l'hélium . L'intérieur de Saturne peut inclure des cristaux congelés d'ammoniac. Il se trouve naturellement sur ??????Deimos et Phobos - les deux lunes de Mars.
L'espace interstellaire
L'ammoniac a été détecté pour la première dans l'espace interstellaire en 1968, basée sur les émissions de micro-ondes de la direction du noyau galactique . Ce fut la première molécule polyatomique d'être ainsi détectée. La sensibilité de la molécule à un large éventail d'excitations et de la facilité avec laquelle il peut être observé dans un certain nombre de régions a fait l'ammoniac une des molécules les plus importantes pour les études de nuages ??????moléculaires. L'intensité relative des raies d'ammoniac peut être utilisée pour mesurer la température du milieu électroluminescent.
L'espèce isotopique suivante de l'ammoniac ont été détectés:
- NH3,15NH3, NH2 D, NHD2, et ND3
La détection de triplement gaz ammoniac deutéré a été considérée comme une surprise que le deutérium est relativement rare. On pense que les conditions de basses températures permettent cette molécule de survivre et d'accumuler.
Depuis sa découverte interstellaire, NH 3 a prouvé être un outil précieux spectroscopique dans l'étude du milieu interstellaire. Avec un grand nombre de transitions sensibles à un large éventail de conditions d'excitation, NH 3 a été largement astronomique détecté - sa détection a été rapporté dans des centaines d'articles de journaux. Ci-dessous est un échantillon d'articles de revues qui met en évidence la gamme de détecteurs qui ont été utilisés pour identifier l'ammoniac.
L'étude de l'ammoniac interstellaire a été important pour un certain nombre de domaines de la recherche au cours des dernières décennies. Certains d'entre eux sont délimitées ci-dessous et impliquent principalement en utilisant l'ammoniac comme un thermomètre interstellaire.
Les mécanismes de formation interstellaires
L'abondance interstellaire pour l'ammoniac a été mesurée pour une variété d'environnements. Le [NH 3 ] / [H 2 rapport] a été estimé entre 10 -7 dans les petits nuages ??????sombres jusqu'à 10 -5 dans le noyau dense du complexe moléculaire d'Orion Cloud. Bien qu'un total de 18 routes de production totaux ont été proposées, le mécanisme de formation principal interstellaire NH 3 est la réaction:
- NH4 ++ e-??? NH3+ H ·
La constante de vitesse, k , de cette réaction dépend de la température de l'environnement, avec une valeur de 5,2 x 10 -6 à 10 K. La constante de vitesse a été calculée à partir de la formule k = a (T / 300) B . Pour la réaction de formation primaire, un = 1,05 × 10 -6 et B = -0,47. En supposant un NH 4 + abondance de 3 × 10 -7 et une abondance d'électrons de 10 -7 typique des nuages ??????moléculaires, la formation se fera à un taux de 1,6 × 10 -9 cm -3 s -1 dans un nuage moléculaire de densité totale 10 5 cm -3 .
Tous les autres réactions de formation proposées ont des constantes de vitesse comprise entre 2 et 13 ordres de grandeur plus petite, ce qui rend leur contribution à l'abondance de l'ammoniac relativement insignifiante. Comme un exemple de la contribution mineure réactions autre de formation jouent, la réaction:
- H2+ NH2??? NH3+ H
présente une constante de vitesse de 2,2 x 10 -15 . En supposant que H 2 densités de 10 5 et NH 2 / H 2 ratio de 10 -7 , cette réaction procède à un taux de 2,2 × 10 -12 , plus de 3 ordres de grandeur plus lente que la réaction primaire ci-dessus.
Parmi les autres réactions de formation possibles sont:
- H-+ NH4 +??? NH3+ H2
- PNH3 ++ e-??? P + NH3
Mécanismes de destruction interstellaires
Il ya au total 113 réactions proposés menant à la destruction de NH 3 . Parmi ceux-ci, 39 ont été compilés dans de vastes tables de la chimie entre les composés C, N et O. Un examen de l'ammoniac interstellaire cite les réactions suivantes que les mécanismes de dissociation principaux:
- (1) NH3+ H3 +??? NH4 ++ H2
- (2) NH3HCO ++??? NH4 ++ CO
avec des constantes de vitesse de 4,39 x 10 -9 et 2,2 x 10 -9 , respectivement. Les équations ci-dessus (1,2) tournent à une vitesse de 8,8 x 10 -9 et 4,4 x 10 -13 , respectivement. Ces calculs ont assumé les constantes et l'abondance de [NH taux donné 3 ] / [H 2 ] = 10 -5 , [H 3 + ] / [H 2 ] = 2 × 10 -5 , [HCO + ] / [H 2 ] = 2 × 10 -9 , et les densités totales de n = 10 5 , typique de froid, les nuages ??????moléculaires denses,. De toute évidence, entre ces deux réactions primaires, l'équation (1) est la réaction de destruction dominante, avec un taux ~ 10.000 fois plus rapide que l'équation (2). Cela est dû à l'abondance relativement élevée de H 3 + .
Antenne simples détections
observations radio de NH 3 du radiotélescope Effelsberg 100 m révèlent que la ligne de l'ammoniac est séparé en deux composantes - une arête de fond et une âme en suspens. L'arrière-plan correspond bien avec les emplacements précédemment détectés CO. Le 25 m Chilbolton télescope en Angleterre détecté signatures de radio d'ammoniac dans les régions H II , HNH 2 O masers, objets HH, et autres objets associés à la formation des étoiles. Une comparaison des largeurs de ligne d'émission indique que les vitesses turbulentes ou systématiques ne pas augmenter dans les noyaux centraux des nuages ??????moléculaires.
Rayonnement micro-ondes à partir d'ammoniac a été observée dans plusieurs objets galactiques dont W3 (OH), Orion A, W43, W51, et cinq sources dans le centre galactique. Le taux de détection élevé indique que ceci est une molécule commune dans le milieu interstellaire et que les régions à haute densité sont communes dans la galaxie.
Études interférométriques
Observations VLA de NH 3 dans sept régions avec haute vitesse sorties gazeux révélé condensations de moins de 0,1 pc en L1551, S140, et Céphée A. Trois condensations individuelles ont été détectés dans Céphée A, l'un d'eux avec une forme très allongée. Elles peuvent jouer un rôle important dans la création de la sortie bipolaire dans la région.
Ammoniac extragalactique a été imagée en utilisant le VLA dans IC 342. Le gaz chaud a des températures supérieures à 70 K, qui a été déduit de rapports de raies d'ammoniac et semble être étroitement associé avec les parties les plus intimes de la barre nucléaire vu dans CO. NH 3 a également été surveillés par VLA vers un échantillon de quatre ultracompact galactique régions HII: G9.62 + 0,19, + 0,03 G10.47, G29.96-0.02 et G31.41 + 0,31. Sur la base de température et de densité de diagnostic, il est conclu que dans ces touffes générales sont susceptibles d'être les sites de formation d'étoiles massives dans une phase d'évolution précoce avant le développement d'une région HII ultracompact.
Détections infrarouges
Absorption à 2,97 micromètres dues à l'ammoniac solide a été enregistrée à partir de grains interstellaires dans l' objet Becklin-Neugebauer et probablement aussi bien dans NGC 2264-IR. Cette détection a aidé à expliquer la forme physique des raies d'absorption de glace précédemment mal compris et les domaines connexes.
Un spectre du disque de Jupiter a été obtenu à partir de l' Observatoire Airborne Kuiper, couvrant 100 à 300 cm -1 gamme spectrale. L'analyse du spectre fournit des informations sur les propriétés moyennes mondiales de gaz d'ammoniac et une brume de glace d'ammoniac.
Un total de 149 postes de nuages ??????sombres ont été interrogés des preuves de «noyaux denses» en utilisant le (J, K) = (1,1) tournant ligne d'inversion de NH 3 . En général, les noyaux ne sont pas de forme sphérique, avec des rapports d'aspect allant de 1,1 à 4,4. Il est également constaté que les noyaux avec des étoiles ont des lignes plus larges que noyaux sans étoiles.
L'ammoniac a été détectée dans la nébuleuse de Draco et dans un ou éventuellement deux nuages ??????moléculaires, qui sont associés à la haute latitude galactique cirrus infrarouge. La conclusion est importante car ils peuvent représenter les berceaux pour les étoiles de type B de métallicité Population I dans le halo galactique qui auraient pu être supportés dans le disque galactique.
Observations de nuages ??????sombres à proximité
En équilibrant l'émission stimulée et à émission spontanée, il est possible de construire une relation entre la température et la densité d'excitation. En outre, puisque les niveaux d'ammoniac transitoires peuvent être estimés par un système à 2 niveaux à basse température, ce calcul est assez simple. Cette prémisse peut être appliqué à de sombres nuages, régions soupçonnées d'avoir des températures extrêmement basses et des sites possibles pour la future formation d'étoiles. Détections d'ammoniac dans les nuages ??????sombres montrent des lignes-indicatifs très étroites non seulement des basses températures, mais aussi d'un niveau de turbulence intérieure nuage bas. calcul des ratios de ligne fournissent une mesure de la température de trouble qui est indépendant du CO observations précédentes. Les observations d'ammoniac étaient conformes aux mesures de CO de températures de rotation de ~ 10 K. Avec cela, les densités peuvent être déterminées, et ont été calculées à varier entre 10 4 et 10 5 cm -3 dans les nuages ??????sombres. Cartographie des NH 3 donne nuages ??????tailles typiques de 0,1 pc et les masses près de 1 masse solaire. Ces froides, des noyaux denses sont les sites de la future formation d'étoiles.
Régions HII UC
Régions ultra-compact HII sont parmi les meilleurs marqueurs de la formation des étoiles de masse élevée. Le matériau dense environnante régions UCHII est susceptible principalement moléculaire. Depuis une étude complète de la formation d'étoiles massives implique nécessairement le nuage d'où l'étoile formée, l'ammoniac est un outil précieux dans la compréhension de ce matériau moléculaire environnant. Étant donné que ce matériau macromoléculaire peut être résolue spatialement, il est possible de contraindre le chauffage / sources, les températures, les masses et les dimensions des régions ionisants. Composantes de vitesse à décalage Doppler permettent la séparation des régions distinctes du gaz moléculaire qui peuvent tracer des sorties et des noyaux chauds provenant d'étoiles de formage.
Détection extragalactique
L'ammoniac a été détecté dans les galaxies extérieures, et en mesurant simultanément plusieurs lignes, il est possible de mesurer directement la température du gaz dans ces galaxies. ratios de ligne impliquent que les températures de gaz sont chauds (~ 50 K), en provenance de nuages ??????denses avec des tailles de dizaines de pc. Cette image est compatible avec l'image au sein de notre Voie Lactée galaxie chaude dense sous forme de noyaux moléculaires autour nouvellement formé étoiles embarqués dans les grandes nuées du matériau moléculaire à l'échelle de plusieurs centaines de pc (nuages ??????moléculaires géants; CMG).