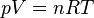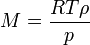Masse molaire
?? propos de ce ??coles s??lection Wikipedia
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. SOS Enfants a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
Masse molaire, symbole M, est la masse d'un en moles d'une substance ( de l'??l??ment chimique ou un compos?? chimique ). C'est un propri??t?? physique qui est caract??ristique de chaque substance pure. La base Unit?? SI de masse est le kg , mais, pour des raisons pratiques et historiques, les masses molaires sont presque toujours indiqu??s en grammes par mole (g / mol ou g mol -1), en particulier dans la chimie .
Masse molaire est ??troitement li??e au poids de formule (FW) ou un parent masse molaire (M r) d'un compos??, et ?? la masses atomiques relatives ou la poids atomiques standard de ses ??l??ments constitutifs. Cependant, il doit ??tre distingu?? de la masse mol??culaire , qui est la masse d'une mol??cule (de ne importe quelle composition isotopique unique) et ne est pas directement li??e ?? la masse atomique, la masse d'un atome (isotope de toute seule). Le daltons, symbole Da, est ??galement parfois utilis??e comme unit?? de masse molaire, en particulier dans la biochimie , de la d??finition 1 Da = 1 g / mole, en d??pit du fait qu'il est strictement une unit?? de masse mol??culaire (Da = 1 1,660 538 782 (83) ?? 10 -27 kg).
Masses molaires ne sont presque jamais mesur??es directement. Ils peuvent ??tre calcul??es ?? partir de poids atomiques standard et sont souvent inscrites dans les catalogues chimiques et sur fiches de donn??es de s??curit?? (FDS). Masses molaires varient typiquement entre:
- 1 ?? 238 g / mol pour des atomes d'??l??ments d'origine naturelle;
- 10-1000 g / mol pour les compos??s chimiques simples;
- 1000-5,000,000 g / mol pour des polym??res, des prot??ines , ADN , fragments, etc.
Masses molaires des ??l??ments
La masse molaire des atomes d'un ??l??ment est donn??e par la poids atomique niveau de l'??l??ment multipli?? par le constante masse molaire, M u = 1 ?? 10 -3 kg / mol = 1 g / mol:
- M (H) = 1,007 97 (7) 1 ?? g / mol = 1,007 94 (7) g / mol
- M (S) = 32,065 (5) ?? 1 g / mol = 32,065 (5) g / mol
- M (Cl) = 35,453 (2) x 1 g / mol = 35,453 (2) g / mol
- M (Fe) = 55,845 (2) x 1 g / mol = 55,854 (2) g / mol
En multipliant par la constante masse molaire assure que le calcul est dimensions correctes: poids atomiques sont des grandeurs sans dimension (ce est ?? dire, des chiffres purs), tandis que des masses molaires ont des unit??s (dans ce cas, g / mol).
Certains ??l??ments sont habituellement rencontr??s en tant que mol??cules , par exemple un atome d'hydrog??ne (H 2), soufre (S 8), chlore (Cl 2). La masse molaire des mol??cules de ces ??l??ments est la masse molaire des atomes multipli?? par le nombre d'atomes dans chaque mol??cule:
- M (H 2) = 1,007 ?? 97 2 (7) 1 ?? g / mol = 2,015 88 (14) g / mol
- M (S 8) = 32,065 x 8 (5) ?? 1 g / mol = 256,52 (4) g / mol
- M (Cl 2) = 2 ?? 35,453 (2) x 1 g / mol = 70,906 (4) g / mol
Masses molaires des compos??s
La masse molaire d'un compos?? est donn??e par la somme de la poids atomiques standard des atomes qui forment le compos?? multipli?? par le constante masse molaire, M u:
- M (NaCl) = [769 22,989 28 (2) + 35,453 (2)] ?? 1 g / mol = 58,443 (2) g / mol
- M (C 12 H 22 O 11) = ([12 ?? 12,0107 (8)] + [1,007 ?? 22 94 (7)] + [x 15,9994 11 (3)]) x 1 g / mol = 486,424 (10) g / mol
Une masse molaire moyenne peut ??tre d??finie pour les m??langes de compos??s. Ceci est particuli??rement important dans la science des polym??res, o?? les mol??cules de polym??re peuvent contenir diff??rents nombres diff??rents de des unit??s monom??res (polym??res non uniformes).
Propri??t??s connexes
Poids mol??culaire (MW) et le poids de formule (FW) sont des termes plus ??g??s pour ce qui est maintenant plus correctement appel?? le rapport masse molaire (M r). C'est un quantit?? sans dimension (?? savoir, un nombre pur, sans unit??s) ??gale ?? la masse molaire divis??e par le constante masse molaire.
Masse mol??culaire
La masse mol??culaire (m) est la masse d'une mol??cule donn??e: il est mesur?? ?? daltons (Da) ou unit??s de masse atomique (u), o?? 1 = 1 u Da = 1,660 538 782 (83) ?? 10 -27 kg). Les diff??rentes mol??cules du m??me compos?? peuvent avoir des masses mol??culaires diff??rentes, car ils contiennent des isotopes d'un ??l??ment. La masse molaire est une mesure de la masse mol??culaire moyenne de toutes les mol??cules dans un ??chantillon, et est habituellement la mesure plus appropri??e lorsqu'il se agit de quantit??s macroscopiques (pesables) d'une substance.
Les masses mol??culaires sont calcul??es ?? partir de la masses atomiques relatives de chaque nucl??ide, tandis que les masses molaires sont calcul??es ?? partir de la poids atomiques de chaque ??l??ment . Le poids atomique tient compte de la r??partition isotopique de l'??l??ment dans un ??chantillon donn?? (g??n??ralement suppos??e ??tre "normal"). Par exemple, l'eau a une masse molaire de 18,0153 (3) g / mol, mais les mol??cules d'eau individuels ont des masses mol??culaires comprises entre 18,010 564 6,863 (15) u (1 H 2 16 O) et 22,027 7,364 (9) u (2 18 H 2 O).
La distinction entre la masse molaire et la masse mol??culaire est important parce que les masses mol??culaires relatives peuvent ??tre mesur??s directement par spectrom??trie de masse , souvent ?? une pr??cision de quelques parties par million. Ce est suffisamment pr??cis pour d??terminer directement la formule chimique d'une mol??cule.
Pr??cision et incertitudes
La pr??cision d'une masse molaire qui est connu d??pend de la pr??cision de la poids atomiques ?? partir de laquelle il a ??t?? calcul??. La plupart des poids atomiques sont connues avec une pr??cision d'au moins une partie ?? dix-mille, souvent bien meilleure (le poids atomique du lithium est un notable, et grave, exception). Ce est suffisant pour pratiquement toutes les utilisations normales de la chimie: il est plus pr??cis que la plupart des analyses chimiques , et d??passe la puret?? de la plupart des r??actifs de laboratoire.
La pr??cision de Atomics poids, et donc des masses molaires, est limit??e par la connaissance de la r??partition isotopique de l'??l??ment. Si une valeur plus pr??cise de la masse molaire est requise, il est n??cessaire de d??terminer la distribution isotopique de l'??chantillon en question, qui peut ??tre diff??rente de la distribution standard utilis??e pour calculer le poids atomique standard. Les distributions isotopiques des diff??rents ??l??ments dans un ??chantillon ne sont pas n??cessairement ind??pendantes l'une de l'autre: par exemple, un ??chantillon qui a ??t?? distill??e sera enrichi dans le briquet isotopes de tous les ??l??ments pr??sents. Cela complique le calcul de la incertitude type de la masse molaire.
Une convention utile pour les travaux de laboratoire normale est de citer des masses molaires ?? deux d??cimales pour tous les calculs. Ce est plus pr??cise que ce qui est habituellement exig??, mais ??vite erreurs d'arrondi lors des calculs. Lorsque la masse molaire est sup??rieure ?? 1000 g / mol, il est rarement appropri?? d'utiliser plus d'une d??cimale. Ces conventions sont respect??es dans les valeurs les plus sous forme de tableaux de masses molaires.
Mesures
Bien que les masses molaires sont presque toujours, en pratique, calcul??e ?? partir des poids atomiques, ils peuvent aussi ??tre mesur??es dans certains cas. Ces mesures sont beaucoup moins pr??cis que modernes spectrom??trie de masse mesures de poids atomiques et des masses mol??culaires, et sont d'un int??r??t essentiellement historique. Toutes les proc??dures se appuient sur propri??t??s colligatives et toute dissociation du compos?? doit ??tre prise en compte.
Densit?? de vapeur
La mesure de la masse molaire par la densit?? de vapeur repose sur le principe, d'abord par ??non??a Amadeo Avogadro, que des volumes ??gaux de gaz dans des conditions identiques contiennent un nombre ??gal de particules. Ce principe est inclus dans le l'??quation des gaz parfaits:
o?? n est le quantit?? de substance. La densit?? de la vapeur (ρ) est donn??e par
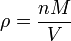 .
.
La combinaison de ces deux ??quations donne une expression de la masse molaire en termes de la densit?? de vapeur pour des conditions de connue la pression et la temp??rature .
Cryoscopie
Le point de cong??lation d'une solution est inf??rieur ?? celui de la pur solvant , et la d??pression du point de cong??lation (T Δ) est directement proportionnelle ?? la concentration de quantit?? pour les solutions dilu??es. Lorsque la concentration en teneur est exprim??e en tant que molalit??, la constante de proportionnalit?? est connu comme le constante cryoscopique (K f) et est caract??ristique pour chaque solvant. Si w repr??sente le fraction massique du solut?? dans la solution, et en l'absence de dissociation du solut??, la masse molaire est donn??e par
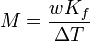 .
.
Point d'??bullition ??l??vation
Le point d'??bullition d'une solution non volatile d'un solut?? est sup??rieur ?? celui de la pur solvant , et l'??l??vation de point d'??bullition (Δ T) est directement proportionnelle ?? la concentration de quantit?? pour les solutions dilu??es. Lorsque la concentration en teneur est exprim??e en tant que molalit??, la constante de proportionnalit?? est connu comme le ??bullioscopique constante (K b) et est caract??ristique de chaque solvant. Si w repr??sente le fraction massique du solut?? dans la solution, et en l'absence de dissociation du solut??, la masse molaire est donn??e par
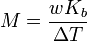 .
.