Biochimie
?? propos de ce ??coles s??lection Wikipedia
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
Biochimie (du grec : βίος, bios, ??vie?? et Keme ??gyptienne, ??Terre??) est l'??tude des produits chimiques dans les processus vivant organismes . Il traite de la la structure et la fonction des composants cellulaires, tels que les prot??ines , les glucides , les lipides , des acides nucl??iques, et autres biomol??cules. La biologie chimique vise ?? r??pondre ?? plusieurs questions d??coulant de la biochimie en utilisant des outils d??velopp??s au sein synth??se chimique.
Bien qu'il existe un grand nombre de diff??rentes biomol??cules, beaucoup sont des mol??cules complexes et de grande taille (appel??s polym??res) qui sont compos??s de sous-unit??s r??p??titives similaires (appel??s monom??res). Chaque classe de biomol??cules polym??re poss??de un ensemble diff??rent de types de sous-unit??s. Par exemple, une prot??ine est un polym??re constitu?? de 20 ou plus acides amin??s . Biochimie ??tudie les propri??t??s chimiques des mol??cules biologiques importantes, telles que des prot??ines, en particulier la chimie de enzyme catalyse les r??actions .
La biochimie de la cellule et le m??tabolisme syst??me endocrinien a ??t?? largement d??crite. Autres domaines de la biochimie incluent le code g??n??tique ( ADN , ARN), la synth??se des prot??ines, membrane cellulaire transports , et la transduction de signal.
Cet article ne traite que de la biochimie terrestre ( de carbone - et l'eau ?? base de), que toutes les formes de vie que nous connaissons sont sur la Terre . Depuis formes de vie en vie aujourd'hui sont ??mis l'hypoth??se par la plupart ont descendu de la m??me anc??tre commun, ils ont biochemistries similaires, m??me pour les questions qui semblent ??tre essentiellement arbitraire, comme chiralit?? de diverses biomol??cules. On ignore si biochemistries alternatives sont possibles ou pratique.
Histoire

?? l'origine, on croyait g??n??ralement que la vie ne ??tait pas soumis aux lois de la science de la fa??on dont les non-vie ??tait. On pensait que les ??tres vivants ne pouvaient produire les mol??cules de la vie (d'autres biomol??cules, qui existaient auparavant). Puis, en 1828, Friedrich W??hler a publi?? un document sur la synth??se de l'ur??e , ce qui prouve que organiques compos??s peuvent ??tre cr????s artificiellement.
L'aube de la biochimie a peut-??tre ??t?? la d??couverte de la premi??re enzyme, diastase (appel?? aujourd'hui amylase), en 1833 par Anselme Payen. Eduard Buchner contribu?? la premi??re d??monstration d'un processus biochimique complexe ext??rieur d'une cellule en 1896: fermentation alcoolique dans des extraits de cellules de levure. Bien que le terme "biochimie" semble avoir ??t?? utilis?? pour la premi??re en 1882, il est g??n??ralement admis que la monnaie officielle de la biochimie se est produite en 1903 par Carl Neuberg, un Allemand chimiste. Auparavant, cette zone aurait ??t?? d??nomm?? chimie physiologique . Depuis lors, la biochimie a progress??, en particulier depuis le milieu du 20??me si??cle, avec le d??veloppement de nouvelles techniques telles que la Chromatographie , Diffraction des rayons X, Spectroscopie RMN, ??tiquetage radio-isotopique, La microscopie ??lectronique et simulations de dynamique mol??culaire. Ces techniques ont permis la d??couverte et l'analyse d??taill??e de nombreuses mol??cules et voies m??taboliques de la cellule , tels que et la glycolyse Cycle de Krebs (cycle de l'acide citrique).
Un autre ??v??nement historique important dans la biochimie est la d??couverte de la g??ne et son r??le dans le transfert d'information dans la cellule. Cette partie de la biochimie est souvent appel?? biologie mol??culaire. Dans les ann??es 1950, James D. Watson , Francis Crick , Rosalind Franklin, et Maurice Wilkins ont jou?? un r??le dans la r??solution de la structure de l'ADN et sugg??rant sa relation avec transfert g??n??tique de l'information. En 1958, George Beadle et Edward Tatum a re??u le prix Nobel pour le travail dans les champignons montrant qu'un g??ne produit une enzyme. En 1988, Colin Pitchfork a ??t?? la premi??re personne reconnue coupable d'assassiner avec l'ADN des preuves, ce qui a conduit ?? la croissance des science m??dico-l??gale. Plus r??cemment, Andrew Z. Fire et Craig C. Mello a re??u le prix Nobel 2006 pour d??couvrir le r??le de l'interf??rence ARN ( ARNi), dans le silen??age de l'expression g??nique.
Aujourd'hui, il existe trois principaux types de biochimie ??tablis par Michael E. sucre. la biochimie des plantes implique l'??tude de la biochimie des organismes autotrophes tels que la photosynth??se et d'autres plantes sp??cifiques biochimiques processus. Biochimie g??n??rale englobe ?? la fois v??g??tale et animale biochimie. Biochimie m??dicale / m??dicament / humain se concentre sur la biochimie des humains et des maladies m??dicales.
Glucides
La fonction de glucides comprend le stockage d'??nergie et fournissant une structure. sucres sont les glucides, mais pas tous les glucides sont les sucres. Il ya plus de glucides sur Terre que tout autre type connu de biomol??cules.
Monosaccharides
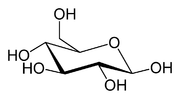
Le type le plus simple de glucides est un monosaccharide, parmi d'autres propri??t??s qui contient du carbone, de l'hydrog??ne et de l'oxyg??ne , essentiellement dans un rapport de 1: 2: 1 (g??n??ralis??e formule C n H 2n O n, o?? n est au moins 3). Le glucose , une des plus importantes les hydrates de carbone, est un exemple d'un monosaccharide. Ainsi en est- fructose, le sucre qui donne des fruits de leur go??t sucr??. Certains glucides (surtout apr??s condensation d'oligo- et polysaccharides) contient moins de carbone par rapport ?? H et O, qui sont toujours pr??sents en 2: 1 (H: O) rapport. Les monosaccharides peuvent ??tre regroup??s en aldoses (ayant un un groupe ald??hyde ?? l'extr??mit?? de la cha??ne, par exemple le glucose) et c??toses (ayant un c??to groupe dans leur cha??ne, par exemple fructose). Les deux aldoses et c??toses se produisent dans un ??quilibre entre les formes ?? cha??ne ouverte et (?? partir de longueurs de cha??ne de C4) des formes cycliques. Celles-ci sont g??n??r??es par formation d'une liaison entre l'un des groupes hydroxyle de la cha??ne de sucre avec le carbone du groupe ald??hyde ou c??to pour former un liaison h??miac??tal. Cela conduit ?? des satur?? ?? cinq cha??nons (dans furanoses) ou six cha??nons (dans pyranoses) des h??t??rocycles contenant un h??t??roatome comme O.
Disaccharides

Deux monosaccharides peuvent ??tre joints ensemble ?? l'aide synth??se de d??shydratation, dans lequel un atome d'hydrog??ne est ??limin?? ?? partir de l'extr??mit?? d'une mol??cule et un un groupe hydroxyle (-OH) est retir?? de l'autre; les r??sidus restants sont ensuite fix??s sur les sites ?? partir desquels ont ??t?? retir??s les atomes. Le H-OH ou H 2 O est alors lib??r?? comme une mol??cule d' eau , d'o?? le terme de d??shydratation. La nouvelle mol??cule, compos?? de deux monosaccharides, est appel?? disaccharide et est conjointe entre eux par un ou glycosidique liaison ??ther . La r??action inverse peut ??galement se produire, en utilisant une mol??cule d'eau pour s??parer un disaccharide et de briser la liaison glycosidique; ce est appel??e hydrolyse. Le disaccharide le plus connu est le saccharose , ordinaire sucre (dans des contextes scientifiques, appel?? sucre de table ou de sucre de canne pour la diff??rencier des autres sucres). Le saccharose est constitu?? d'une mol??cule de glucose et d'une mol??cule de fructose reli??s entre eux. Un autre disaccharide est importante lactose, consistant en une mol??cule de glucose et d'un mol??cule de galactose. Comme la plupart des humains ??ge, la production de lactase, l'enzyme qui hydrolyse le lactose en glucose et galactose, diminue g??n??ralement. Il en r??sulte carence en lactase, ??galement appel??e intol??rance au lactose.
des polym??res de sucre sont caract??ris??s par la r??duction ou l'extr??mit?? non r??ductrice. Un extr??mit?? r??ductrice d'un hydrate de carbone est un atome de carbone qui peut ??tre en ??quilibre avec la cha??ne ouverte ald??hyde ou forme c??to. Si la jonction des monom??res se effectue ?? un tel atome de carbone, le groupe hydroxy libre du pyranose ou furanose est ??chang?? avec une cha??ne OH-c??t?? d'un autre sucre, qui donne une pleine ac??tal. Elle interdit l'ouverture de la cha??ne ?? la forme ald??hyde ou c??tone et rend le r??sidu modifi?? non r??ducteur. Le lactose contient une extr??mit?? r??ductrice, ?? sa fraction de glucose, tandis que la fraction galactose former un ac??tal complet avec le groupe C4-OH de glucose. Le saccharose ne est pas une extr??mit?? r??ductrice en raison de la formation d'ac??tal complet entre le carbone de l'ald??hyde de glucose (C1) et le c??to carbone de fructose (C2).
Les oligosaccharides et polysaccharides

Lorsque quelques-uns (environ trois ?? six) monosaccharides sont r??unies, il est appel?? un oligosaccharides (oligo signifie ??peu??). Ces mol??cules ont tendance ?? ??tre utilis??es comme marqueurs et des signaux, ainsi que d'avoir d'autres utilisations.
De nombreux monosaccharides r??unis font un polysaccharide. Ils peuvent ??tre r??unis en une longue cha??ne lin??aire, ou peuvent ??tre ramifi??s. Deux des polysaccharides les plus courants sont la cellulose et le glycog??ne, les deux consistant en r??p??tant glucose monom??res.
- La cellulose est faite par les plantes et est un ??l??ment structural important de leur parois cellulaires. Les humains ne peuvent ni fabriquer, ni dig??rer.
- Le glycog??ne, d'autre part, est une animaux hydrate de carbone; les humains et les autres animaux utilisent comme une forme de stockage de l'??nergie.
Prot??ines

Comme glucides, certaines prot??ines jouent des r??les largement structurelles. Par exemple, les mouvements des prot??ines actine et en fin de compte la myosine sont responsables de la contraction du muscle squelettique. Une propri??t?? de nombreuses prot??ines, ce est qu'ils se lient sp??cifiquement ?? une certaine mol??cule ou d'une classe de mol??cules, ils peuvent ??tre extr??mement s??lectif en ce qu'ils se lient. Les anticorps sont un exemple de prot??ines qui se fixent ?? un type sp??cifique de mol??cule. En fait, la enzyme dosage immunoenzymatique (ELISA), qui utilise des anticorps, est actuellement l'un des tests les plus sensibles m??decine moderne utilise pour d??tecter les diverses biomol??cules. Probablement prot??ines les plus importantes, cependant, sont les enzymes. Ces mol??cules ??tonnantes reconnaissent mol??cules r??actifs sp??cifiques appel??s substrats; puis ils catalysent la r??action entre eux. En abaissant la ??nergie d'activation , l'enzyme acc??l??re cette r??action par un taux de 10 11 ou plus: une r??action qui prendrait normalement plus de 3000 ans pour terminer spontan??ment pourrait prendre moins d'une seconde avec une enzyme. L'enzyme lui-m??me ne est pas utilis??e dans le processus, et est libre de catalyser la m??me r??action avec un nouvel ensemble de substrats. Utilisation de divers modificateurs, l'activit?? de l'enzyme peut ??tre r??gul??e, ce qui permet le contr??le de la biochimie de la cellule dans son ensemble.
En substance, les prot??ines sont des cha??nes d' acides amin??s . Un acide amin?? est constitu?? d'un atome de carbone li?? ?? quatre groupes. L'un est un groupe amino groupe, -NH 2, et l'autre est un acide carboxylique groupe -COOH (m??me si ceux-ci existent sous forme de -NH 3 + et -COO - dans des conditions physiologiques). Le troisi??me est un simple, l'hydrog??ne atomique. Le quatri??me est commun??ment d??nomm??e "-R" et est diff??rente pour chaque acide amin??. Il ya vingt acides amin??s standards. Certains d'entre eux ont des fonctions par eux-m??mes ou sous une forme modifi??e; par exemple, les fonctions du glutamate comme un important neurotransmetteur.

Les acides amin??s peuvent ??tre li??s ensemble par l'interm??diaire d'un liaison peptidique. Dans cette synth??se de la d??shydratation, une mol??cule d'eau est enlev??e et la liaison peptidique relie l'atome d'azote du groupe amino d'un acide amin?? ?? l'atome de carbone du groupe carboxylique de l'autre. La mol??cule qui en r??sulte est appel??e dipeptidiques et courts tron??ons d'acides amin??s (habituellement, moins d'une trentaine) sont appel??s des peptides ou des polypeptides. ??tirements m??ritent plus les prot??ines de titre. A titre d'exemple, le sang importants prot??ines s??riques albumine contient 585 r??sidus d'acides amin??s.
La structure des prot??ines est traditionnellement d??crit dans une hi??rarchie de quatre niveaux. Le la structure primaire d'une prot??ine se compose simplement de sa s??quence d'acides amin??s lin??aire; par exemple, ??alanine-glycine-tryptophane-s??rine-glutamate-asparagine-glycine-lysine ...". La structure secondaire est pr??occup?? par la morphologie locale. Certaines combinaisons d'acides amin??s auront tendance ?? se enrouler dans une bobine appel?? α-h??lice ou en une feuille appel??e β-feuille; certains α-h??lices peut ??tre vu dans le sch??ma d'h??moglobine sup??rieur. Structure tertiaire est l'ensemble de forme tridimensionnelle de la prot??ine. Cette forme est d??termin??e par la s??quence d'acides amin??s. En fait, un seul changement peut changer toute la structure. La cha??ne alpha de l'h??moglobine contient 146 r??sidus d'acides amin??s; substitution de la r??sidu de glutamate en position 6 avec un r??sidu valine modifie le comportement de l'h??moglobine, si bien qu'il en r??sulte la dr??panocytose . Enfin structure quaternaire concerne la structure d'une prot??ine avec de multiples sous-unit??s peptidiques, comme l'h??moglobine, avec ses quatre sous-unit??s. Toutes les prot??ines ne ont pas plus d'une sous-unit??.
Prot??ines ing??r??es sont g??n??ralement divis??s en acides amin??s ou dipeptides simples dans la intestin gr??le, puis absorb??. Ils peuvent ensuite ??tre r??unis pour faire de nouvelles prot??ines. Produits interm??diaires de la glycolyse, le cycle de l'acide citrique, et la voie des pentoses phosphates peut ??tre utilis?? pour rendre l'ensemble des vingt acides amin??s, et la plupart des bact??ries et des plantes poss??dent toutes les enzymes n??cessaires ?? leur synth??se. Les humains et les autres mammif??res, cependant, ne peuvent synth??tiser la moiti?? d'entre eux. Ils ne peuvent pas synth??tiser l'isoleucine, la leucine, lysine, m??thionine, la ph??nylalanine, thr??onine, le tryptophane, et valine. Il se agit de la acides amin??s essentiels, car il est essentiel de les ing??rer. Les mammif??res ne poss??dent les enzymes de synth??se l'alanine, asparagine, aspartate, cyst??ine, glutamate, la glutamine, glycine, proline, la s??rine, et la tyrosine, les acides amin??s non essentiels. Alors qu'ils peuvent synth??tiser arginine et histidine, ils ne peuvent pas produire en quantit??s suffisantes pour les jeunes animaux en pleine croissance, et ceux-ci sont souvent consid??r??s comme des acides amin??s essentiels.
Si le groupe amino est ??limin?? ?? partir d'un acide amin??, il laisse derri??re lui un squelette carbon?? appel?? α- c??to. Enzymes appel??s transaminases peuvent facilement transf??rer le groupe amino d'un acide amin?? (ce qui en fait un acide α-c??to) ?? un autre acide α-c??to (ce qui en fait un acide amin??). Ceci est important dans la biosynth??se des acides amin??s, comme pour la plupart des voies, des interm??diaires d'autres voies biochimiques sont convertis au squelette de l'acide α-c??to, puis un groupe amino est ajout??, souvent via transamination. Les acides amin??s peuvent ensuite ??tre li??s ensemble pour faire une prot??ine.
Un processus similaire est utilis?? pour d??composer les prot??ines. Il est d'abord hydrolys?? en ses amino-acides constitutifs. Gratuit l'ammoniac (NH 3), existant en tant que ion ammonium (NH 4 +) dans le sang, est toxique pour les formes de vie. Un proc??d?? appropri?? pour excr??ter il doit donc exister. Diff??rentes strat??gies ont ??volu?? dans diff??rents animaux, en fonction des besoins des animaux. Les organismes unicellulaires, bien s??r, il suffit de rel??cher l'ammoniac dans l'environnement. De m??me, poissons osseux peuvent lib??rer l'ammoniac dans l'eau o?? il est dilu?? rapidement. En g??n??ral, les mammif??res convertissent l'ammoniaque en ur??e, par l'interm??diaire du cycle de l'ur??e.
Lipides
Le terme lipide comprend un large ??ventail de mol??cules et dans une certaine mesure est un fourre-tout pour relativement insoluble dans l'eau ou compos??s non polaires d'origine biologique, y compris cires, acides gras , acides gras d??riv??s les phospholipides, sphingolipides, glycolipides et terp??no??des (par ex. les r??tino??des et les st??ro??des). Certains lipides sont lin??aires mol??cules aliphatiques, tandis que d'autres ont des structures cycliques. Certains sont aromatiques, tandis que d'autres ne sont pas. Certains sont flexibles, tandis que d'autres sont rigides.
La plupart des lipides ont un certain caract??re polaire en plus d'??tre en grande partie non polaire. En g??n??ral, la majeure partie de leur structure est non polaire ou hydrophobe ("l'eau-craignant"), ce qui signifie qu'elle ne interagit pas bien avec des solvants polaires comme l'eau. Une autre partie de leur structure est polaire ou hydrophile ("l'eau-aimer??) et aura tendance ?? associer avec des solvants polaires comme l'eau. Cela fait d'eux mol??cules amphiphiles (ayant des parties ?? la fois hydrophobes et hydrophiles). Dans le cas de le cholest??rol, le groupe polaire est un simple -OH ( un groupe hydroxyle ou alcool). Dans le cas des phospholipides, les groupes polaires sont beaucoup plus grandes et plus polaire, tel que d??crit ci-dessous.
Les lipides sont une partie int??grante de notre alimentation quotidienne. Plus huiles et produits laitiers que nous utilisons pour cuisiner et manger comme le beurre , le fromage , ghee etc., sont constitu??s de graisses. Les huiles v??g??tales sont riches en divers les acides gras polyinsatur??s (AGPI). Les aliments contenant des lipides sont soumis ?? une digestion dans le corps et sont divis??es en acides gras et le glycerol, qui sont les produits de d??gradation finaux des graisses et des lipides.
Acides nucl??iques
Un acide nucl??ique est un haut poids mol??culaire biochimique complexe macromol??cule compos??e de cha??nes de nucl??otides qui v??hiculent l'information g??n??tique. Les acides nucl??iques les plus communs sont l'acide d??soxyribonucl??ique (ADN) et l'acide ribonucl??ique ( ARN). Les acides nucl??iques sont pr??sents dans toutes les cellules vivantes et les virus. Mis ?? part le mat??riel g??n??tique de la cellule, les acides nucl??iques jouent souvent un r??le des seconds messagers, ainsi que la formation de la mol??cule de base de l'ad??nosine triphosphate , la mol??cule-support ??nergie primaire trouv?? dans tous les organismes vivants.
Acide nucl??ique, ainsi appel?? en raison de sa pr??valence dans cellulaire noyaux, est le nom g??n??rique de la famille de biopolym??res. Les monom??res sont appel??s nucl??otides, et chacun se compose de trois ??l??ments: un h??t??rocyclique azot?? base (soit un une purine ou pyrimidine), un pentose sucre , et un groupe phosphate. Types d'acides nucl??iques diff??rentes diff??rent dans le sucre sp??cifique trouv?? dans leur cha??ne (par exemple ADN ou acide d??soxyribonucl??ique contient 2- d??soxyriboses). En outre, les bases azot??es possibles dans les deux acides nucl??iques sont diff??rents: ad??nine, cytosine, et guanine se produire dans les deux ARN et l'ADN, tout en thymine se produit uniquement dans l'ADN et l'uracile dans l'ARN produit.
Relations avec d'autres "?? l'??chelle mol??culaire" sciences biologiques
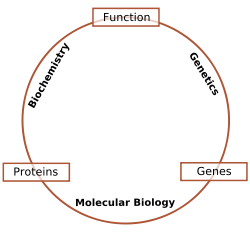
Les chercheurs en biochimie utilisent des techniques sp??cifiques indig??nes ?? la biochimie, mais de plus en plus les combiner avec des techniques et des id??es de la g??n??tique , la biologie mol??culaire et biophysique. Il n'a jamais ??t?? une ligne dure entre ces disciplines en termes de contenu et de la technique, mais les membres de chaque discipline ont dans le pass?? ??t?? tr??s territoriale; aujourd'hui les termes de biologie mol??culaire et de biochimie sont presque interchangeables. La figure suivante est un sch??ma qui repr??sente une vue possible de la relation entre les champs:
- La biochimie est l'??tude des substances chimiques et des processus d??mographiques qui surviennent dans la vie des organismes . Biochimistes se concentrent fortement sur le r??le, la fonction et la structure de biomol??cules. L'??tude de la chimie derri??re les processus biologiques et la synth??se de mol??cules biologiquement actives sont des exemples de la biochimie.
- La g??n??tique est l'??tude de l'effet des diff??rences g??n??tiques sur les organismes. Souvent, cela peut ??tre d??duit par l'absence d'une composante normale (par exemple une g??ne). L'??tude de " "- organismes mutants qui sont d??pourvus d'un ou plusieurs ??l??ments fonctionnels ?? l'??gard de la soi-disant" type sauvage "ou normal ph??notype. (Interactions g??n??tiques ??pistasie) peut souvent confondre interpr??tations simples de ces ??tudes "knock-out".
- La biologie mol??culaire est l'??tude des m??canismes mol??culaires du processus de replication, la transcription et la traduction de la mat??riel g??n??tique. Le dogme central de la biologie mol??culaire, o?? le mat??riel g??n??tique est transcrit en ARN, puis traduit en prot??ine, en d??pit d'??tre une image simpliste de la biologie mol??culaire, fournit toujours un bon point de d??part pour comprendre le domaine. Cette image, cependant, est en cours de r??vision ?? la lumi??re de nouveaux r??les ??mergents pour ARN.
- Biologie chimique cherche ?? d??velopper de nouveaux outils bas??s sur petites mol??cules qui permettent perturbation minimale des syst??mes biologiques tout en fournissant des informations d??taill??es sur leur fonction. En outre, la biologie chimique utilise des syst??mes biologiques pour cr??er des hybrides non naturelles entre biomol??cules et dispositifs synth??tiques (par exemple vid?? capsides virales qui peuvent offrir une th??rapie g??nique ou des mol??cules de m??dicament).