
Catalyse
Saviez-vous ...
Cette s??lection de wikipedia a ??t?? choisi par des b??n??voles aidant les enfants SOS de Wikipedia pour cette s??lection Wikipedia pour les ??coles. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
Dans la chimie et la biologie , la catalyse est une mani??re d'acc??l??rer la vitesse d'une r??action chimique au moyen de mise en contact des r??actifs avec une substance appel??e un catalyseur, qui lui-m??me ne est pas consomm?? par la r??action globale. Plus g??n??ralement, on peut parfois appeler tout ce qui acc??l??re un processus, un ??catalyseur?? (Du grec καταλύειν, ce qui signifie d'annuler ou de d??nouer ou de ramasser).
Un catalyseur fournit une voie alternative ?? produits, la voie catalytique ??tant soumis ?? faible ??nergie d'activation que dans la r??action non catalys??e. Une ??nergie d'activation r??duit augmente la vitesse de r??action . Les catalyseurs g??n??ralement changent au cours d'une r??action, mais sont r??g??n??r??s.
Un bon exemple d'une utilisation de catalyseur est dans la dismutation du peroxyde d'hydrog??ne pour donner de l'eau et de l'oxyg??ne :
- 2 H 2 O 2 → 2 H 2 O + O 2
Cette r??action est lente, comme indiqu?? par le fait que l'on peut acheter des solutions de peroxyde d'hydrog??ne. Lors de l'addition de du dioxyde de mangan??se au peroxyde d'hydrog??ne, la r??action se produit rapidement que signal?? par effervescence d'oxyg??ne. Dans les manifestations, l'oxyg??ne d??gag?? est d??tectable par son effet sur une b??chette incandescente. Le dioxyde de mangan??se peut ??tre r??cup??r?? et r??utilis?? ind??finiment, il est donc un catalyseur - il ne est pas consomm?? par la r??action. (Le H 2 O 2 vendu comme un agent de st??rilisation dans les pharmacies est trop dilu?? pour que cela fonctionne de fa??on spectaculaire.)
Un promoteur modifie chimiquement un catalyseur, mais ne est pas en soi un catalyseur. Une inhibiteur r??duit l'efficacit?? du (ou ralentit l'effet d ') un catalyseur.
Histoire
Les processus de phrase catalys??e a ??t?? invent?? par J??ns Jakob Berzelius en 1836 pour d??crire les r??actions qui sont acc??l??r??s par des substances qui restent inchang??s apr??s la r??action. Autres chimistes pr??coces impliqu??s dans la catalyse ??taient Alexander Mitscherlich en 1831, qui fait r??f??rence ?? contacter processus et Johann Wolfgang D??bereiner qui a parl?? de l'action de contact et dont plus l??ger bas?? sur l'hydrog??ne et un platine ??ponge est devenu un ??norme succ??s commercial dans les ann??es 1820. Humphrey Davy a d??couvert l'utilisation du platine dans la catalyse. Dans les ann??es 1880, Wilhelm Ostwald au Universit?? de Leipzig a commenc?? une s??rie d'enqu??tes syst??matiques dans des r??actions qui ont ??t?? catalys??es par la pr??sence d' acides et bases, et a trouv?? ?? la fois que les r??actions chimiques se produisent ?? des taux finies, et que ces taux peut ??tre utilis?? pour d??terminer les forces d'acides et de bases. Pour ce travail, Ostwald a re??u le 1909 Prix Nobel de chimie .
M??canisme typique
Les catalyseurs r??agissent g??n??ralement avec un ou plusieurs r??actifs pour former un interm??diaire qui donnent ensuite le produit de r??action final, dans le proc??d?? de r??g??n??ration du catalyseur. Ce qui suit est un sch??ma r??actionnel typique, o?? C repr??sente le catalyseur, a et b sont r??actifs, et D est le produit de la r??action de A et B:
- A + C → AC (1)
- B + AC → ABC (2)
- ABC → CD (3)
- CD → C + D (4)
Bien que le catalyseur (C) est consomm??e par une r??action, il est ensuite produit par r??action 4, de sorte que pour la r??action globale:
- A + B → D
Cycles catalytiques
Un cycle catalytique ou catalytique m??canisme est un m??canisme de r??action qui implique un catalyseur. Cycles catalytiques sont au c??ur de toute discussion de la catalyse, que ce soit dans la biochimie , chimie organom??tallique, ou la chimie du solide.
Souvent, un catalyseur dit sacrificiel fait ??galement partie du syst??me de r??action dans le but de r??g??n??rer le catalyseur vrai dans chaque cycle. Comme son nom l'indique le catalyseur sacrificiel ne est pas r??g??n??r?? et est plut??t consomm?? de fa??on irr??versible. Ce compos?? sacrificielle est ??galement connu comme un catalyseur stoechiom??trique lorsqu'il est ajout?? en des quantit??s stoechiom??triques par rapport au r??actif principal. Habituellement, le v??ritable catalyseur est une mol??cule complexe et co??teux et ajout?? en quantit?? aussi faible que possible. Le catalyseur stoechiom??trique d'autre part devrait ??tre pas cher et abondant.
Catalyseurs et ??nerg??tique de r??action
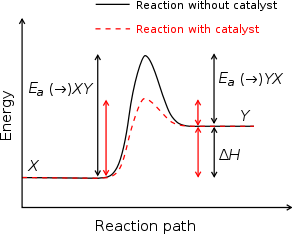
Catalyseurs travaillent en fournissant un (alternative) m??canisme impliquant un ??tat de transition diff??rente et inf??rieure ??nergie d'activation . L'effet de ceci est que les collisions mol??culaires ont plus l'??nergie n??cessaire pour atteindre l'??tat de transition. Par cons??quent, les catalyseurs peuvent effectuer des r??actions qui, bien que thermodynamiquement possible, ne serait pas fonctionner sans la pr??sence d'un catalyseur, ou effectuer eux beaucoup plus rapide, plus pr??cise, ou ?? des temp??ratures plus basses. Ceci peut ??tre observ?? sur un Distribution de Boltzmann et ??nergie profil diagramme. Cela signifie que les catalyseurs de r??duire la quantit?? d'??nergie n??cessaire pour d??marrer une r??action chimique.
Catalyseurs ne peuvent pas faire des r??actions d??favorables ??nergiquement possible - ils ne ont aucun effet sur le ??quilibre chimique d'une r??action parce que le taux de fois vers l'avant et la r??action inverse sont ??galement touch??s (voir aussi la thermodynamique ). La variation d'??nergie libre de r??action net est le m??me si on utilise un catalyseur ou pas; le catalyseur est tout simplement plus facile ?? activer.
Le SI unit?? d??riv??e pour mesurer l'activit?? catalytique d'un catalyseur est la katal, qui est moles par seconde. Le degr?? d'activit?? d'un catalyseur peut ??galement ??tre d??crit par le remettre num??ro (ou TON) et l'efficacit?? catalytique par le turn over fr??quence (TOF). L'??quivalent biochimique est la unit?? enzyme.
Pour plus d'informations sur l'efficacit?? de la catalyse enzymatique voir le Section Enzyme # Kinetics.
Autocatalyse
En autocatalyse, une r??action produit des catalyseurs.
Les types de catalyseurs
Les catalyseurs peuvent ??tre soit ou h??t??rog??ne homog??ne. Biocatalyseurs sont souvent consid??r??s comme un groupe distinct.
Catalyseurs h??t??rog??nes sont pr??sents dans diff??rentes phases de la r??actifs (par exemple, un solide catalyseur dans un liquide de m??lange r??actionnel ), tandis que des catalyseurs homog??nes sont dans la m??me phase (par exemple, un catalyseur dissous dans un m??lange r??actionnel liquide).
Catalyseurs h??t??rog??nes
Un mod??le simple pour catalyse h??t??rog??ne comprend la fourniture d'un catalyseur surface sur laquelle les r??actifs (ou substrats) deviennent temporairement adsorb??es. Obligations dans le substrat se affaiblissent suffisamment pour que de nouveaux liens ?? cr??er. Les liens entre les produits et le catalyseur sont plus faibles, de sorte que les produits sont lib??r??s. Diff??rents m??canismes possibles pour r??actions sur les surfaces sont connus, selon la fa??on dont l'adsorption a lieu ( Langmuir-Hinshelwood et Eley-Rideal).
Par exemple, dans le Proc??d?? Haber pour la fabrication de l'ammoniac , finement divis??es fer agit comme un catalyseur h??t??rog??ne. Sites actifs sur le m??tal permettent liaison faible partielle des r??actifs gaz , qui sont adsorb?? sur la surface m??tallique. En cons??quence, la liaison dans la mol??cule d'un r??actif est affaiblie et les mol??cules de r??actif sont maintenus ?? proximit?? les unes des autres. De cette mani??re, la particuli??rement forte triple liaison dans de l'azote est affaiblie et les mol??cules d'hydrog??ne et d'azote est pr??sent??e plus rapproch??es que cela serait le cas dans la phase gazeuse, de sorte que la vitesse de r??action augmente.
D'autres catalyseurs h??t??rog??nes comprennent vanadium (V) dans l'oxyde proc??d?? de contact, le nickel dans la fabrication de margarine, l'alumine et la silice dans le de craquage des alcanes et platine , rhodium et palladium dans convertisseurs catalytiques. Silicates m??soporeux ont trouv?? une utilit?? dans la catalyse h??t??rog??ne de r??action parce que leur grande surface accessible permet un chargement de catalyseur ??lev??e.
Dans les moteurs de voiture, incompl??te combustion de la combustible permet d'obtenir du monoxyde de carbone , qui est toxique. L'??tincelle ??lectrique et des temp??ratures ??lev??es permettent ??galement de l'oxyg??ne et de l'azote ?? r??agir et la forme le monoxyde d'azote et le dioxyde d'azote, qui sont responsables de photochimique smog et les pluies acides . Les convertisseurs catalytiques r??duisent ces ??missions par adsorption de CO et NO catalytique sur la surface, o?? les gaz sont soumis ?? un . r??action redox du dioxyde de carbone et d'azote sont d??sorb??s de la surface et ??mis sous forme de gaz relativement inoffensifs:
- 2CO + 2NO → 2CO 2 + N 2
Beaucoup de catalyseurs utilis??s dans les raffineries et dans les applications p??trochimiques sont r??g??n??r??s et r??utilis??s plusieurs fois pour r??duire les co??ts et de l'??nergie et de r??duire l'impact environnemental du recyclage ou l'??limination des catalyseurs us??s.
Les catalyseurs homog??nes
Les catalyseurs homog??nes sont dans la m??me phase que les r??actifs.
Dans la catalyse homog??ne, le catalyseur est une mol??cule qui facilite la r??action. Le catalyseur initie une r??action avec un ou plusieurs r??actifs pour former des interm??diaires (s) et, dans certains cas, un ou plusieurs produits. Les ??tapes ult??rieures conduisent ?? la formation de produits restants et ?? la r??g??n??ration du catalyseur.
Des exemples de catalyseurs homog??nes sont les suivantes:
1) L'ion H + (aq) qui agit comme un catalyseur dans est??rification, ainsi que dans la r??action inverse - hydrolyse d'esters tels que l'ac??tate de m??thyle est catalys??e par H +
2) Chlore radicaux libres dans la d??composition de l'ozone . Ces radicaux sont form??s par l'action des rayons ultraviolets sur de rayonnement chlorofluorocarbures (CFC). Ils r??agissent avec l'ozone pour former des mol??cules d'oxyg??ne et r??g??n??rer les radicaux de catalyseur. Ce processus d??truit la couche mince de ozone stratosph??rique.
- ?? Cl + O 3 → ClO ?? + O 2
- ClO + O ?? ?? ?? → Cl + O 2
3) Les oxydes d'azote dans le oxydation de le dioxyde de soufre ?? trioxyde de soufre par dans le dioxyg??ne processus de chambre.
Biocatalyseurs
Dans la nature les enzymes sont des catalyseurs dans m??tabolisme. En biochimie catalyse est ??galement observ??e avec abzymes et des ribozymes, d??soxyribozymes ont ??galement ??t?? cr????es dans le laboratoire.
Biocatalyseurs peuvent ??tre consid??r??s comme un m??lange d'un catalyseur homog??ne et h??t??rog??ne. Ce est parce que l'enzyme est en solution elle-m??me, mais la r??action a lieu ?? la surface de l'enzyme. Plusieurs facteurs influent sur l'activit?? des enzymes. Les plus importants sont:
- Temp??rature
- pH
- La concentration d'enzyme
- concentration du substrat
??lectrocatalyseurs
Dans le contexte de ??lectrochimie, en particulier dans carburant ing??nierie cellulaire, divers catalyseurs riches en m??taux sont utilis??s pour promouvoir l'efficacit?? d'un moiti?? r??action qui se produit ?? l'int??rieur de la pile ?? combustible. Un type courant de ??lectrocatalyseur de pile ?? combustible est bas??e sur minuscule nanoparticules de platine qui ornent l??g??rement plus grandes carbone particules. Lorsque ce type d'??lectrocatalyseur de platine est en contact avec l'un des ??lectrodes dans une pile ?? combustible, il augmente le d??bit de la redox demi-r??action dans laquelle l'oxyg??ne gazeux est r??duit ?? l'eau (ou de l'hydroxyde ou du peroxyde d'hydrog??ne ).
Importance
La catalyse est d'une importance primordiale dans l'industrie chimique. La production de la plupart des produits chimiques industriels importants implique catalyse. Deux proc??d??s commerciaux notables sont la Proc??d?? Haber pour l'ammoniac synth??se et la Synth??se de Fischer-Tropsch. La recherche sur la catalyse est un domaine majeur en sciences appliqu??es, et implique de nombreux domaines de la chimie, notamment dans chimie organom??tallique et la physique. La catalyse est important dans de nombreux aspects de la science de l'environnement , de la convertisseur catalytique dans les automobiles aux causes pr??sum??es du trou d'ozone . Catalytique plut??t que r??actions stoechiom??triques sont pr??f??r??s dans respectueux de l'environnement chimie verte en raison de la quantit?? r??duite de d??chets g??n??r??s.
Parmi les exemples notables
On estime que 90% de tous les produits chimiques produits dans le commerce implique des catalyseurs ?? un certain stade dans le processus de leur fabrication.
Le dioxyde de mangan??se est utilis?? en laboratoire pour pr??parer de l'oxyg??ne par d??composition de peroxyde d'hydrog??ne ?? l'oxyg??ne et l'eau .
Applications bien connues de catalyseurs synth??tiques sont:
- Les convertisseurs catalytiques ?? base de platine et mangan??se se d??composent certains des sous-produits plus nocifs des gaz d'??chappement automobile. Les catalyseurs utilis??s sont des micro-con??ues pour avoir de grandes surfaces.
- la Proc??d?? Haber pour la synth??se d' ammoniac ?? partir d'azote et un atome d'hydrog??ne , o?? le fer est le catalyseur.
Des exemples de catalyseurs qui effectuent des transformations sp??cifiques sur les groupes fonctionnels:
- Transformations de ol??finiques groupes:
- la Catalyseur Ziegler-Natta utilis?? pour produire en masse poly??thyl??ne et polypropylene.
- la Catalyseur de Grubbs pour m??tath??se d'ol??fines.
- la Proc??d?? Monsanto
- la Processus Wacker
- la R??action de Heck.
Ces exemples donn??s montrent que diff??rents catalyseurs d'effectuer d'autres transformations sur les m??mes groupes fonctionnels, o?? la r??action ne serait pas proc??der, proc??der tr??s lentement, ou alors de mani??re non s??lective sans la pr??sence du catalyseur.
Le catalyseur le plus courant est le proton. De nombreux m??taux de transition et de m??tal de transition complexes sont utilis??s dans la catalyse ainsi.
Nouvelles orientations - organocatalyse
Bien que les catalyseurs de m??taux de transition sont bien ??tablis, une nouvelle tendance est ?? organocatalyse qui utilisent des mol??cules organiques relativement simples comme catalyseurs. Bien que typiquement, la charge de catalyseur est beaucoup plus ??lev??e que les catalyseurs ?? base de m??taux de transition, les catalyseurs sont en g??n??ral disponibles dans le commerce en vrac, en aidant ?? r??duire les co??ts de fa??on drastique. Organocatalyseurs de la ??nouvelle g??n??ration?? sont comp??titifs ?? des catalyseurs contenant des m??taux traditionnels et sont dus ?? l'inhibition faible produit applicable en quantit??s stoechiom??triques. Le caract??re chimique de organocatalyseurs offre des perspectives et avantages nouveaux et attrayants pour les chimistes de synth??se de travail.
Les proc??d??s catalytiques
En 2005, les processus catalytiques g??n??r??s environ 900 milliards de dollars en produits dans le monde entier. (Pdf)
- Catalyse acide-base
- Les convertisseurs catalytiques ?? base de platine et de rhodium d??composent certains des sous-produits plus nocifs des gaz d'??chappement automobile.
- Les piles ?? combustible
- Synth??se de Fischer-Tropsch.
- Proc??d?? Haber (synth??se de l'ammoniac ?? partir d'azote et un atome d'hydrog??ne , le cas ordinaire fer est utilis?? comme catalyseur)
- Hydrog??nation
- M??thanol synth??se
- L'acide nitrique production
- Petroleum raffinage et du traitement
- Alkylation
- Craquage catalytique - rupture hydrocarbures ?? longue cha??ne en petits morceaux
- Reformage du naphta
- Reformage ?? la vapeur de pour produire des hydrocarbures gaz de synth??se
- L'acide sulfurique production
- Transest??rification
- La polym??risation d'ol??fines
