
Le monoxyde de carbone
Contexte des ??coles Wikip??dia
Cette s??lection se fait pour les ??coles par la charit?? pour enfants lire la suite . SOS Enfants a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Le monoxyde de carbone | |
|---|---|
 |  |
Le monoxyde de carbone | |
Autres noms Oxyde de carbone, | |
| Identificateurs | |
| Num??ro CAS | 630-08-0 |
| Num??ro RTECS | FG3500000 |
| Propri??t??s | |
| Formule mol??culaire | CO |
| Masse molaire | 28,0101 g / mol |
| Apparence | Incolore, gaz inodore |
| Densit?? | 0,789 g / cm??, liquide 1,250 g / L ?? 0 ?? C, 1 atm. 1,145 g / L ?? 25 ?? C, 1 atm. ( plus l??ger que l'air) |
| Point de fusion | -205 ?? C (68 K) |
| Point d'??bullition | -192 ?? C (81 K) |
| Solubilit?? dans l'eau | 0,0026 g / 100 ml (20 ?? C) |
| Moment de dip??le | 0,112 D (3,74 ?? 10 -31 C ?? m) |
| Risques | |
| FS | MSDS externe |
| Classification UE | Facilement inflammable (F +) Repr. Cat. 1 Toxique (T) |
| Phrases-R | R12, R23, R33, R48, R61 |
| Phrases S | S9, S16, S33, S45, S53 |
| NFPA 704 |  2 3 2 |
| Point d'??clair | Gaz inflammable |
| Des compos??s apparent??s | |
| Oxydes connexes | dioxyde de carbone ; sous-oxyde de carbone; monoxyde de dicarbon; trioxyde de carbone |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le monoxyde de carbone, avec la formule chimique CO, est un gaz incolore, inodore et sans saveur de gaz . Il se compose d'un carbone atome li?? par covalence ?? une oxyg??ne atomique. Il existe deux liaisons covalentes et une liaison covalente dative entre l'oxyg??ne et l'atome de carbone qui provient de l'oxyg??ne.
Le monoxyde de carbone est produit ?? partir de la partie combustion de charbon contenant des compos??s, notamment dans moteurs ?? combustion interne. formes de monoxyde de carbone, de pr??f??rence ?? la plus habituelle du dioxyde de carbone lorsqu'il existe une disponibilit?? r??duite de l'oxyg??ne pr??sent au cours du processus de combustion. Le monoxyde de carbone a une valeur importante de carburant, la combustion dans l'air avec une flamme bleue caract??ristique, la production de dioxyde de carbone . En d??pit de sa grave toxicit??, CO joue un r??le tr??s utile dans la technologie moderne, ??tant un pr??curseur ?? une myriade de produits.
Production
Le monoxyde de carbone est donc d'une importance fondamentale que de nombreuses m??thodes ont ??t?? d??velopp??es pour sa production.
Producteur de gaz est form??e par la combustion de carbone dans l'oxyg??ne ?? des temp??ratures ??lev??es quand il ya un exc??s de carbone. Dans un four, de l'air est pass?? ?? travers un lit de coke. Le CO 2 produit initialement se ??quilibre avec le carbone chaude restante pour donner CO. La r??action de O 2 avec le carbone pour donner CO est d??crit comme l'??quilibre Boudouard. Au-dessus de 800 ?? C, CO est le produit pr??dominant:
- O 2 + 2 C → CO 2
- AH = -221 kJ / mol
L'inconv??nient de cette m??thode est si ce est fait avec de l'air il laisse un m??lange qui est principalement l'azote.
Le gaz de synth??se ou gaz ?? l'eau est produite par la r??action endothermique de la vapeur et du carbone:
- H 2 O + C → CO + H 2
- AH = 131 kJ / mol
CO est ??galement un sous-produit de la r??duction des minerais d'oxydes m??talliques avec du carbone, repr??sent??s sous une forme simplifi??e comme suit:
- MO + C → M + CO
- AH = 131 kJ / mol
Depuis CO est un gaz, le proc??d?? de r??duction peut ??tre conduite par chauffage, en exploitant la (favorable) positif entropie de la r??action. Le Ellingham diagramme montre que la formation de CO est favoris??e par rapport ?? CO 2 ?? des temp??ratures ??lev??es.
CO est le l'anhydride de l'acide formique . Comme telle, elle est commod??ment produit par la d??shydratation de l'acide formique, par exemple avec l'acide sulfurique . Une autre pr??paration de laboratoire pour le monoxyde de carbone consiste ?? chauffer un m??lange intime de poudre de zinc m??tal et de carbonate de calcium .
- Zn + CaCO3 → ZnO + CaO + CO
Un autre style de laboratoire de g??n??rer CO r??agit saccharose et hydroxyde de sodium dans un syst??me ferm??.
Structure
La mol??cule de CO est caract??ris?? par une liaison de longueur 0,1128 nm. Accusation formelle et ??lectron??gativit?? diff??rence se annulent mutuellement. Le r??sultat est un petit moment dipolaire n??gatif, par son extr??mit?? sur l'atome de carbone, mais en r??alit??, les six ??lectrons partag??s sont susceptibles d'??tre tir??e plus pr??s de l'oxyg??ne de carbone. Cette distance est compatible avec une triple liaison partielle. La mol??cule a un petit moment dipolaire et peut ??tre repr??sent?? par trois structures de r??sonance:
La forme de r??sonance ?? gauche est le plus important.
Diazote est iso??lectronique ?? l'oxyde de carbone, ce qui signifie que ces mol??cules ont le m??me nombre d'??lectrons et de liaison similaire. Les propri??t??s physiques de N 2 et de CO sont similaires, bien que CO est plus r??actif.
Principales r??actions chimiques
Les utilisations industrielles
Le monoxyde de carbone est un important gaz industriel qui a de nombreuses applications dans la fabrication de produits chimiques en vrac.
Volume ??lev?? les ald??hydes sont produits par le de r??action d'hydroformylation des alc??nes , CO et H 2. Dans l'une des nombreuses applications de cette technologie, hydroformylation est coupl??e ?? la Proc??d?? Shell-ol??fine sup??rieure pour obtenir des pr??curseurs de d??tergents.
Le m??thanol est produit par l' hydrog??nation de CO. Dans une r??action associ??e, l'hydrog??nation du CO est coupl?? ?? la formation de liaison CC, comme dans le Proc??d?? Fischer-Tropsch o?? le CO est hydrog??n?? pour combustibles hydrocarbon??s liquides. Cette technologie permet de charbon ?? convertir ?? l'essence.
Dans le Proc??d?? Monsanto, le monoxyde de carbone et le methanol r??agissent en pr??sence d'un homog??ne rhodium catalyseur et HI pour donner de l'acide ac??tique . Ce processus est responsable de la majeure partie de la production industrielle de l'acide ac??tique .
Le monoxyde de carbone est un composant de principe gaz de synth??se, qui est souvent utilis?? pour la puissance industrielle. Le monoxyde de carbone (CO) est trop utilis?? dans les op??rations ?? l'??chelle industrielle pour purifier Nickel , ce est un pr??curseur d'un processus de corrosion appel?? Processus Mond.
La chimie de coordination


La plupart des m??taux sous forme des complexes de coordination contenant li?? de mani??re covalente monoxyde de carbone. Seuls ceux dans les ??tats d'oxydation inf??rieurs sera complexe avec du monoxyde de carbone ligands. Ce est parce que il doit y avoir la densit?? ??lectronique suffisante pour faciliter retour don de m??tal d xz -orbital, ?? l'π * orbitale mol??culaire du CO. Le doublet libre sur l'atome de carbone en CO, ??galement fait don de densit?? d'??lectrons de la d-X?? Y?? sur le m??tal pour former un liaison sigma. En du carbonyle de nickel, Ni (CO) 4 formes par la combinaison directe de l'oxyde de carbone et de nickel m??tallique ?? la temp??rature ambiante. Pour cette raison, le nickel dans ne importe quel tube ou partie ne doit pas entrer en contact prolong?? avec le monoxyde de carbone (corrosion). Nickel carbonyle se d??compose facilement revenir ?? Ni et CO au contact avec des surfaces chaudes, et cette m??thode a d??j?? ??t?? utilis?? pour la purification industrielle de nickel dans le Proc??d?? Mond.
Dans carbonyle de nickel et d'autres compos??s carbonyl??s, la paire d'??lectrons sur l'atome de carbone interagit avec le m??tal; le monoxyde de carbone don de la paire d'??lectrons au m??tal. Dans ces situations, le monoxyde de carbone du carbonyle est appel??e ligand. L'un des principaux facteurs ?? carbonyles m??talliques est pentacarbonyle de fer, Fe (CO) 5:

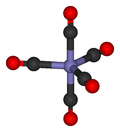
De nombreux complexes m??tal-CO sont pr??par??s par d??carbonylation de solvants organiques, non pas de CO. Par exemple, le trichlorure d'iridium et r??agir la triph??nylphosphine en ??bullition m??thoxy??thanol ou DMF) pour donner IrCl (CO) (PPh 3) 2.
La chimie organique et de groupe principale
En pr??sence d'acides forts et de l'eau, du monoxyde de carbone r??agit avec les ol??fines pour former des acides carboxyliques dans un proc??d?? connu comme la r??action de Koch-Haaf. Dans le R??action Gattermann-Koch, ar??nes sont converties en les d??riv??s de benzald??hyde en pr??sence d' AlCl 3 et HCl. Compos??s organolithium, par exemple, butyl lithium r??agit avec le CO, mais cette r??action b??n??ficie peu d'utilit??.
Bien que le CO r??agit avec carbocations et carbanions, il est relativement non r??actif envers les compos??s organiques sans l'intervention de catalyseurs m??talliques.
Avec principaux r??actifs de groupe, CO subit plusieurs r??actions notables. La chloration de CO est la voie industrielle au compos?? importante phosg??ne. Avec CO borane forme un produit d'addition, H 3 BCO, qui est iso??lectronique avec le acylium cations [3 H ACO] +. CO r??agit avec le sodium pour donner des produits r??sultant du couplage CC tel que Na 2 C 2 O 2 (acetylenediolate de sodium) et de potassium pour donner K 2 C 2 O 2 (acetylenediolate de potassium) et K 2 C 6 O 6 (rhodizonate de potassium).
Le monoxyde de carbone dans l'atmosph??re

Le monoxyde de carbone, bien que consid??r?? comme un polluant aujourd'hui, a toujours ??t?? pr??sent dans l'atmosph??re, principalement comme un produit de l'activit?? volcanique . Il se produit dissous dans la roche volcanique fondue ?? haute pressions sur la terre de manteau. contenu de monoxyde de carbone des gaz volcaniques varient de moins de 0,01% ?? autant que 2% selon le volcan. Il est ??galement pr??sent naturellement dans les feux de brousse. Parce que les sources naturelles de monoxyde de carbone sont si variables d'ann??e en ann??e, il est extr??mement difficile de mesurer avec pr??cision les ??missions naturelles de gaz.
Le monoxyde de carbone a un for??age radiatif indirect effet en ??levant les concentrations de m??thane et troposph??rique ozone par des r??actions chimiques avec d'autres constituants atmosph??riques (par exemple, le hydroxyle radical OH.) qui, autrement, les d??truire. Par des processus naturels dans l'atmosph??re, il est ??ventuellement oxyd?? en dioxyde de carbone . concentrations de monoxyde de carbone sont ?? la fois de courte dur??e dans l'atmosph??re et dans l'espace variable.
CO anthropique des ??missions automobiles et industrielles peut contribuer ?? l' effet de serre et le r??chauffement climatique. Dans les zones urbaines monoxyde de carbone, avec ald??hydes, r??agit par voie photochimique pour produire radicaux peroxy. Des radicaux peroxy r??agissent avec l'oxyde d'azote pour augmenter le rapport de NO 2 en NO, ce qui r??duit la quantit?? de NO qui est disponible pour r??agir avec l'ozone . Le monoxyde de carbone est aussi un constituant de fum??e de tabac.
R??le dans la physiologie et de la nourriture
Le monoxyde de carbone est utilis?? dans atmosph??re modifi??e syst??mes d'emballage aux ??tats-Unis, principalement avec des produits de viande fra??che, comme le b??uf et le porc. Le CO se combine avec myoglobine pour former carboxymyoglobine, un pigment rouge cerise brillant. Carboxymyoglobine est plus stable que la forme oxyg??n??e de la myoglobine, oxymyoglobine, qui peut se oxyder au pigment brun, metmyoglobine. Cette couleur rouge stable peut persister beaucoup plus longtemps que dans la viande normalement emball??s, donnant l'apparence de fra??cheur. Des niveaux typiques de CO utilis??es sont de 0,4% ?? 0,5%.
La technologie a d'abord ??t?? donn??e g??n??ralement reconnu comme ??tat de s??curit?? par le FDA en 2002 pour une utilisation comme syst??me de conditionnement secondaire. En 2004, la FDA a approuv?? CO que la m??thode d'emballage primaire, d??clarant que le CO ne masque pas l'odeur d??t??rioration. Malgr?? cette d??cision, la technologie reste controvers??e aux ??tats-Unis pour les craintes que ce est la d??t??rioration trompeur et masques.
Une r??action dans le corps produit du CO. Le monoxyde de carbone est produit naturellement que la r??partition des h??me (ce qui est l'un des fractions d'h??moglobine), un substrat pour l'enzyme h??me oxyg??nase. Les r??sultats de r??action enzymatique en r??partition de l'h??me ?? CO, biliverdine et Fe 3+ radicale. Le CO produit de fa??on endog??ne peut avoir des r??les physiologiques importants dans le corps (par exemple, en tant que neurotransmetteur ou un relaxant les vaisseaux sanguins). En outre CO r??gule les r??actions inflammatoires d'une mani??re qui emp??che le d??veloppement de plusieurs maladies comme l'ath??roscl??rose ou de paludisme grave.
CO est un nutriment pour bact??ries m??thanog??nes, un bloc de construction pour ac??tyl coenzyme A. Ce th??me fait l'objet pour le domaine ??mergent de la la chimie bioorganometallic. Chez les bact??ries, CO est produit par la r??duction du dioxyde de carbone par la d??shydrog??nase de l'enzyme monoxyde de carbone, une prot??ine Fe-Ni-S-contenant.
Une prot??ine CO-capteur sur la base h??me, COOA, est connue. La port??e de son r??le biologique est pas encore clair, il est apparemment partie d'une voie de signalisation dans les bact??ries et les arch??es, mais son apparition chez les mammif??res ne est pas ??tablie.
CO est aussi en cours d'??tude dans plusieurs laboratoires de recherche dans le monde entier pour ses propri??t??s anti-inflammatoires et cytoprotecteurs qui peuvent ??tre utilis??s en th??rapeutique pour pr??venir le d??veloppement d'une s??rie d'??tats pathologiques tels que les l??sions d'isch??mie de reperfusion, un rejet de greffe, l'ath??roscl??rose, le sepsis, s??v??re paludisme ou l'auto-immunit??. Il n'y a pas les applications cliniques de CO chez les humains.
Histoire
Le monoxyde de carbone a ??t?? pr??par?? par le Fran??ais chimiste de Lassone en 1776 par chauffage l'oxyde de zinc avec coke. Il a conclu ?? tort que le produit gazeux ??tait l'hydrog??ne comme il a br??l?? avec une flamme bleue. Le gaz a ??t?? identifi?? comme un compos?? contenant du carbone et de l'oxyg??ne par le chimiste anglais William Cruikshank dans l'ann??e 1800.
Les propri??t??s toxiques de CO ont d'abord ??t?? une enqu??te approfondie par le physiologiste fran??ais Claude Bernard autour de 1846. Il a empoisonn?? les chiens avec le gaz, et a remarqu?? que leur sang ??tait plus rutilant dans tous les vaisseaux. ??Rutilant 'est un mot fran??ais, mais a aussi une entr??e dans les dictionnaires anglais, ce qui signifie rouge, chatoyante, ou dor??. Cependant, il a ??t?? traduit ?? l'??poque comme la pourpre, ??carlate, et maintenant est c??l??bre connu comme ??rose cerise.
Pendant la Seconde Guerre mondiale , le monoxyde de carbone a ??t?? utilis?? pour garder v??hicules ?? moteur fonctionnant dans des parties du monde o?? l'essence ??tait rare. Charbon externe ou en bois les br??leurs sont mont??s, et le monoxyde de carbone produit par gaz??ification a ??t?? canalis??e vers la carburateur. Le CO est dans ce cas appel?? " gaz de bois ". Le monoxyde de carbone aurait ??galement ??t?? utilis?? sur une petite ??chelle pendant l'Holocauste ?? un Camps d'extermination nazis, et dans le Aktion T4 " ??programme d'euthanasie.
Toxicit??
Le monoxyde de carbone est un gaz toxique et de fa??on significative n'a pas d'odeur ou la couleur. Ce est le type le plus commun d'empoisonnement mortel dans de nombreux pays. Les expositions peuvent conduire ?? une toxicit?? significative de la syst??me nerveux central et le c??ur . Apr??s l'empoisonnement, ?? long terme s??quelles se produisent souvent. Le monoxyde de carbone peut aussi avoir des effets graves sur la b??b?? d'une femme enceinte. Les sympt??mes d'intoxication l??g??re comprennent des maux de t??te et des ??tourdissements ?? des concentrations inf??rieures ?? 100 ppm. Des concentrations aussi faibles que 667 ppm peuvent causer jusqu'?? 50% de l'h??moglobine du corps pour ??tre convertie en carboxy-h??moglobine (HbCO). Carboxy-h??moglobine est assez stable mais ce changement est r??versible. Carboxy-h??moglobine est inefficace pour fournir de l'oxyg??ne, d'o?? certaines parties du corps ne re??oit pas d'oxyg??ne n??cessaire. En cons??quence, les expositions de ce niveau peuvent ??tre mortelles. Aux Etats-Unis, OSHA limite les niveaux d'exposition en milieu de travail ?? long terme ?? 50 ppm.
Les m??canismes par lesquels le monoxyde de carbone produit des effets toxiques ne sont pas encore enti??rement compris, mais l'h??moglobine, la myoglobine, et mitochondriale cytochrome oxydase sont pens??s pour ??tre compromise. Le traitement consiste en grande partie de l'administration de 100% d'oxyg??ne ou oxyg??noth??rapie hyperbare, bien que le traitement optimal reste controvers??e. Domestique empoisonnement au monoxyde de carbone peut ??tre emp??ch??e par l'utilisation de m??nage des d??tecteurs de monoxyde de carbone.

