
Rhodium
?? propos de ce ??coles s??lection Wikipedia
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Rhodium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
45 Rh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
m??tallique blanc argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | rhodium, Rh, 45 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / r oʊ r?? Je ə m / ROH -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 9, 5, r?? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 102,90550 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 5s 1 4d 8 2, 8, 18, 16, 1 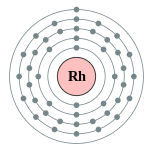 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | William Hyde Wollaston (1804) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | William Hyde Wollaston (1804) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 12,41 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 10,7 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2237 K , 1964 ?? C, 3567 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3968 K, 3695 ?? C, 6683 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 26,59 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 494 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 24,98 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 6, 5, 4, 3, 2, 1, -1 ( l'oxyde amphot??re) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,28 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 719,7 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1740 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2997 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 134 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 142 ?? 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (0 ?? C) 43,3 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 150 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 8,2 pm ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 4,700 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 380 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 150 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 275 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 1246 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 1100 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-16-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de rhodium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le rhodium est un ??l??ment chimique qui est une maladie rare, blanc argent??, dur et chimiquement inerte de m??tal de transition et un ??l??ment de la groupe du platine. Il a la symbole chimique Rh et de num??ro atomique 45. Il est compos?? d'une seule naturelle isotope , 103 Rh. D'origine naturelle rhodium se trouve g??n??ralement sous forme de m??tal libre, alli?? avec des m??taux similaires, et rarement sous forme de compos?? chimique dans des min??raux tels que bowieite et rhodplumsite. Ce est une des plus rares m??taux pr??cieux.
Le rhodium est un soi-disant un m??tal noble, r??sistant ?? la corrosion, qui se trouve dans les minerais de nickel ou du platine, avec les autres membres de la des m??taux du groupe du platine. C'??tait d??couvert en 1803 par William Hyde Wollaston dans une telle minerai, et le nom de la couleur rose de l'un de ses compos??s chlor??s, apr??s qu'il a produit mis ?? r??agir avec le m??lange d'acides puissant l'eau r??gale.
L'utilisation principale de l'??l??ment (plus de 80% de la production mondiale de rhodium) est l'un des catalyseurs de la trois voies de convertisseurs catalytiques dans les automobiles. Parce rhodium m??tallique est inerte contre la corrosion et les produits chimiques les plus agressifs, et en raison de sa raret??, le rhodium est g??n??ralement alli?? avec le platine ou le palladium et appliqu?? ?? haute temp??rature et des rev??tements r??sistant ?? la corrosion. Or blanc est souvent plaqu?? avec une couche de rhodium mince pour am??liorer son empreinte tout argent sterling plaqu?? rhodium est souvent pour la r??sistance ternir.
Rhodium d??tecteurs sont utilis??s dans les r??acteurs nucl??aires pour mesurer la neutron niveau de flux.
Histoire

Rhodium ( grec rhodon (ῥόδον) signifie "rose") a ??t?? d??couvert en 1803 par William Hyde Wollaston, peu de temps apr??s sa d??couverte de palladium . Il a utilis?? brut platine minerai vraisemblablement obtenu ?? partir de l'Am??rique du Sud . Son proc??dure implique la dissolution du minerai dans eau r??gale et neutralisation de l'acide avec de l'hydroxyde de sodium (NaOH). Il a ensuite pr??cipit?? la platine comme chloroplatinate d'ammonium en ajoutant le chlorure d'ammonium, NH 4 Cl. La plupart des autres m??taux comme le cuivre , le plomb , le palladium et le rhodium ont ??t?? pr??cipit??es avec du zinc . Dilu?? l'acide nitrique dissous tous, mais le palladium et le rhodium, qui ont ??t?? dissous dans l'eau r??gale, et le rhodium a ??t?? pr??cipit?? par addition de chlorure de sodium sous forme de Na 3 [RhCl 6] n ?? H 2 O. Apr??s avoir ??t?? lav?? avec de l'??thanol, le pr??cipit?? rose-rouge a ??t?? amen?? ?? r??agir avec du zinc, ce qui d??place le rhodium dans le compos?? ionique ainsi lib??r?? et le rhodium comme m??tal libre.
Apr??s la d??couverte de l'??l??ment rare ne avait que des applications mineures, par exemple par le tournant du si??cle thermocouples contenant du rhodium ont ??t?? utilis??s pour mesurer des temp??ratures jusqu'?? 1800 ?? C. La premi??re application importante a ??t?? galvanisation pour utilisations d??coratives et comme rev??tement r??sistant ?? la corrosion. L'introduction du moyen de trois Convertisseur catalytique par Volvo en 1976 a augment?? la demande de rhodium. Les convertisseurs catalytiques pr??c??dents utilis??s platine ou le palladium tandis que le catalyseur ?? trois voies utilis?? rhodium pour r??duire la quantit?? de NOx dans les gaz d'??chappement.
Caract??ristiques
| Z | ??l??ment | Nombre de ??lectrons / shell |
|---|---|---|
| 27 | cobalt | 2, 8, 15, 2 |
| 45 | rhodium | 2, 8, 18, 16, 1 |
| 77 | iridium | 2, 8, 18, 32, 15, 2 |
| 109 | meitnerium | 2, 8, 18, 32, 32, 15, 2 |
Le rhodium est un, argent??, m??tal dur et durable qui a une haute r??flectance. Rhodium m??tallique ne fait pas normalement une oxyde, m??me lorsqu'il est chauff??. L'oxyg??ne est absorb?? ?? partir du atmosph??re seulement au point de fusion de rhodium, mais est lib??r?? lors de la solidification. Rhodium a ?? la fois un point de fusion sup??rieur et inf??rieur densit?? de platine . Il ne est pas attaqu?? par la plupart des acides : il est tout ?? fait insoluble dans l'acide nitrique et se dissout peu dans l'eau r??gale.
Propri??t??s chimiques

Rhodium appartient ?? groupe 9 du tableau p??riodique, mais a une configuration atypique dans ses couches ??lectroniques ultrap??riph??riques par rapport au reste des membres. Ceci peut ??galement ??tre observ?? au voisinage de niobium (41), le ruth??nium (44), et du palladium (46).
| ??tats d'oxydation de rhodium | |
|---|---|
| 0 | Rh 4 (CO) 12 |
| 1 | RhCl (PH 3) 2 |
| 2 | Rh 2 (O 2 CCH 3) 4 |
| 3 | RhCl3, Rh 2 O 3 |
| 4 | RHF 4, RhO 2 |
| 5 | RHF 5, Sr trois LiRhO 6 |
| 6 | RHF 6 |
La commune ??tat d'oxydation du rhodium est trois, mais les ??tats d'oxydation 0-6 sont ??galement observ??es.
Contrairement ruth??nium et l'osmium , le rhodium ne forme pas de compos??s volatils d'oxyg??ne. Les oxydes stables connus comprennent Rh 2 O 3, RhO 2, RhO 2 ?? x H 2 O, Na 2 RhO 3, Sr 3 LiRhO 6 et Sr 3 NaRhO 6. compos??s halog??nes sont connus dans presque toute la gamme des ??tats d'oxydation possibles. rhodium (III) chlorure , le rhodium (IV) de fluorure, le rhodium (V) et le fluorure rhodium (VI) de fluorure sont quelques exemples. Les ??tats d'oxydation inf??rieurs sont seulement stable, lorsque les ligands sont pr??sents.
Le compos?? rhodium-halog??ne le plus connu est le Chlorotris de catalyseur (triph??nylphosphine) de rhodium de Wilkinson (I). Ce catalyseur est utilis??, par exemple, dans l'hydroformylation ou l'hydrog??nation des alc??nes .
Isotopes
Naturellement rhodium survenant est compos?? d'un seul isotope , 103 Rh. Le plus stable radio-isotopes sont 101 Rh avec une demi-vie de 3,3 ans, 102 Rh avec une demi-vie de 207 jours, 102m Rh avec une demi-vie de 2,9 ans, et 99 Rh avec une demi-vie de 16,1 jours. Vingt autres radio-isotopes ont ??t?? caract??ris??s avec poids atomiques allant de 92,926 u (93 Rh) ?? 116,925 u (117 Rh). La plupart d'entre eux ont une demi-vie plus courte d'une heure, ?? l'exception de 100 Rh (demi-vie: 20,8 heures) et 105 Rh (demi-vie: 35,36 heures). Il ya ??galement de nombreux ??tats m??ta, l'??tre le plus stable 102m Rh (0,141 MeV) avec une demi-vie d'environ 2,9 ann??es et 101m Rh (0,157 MeV) avec une demi-vie de 4,34 jours (voir isotopes de rhodium).
Le primaire mode de d??sint??gration avant le seul isotope stable, 103 Rh, est capture d'??lectrons et le mode primaire apr??s est- ??missions beta. Le primaire produit de d??sint??gration avant 103 Rh est le ruth??nium et le produit primaire apr??s est le palladium .
Occurrence
Le rhodium est un des ??l??ments les plus rares de la cro??te de la Terre, dont il comprend environ 0,0002 parties par million (2 ?? 10 -10). Sa raret?? affecte son prix, et donc son utilisation dans des applications commerciales.
Mines et prix

L'extraction industrielle complexe de rhodium est que le m??tal se produit dans les minerais m??lang??s ?? d'autres m??taux tels que le palladium , l'argent , le platine et l'or . On le trouve dans les minerais de platine et on l'extrait en tant que m??tal inerte blanc qui est tr??s difficile ?? fondre. Les principales sources sont situ??es en Afrique du Sud, dans les sables de la rivi??re Oural, et en Am??rique du Nord, y compris le cuivre - sulfure de nickel zone mini??re de la Sudbury, R??gion de l'Ontario. Bien que la quantit?? ?? Sudbury est tr??s faible, la grande quantit?? de minerai de nickel trait?? rend rentables de r??cup??ration de rhodium. Le principal exportateur de rhodium est l'Afrique du Sud (environ 80% en 2010), suivie par la Russie. La production annuelle mondiale de cet ??l??ment est inf??rieure ?? 30 tonnes et il ya tr??s peu de rhodium portant min??raux . Le prix du rhodium est historiquement tr??s variable. En 2007, le rhodium a co??t?? environ huit fois plus que l'or, 450 fois plus que l'argent, et 27 250 fois plus que le cuivre en poids. En 2008, le prix a augment?? bri??vement ci-dessus $ 10 000 l'once. Le ralentissement ??conomique du 3e trimestre de 2008 a pouss?? les prix du rhodium fortement en dessous de $ 1000 l'once, mais ils rebondi ?? $ 2750 au d??but de 2010 (plus de deux fois le prix de l'or).
Combustibles nucl??aires usag??s
Le rhodium est un produit de fission de uranium 235; par cons??quent, chaque kg de produits de fission contenant des quantit??s significatives de m??taux du groupe du platine plus l??gers y compris le rhodium. Le combustible nucl??aire irradi?? pourrait ??tre une source possible de rhodium. Toutefois, l'extraction est complexe et co??teux, et les pr??sentent ??galement des isotopes radioactifs de rhodium exigerait un stockage de plusieurs demi-vie de l'isotope d??composition plus longue dur??e (soit environ 10 ann??es) pour r??duire la radioactivit??. Cela rend cette source de rhodium sans attrait et sans extraction ?? grande ??chelle a ??t?? tent??e.
Applications
La principale utilisation de cet ??l??ment est dans les automobiles comme un convertisseur catalytique, qui change hydrocarbures nocifs imbr??l??s, monoxyde de carbone et ??missions d'oxydes d'azote du moteur en gaz moins nocifs. De 27200 kg de rhodium consomm??es dans le monde en 2010, quelques 22500 kg (82,7%) sont all??s dans et 7300 kg r??cup??r??s ?? partir de cette application. Environ 1770 kg de rhodium a ??t?? utilis?? dans l'industrie du verre, principalement pour la production de fibre de verre et verre ?? ??cran plat, et 2110 kg dans l'industrie chimique.
Catalyseur
En 2010, plus de 80% de la production mondiale de rhodium a ??t?? consomm?? pour produire convertisseurs catalytiques ?? trois voies. Le rhodium pr??sente certains avantages par rapport aux autres m??taux du platine dans la r??duction de oxydes d'azote en azote et oxyg??ne :
- 2 NO x → x O 2 + N 2
Base de rhodium catalyseurs sont utilis??s dans un certain nombre de proc??d??s industriels; notamment dans l'automobile convertisseurs catalytiques et de carbonylation catalytique du m??thanol pour produire de l'acide ac??tique par le Proc??d?? Monsanto. Il est ??galement utilis?? pour catalyser l'addition de hydrosilanes mol??culaire ?? des doubles liaisons, un processus important dans la fabrication de certains caoutchoucs de silicone. Des catalyseurs de rhodium sont ??galement utilis??s pour r??duire le benz??ne ?? cyclohexane.
Le complexe d'un ion rhodium avec BINAP donne un catalyseur chiral largement utilis?? pour synth??se chirale, comme dans la synth??se de menthol .
Usages ornementaux
Rhodium trouve une utilisation dans les bijoux et d??corations. C'est ??lectrolytique sur or blanc et platine pour lui donner une surface blanche r??fl??chissante. Ceci est connu comme le rhodium clignotant dans les affaires de bijoux. Il peut ??galement ??tre utilis?? dans le rev??tement argent sterling pour se prot??ger contre le ternissement, qui est le sulfure d'argent (Ag 2 S) produit ?? partir du sulfure d'hydrog??ne atmosph??rique (H 2 S). Solide (pur) bijoux de rhodium est tr??s rare, parce que le m??tal est ?? la fois point de fusion ??lev?? et les pauvres mall??abilit?? (faisant par exemple des bijoux tr??s difficile ?? fabriquer) plut??t que du fait de son prix ??lev??. En outre, son co??t ??lev?? assure que la plupart de son utilisation de bijoux est sous la forme de petites quantit??s de poudre (commun??ment appel?? ??ponge de rhodium) dissous dans des solutions de galvanoplastie.
Rhodium a ??galement ??t?? utilis?? pour les honneurs ou pour symboliser la richesse, lorsque des m??taux les plus couramment utilis??s tels que l'argent, l'or, le platine ou sont jug??es insuffisantes. En 1979, le Livre Guinness des Records du Monde a donn?? Paul McCartney un disque rhodi?? pour ??tre l'histoire de tous les temps compositeur best-seller et l'enregistrement artiste.
D'autres utilisations
Le rhodium est utilis?? comme agent d'alliage pour le durcissement et l'am??lioration de la r??sistance ?? la corrosion de platine et de palladium . Ces alliages sont utilis??s dans les enroulements du four, des douilles pour la production de fibres de verre, thermocouples, des ??lectrodes pour a??ronefs bougies, et des creusets de laboratoire. D'autres utilisations incluent:
- Une Mat??riau de contact ??lectrique en raison de sa faible r??sistance ??lectrique , faible et stable r??sistance de contact, et de haute corrosion r??sistance.
- Rhodium plaqu??, faite par galvanoplastie ou l'??vaporation, est extr??mement dur et est utilis?? pour les instruments optiques.
- Il est ??galement utilis?? en tant que filtre en syst??mes de mammographie en raison des rayons X caract??ristiques qu'elle produit.
- D??tecteurs Rhodium de neutrons sont utilis??s dans les r??acteurs nucl??aires d'ing??nierie de combustion pour mesurer les flux de neutrons - une m??thode qui n??cessite un filtre num??rique pour d??terminer le niveau de flux de neutrons actuelle, car il ya trois signaux g??n??r??s: imm??diate, quelques secondes plus tard, et une minute plus tard, chacune avec son propre niveau de signal, et tous les trois sont combin??s dans les signaux de d??tection de rhodium. L'arbre R??acteurs nucl??aires Palo Verde ont chacun 305 d??tecteurs de neutrons rhodium, 61 d??tecteurs sur chacun des cinq niveaux verticaux, fournissant une "image" 3D pr??cis de r??activit?? et permettant un r??glage fin de br??ler ??conomiquement la plus combustible nucl??aire.

A 78 g ??chantillon de rhodium

Section d'un m??tal-core convertisseur catalytique

Anneau de mariage or blanc rhodi??

Feuille Rhodium et le fil
Pr??cautions
??tre un m??tal noble, le rhodium pur est inerte. Toutefois, les complexes chimiques de rhodium peuvent ??tre r??actif. Dose l??tale moyenne (DL 50) chez les rats est de 198 mg de chlorure de rhodium (RhCl 3) par kilogramme de poids corporel. Des compos??s de rhodium peuvent fortement tacher la peau humaine. Comme les autres m??taux nobles, qui sont tous trop inerte pour se produire des compos??s chimiques dans la nature, le rhodium n'a pas ??t?? trouv?? ?? jouer, ou soup??onn?? de jouer, un r??le biologique. Si elle est utilis??e sous forme ??l??mentaire plut??t que comme compos??s, le m??tal est sans danger.
