
Lutetium
?? propos de ce ??coles s??lection Wikipedia
SOS Enfants a essay?? de rendre le contenu plus accessible Wikipedia par cette s??lection des ??coles. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Lutetium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
71 Lu | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||
blanc argent??  | |||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||
| Nom, symbole, nombre | lut??tium, Lu, 71 | ||||||||||||||||||||||||||||||
| Prononciation | / LJ U t Je ʃ Je ə m / TEE lew- -shee-əm | ||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | lanthanides parfois consid??r?? comme un m??tal de transition | ||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 6, r?? | ||||||||||||||||||||||||||||||
| Poids atomique standard | 174.9668 (4) | ||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 6s 2 4f 14 5d 1 2, 8, 18, 32, 9, 2 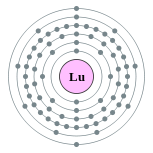 | ||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||
| D??couverte | Georges Urbain et Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Premier isolement | Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 9,841 g ?? cm -3 | ||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 9,3 g ?? cm -3 | ||||||||||||||||||||||||||||||
| Point de fusion | 1925 K , 1652 ?? C, 3006 ?? F | ||||||||||||||||||||||||||||||
| Point d'??bullition | 3675 K, 3402 ?? C, 6156 ?? F | ||||||||||||||||||||||||||||||
| La chaleur de fusion | ca. 22 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 414 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 26,86 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 (Faiblement oxyde de base) | ||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,27 (??chelle de Pauling) | ||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 523,5 kJ ?? mol -1 | ||||||||||||||||||||||||||||||
| 2??me: 1340 kJ ?? mol -1 | |||||||||||||||||||||||||||||||
| 3??me: 2022,3 kJ ?? mol -1 | |||||||||||||||||||||||||||||||
| Rayon atomique | 174 h | ||||||||||||||||||||||||||||||
| Rayon covalente | 187 ?? 20 heures | ||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (poly) 582 nΩ ?? m | ||||||||||||||||||||||||||||||
| Conductivit?? thermique | 16,4 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 9,9 um / (m ?? K) | ||||||||||||||||||||||||||||||
| Le module d'Young | 68,6 GPa | ||||||||||||||||||||||||||||||
| Module de cisaillement | 27,2 GPa | ||||||||||||||||||||||||||||||
| Module Bulk | 47,6 GPa | ||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,261 | ||||||||||||||||||||||||||||||
| Duret?? Vickers | 1160 MPa | ||||||||||||||||||||||||||||||
| Duret?? Brinell | 893 MPa | ||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7439-94-3 | ||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de lut??tium | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Lut??tium est un ??l??ment chimique avec le symbole Lu et de num??ro atomique 71. Ce est un blanc argent?? m??tallique r??sistant ?? la corrosion dans un endroit sec, mais pas l'air humide. Ce est le dernier ??l??ment de la lanthanides s??rie, et traditionnellement compt?? parmi les terres rares.
Lut??tium a ??t?? d??couvert ind??pendamment en 1907 par le scientifique fran??ais Georges Urbain, min??ralogiste autrichien Baron Carl Auer von Welsbach et chimiste am??ricain Charles James. Tous ces hommes ont trouv?? le lut??tium sous forme d'impuret??s dans le minerai ytterbium, qui a ??t?? pr??c??demment pens?? ?? constitu??s enti??rement de l'ytterbium. Le diff??rend sur la priorit?? de la d??couverte se est produite peu de temps apr??s, avec Urbain et von Welsbach accusant mutuellement de la publication des r??sultats influenc??s par les recherches publi??es de l'autre; l'honneur est all?? ?? nommer Urbain comme il a publi?? ses r??sultats plus t??t. Il a choisi le nom lut??cium pour le nouvel ??l??ment, mais en 1949 l'orthographe de l'??l??ment 71 a ??t?? modifi?? au lut??cium. En 1909, la priorit?? a ??t?? finalement accord?? ?? Urbain et ses noms ont ??t?? adopt??es comme les officiels; Toutefois, le nom cassiopeium (ou cassiopium tard) pour l'??l??ment 71 propos?? par von Welsbach a ??t?? utilis?? par de nombreux scientifiques allemands jusqu'?? ce que les ann??es 1950.
Lutetium ne est pas un ??l??ment particuli??rement abondante, bien significativement plus fr??quente que l'argent dans la cro??te de la terre; elle a peu d'utilisations sp??cifiques. Lut??cium-176 est un (2,5%) isotope radioactif relativement abondante avec une demi-vie d'environ 38 milliards d'ann??es, et ainsi utilis??e pour d??terminer l'??ge de m??t??orites. Lutetium se produit habituellement en association avec l'??l??ment yttrium et est parfois utilis?? dans le m??tal et alliages comme catalyseur dans diff??rentes r??actions chimiques. Lu- 177 DOTA-TATE est utilis?? pour la th??rapie par radionucl??ides (voir La m??decine nucl??aire) sur les tumeurs neuroendocrines.
Caract??ristiques
Propri??t??s physiques
Un atome de lut??tium a 71 ??lectrons, dispos??s dans la configuration [ Xe ] 4f 14 5d 1 6s 2. Lors de la saisie d'une r??action chimique, l'atome perd ses deux ??lectrons ultrap??riph??riques et 5d-??lectron unique; ce est inhabituel puisque les r??actions des autres lanthanides impliquent invariablement ??lectrons f-shell. L'atome de lut??tium est la plus petite parmi les atomes de lanthanides, en raison de la contraction lanthanide, et en tant que r??sultat de lut??tium a la plus forte densit??, point de fusion, et la duret?? des lanthanides.
Les compos??s chimiques et les propri??t??s
Les compos??s de lut??cium contiennent toujours l'??l??ment ?? l'??tat d'oxydation +3. Les solutions aqueuses de la plupart des sels de lut??tium sont incolores et forment des solides cristallins blancs lors du s??chage, ?? l'exception de l'iodure commun. Les sels solubles, tels que le nitrate, le sulfate et l'ac??tate hydrates forment lors de la cristallisation. Le l'oxyde, l'hydroxyde, le fluorure, le carbonate, le phosphate et oxalate sont insolubles dans l'eau.
Lutetium m??tal est l??g??rement instable dans l'air dans des conditions normales, mais il br??le facilement ?? 150 ?? C pour former de l'oxyde de lut??cium. Le compos?? r??sultant est connu pour adsorber l'eau et le dioxyde de carbone , et peut ??tre utilis??e pour ??liminer les vapeurs de ces compos??s d'atmosph??res closes. Des observations similaires sont en cours de r??action entre le lut??tium et de l'eau (lent et rapide ?? froid ?? chaud); hydroxyde de lut??tium est form??e dans la r??action. Lut??cium m??tal est connu pour r??agir avec les quatre halog??nes l??gers pour former tri halog??nures; chacun d'entre eux (?? l'exception du fluorure) sont solubles dans l'eau.
Lut??cium se dissout facilement dans les acides faibles et diluer l'acide sulfurique pour former des solutions contenant des ions de lut??tium incolores, qui existent en tant que [Lu (H 2 O) 9] 3+ complexe:
- Lu 2 + 3 H 2 SO 4 + 18 H 2 O 2 → [Lu (H 2 O) 9] 3+ + 3 SO 2-
4 + 3 H 2 ↑
Isotopes
Lutetium se produit sur la Terre sous forme de deux isotopes: lut??cium-175 et le lut??cium-176. Sur ces deux, seul le premier est stable, ce qui rend l'??l??ment monoisotopique. Ce dernier l'un, lut??cium-176, se d??sint??gre via d??sint??gration b??ta avec une demi-vie de 3,78 ?? 10 10 ans; il repr??sente environ 2,5% du lut??cium naturel. ?? ce jour, 32 des radio-isotopes de l'??l??ment de synth??se ont ??t?? caract??ris??s, en masse allant de 149,973 (lut??tium-150) ?? 183,961 (lut??tium-184); les isotopes les plus stables telles sont lut??tium-174, avec une demi-vie de 3,31 ans et le lut??tium-173, avec une demi-vie de 1,37 ans. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 9 jours, et la majorit?? d'entre eux ont des demi-vies qui sont ?? moins d'une demi-heure. Isotopes plus l??ger que l'??curie d??croissance lut??cium-175 via capture d'??lectrons (pour produire des isotopes de l' ytterbium ), avec une certaine alpha et la tomographie par ??mission); les isotopes plus lourds se d??sint??grent principalement par d??sint??gration b??ta, la production d'isotopes d'hafnium.
L'??l??ment 42 comporte ??galement isom??res nucl??aires, avec des masses de 150, 151, 153-162, 166-180 (pas tous un num??ro de masse correspond ?? un seul isom??re). Le plus stable d'entre eux sont lut??tium-177m, avec demi-vie de 160,4 jours et le lut??tium-174m, avec demi-vie de 142 jours; ce est plus longue que la demi-vie des ??tats fondamentaux de tous les isotopes radioactifs de lut??tium, sauf que pour le lut??cium-173, 174 et 176.
Histoire
Lut??tium, d??riv?? du latin Lutetia ( Paris ), ??tait ind??pendamment d??couvert en 1907 par le scientifique fran??ais Georges Urbain, min??ralogiste autrichien Baron Carl Auer von Welsbach et chimiste am??ricain Charles James. Ils ont trouv?? comme impuret?? dans ytterbium, qui a ??t?? pens?? par le chimiste suisse Jean Charles Galissard de Marignac ?? constitu??s enti??rement de l'ytterbium . Les scientifiques ont propos?? des noms diff??rents pour les ??l??ments: Urbain a choisi neoytterbium et le lut??cium, tandis que Welsbach choisi aldebaranium et cassiopeium. Ces deux articles se accusent mutuellement de la publication des r??sultats sur la base de l'autre partie.
La Commission sur la masse atomique, qui ??tait alors responsable de l'attribution de nouveaux noms d'??l??ments, a r??gl?? le diff??rend en 1909 en accordant la priorit?? ?? Urbain et l'adoption de ses noms comme ceux officielles, bas??es sur le fait que la s??paration des lut??cium de la ytterbium de Marignac a ??t?? le premier d??crit par Urbain; apr??s les noms de Urbain ont ??t?? reconnus, neoytterbium a ??t?? revenue ?? l'ytterbium. Jusque dans les ann??es 1950, certains chimistes allemands appel??s par leur nom de lut??tium cassiopeium de von Welsbach; en 1949, l'orthographe de l'??l??ment 71 a ??t?? modifi?? au lut??cium. Cependant, 1907 ??chantillons de Welsbach de lut??tium avaient ??t?? pure, tandis que les ??chantillons de 1907 Urbain contenaient seulement des traces de lut??tium. Ce tromp?? tard Urbain en pensant qu'il avait d??couvert l'??l??ment 72, qu'il nomma celtium , qui ??tait en fait le lut??tium tr??s pur. Charles James, qui est rest?? hors de l'argument prioritaire, a travaill?? sur une ??chelle beaucoup plus grande et poss??dait la plus grande offre de lut??tium ?? l'??poque. Pur lut??tium m??tal a ??t?? la premi??re fois en 1953.
Pr??sence et la production

Trouv?? avec presque tous les autres m??taux des terres rares mais jamais par elle-m??me, le lut??tium est tr??s difficile de s??parer d'autres ??l??ments. Le principal minerai commercialement viable de lut??tium est la terre rare phosphate min??ral monazite: ( Ce , La , etc.) P O 4, qui contient 0,0001% de l'??l??ment. L'abondance de lut??tium dans la cro??te terrestre est seulement d'environ 0,5 mg / kg. Les principales zones mini??res sont la Chine , ??tats-Unis , le Br??sil , l'Inde , le Sri Lanka et l'Australie . La production mondiale de lut??tium (sous la forme d'oxyde) est d'environ 10 tonnes par an. Pur lut??tium m??tal est tr??s difficile ?? pr??parer. Il est l'un des plus rare et le plus cher des m??taux des terres rares avec le prix environ US $ 10 000 par kilogramme, soit environ un quart de celle de l'or .
Min??raux broy??s sont trait??es avec des concentr??e chaude d'acide sulfurique pour produire des sulfates de terres rares soluble dans l'eau. thorium pr??cipite dans la solution sous forme d'hydroxyde et est enlev??e. Apr??s que la solution est trait??e avec oxalate d'ammonium pour convertir les terres rares dans leurs oxalates insolubles. Les oxalates sont convertis en oxydes par recuit. Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des principaux composants, le c??rium , dont l'oxyde est insoluble dans HNO 3. Plusieurs m??taux de terres rares, y compris le lut??tium, sont s??par??s comme un double sel avec du nitrate d'ammonium par cristallisation. Lut??tium est s??par?? par l'??change d'ions. Dans ce proc??d??, les ions de terres rares sont adsorb??s sur la r??sine ??changeuse d'ions appropri??e, par ??change avec de l'hydrog??ne, l'ammonium ou des ions cuivriques pr??sents dans la r??sine. sels de lut??tium sont ensuite lav??es s??lectivement par agent complexant appropri??. Lutetium m??tal est alors obtenue par r??duction des anhydre Lu Cl 3 ou Lu F 3 soit par un m??tal alcalin ou m??tal alcalino-terreux .
- 2 LUCL 3 + 3 → Ca 2 + 3 Lu CaCl2
Applications
En raison de la raret?? et le prix ??lev??, le lut??tium a tr??s peu d'utilisations commerciales. Cependant, le lut??tium stable peut ??tre utilis?? en tant que catalyseurs en p??trole craquage dans les raffineries et peut ??galement ??tre utilis?? dans l'alkylation, l'hydrog??nation , et des applications de polym??risation.
Lut??cium grenat d'aluminium (Al 5 O 12 Lu 3) a ??t?? propos?? pour une utilisation comme mat??riau de lentille en haut indice de r??fraction la lithographie par immersion. En outre, une petite quantit?? de lut??tium est ajout?? en tant que dopant ?? gadolinium gallium grenat (GGG), qui est utilis?? dans dispositifs de m??moire ?? bulles magn??tiques. C??rium dop?? lut??tium oxyorthosilicate (LSO) est actuellement le compos?? pr??f??r?? pour les d??tecteurs dans tomographie par ??mission de positrons (PET). Lut??tium est utilis?? comme un phosphore dans les ampoules LED.
Mis ?? part le lut??tium stable, ses isotopes radioactifs ont plusieurs utilisations sp??cifiques. Le mode demi-vie et de la d??composition appropri??e fait lut??tium-176 utilis?? comme un ??metteur b??ta pur, en utilisant le lut??tium qui a ??t?? expos?? ?? activation neutronique, et le lut??tium-hafnium datant de la date m??t??orites. L'isotope synth??tique lut??tium-177 li?? ?? octr??otate (a analogue de la somatostatine), est utilis?? exp??rimentalement cibl??e la th??rapie par radionucl??ides pour tumeurs neuroendocrines.
Tantalate de lut??tium (LuTaO 4) est la mati??re la plus dense connue stable blanc (densit?? 9,81 g / cm 3) et par cons??quent est un h??te id??al pour les luminophores X-ray. Le mat??riau blanc seulement plus dense est le dioxyde de thorium, avec une densit?? de 10 g / cm 3, mais il contient le thorium est radioactif.
Pr??cautions
Comme d'autres m??taux des terres rares, le lut??tium est consid??r?? comme ayant un degr?? de toxicit?? faible, mais ses compos??s doit ??tre manipul?? avec soin n??anmoins: par exemple, l'inhalation de fluorure lut??tium est dangereux et le compos?? irrite la peau. nitrate de Lutetium peut ??tre dangereux car il peut d'exploser et de br??ler une fois chauff??. poudre d'oxyde de lut??cium est toxique aussi bien si inhal?? ou ing??r??.
De la m??me fa??on avec une autre groupe 3 ??l??ments et les lanthanides, le lut??tium a pas de r??le biologique connu, mais il se trouve m??me dans les ??tres humains , en se concentrant dans les os, et dans une moindre mesure dans le foie et les reins. sels de lut??tium sont connus pour se produire avec d'autres sels lanthanides dans la nature; l'??l??ment est le moins abondant dans le corps humain de tous les lanthanides. L'alimentation humaine ne ont pas ??t?? suivis pour le contenu de lut??tium, donc on ne sait pas combien l'humain moyen prend en, mais estimations montrer le montant ne est que de plusieurs microgrammes par ann??e, provenant tous de petites quantit??s prises par les plantes. Sels solubles lut??tium sont l??g??rement toxiques, mais ceux ne sont pas insolubles.
