
Acide sulfurique
Saviez-vous ...
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. M??res SOS chaque regard apr??s une une famille d'enfants parrain??s .
| Acide sulfurique | |
|---|---|
 | |
 | |
Acide Sulfurique | |
Autres noms huile de vitriol | |
| Identificateurs | |
| Num??ro CAS | 7664-93-9 |
| Num??ro RTECS | WS5600000 |
| Propri??t??s | |
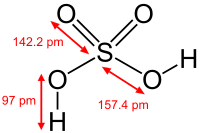
| Formule mol??culaire | H 2 SO 4 |
| Masse molaire | 98,078 g / mol |
| Apparence | limpide, incolore, liquide inodore, |
| Densit?? | 1,84 g cm -3, liquide |
| Point de fusion | 10 ?? C, 283 K, 50 ?? F |
| Point d'??bullition | 290 ?? C, 563 K, 554 ?? F (pb de l'acide pur. 98% de solution bout ?? 338 ?? C) |
| Solubilit?? dans l'eau | enti??rement miscible (Exothermique) |
| Viscosit?? | 26,7 c P ?? 20 ?? C |
| Risques | |
| FS | MSDS externe |
| Classification UE | Hautement corrosifs (C) |
| Phrases-R | R35 |
| Phrases S | (S1 / 2), S26, S30, S45 |
| NFPA 704 |  0 3 2 COR |
| Point d'??clair | Ininflammable |
| Des compos??s apparent??s | |
| Connexe les acides forts | Acide s??l??nique Acide chlorhydrique Acide nitrique |
| Des compos??s apparent??s | Le sulfure d'hydrog??ne L'acide sulfureux Acide de Caro Le trioxyde de soufre Oleum |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
L'acide sulfurique, (??galement connu comme l'acide sulfurique) H 2 S O 4, est un solide un acide min??ral. Il est soluble dans l'eau ?? toutes les concentrations. Il ??tait autrefois connu comme l'huile de vitriol, invent?? par le 8??me si??cle Alchimiste musulman Jabir ibn Hayyan (Geber) apr??s sa d??couverte de la substance chimique. L'acide sulfurique a de nombreuses applications, et est l'un des meilleurs produits de la industrie chimique. La production mondiale en 2001 ??tait de 165 millions tonnes, d'une valeur approximative de 8 milliards de dollars. Principales utilisations comprennent traitement du minerai, engrais fabrication, le raffinage du p??trole , le traitement des eaux us??es, et synth??se chimique.
De nombreuses prot??ines sont faites de soufre -contenant des acides amin??s (tels que la cyst??ine et m??thionine) qui produisent de l'acide sulfurique lorsque m??tabolis?? par l'organisme.
Occurrence
Acide pur (non dilu??) sulfurique ne se rencontre pas sur la Terre, en raison de grande affinit?? de l'acide sulfurique pour l'eau. En dehors de cela, l'acide sulfurique est un constituant de la pluie acide , qui est form?? par l'air oxydation de le dioxyde de soufre en pr??sence d' eau , ?? savoir, l'oxydation de l'acide sulfureux. Le dioxyde de soufre est le sous-produit principal produit lorsque des combustibles contenant du soufre, comme le charbon ou d'huile sont br??l??s.
L'acide sulfurique est form??e naturellement par oxydation de min??raux sulfur??s, tels que le sulfure de fer. L'eau qui en r??sulte peut ??tre tr??s acide et est appel?? Drainage minier acide (DMA). Cette eau acide est capable de dissoudre les m??taux pr??sents dans les minerais de sulfure, ce qui entra??ne de couleurs vives, les ruisseaux toxiques. L'oxydation du sulfure de fer pyrite par l'oxyg??ne mol??culaire produit du fer (II) ou Fe 2+:
Le Fe2 + peut en outre ??tre oxyd?? en Fe 3+, selon:
et le Fe 3+ produite peut ??tre pr??cipit?? sous la forme hydroxyde ou oxyde hydrat??. L'??quation pour la formation de l'hydroxyde est
- Fe 3+ + 3 H 2 O → Fe (OH) 3 + 3 H +.
Le fer (III) d'ions ("de fer ferrique", dans la nomenclature occasionnel) peut ??galement oxyder pyrite. Lorsque le fer (III) l'oxydation de la pyrite se produit, le processus peut devenir rapide. des valeurs de pH en dessous de z??ro ont ??t?? mesur??es dans AMD produite par ce processus.
La DMLA peut ??galement produire de l'acide sulfurique ?? un d??bit plus lent, de sorte que le Neutralisation de l'acide Capacit?? (ANC) de l'aquif??re peut neutraliser l'acide produit. Dans de tels cas, la Total des solides dissous (TDS) de concentration de l'eau peuvent ??tre augment??es forme la dissolution des min??raux de la r??action acide-neutralisation avec les min??raux.
L'acide sulfurique extraterrestre
L'acide sulfurique est produit dans la haute atmosph??re de V??nus par le soleil de action photochimique sur le dioxyde de carbone , le dioxyde de soufre, et de l'eau vapeur. ultraviolets photons de longueurs d'onde de moins de 169 nm peut photodissociate dioxyde de carbone en monoxyde de carbone et atomes d'oxyg??ne . L'oxyg??ne atomique est tr??s r??actif. Quand il r??agit avec le dioxyde de soufre, un composant de trace de l'atmosph??re v??nusienne, le r??sultat est le trioxyde de soufre, qui peut se combiner avec la vapeur d'eau, un autre composant de trace de l'atmosph??re de V??nus, pour donner l'acide sulfurique.
Dans les parties sup??rieures, plus froides de l'atmosph??re de V??nus, l'acide sulfurique existe sous forme liquide, et ??pais acide sulfurique nuages la surface de la plan??te compl??tement obscure en vue de dessus. La couche de nuages principale se ??tend de 45 ?? 70 km au-dessus de la surface de la plan??te, avec des brumes minces se ??tendant aussi bas que 30 et aussi ??lev??es que 90 kilom??tres au-dessus de la surface.
Spectres infrarouge de la NASA s ' Galileo mission montrent absorptions distinctes sur Jupiter moon s ' Europa qui ont ??t?? attribu??es ?? un ou plusieurs hydrates de l'acide sulfurique. L'interpr??tation des spectres est quelque peu controvers??e. Certains scientifiques plan??taires pr??f??rent affecter les caract??ristiques spectrales ?? l'ion de sulfate, peut-??tre dans le cadre d'un ou plusieurs min??raux ?? la surface de Europa.
Fabrication
L'acide sulfurique est produit ?? partir de soufre , de l'oxyg??ne et de l'eau via le processus de contact.
Dans la premi??re ??tape, le soufre est br??l?? pour produire le dioxyde de soufre.
Ce est ensuite oxyd?? en le trioxyde de soufre en utilisant de l'oxyg??ne en pr??sence d'un vanadium (V) de l'oxyde catalyseur .
- (2) 2 SO 2 + O 2 (g) → 2 SO 3 (g) (en pr??sence de V 2 O 5)
Enfin, le le trioxyde de soufre est trait?? avec de l'eau (g??n??ralement de 97 ?? 98% de H 2 SO 4 contenant 3.2% d'eau) pour produire de l'acide sulfurique 98-99%.
Notez que la dissolution directement SO 3 dans l'eau ne est pas pratique en raison de la tr??s nature exothermique de la r??action , formant un brouillard corrosif au lieu d'un liquide. Alternativement, SO 3 peut ??tre absorb??e par H 2 SO 4 pour produire ol??um (H 2 S 2 O 7), qui peut ensuite ??tre m??lang?? avec l'eau pour former de l'acide sulfurique.
- (3) H 2 SO 4 8 ( l 8) SO 3 + H 2 S → 2 O 7 (l)
Oleum est mis ?? r??agir avec l'eau pour former H 2 SO 4 concentr??.
- (4) H 2 S 2 O 7 (l) + H 2 O (l) 2 → H 2 SO 4 (l)
Propri??t??s physiques
Les formes de l'acide sulfurique
Bien que l'acide sulfurique ?? pr??s de 100% peut ??tre faite, ce perd SO 3 au point d'??bullition pour produire 98,3% d'acide. La note de 98% (18M) est plus stable au stockage, et est la forme habituelle de ce qui est d??crit comme l'acide sulfurique concentr??. Autre Les concentrations sont utilis??es ?? des fins diff??rentes. Des concentrations courantes sont
- 10%, l'acide sulfurique dilu?? pour une utilisation en laboratoire,
- 33,5%, l'acide de batterie (utilis?? dans batteries plomb-acide),
- 62,18%, la chambre ou de l'acide d'engrais,
- 77,67%, une tour ou l'acide Glover,
- 98%, de l'acide concentr??.
Diff??rentes puret??s sont ??galement disponibles. Qualit?? technique H 2 SO 4 est impur et souvent de couleur, mais est adapt?? pour faire de l'engrais. Nuances pures telles que, ??tats-Unis (USP) de grade sont utilis??s pour la fabrication produits pharmaceutiques et les mati??res colorantes.
Lorsque de fortes concentrations de SO 3 ( g ) sont ajout??s ?? de l'acide sulfurique, H 2 S 2 O 7, appel??e pyrosulfurique acide, l'acide sulfurique fumant ou oleum ou, moins fr??quemment, l'acide Nordhausen, est form??. Les concentrations de oleum sont soit exprim?? en termes de% SO 3 (appel?? oleum%) ou en tant que% de H 2 SO 4 (le montant fait si H 2 O ont ??t?? ajout??s); Les concentrations courantes sont l'ol??um 40% (109% de H 2 SO 4) et l'ol??um 65% (114,6% de H 2 SO 4). Pur H 2 S 2 O 7 est un solide ?? point de fusion 36 ?? C.
La polarit?? et la conductivit??
Anhydre H 2 SO 4 est une tr??s liquide polaire, ayant une constante di??lectrique de l'ordre de 100. Il a une conductivit?? ??lectrique ??lev??e, provoqu??e par dissociation par se protonant, un processus connu sous le nom autoprotolyse.
- 2 H 2 SO 4 ⇌ H 3 SO 4 + 4 + ASS -
Le la constante d'??quilibre pour la autoprotolyse est
- K p (25 ?? C) = [H 3 SO 4 +] [HSO 4 -] = 2,7 x 10 -4.
La constante d'??quilibre pour comparable eau, K w est de 10 -14, un facteur de 10 10 (10,000,000,000) plus petit.
En d??pit de la viscosit?? de l'acide, l'efficacit?? conductivit?? de la H 3 SO 4 + et HSO 4 - ions sont ??lev??s en raison d'un m??canisme intra-mol??culaire protons interrupteur (analogue ?? la Grotthuss m??canisme dans l'eau), ce qui rend l'acide sulfurique un bon conducteur. Ce est ??galement un excellent solvant pour de nombreuses r??actions.
L' ??quilibre est en fait plus complexe que montr?? ci-dessus; 100% de H 2 SO 4 contient les esp??ces suivantes ?? l'??quilibre (chiffres pr??sent??s comme millimole par kg de solvant): HSO 4 - (15,0), H 3 SO 4 + (11.3), H 3 O + (8,0), HS 2 O 7 - (4,4), H 2 S 2 O 7 (3,6), H 2 O (0,1).
Propri??t??s chimiques
R??action avec l'eau
Le r??action d'hydratation de l'acide sulfurique est tr??s exothermique. Si l'eau est ajout?? ?? l'acide sulfurique concentr??, il peut r??agir, ??bullition et cracher dangereusement. Il faut toujours ajouter l'acide ?? l'eau plut??t que de l'eau ?? l'acide. Cela peut se rappeler par mn??moniques tels que: ". Faites ce que tu devrais, ajouter l'acide ?? l'eau", "Si vous pensez trop placide, ajouter l'eau ?? l'acide de votre vie", "AA: ajouter de l'acide", ou "Acid Drop, pas d'eau", ou "acide ?? l'eau, comme A & W Root Beer "ou" Mettez le roi dans l'eau, pas de l'eau dans le roi ". La n??cessit?? de cette mesure de s??curit?? est due aux densit??s relatives de ces deux liquides. L'eau est moins dense que l'acide sulfurique, ce qui signifie l'eau aura tendance ?? flotter au-dessus de cet acide. La r??action est meilleure pens??e de comme faisant ions hydronium, par
- H 2 SO 4 + H 2 O → H 3 O + + HSO 4 -,
et puis
- HSO 4 - + H 2 O → H 3 O + + SO 4 2-.
Parce que l'hydratation de l'acide sulfurique est thermodynamiquement favorable, l'acide sulfurique est un excellent agent de d??shydratation, et est utilis?? pour pr??parer de nombreux fruits secs. L'affinit?? de l'acide sulfurique pour l'eau est suffisamment forte qu'elle va supprimer hydrog??ne et oxyg??ne atomes d'autres compos??s; par exemple, en m??langeant amidon (C 6 H 12 O 6) n et de l'acide sulfurique concentr?? donne ??l??mentaire du carbone et de l'eau qui est absorb??e par l'acide sulfurique (qui devient l??g??rement dilu??): (C 6 H 12 O 6) n → 6C + 6H 2 O. L'effet de ceci peut ??tre vu lorsque l'acide sulfurique concentr?? est renvers?? sur le papier; la cellulose r??agit pour donner un aspect br??l??, le carbone appara??t beaucoup plus comme de la suie serait dans un incendie. Une r??action plus dramatique se produit lorsque l'acide sulfurique est ajout?? ?? une cuill??re ?? soupe de blanc sucre ; une colonne rigide de noir, carbone poreux va rapidement ??merger. Le carbone se sentir fortement de caramel.
Autres r??actions
A titre d'acide, l'acide sulfurique r??agit avec la plupart bases pour donner le sulfate . Par exemple, le sulfate de cuivre (II) . Ce sel bleu du cuivre , couramment utilis?? pour ??lectrod??position et en tant que fongicide, est pr??par?? par la r??action de cuivre (II) oxyde avec de l'acide sulfurique:
L'acide sulfurique peut aussi ??tre utilis?? pour d??placer des acides plus faibles ?? partir de leurs sels. La r??action avec l'ac??tate de sodium, par exemple, d??place l'acide ac??tique :
- H 2 SO 4 + CH 3 COONa → NaHSO 4 + CH 3 COOH
De m??me, la r??action d'acide sulfurique avec du nitrate de potassium peut ??tre utilis?? pour produire de l'acide nitrique et un pr??cipit?? de le bisulfate de potassium. Lorsqu'il est combin?? avec de l'acide nitrique , l'acide sulfurique sert ?? la fois un acide et un agent d??shydratant pour former le ion nitronium NO 2 +, ce qui est important dans impliquant des r??actions de nitration une substitution aromatique ??lectrophile. Ce type de r??action, o?? se produit sur une protonation de l'oxyg??ne atomique, est important dans de nombreux chimie organique , tels que des r??actions Est??rification de Fischer et la d??shydratation d'alcools.
L'acide sulfurique r??agit avec la plupart des m??taux par l'interm??diaire d'une r??action de d??placement unique pour produire de l'hydrog??ne gazeux et le sulfate de m??tal. Diluer H 2 SO 4 attaques de fer , aluminium , zinc , mangan??se , magn??sium et de nickel , mais les r??actions avec l'??tain et le cuivre n??cessite l'acide d'??tre chaud et concentr??. plomb et de tungst??ne , cependant, sont r??sistantes ?? l'acide sulfurique. La r??action avec le fer (repr??sent??) est typique pour la plupart de ces m??taux, mais la r??action avec de l'??tain est inhabituel en ce qu'il produit le dioxyde de soufre au lieu de l'hydrog??ne.
- Sn (s) + 2 H 2 SO 4 (aq) → SnSO 4 (aq) + 2 H 2 O (l) + SO 2 (g)
L'acide sulfurique subit une substitution aromatique ??lectrophile avec des compos??s aromatiques pour donner le les acides sulfoniques:

Utilisations

L'acide sulfurique est un tr??s important produits chimiques, et en effet, la production d'acide sulfurique d'une nation est un bon indicateur de sa force industrielle. L'utilisation majeure (60% de la production mondiale totale) de l'acide sulfurique est dans la "voie humide" pour la production d' acide phosphorique , utilis?? pour la fabrication de phosphate engrais ainsi que phosphate trisodique pour d??tergents. Dans cette m??thode, la roche phosphat??e est utilis??, et plus de 100 millions de tonnes sont trait??es chaque ann??e. Cette mati??re premi??re est repr??sent??e ci-dessous fluorapatite, si la composition exacte peut varier. Ce est trait??e avec de l'acide sulfurique ?? 93% pour produire le sulfate de calcium, le fluorure d'hydrog??ne (HF) et d'acide phosphorique . Le HF est retir?? en tant que l'acide fluorhydrique. L'ensemble du processus peut ??tre repr??sent?? comme:
L'acide sulfurique est utilis?? en grandes quantit??s par le fer et la sid??rurgie industrie pour enlever l'oxydation, rouille et ??chelle de feuille et billettes avant lamin??s de la vente au automobile et l'industrie des produits blancs. Acide utilis?? est souvent recycl?? par une usine d'acide ??puis?? r??g??n??ration (SAR). Ces plantes br??ler acide us?? avec le gaz naturel, le gaz de raffinerie, le mazout ou d'autres sources de carburant. Ce processus de combustion produit du dioxyde de soufre gazeux (SO 2) et de trioxyde de soufre (SO 3), qui sont ensuite utilis??es pour fabriquer de l'acide "nouveau" sulfurique. SAR plantes sont des ajouts communs aux usines de fusion de m??taux, les raffineries de p??trole et d'autres industries o?? l'acide sulfurique est consomm?? en vrac, comme l'exploitation d'une usine de SAR est beaucoup moins cher que les co??ts r??currents de l'??limination de l'acide us?? et de nouveaux achats d'acide.
Le sulfate d'ammonium, un important engrais azot??, est le plus souvent un sous-produit de cokeries fournissant le fer et les usines de fabrication de l'acier. Faire r??agir le ammoniac produit dans la d??composition thermique du charbon avec de l'acide sulfurique r??siduaire permet ?? l'ammoniac d'??tre cristallis?? sous forme de sel (souvent brun raison de la contamination de fer) et vendu ?? l'industrie agro-chimiques.
Une autre utilisation importante de l'acide sulfurique est destin?? ?? la fabrication de sulfate d'aluminium, ??galement connu comme l'alun de fabricant de papier. Cela peut r??agir avec de petites quantit??s de savon sur des fibres de p??te ?? papier pour donner aluminium g??latineux carboxylates, qui aident ?? coaguler les fibres de p??te en une surface de papier dur. Il est ??galement utilis?? pour la fabrication de l'hydroxyde d'aluminium, qui est utilis?? ?? usines de traitement d'eau ?? filtrer les impuret??s, ainsi que pour am??liorer le go??t de l' eau . sulfate d'aluminium est pr??par?? en faisant r??agir bauxite avec de l'acide sulfurique:
L'acide sulfurique est utilis?? pour une vari??t?? d'autres fins dans l'industrie chimique. Par exemple, ce est le catalyseur acide habituel pour la conversion de cyclohexanoneoxime ?? caprolactame, utilis?? pour la fabrication nylon. Il est utilis?? pour la fabrication de l'acide chlorhydrique ?? partir de par l'interm??diaire du sel Proc??d?? Mannheim. Une grande partie du H 2 SO 4 est utilis?? dans le p??trole raffinage, par exemple comme un catalyseur pour la r??action de isobutane avec pour donner isobutyl??ne iso-octane, d'un compos?? qui ??l??ve le l'indice d'octane de essence (essence). L'acide sulfurique est ??galement important dans la fabrication de solutions de colorants et est "acide" en plomb (batteries automobiles).
L'acide sulfurique est ??galement utilis?? comme agent d??shydratant g??n??ral sous sa forme concentr??e. Voir r??action avec l'eau .
Cycle soufre-iode
Le cycle de soufre-iode est une s??rie de proc??d??s thermochimiques utilis??es pour obtenir de l'hydrog??ne . Il se compose de trois r??actions chimiques dont r??actif net est l'eau et dont les produits nets sont l'hydrog??ne et l'oxyg??ne .
-
2 H 2 S O 2 → 4 S O 2 + 2 H 2 O + O 2 (830 ?? C) I 2 + S O 2 + 2 H 2 O → 2 H I + H 2 S O 4 (120 ?? C) 2 H I → I + 2 H 2 (320 ?? C)
Les soufre et iode compos??s sont r??cup??r??s et r??utilis??s, donc l'examen du processus comme un cycle. Ce processus est endothermique et doit avoir lieu ?? des temp??ratures ??lev??es, de sorte que l'??nergie sous forme de chaleur doit ??tre fournie.
Le cycle de soufre-iode a ??t?? propos??e comme un moyen de fournir de l'hydrog??ne ?? une ??conomie de l'hydrog??ne. Il ne n??cessite pas les hydrocarbures tels que les m??thodes actuelles de reformage ?? la vapeur.
Le cycle iode-soufre est actuellement ?? l'??tude comme une m??thode possible d'obtenir de l'hydrog??ne, mais la, acide corrosif concentr??s ?? haute temp??rature pr??sente des risques de s??curit?? actuellement insurmontables si le processus a ??t?? construit sur une grande ??chelle.
Histoire

La d??couverte de l'acide sulfurique est cr??dit?? au 8??me si??cle Arabian chimiste et alchimiste, Jabir ibn Hayyan (Geber). L'acide a ensuite ??t?? ??tudi?? par 9??me si??cle Persique m??decin et alchimiste Ibn Zakariya al-Razi (Rhazes), qui a obtenu la substance par distillation s??che de min??raux, y compris de fer (II) heptahydrate de sulfate, FeSO 4 ??? 7H 2 O, et de cuivre (II) sulfate pentahydrat??, CuSO 4 ??? 5H 2 O. Lorsqu'il est chauff??, ces compos??s se d??composent pour oxyde de fer (II) et oxyde de cuivre (II), respectivement, en d??gageant de l'eau et le trioxyde de soufre, qui se combinent pour produire une solution dilu??e d'acide sulfurique. Cette m??thode a ??t?? popularis??e en Europe par des traductions de l'arabe et trait??s persans, ainsi que des livres par les alchimistes europ??ens, tels que le 13e si??cle allemand Albertus Magnus.
L'acide sulfurique a ??t?? connu pour alchimistes m??di??vaux europ??ens comme l'huile de vitriol, l'esprit de vitriol, ou simplement vitriol, parmi d'autres noms. Le mot d??rive du vitriol vitreus latine, "verre", se r??f??rant ?? l'aspect vitreux des sels de sulfate, qui a ??galement port?? le nom de vitriol. Sels appel??s par ce nom inclus sulfate de cuivre (II) (vitriol bleu, ou rarement romaine vitriol), sulfate de zinc (de vitriol blanc), fer (II) sulfate (de vitriol vert), fer (III) sulfate (vitriol de Mars), et cobalt (II) sulfate (vitriol rouge).
Vitriol a ??t?? largement consid??r?? comme le plus important alchimique substance, destin?? ?? ??tre utilis?? comme un pierre philosophale. Hautement vitriol purifi?? a ??t?? utilis?? comme milieu pour la r??action d'autres substances. Ce est en grande partie parce que l'acide ne r??agit pas avec l'or , dont la production ??tait souvent l'objectif final du processus alchimiques. L'importance de vitriol ?? l'alchimie est mis en ??vidence dans la devise alchimique, Visita interiora Terrae Rectificando Invenies Occultum Lapidem qui est un sens de backronym (??Visite de l'int??rieur de la terre et de redressement (ce est ?? dire la purification), vous trouverez la pierre cach??e / secret??), trouv?? dans L'Azoth des Philosophes par l'alchimiste du 15??me si??cle Basile Valentin,.
Au 17??me si??cle, le chimiste allemand-n??erlandais Johann Glauber pr??par?? l'acide sulfurique par la combustion du soufre avec le salp??tre ( nitrate de potassium , KNO 3), en pr??sence de vapeur. Comme le salp??tre se d??compose, il oxyde le soufre SO 3, qui se combine avec l'eau pour produire de l'acide sulfurique. En 1736, Joshua Ward, London pharmacien, a utilis?? cette m??thode pour commencer la premi??re production ?? grande ??chelle d'acide sulfurique.
En 1746, dans Birmingham , John Roebuck adapt?? cette m??thode pour produire de l'acide sulfurique dans plomb chambres -Doubl??s, qui ??taient plus forts, moins cher, et pourrait ??tre plus grande que les r??cipients en verre utilis??s pr??c??demment. Cette processus de chambre plomb a permis l'industrialisation efficace de production d'acide sulfurique. Apr??s plusieurs am??liorations, cette m??thode est rest??e la norme pendant pr??s de deux si??cles pour la production d'acide sulfurique.
L'acide sulfurique cr???? par le processus de John Roebuck seulement approch?? une concentration de 35 ?? 40%. Raffinements plus tard pour le processus plomb chambre par chimiste fran??ais Joseph-Louis Gay-Lussac et chimiste britannique John Glover am??lior?? le rendement ?? 78%. Toutefois, la fabrication de certaines colorants et autres proc??d??s chimiques n??cessitent un produit plus concentr??. Tout au long du 18??me si??cle, cela ne pouvait ??tre faite par min??raux de distillation ?? sec dans une technique semblable ?? l'original alchimiques processus. pyrite ( de disulfure de fer , FeS 2) a ??t?? chauff?? dans l'air pour produire de fer (II) sulfate, FeSO 4, qui a ??t?? oxyd?? par un chauffage suppl??mentaire dans l'air pour former fer (III) sulfate, Fe 2 (SO 4) 3, qui, lorsqu'il est chauff?? ?? 480 ?? C, d??compos?? pour de fer (III) de l'oxyde et le trioxyde de soufre, qui peut ??tre pass?? ?? travers l'eau pour donner de l'acide sulfurique ?? une concentration quelconque. Cependant, la charge de ce processus a emp??ch?? l'utilisation ?? grande ??chelle d'acide sulfurique concentr??.
En 1831, la Colombie- vinaigre marchand Peregrine Phillips a brevet?? le proc??d?? de contact, qui est un proc??d?? beaucoup plus ??conomique pour produire du trioxyde de soufre et de l'acide sulfurique concentr??. Aujourd'hui, la quasi-totalit?? de l'acide sulfurique dans le monde est produite en utilisant cette m??thode.
S??curit??
les risques de laboratoire

Les propri??t??s corrosives de l'acide sulfurique sont accentu??s par sa tr??s r??action exothermique avec l'eau . Br??le donc de l'acide sulfurique sont potentiellement plus graves que celles des acides forts comparables (par exemple l'acide chlorhydrique ), comme il ya des dommages de tissu suppl??mentaire d?? ?? la d??shydratation et en particulier en raison de la chaleur d??gag??e par la r??action avec de l'eau; ce est ?? dire les dommages thermiques secondaire. Le danger est ??videmment plus grande avec des pr??parations plus concentr??es d'acide sulfurique, mais il faut se rappeler que m??me le laboratoire normale "diluer" qualit?? (env. 1 M, 10%) se carboniser papier par d??shydratation si on les laisse en contact pendant un certain temps suffisante. Solutions ??gales ou plus fort que 1,5 M doivent ??tre ??tiquet??s corrosif, irritant tandis que les solutions sup??rieure ?? 0,5 M, mais moins de 1,5 M devraient ??tre ??tiquet??s. L'acide sulfurique fumant (ol??um) ne est pas recommand?? pour une utilisation dans les ??coles parce qu'elle est tr??s dangereux. Le traitement de secourisme g??n??ral pour les d??versements d'acide sur la peau est, comme pour les autres corrosifs agents, l'irrigation avec de grandes quantit??s d'eau: laver doit ??tre poursuivi pendant au moins dix ?? quinze minutes pour refroidir le tissu entourant la br??lure ?? l'acide et ?? emp??cher dommages secondaires. Les v??tements contamin??s doivent ??tre retir??s imm??diatement et la peau sous-jacente lav?? ?? fond.
Pr??paration de l'acide dilu?? peut aussi ??tre dangereux en raison de la chaleur lib??r??e dans le processus de dilution. Il est essentiel que l'acide concentr?? est ajout?? ?? l'eau et non l'inverse, pour profiter de la relativement ??lev??e capacit?? calorifique de l'eau. L'addition d'eau ?? l'acide sulfurique concentr?? conduit au mieux ?? la dispersion d'un acide sulfurique a??rosol, au pire ?? un explosion. Pr??paration des solutions de plus de 6 M (35%) de la concentration est la plus dangereuse, car la chaleur produite peut ??tre suffisant pour faire bouillir l'acide dilu??: agitation m??canique efficace et refroidissement externe (par exemple un bain de glace) sont essentiels.
Les risques industriels
Bien que l'acide sulfurique est ininflammable, contact avec des m??taux dans le cas de d??versement peut conduire ?? la lib??ration de l'hydrog??ne gazeux. La dispersion des a??rosols acides gazeux et le dioxyde de soufre est un risque suppl??mentaire d'incendies impliquant l'acide sulfurique.
L'acide sulfurique ne est pas consid??r?? comme toxique en plus de son danger corrosive ??vident, et les principaux risques professionnels sont contact avec la peau conduisant ?? des br??lures (voir ci-dessus) et l'inhalation des a??rosols. L'exposition ?? des a??rosols ?? des concentrations ??lev??es conduit ?? une irritation s??v??re et imm??diat des yeux, les voies respiratoires et les muqueuses: ce cesse rapidement apr??s l'exposition, mais il existe un risque ult??rieur de ??d??me pulmonaire en cas de dommages de tissu a ??t?? plus s??v??re. A des concentrations inf??rieures, le sympt??me le plus fr??quemment rapport?? d'une exposition chronique aux a??rosols d'acide sulfurique est l'??rosion des dents, a trouv?? dans presque toutes les ??tudes: indications de possibles dommages chroniques ?? la voies respiratoires ne sont pas concluants ?? partir de 1997. Dans le ??tats-Unis , le limite d'exposition admissible (PEL) pour l'acide sulfurique est fix?? ?? 1 mg / m??: limites dans d'autres pays sont similaires. Fait int??ressant, il ya eu des rapports de l'ingestion d'acide sulfurique conduisant ?? carence en vitamine B12 avec subaigu?? combin??e d??g??n??rescence. La moelle ??pini??re est le plus souvent affect??e dans de tels cas, mais les nerfs optiques peut montrer d??my??linisation, la perte de axones et gliose.
Les restrictions l??gales
Le commerce international de l'acide sulfurique est contr??l?? par le Convention des Nations Unies contre le trafic illicite de stup??fiants et de substances psychotropes, 1988, qui ??num??re l'acide sulfurique dans le tableau II de la convention comme un produit chimique fr??quemment utilis?? dans la fabrication illicite de stup??fiants ou de substances psychotropes.
Au Etats-Unis d'Am??rique , l'acide sulfurique est compris dans Liste II de la liste des produits chimiques essentiels ou pr??curseurs ??tabli conform??ment ?? la Loi sur la traite d??tournement de pr??curseurs chimiques et. En cons??quence, les op??rations de l'acide sulfurique, tels que les ventes, les transferts, les exportations et les importations aux ??tats-Unis-sont assujettis ?? la r??glementation et la surveillance par le Drug Enforcement Administration.
Dans la fiction
Dans plusieurs films, dessins anim??s et des ??missions de t??l??vision, en particulier ceux de science-fiction, l'acide sulfurique est normalement d??peints comme un liquide de cuisson ?? la vapeur vert bouillonnant, parfois capable de dissoudre presque ne importe quoi en un instant. Ce est purement pour l'attrait visuel, puisque bouillante vert acide est plus dangereux mine que la forme claire et sirupeux r??elle, il est vraiment. L'utilisation de l'acide sulfurique comme une arme dans les crimes d'agression, connu sous le nom " vitriol jeter ", a parfois ??t?? assez commune (si sensationnelle) de faire son chemin dans les romans et les histoires courtes. Les exemples incluent L'aventure de l'Illustre Client, par Arthur Conan Doyle, L'Amour de Long Ago, par Guy de Maupassant et Brighton Rock par Graham Greene. Un groupe, My Vitriol, tirent leur nom de son utilisation comme une arme ?? Brighton Rock. Un ??pisode de Saturday Night Live h??berg?? par Mel Gibson inclus un croquis Western parodie "Sh??rif Jeff acide," qui porte un flacon d'acide au lieu d'un Six Shooter. Le M??chant DC Comics Deux visage ??tait d??figur?? ?? la suite d'un jet de vitriol. Ce crime est ??galement mentionn?? dans Nineteen Eighty-Four par George Orwell; le protagoniste Winston Smith accepte de jeter du vitriol au visage d'un enfant si ce serait pour "de la Fraternit??", et l'ennemi de Winston O'Brien tard utilise ces mots barbares de saper sa logique. Le roman Veronika d??cide de mourir par Paulo Coelho parle d'une fille qui a tent?? de se suicider et se termine avec l'empoisonnement de vitriol. Le m??decin / th??rapeute dans ce roman ??crit aussi une th??se sur la gu??rison intoxication vitriol. La substance a ??galement ??t?? utilis?? par un jeune gangster dans Saison 6B, Episode 5 Les Sopranos comme une forme de torture.
