
Propri??t??s de l'eau
?? propos de ce ??coles s??lection Wikipedia
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille pr??s de la charit??. Lire la suite ...
| Eau (H 2 O) | |
|---|---|
 | |
 | |
Eau | |
Autres noms Aqua | |
| Identificateurs | |
| Num??ro CAS | 7732-18-5 |
| Num??ro RTECS | ZC0110000 |
| Propri??t??s | |
| Formule mol??culaire | H 2 O ou HOH |
| Masse molaire | 18,01524 g / mol |
| Apparence | solide blanc ou presque incolore, transparent, avec une l??g??re touche de bleu, solide ou liquide cristallin |
| Densit?? | 1000 kg ?? m -3, liquide (4 ?? C) 917 kg ?? m -3, solide |
| Point de fusion | |
| Point d'??bullition | 100 ?? C, 212 ?? F (373,15 K) |
| Acidit?? (p K a) | 15,74 ~ 35-36 |
| Basicit?? (p K b) | 15,74 |
| Viscosit?? | 0,001 Pa.s ?? 20 ?? C |
| Structure | |
| Crystal structure | Hexagonal Voir la glace |
| Forme mol??culaire | courb?? |
| Moment de dip??le | 1,85 R?? |
| Risques | |
| Principal dangers | intoxication par l'eau, noyade (voir aussi Monoxyde de dihydrog??ne canular) |
| NFPA 704 |  0 0 1 |
| Des compos??s apparent??s | |
| Connexes solvants | ac??tone m??thanol |
| Des compos??s apparent??s | la vapeur d'eau glace eau lourde |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Eau ( H 2 O , H OH ) est le plus abondant mol??cule sur la Terre la surface de, la composition d'environ 70% de la surface de la Terre que l'??tat liquide et solide en plus d'??tre pr??sent dans l'atmosph??re sous forme de vapeur. C'est dans l'??quilibre dynamique entre le liquide et Etats vapeur ?? temp??rature et pression normales. ?? la temp??rature ambiante, il est presque incolore avec un soup??on de bleu, insipide, et liquide inodore. De nombreuses substances se dissolvent dans l'eau et il est commun??ment d??nomm?? universel solvant . De ce fait, l'eau dans la nature et de l'utilisation est rarement pur, et peut avoir des propri??t??s diff??rentes de celles en laboratoire. Cependant, il existe de nombreux compos??s qui sont essentiellement, voire totalement, insoluble dans l'eau. L'eau est la seule substance commune qui se trouve naturellement dans les trois communes ??tats de la mati??re-pour d'autres substances, voir les propri??t??s chimiques . L'eau permet ??galement jusqu'?? 75% du corps humain.
Les formes de l'eau
- Voir l' eau # Aper??u des types d'eau
L'eau peut prendre de nombreuses formes. L' ??tat solide de l'eau est g??n??ralement connu comme la glace (alors que de nombreuses autres formes existent; voir l'eau solide amorphe); l' ??tat gazeux est connue comme la vapeur d'eau (ou vapeur), et le liquide commune de phase est g??n??ralement consid??r?? comme simplement de l'eau. Dessus d'un certain temp??rature et pression critique (647 K et 22,064 MPa), les mol??cules d'eau assumer un ??tat supercritique, dans lequel les grappes de liquide comme flotter dans une phase vapeur en forme.
L'eau lourde de l'eau dans lequel l'hydrog??ne est remplac?? par son plus lourd isotope , deut??rium. Il est presque identique chimiquement ?? de l'eau normale. L'eau lourde est utilis??e dans le industrie nucl??aire pour ralentir les neutrons .
Physique et chimie de l'eau
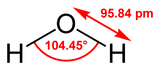
L'eau est le substance chimique avec la formule chimique H 2 O : une mol??cule d'eau a deux hydrog??ne atomes covalence li?? ?? un seul oxyg??ne atomique. L'eau est un liquide insipide et inodore au temp??rature ambiante et de la pression, et semble incolore en petites quantit??s, mais il a sa propre teinte bleue tr??s l??g??re intrins??que. Glace appara??t ??galement incolore et la vapeur d'eau est essentiellement invisible ?? l'??tat gazeux. L'eau est principalement un liquide dans des conditions standard, ce qui ne est pas pr??dite ?? partir de sa relation ?? d'autres analogues de la hydrures famille d'oxyg??ne dans le tableau p??riodique , qui sont des gaz tels que sulfure d'hydrog??ne. Aussi les ??l??ments environnants oxyg??ne dans le tableau p??riodique , azote , fluor , phosphore , soufre et chlore , tout se combinent avec l'hydrog??ne pour produire des gaz dans des conditions standard. La raison pour laquelle le dihydrure d'oxyg??ne (de l'eau) forme un liquide est qu'il est plus ??lectron??gatif que l'ensemble de ces ??l??ments (?? l'exception du fluor). Oxyg??ne attire les ??lectrons beaucoup plus fortement que l'hydrog??ne, ce qui entra??ne une charge nette positive sur les atomes d'hydrog??ne, et une charge n??gative nette sur l'atome d'oxyg??ne. La pr??sence d'une charge sur chacun de ces atomes donne chaque mol??cule d'eau un filet instant dip??le. Attraction ??lectrique entre les mol??cules d'eau en raison de ce dip??le tire mol??cules individuelles se rapprocher, ce qui rend plus difficile de s??parer les mol??cules et augmentant par cons??quent le point d'??bullition. Cette attraction est connu comme une liaison hydrog??ne. L'eau peut ??tre d??crit comme un liquide polaire qui se dissocie de fa??on disproportionn??e dans le ion hydronium (H 3 O + (aq)) et l'un associ?? hydroxyde ions (OH - (aq)). L'eau est en ??quilibre dynamique entre le liquide , gaz et solides Etats ?? temp??rature et pression normales (0 ?? C, 100,000 kPa), et est la seule substance pure trouve naturellement sur Terre de l'??tre.
Eau, la glace et de la vapeur
La capacit?? thermique et chaleurs de vaporisation et la fusion
L'eau a le deuxi??me plus haut la capacit?? thermique sp??cifique de ne importe quel compos?? chimique connu, apr??s l'ammoniac , ainsi qu'un haut chaleur de vaporisation (40,65 kJ mol -1), qui sont tous deux en raison de la vaste une liaison hydrog??ne entre les mol??cules. Ces deux propri??t??s inhabituelles permettent ?? l'eau ?? mod??r??e de la Terre le climat en tamponnant grandes fluctuations de temp??rature.
Le sp??cifique enthalpie de fusion de l'eau est 333,55 kJ kg -1 ?? 0 ??C. Des substances communes, seulement celle de l'ammoniac est plus ??lev??. Cette propri??t?? conf??re une r??sistance ?? la fusion sur la glace des glaciers et la d??rive de la glace. Avant l'av??nement de la m??canique r??frig??ration, la glace ??tait d'usage courant pour retarder la d??t??rioration des aliments.
Densit?? de l'eau et de la glace
| Temp (?? C) | Densit?? (g / cm 3) |
|---|---|
| 100 | 0,9584 |
| 80 | 0,9718 |
| 60 | 0,9832 |
| 40 | 0,9922 |
| 30 | 0.9956502 |
| 25 | 0.9970479 |
| 22 | 0.9977735 |
| 20 | 0.9982071 |
| 15 | 0.9991026 |
| 10 | 0.9997026 |
| 4 | 0.9999720 |
| 0 | 0.9998395 |
| -10 | 0.998117 |
| -20 | 0.993547 |
| -30 | 0.983854 |
| La densit?? de l'eau, en grammes par centim??tre cube ?? diff??rentes temp??ratures en degr??s Celsius, Les valeurs inf??rieures ?? 0 ?? C se r??f??rent ?? eau en surfusion. Eau - Densit?? et Poids sp??cifique | |
La forme solide de la plupart des substances est plus dense que le liquide de phase ; Ainsi, un bloc de mati??re solide pur va sombrer dans un bain de substance liquide pur. Mais, en revanche, un bloc de commune glace flottent dans un baquet d'eau parce que l'eau solide est moins dense que l'eau liquide. Ce est une propri??t?? caract??ristique tr??s importante d'eau. ?? la temp??rature ambiante, l'eau liquide devient plus dense avec abaissement de la temp??rature, tout comme d'autres substances. Mais ?? 4 ?? C (3,98 plus pr??cis??ment), juste au-dessus de z??ro, l'eau atteint son densit?? maximale, et que l'eau se refroidit de plus vers son point de cong??lation, l'eau liquide, dans des conditions standard, se d??veloppe pour devenir moins dense. La raison physique en est li?? ?? la la structure cristalline de l'ordinaire glace , appel??e hexagonal la glace Ih. L'eau, le plomb , l'uranium , le n??on et le silicium sont quelques-uns des rares mat??riaux qui se ??panouissent quand ils g??lent; plus contrat d'autres mat??riaux. Toutes les formes de glace ne sont pas moins dense que l'eau liquide mais, HDA et VHDA par exemple sont ?? la fois plus dense que la phase liquide de l'eau pure. Ainsi, la raison pour laquelle la forme commune de la glace est moins dense que l'eau est un peu non-intuitive et se appuie fortement sur les propri??t??s inhabituelles inh??rents ?? la liaison hydrog??ne.
En g??n??ral, l'eau se dilate quand il g??le ?? cause de son structure mol??culaire, en tandem avec l'insolite l'??lasticit?? de la liaison hydrog??ne et l'??nergie la plus basse particulier hexagonale en cristal conformation qu'il adopte dans des conditions standard. Ce est, lorsque l'eau se refroidit, il tente de se empiler dans un la configuration du r??seau cristallin qui se ??tend le de rotation et composantes de vibration de la liaison, de sorte que l'effet est que chaque mol??cule d'eau est pouss?? plus loin ?? partir de chacune de ses mol??cules voisines. Cela r??duit efficacement la densit?? ρ de l'eau quand la glace se forme dans des conditions standard.
part d'eau de l'??tat liquide ?? plus forte densit?? avec seulement quelques mat??riaux comme le gallium , le germanium , le bismuth et l'antimoine .
L'importance de cette propri??t?? ne peut pas ??tre surestim??e pour son r??le sur la ??cosyst??me de la Terre. Par exemple, si l'eau ??tait plus dense quand ils sont gel??s, les lacs et les oc??ans dans un environnement polaire finiraient g??lent (de haut en bas). Ce serait le cas parce que la glace gel??e r??glerait sur le lac et les lits des rivi??res, et le ph??nom??ne de r??chauffement n??cessaire (voir ci-dessous) ne pouvait pas se produire en ??t??, car la couche de surface chaude serait moins dense que la couche solide congel?? ci-dessous. Ce est une caract??ristique importante de cette nature qui ne se produit pas naturellement dans l'environnement.
N??anmoins, l'expansion inhabituelle de cong??lation de l'eau (dans des milieux naturels ordinaires dans les syst??mes biologiques pertinentes), en raison de la liaison hydrog??ne, de 4 ?? C au-dessus de cong??lation au point de cong??lation offre un avantage important pour la vie de l'eau douce en hiver. Eau glac??e ?? la surface augmentation de la densit?? et de puits, formant convection des courants qui refroidissent le corps entier de l'eau, mais lorsque la temp??rature de l'eau du lac atteigne 4 ?? C, l'eau sur la surface de la densit?? diminue car il refroidit davantage et reste en tant que couche de surface qui a finalement g??le et forme glace. Depuis convection descendant de l'eau froide est bloqu?? par le changement de densit??, toute grande ??tendue d'eau douce gel??e en hiver aura l'eau la plus froide pr??s de la surface, loin de la lit ou lit du lac.
L'eau g??le ?? 0 ?? C (32 ?? F, 273 K), cependant, il peut ??tre surfusion dans un ??tat fluide jusqu'?? son nucl??ation des cristaux homog??ne ?? presque 231 K (-42 ?? C).
L'eau augmente consid??rablement lorsque la temp??rature augmente. La densit?? est 4% de moins que le maximum que la temp??rature approche ??bullition.
Densit?? de l'eau sal??e et de glace
La densit?? de l'eau d??pend de la teneur en sel dissous ainsi que la temp??rature de l'eau. Ice flotte encore dans les oc??ans, sinon ils g??lerait de bas en haut. Toutefois, la teneur en sel des oc??ans abaisse le point d'environ 2 ?? C de cong??lation et abaisse la temp??rature du maximum de densit?? de l'eau jusqu'au point de cong??lation. Ce est pourquoi, dans l'eau de l'oc??an, la convection ?? la baisse de l'eau froide ne est pas bloqu?? par une expansion de l'eau car il devient plus froid pr??s du point de cong??lation. Eau froide les oc??ans pr??s du point de cong??lation continue ?? couler. Pour cette raison, toute cr??ature tenter de survivre au fond de cette eau froide que l' oc??an Arctique vit g??n??ralement dans l'eau qui est de 4 ?? C plus froid que la temp??rature au bas de congel??-over lacs d'eau douce et les rivi??res en hiver.
Comme le surface de l'eau sal??e commence ?? geler (?? -1,9 ?? C pour la salinit?? normale d'eau de mer , 3,5%) la glace qui se forme est essentiellement sans sel avec une densit?? approximativement ??gale ?? celle de la glace d'eau douce. Cette glace flotte ?? la surface et le sel qui est "gel?? out" se ajoute ?? la salinit?? et la densit?? de l'eau de mer juste en dessous, dans un proc??d?? connu sous le nom rejet de la saumure. Cette eau sal??e plus dense se enfonce par convection et le remplacement de l'eau de mer est soumise au m??me processus. Cette donne de la glace d'eau douce essentiellement ?? -1,9 ?? C ?? la surface. La densit?? accrue de l'eau de mer sous la glace formant la fait couler vers le bas.
Miscibilit?? et la condensation
L'eau est Miscible avec de nombreux liquides, par exemple l'??thanol en toutes proportions, en formant un seul liquide homog??ne. Sur l'eau et d'autres de la main plus les huiles sont non miscible formant habituellement couches selon la densit?? croissante de la partie sup??rieure.
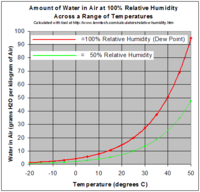
En tant que gaz, de vapeur d'eau est compl??tement miscibles avec l'air. D'autre part la pression de vapeur d'eau maximale qui est thermodynamiquement stable avec le liquide (ou solide) ?? une temp??rature donn??e est relativement faible par rapport ?? la pression atmosph??rique totale. Par exemple, si la vapeur la pression partielle est de 2% de la pression atmosph??rique et l'air est refroidi de 25 ?? C, en commen??ant ?? environ 22 ?? C l'eau va commencer ?? se condenser, en d??finissant le point de ros??e, et la cr??ation brouillard ou ros??e. Repr??sente le processus inverse pour le brouillard br??ler dans la matin??e. Si l'on augmente l'humidit?? ?? la temp??rature ambiante, par exemple en ex??cutant une douche chaude ou un bain, et la temp??rature reste ?? peu pr??s le m??me, la vapeur atteint rapidement la pression pour le changement de phase, et se condense sous forme de vapeur. Un gaz dans ce contexte est appel?? satur?? ou 100% d'humidit?? relative, lorsque la pression de vapeur d'eau dans l'air est ?? l'??quilibre avec la pression de vapeur en raison de (liquide) de l'eau; eau (ou de la glace, se il est assez cool) ne parviennent pas ?? perdre de la masse par ??vaporation lorsqu'elle est expos??e ?? l'air satur??. Parce que la quantit?? de vapeur d'eau dans l'air est faible, l'humidit?? relative, le rapport de la pression partielle due ?? la vapeur d'eau ?? la pression partielle de vapeur satur??e, est beaucoup plus utile. pression de vapeur d'eau au-dessus de 100% d'humidit?? relative est appel?? super-satur??e et peut se produire si l'air est refroidi rapidement, disons par se levant brusquement dans un courant d'air ascendant.
Pressions de vapeur d'eau
| Temp??rature (?? C) | Pression (torrs) |
|---|---|
| 0 | 4,58 |
| 5 | 6,54 |
| 10 | 9,21 |
| 12 | 10,52 |
| 14 | 11,99 |
| 16 | 13,63 |
| 17 | 14,53 |
| 18 | 15,48 |
| 19 | 16,48 |
| 20 | 17,54 |
| 21 | 18,65 |
| 22 | 19,83 |
| 23 | 21.07 |
| 24 | 22,38 |
| 25 | 23,76 |
Compressibilit??
Le la compressibilit?? de l'eau est fonction de la pression et de la temp??rature. A 0 ?? C dans la limite de pression nulle ?? la compressibilit?? est de 5,1 ?? 10 -5 bar -1. Dans la limite de pression z??ro la compressibilit?? atteint un minimum de 4,4 ?? 10 -5 bar -1 environ 45 ?? C avant d'augmenter ?? nouveau la temp??rature augmente. Comme la pression est augment??e les baisses de compressibilit??, ??tant de 3,9 ?? 10 -5 bar -1 ?? 0 ?? C et 1000 bar. Le module de masse d'eau est de 2,2 ?? 10 9 Pa. La faible compressibilit?? de non-gaz, et de l'eau en particulier, conduit ?? les souvent ??tant suppos??e incompressible. La faible compressibilit?? de l'eau signifie que m??me dans les profonds oc??ans ?? 4000 m de profondeur, o?? les pressions sont 4 ?? 10 7 Pa, il ya seulement une baisse de 1,8% en volume.
Point triple
| Phases en ??quilibre stable | Pression | Temp??rature |
|---|---|---|
| eau liquide, la glace Ih, et de la vapeur d'eau | 611,73 Pa | 273,16 K (0,01 ?? C) |
| eau liquide, de glace Ih, et glace III | 209,9 MPa | 251 K (-22 ?? C) |
| eau liquide, de glace III, et glace V | 350,1 MPa | -17,0 ?? C |
| eau liquide, de glace V et VI de la glace | 632,4 MPa | 0,16 ?? C |
| la glace Ih, Ice II, III et la glace | 213 MPa | -35 ?? C |
| II glace, de la glace III, V et de la glace | 344 MPa | -24 ?? C |
| II glace, de la glace V, VI et de la glace | 626 MPa | -70 ?? C |
La temp??rature et pression ?? laquelle solide, liquide et gazeux de l'eau coexistent en ??quilibre est appel?? point triple de l'eau. Ce point est utilis?? pour d??finir les unit??s de temp??rature (le kelvin , l'unit?? SI de temp??rature thermodynamique et, indirectement, le degr?? Celsius et m??me le degr?? Fahrenheit). En cons??quence, la temp??rature du point triple de l'eau est une valeur prescrite au lieu d'une quantit?? mesur??e. Le point triple est ?? une temp??rature de 273,16 K (0,01 ?? C) par convention, et ?? une pression de 611,73 Pa. Cette pression est tr??s faible, environ 1/166 de la pression barom??trique au niveau normal de la mer de 101 325 Pa. La pression atmosph??rique de surface sur la plan??te Mars est remarquablement proche de la pression du point triple, et le z??ro-??l??vation ou ??niveau de la mer?? de Mars est d??finie par la hauteur ?? laquelle la pression atmosph??rique correspond au point triple de l'eau.

M??me se il est commun??ment d??sign?? comme ??le point triple de l'eau", la combinaison stable de l'eau liquide, glace I, et de la vapeur d'eau ne est qu'un de plusieurs points triples sur le diagramme de phase de l'eau. Gustav Heinrich Johann Apollon Tammann ?? G??ttingen a produit des donn??es sur plusieurs autres points triples au d??but du 20e si??cle. Kamb et d'autres document??s autres points triples dans les ann??es 1960.
Effet Mpemba
Le Effet Mpemba est le ph??nom??ne surprenant par lequel l'eau chaude peut, sous certaines conditions, de geler plus vite que l'eau froide, m??me si elle doit passer la temp??rature plus basse sur le chemin de cong??lation. Cependant, ceci peut ??tre expliqu?? par ??vaporation, convection, surfusion, et la effet de isolant gel.
Transition ?? temp??rature ambiante cong??lation
Hot ice est le nom donn?? ?? un autre ph??nom??ne surprenant dans lequel l'eau ?? la temp??rature ambiante peut ??tre transform?? en glace qui reste ?? la temp??rature ambiante par l'alignement des dip??les d'eau et la cristallisation dans la glace cube polaire gr??ce ?? la fourniture d'un champ ??lectrique de l'ordre de 10 6 volts par m??tre. Ce ph??nom??ne a ??t?? plus tard ??t?? ??cart?? comme ne ??tant pas due au gel tension induite et attribu?? ?? un artefact.
L'effet de ces champs ??lectriques a ??t?? sugg??r?? comme une explication de la formation des nuages. Les premiers temps formes de glace des nuages autour d'une particule d'argile, il n??cessite une temp??rature de -10 ?? C, mais la suite le gel autour de la m??me particule d'argile n??cessite une temp??rature de seulement -5 ?? C, ce qui sugg??re une sorte de changement structurel.
La tension de surface
Les gouttes d'eau sont stables, en raison de la forte tension de surface de l'eau, 72,8 mN / m, le plus ??lev?? des liquides non m??talliques. Ceci peut ??tre vu lorsque de petites quantit??s d'eau sont plac??s sur une surface telle que du verre: l'eau reste sous forme de gouttes en m??me temps. Cette propri??t?? est importante pour la vie. Par exemple, lorsque de l'eau est effectu??e par xyl??me des plantes ?? tiges les attractions intermol??culaires fortes maintiennent la colonne d'eau en m??me temps. Propri??t??s de coh??sion forte emprise de la colonne d'eau ensemble, et de fortes propri??t??s adh??sives collent l'eau ?? la xyl??me, et ??viter les ruptures de tension provoqu??e par transpiration traction. Autres liquides avec une tension de surface inf??rieure auraient plus tendance ?? "d??chirer", formage sous vide ou poches d'air et rendre le transport de l'eau du xyl??me inop??rant.
Propri??t??s ??lectriques
L'eau pure ne contenant pas de ions est un excellent isolant, cependant, pas m??me l'eau "d??min??ralis??e", est compl??tement libre d'ions. subit d'eau auto-ionisation ?? toute temp??rature au-dessus du z??ro absolu . En outre, parce que l'eau est un bon solvant, il a presque toujours un solut?? dissous en elle, le plus souvent un le sel. Si de l'eau a m??me une petite quantit?? d'une telle impuret??, alors il peut facilement conduire l'??lectricit??, sous forme d'impuret??s comme le sel se s??parer en libres ions en solution aqueuse par lequel un courant ??lectrique peut circuler.
L'eau peut ??tre fractionn?? en ses ??l??ments constitutifs, de l'hydrog??ne et de l'oxyg??ne, par passage d'un courant ?? travers elle. Ce processus est appel?? ??lectrolyse . Les mol??cules d'eau se dissocient naturellement en H + et des ions OH -, qui sont tir??s vers le cathode et anode, respectivement. A la cathode, deux ions H + de ramasser ??lectrons et forme H 2 gaz. A l'anode, quatre ions OH - se combinent et lib??rent des gaz O 2, de l'eau mol??culaire, et quatre ??lectrons. Les gaz produits bulles ?? la surface, o?? elles peuvent ??tre recueillies. On sait que la r??sistivit?? ??lectrique maximale th??orique d'eau est d'environ 182 kQ ?? m?? / m (ou 18,2 cm?? ?? MQ / cm) ?? 25 ?? C. Ce chiffre correspond bien ?? ce qui est g??n??ralement vu sur osmose inverse, ultrafiltration et d??min??ralis??e les syst??mes d'eau ultrapure utilis??s, par exemple, dans les usines de fabrication de semiconducteurs. Un niveau de contaminant sel ou d'acide sup??rieure ?? celle de m??me 100 parties par billion (ppt) dans l'eau ultra-pure va commencer ?? baisser sensiblement son niveau de r??sistivit?? jusqu'?? plusieurs kilohm-m??tres carr??s par m??tre (un changement de plusieurs centaines nanosiemens par m??tre de conductance).
Conductivit?? ??lectrique
L'eau pure a une faible conductivit?? ??lectrique, mais ceci augmente de mani??re significative sur la solvatation d'une petite quantit?? d'eau de mat??riau ionique tel que du chlorure d'hydrog??ne. Ainsi, les risques de ??lectrocution sont beaucoup plus dans l'eau avec les impuret??s habituelles ne se trouvent pas dans l'eau pure. (Il est ?? noter, cependant, que les risques de diminution d'??lectrocution lorsque les impuret??s augmentent au point o?? l'eau elle-m??me est un meilleur conducteur que le corps humain. Par exemple, les risques d'??lectrocution dans l'eau de mer sont plus faibles que dans l'eau douce , que la mer a un niveau beaucoup plus ??lev?? d'impuret??s, en particulier le sel commun, et le trajet de courant recherchera la meilleure chef d'orchestre. Ce est, n??anmoins, pas infaillible et des risques importants demeurent dans l'eau sal??e.) Toutes les propri??t??s ??lectriques observables dans l'eau sont des ions de sels min??raux et de dioxyde de carbone dissous. L'eau ne auto-ioniser o?? deux mol??cules d'eau deviennent une hydroxyde anions et une hydronium cation, mais pas assez pour transporter suffisamment courant ??lectrique pour effectuer un travail ou un pr??judice pour la plupart des op??rations. Dans l'eau pure, l'??quipement sensible peut d??tecter un tr??s l??ger ??lectrique conductivit?? de 0,055 uS / cm ?? 25 ?? C. L'eau peut ??galement ??tre ??lectrolys??e dans les gaz d'oxyg??ne et d'hydrog??ne, mais en l'absence d'ions dissous ce est un processus tr??s lent, est r??alis??e en tant que tr??s peu de courant. Tandis que les ??lectrons sont les porteurs primaires de charge dans l'eau (m??taux), et dans la glace (et quelques autres ??lectrolytes), protons sont les porteurs primaires (voir Conducteur protonique).
La nature dipolaire de l'eau
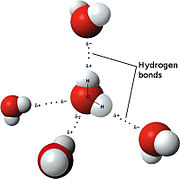
Une caract??ristique importante de l'eau est son nature polaire. La mol??cule d'eau forme un angle, avec des atomes d'hydrog??ne au niveau des pointes et de l'oxyg??ne au sommet. Etant donn?? que l'oxyg??ne a une ult??rieure ??lectron??gativit?? de l'hydrog??ne, du c??t?? de la mol??cule par l'atome d'oxyg??ne a une charge n??gative partielle. Une mol??cule avec une telle diff??rence de charge est appel?? dip??le. Les diff??rences de charge provoquent des mol??cules d'eau pour ??tre attir??s les uns aux autres (les zones relativement positives ??tant attir??es vers les zones relativement n??gatifs) et ?? d'autres mol??cules polaires. Cette attraction est connu comme une liaison hydrog??ne, et explique la plupart des propri??t??s de l'eau. Certaines mol??cules, telles que le dioxyde de carbone, ont ??galement une diff??rence d'??lectron??gativit?? entre les atomes Mais la diff??rence est que la forme de dioxyde de carbone est align??e de mani??re sym??trique de sorte que les charges oppos??es se annulent mutuellement. Ce ph??nom??ne de l'eau peut ??tre vu si vous d??tenez une source ??lectrique ?? proximit?? d'un mince filet d'eau tombant verticalement, provoquant le flux de plier vers la source ??lectrique.
Bien que la liaison hydrog??ne est une attraction relativement faible par rapport aux liaisons covalentes au sein de la mol??cule d'eau elle-m??me, il est responsable d'un certain nombre de propri??t??s physiques de l'eau. Une telle propri??t?? est relativement ??lev?? ses fusion et point d'??bullition temp??ratures; plus la chaleur est l'??nergie n??cessaire pour briser les liaisons hydrog??ne entre mol??cules. Le sulfure d'hydrog??ne du compos?? analogue (H 2 S), qui a beaucoup plus faible liaison hydrog??ne, est un gaz ?? la temp??rature ambiante m??me si elle a deux fois la masse mol??culaire de l'eau. La liaison suppl??mentaire entre les mol??cules d'eau donne ??galement une grande eau liquide la capacit?? thermique sp??cifique. Cette capacit?? thermique ??lev??e rend l'eau un bon moyen de stockage de chaleur.
La liaison hydrog??ne donne ??galement de l'eau de son comportement inhabituel lors de la cong??lation. Lorsque refroidi ?? proximit?? du point de cong??lation, la pr??sence de liaisons hydrog??ne signifie que les mol??cules, comme ils r??arrangent pour minimiser leur ??nergie, forment la hexagonale structure cristalline de glace qui est en fait une densit?? plus faible, d'o?? la forme solide, la glace, va flotter dans l'eau. En d'autres termes, l'eau se dilate en gelant, alors que presque tous les autres mat??riaux se contractent lors de la solidification.
Une cons??quence int??ressante de la mati??re solide ayant une densit?? inf??rieure ?? celle du liquide qui est glace fondra si une pression suffisante est appliqu??e. Avec une pression croissante de la temp??rature de point de fusion diminue et lorsque la temp??rature de point de fusion est inf??rieur ?? la temp??rature ambiante, la glace commence ?? fondre. Une augmentation significative de la pression est n??cessaire pour abaisser la temp??rature du point de fusion -la pression exerc??e par un patineur sur la glace ne ferait que r??duire le point de fusion d'environ 0,09 ?? C (0,16 ?? F).
- Polarit?? Electronegative
L'eau a une charge n??gative partielle (σ-) pr??s de l'atome d'oxyg??ne en raison des paires d'??lectrons non partag??s, et des charges positives partielles (σ) + de pr??s les atomes d'hydrog??ne. Dans l'eau, cela se produit parce que l'atome d'oxyg??ne est plus ??lectron??gatif que les atomes d'hydrog??ne - ce est, il a une "forte puissance de traction "sur de la mol??cule les ??lectrons , les rapprocher (avec leur charge n??gative) et rendre la zone autour de l'atome d'oxyg??ne plus n??gative que la zone autour de la fois de l'hydrog??ne atomes.
Adh??sion

b??tonnets de l'eau pour se ( la coh??sion), car il est polaire. L'eau a ??galement ??lev?? propri??t??s d'adh??rence en raison de sa nature polaire. Sur extr??mement propre / lisse en verre l'eau peut se former un film mince parce que les forces mol??culaires entre le verre et les mol??cules d'eau (forces adh??sives) sont plus fortes que les forces de coh??sion. Dans les cellules biologiques et organelles, l'eau est en contact avec la membrane et des prot??ines qui sont des surfaces hydrophile; ce est-?? surfaces qui ont une forte attirance pour l'eau. Irving Langmuir a observ?? une forte force de r??pulsion entre les surfaces hydrophiles. Pour d??shydrater hydrophiles surfaces ?? enlever les couches fortement ancr??es d'eau d'hydratation-faire n??cessite un travail consid??rable contre ces forces, disant forces d'hydratation. Ces forces sont tr??s grandes, mais diminuent rapidement sur un nanom??tre ou moins. Leur importance dans la biologie a ??t?? largement ??tudi?? par V. Adrian Parsegian du Institut national de la sant??. Elles sont particuli??rement importantes lorsque les cellules sont d??shydrat??es par l'exposition ?? des atmosph??res s??ches ou au gel extracellulaire.
La tension de surface

L'eau a une haute tension superficielle provoqu??e par la forte coh??sion entre les mol??cules d'eau. Ceci peut ??tre vu lorsque de petites quantit??s d'eau sont plac??s sur une surface non-soluble, tel que poly??thyl??ne; l'eau reste ensemble sous forme de gouttes. Tout aussi important, l'air emprisonn?? dans les perturbations de surface forme des bulles, qui durent parfois assez longtemps pour transf??rer les mol??cules de gaz ?? l'eau. Un autre effet de la tension superficielle est ondes capillaires qui sont les ondulations de surface qui se forment autour de l'impact des gouttes sur la surface d'eau, et quelques fois se produisent des courants de subsurface solides se ??coulent ?? la surface de l'eau. L'??lasticit?? apparente caus??e par la tension de surface entra??ne les vagues.
L'action capillaire
L'action capillaire se r??f??re au processus de l'eau en mouvement jusqu'?? un tube ??troit contre la force de gravit?? . Il se produit parce que l'eau est conforme aux c??t??s du tube, et ensuite la tension de surface a tendance ?? redresser la surface faisant l'??l??vation de surface, et plus d'eau est tir?? vers le haut par la coh??sion. Le processus se r??p??te tant que l'eau se ??coule dans le tube jusqu'?? ce qu'il y ait suffisamment d'eau que la gravit?? se oppose ?? la force d'adh??rence.
L'eau comme solvant

L'eau est ??galement un bon solvant en raison de sa polarit??. Substances qui seront bien m??langer et dissoudre dans l'eau (par exemple les sels ) sont connus comme " "substances (aimant l'eau), tandis que ceux qui ne se m??langent pas bien avec de l'eau (par exemple hydrophiles graisses et huiles ), sont connus comme " "(eau-craignant) substances hydrophobes. La capacit?? d'une substance ?? dissoudre dans l'eau est d??termin??e par si oui ou non la substance peut correspondre ou mieux la forte des forces d'attraction qui g??n??rent des mol??cules d'eau entre autres mol??cules d'eau. Si une substance a des propri??t??s qui ne permettent pas de surmonter ces forces intermol??culaires fortes, les mol??cules sont " pouss?? hors "de l'eau et ne se dissout pas. Contrairement aux substances erreur courante, de l'eau et hydrophobes ne pas" repousser ", et l'hydratation d'une surface hydrophobe est ??nerg??tiquement, mais pas de mani??re entropique, favorable.
Quand un compos?? ionique ou polaire entre l'eau, il est entour?? par des mol??cules d'eau ( L'hydratation). La taille relativement petite des mol??cules d'eau permet g??n??ralement de nombreuses mol??cules d'eau pour entourer une mol??cule de solut?? . Les extr??mit??s des dip??les partiellement n??gatives de l'eau sont attir??s par les composants du solut??, et vice versa pour les extr??mit??s positives dipolaires charg?? positivement.
En g??n??ral, des substances ioniques et polaires, tels que des acides , des alcools , et sels sont relativement solubles dans l'eau, et des substances non polaires telles que les graisses et les huiles sont pas. Mol??cules non polaires restent ensemble dans l'eau car il est ??nerg??tiquement plus favorable pour les mol??cules d'eau ?? liaison hydrog??ne ?? l'autre que de se engager dans de van der Waals avec des mol??cules non polaires.
Un exemple d'un solut?? ionique est le sel de table ; le chlorure de sodium, NaCl, Na + se s??pare en cations et Cl - anions , chacune ??tant entour??e par des mol??cules d'eau. Les ions sont ensuite facilement transport??s loin de leur r??seau cristallin dans la solution. Un exemple d'un solut?? non ionique est le sucre de table . Les dip??les d'eau font des liaisons hydrog??ne avec les r??gions polaires de la mol??cule de sucre (groupes OH) et lui permettent d'??tre emport?? dans la solution.
Nature amphot??re de l'eau
Chimiquement, l'eau est amphot??re - ce est ?? dire, il est capable d'agir soit comme un acide ou un base. Parfois l'acide hydroxic terme est utilis?? lorsque l'eau agit comme un acide dans une r??action chimique. A un pH de 7 (neutre), la concentration en hydroxyde ions (OH -) est ??gale ?? celle de la hydronium (H 3 O +) ou un atome d'hydrog??ne (H +) des ions. Si l' ??quilibre est perturb??, la solution devient acide (concentration plus ??lev??e en ions hydronium) ou de base (plus forte concentration d'ions hydroxyde).
L'eau peut agir comme un acide ou une base dans les r??actions. Selon le Bronsted-Lowry syst??me, un acide est d??fini comme une esp??ce qui fait don d'un proton (un ion H +) dans une r??action, et une base comme l'un qui re??oit un proton. Lors de la r??action avec un acide plus fort, l'eau agit en tant que base; lors de la r??action avec une base forte, il agit comme un acide. Par exemple, il re??oit un ion H + de HCl dans de l'??quilibre:
- HCl + H 2 O ⇌ H 3 O + + Cl -
Ici l'eau agit comme une base, en recevant un ion H +.
Dans la r??action avec l'ammoniac , NH 3, de l'eau d'un don d'ions H +, et agit donc comme un acide:
- NH 3 + H 2 O ⇌ NH 4 + + OH -
L'acidit?? dans la nature
En th??orie, l'eau pure a une pH de 7 ?? 298 K. En pratique, l'eau pure est tr??s difficile ?? produire. L'eau laiss??e expos??e ?? l'air, pour toute longueur de temps va rapidement dissoudre le dioxyde de carbone , formant une solution dilu??e de l'acide carbonique, ayant un pH d'environ 5,7 limitatif. Comme les gouttelettes des nuages se forment dans l'atmosph??re et que les gouttes de pluie tombent ?? travers les petites quantit??s d'air de CO 2 sont absorb??s et donc plus de pluie est l??g??rement acide. Si de grandes quantit??s de l'azote et de soufre oxydes sont pr??sents dans l'air, eux aussi se dissolvent dans le nuage et gouttes de pluie produire plus graves acide pluie probl??mes.
Liaison hydrog??ne dans de l'eau
Une mol??cule d'eau peut former un maximum de quatre liaisons hydrog??ne, car il peut accepter deux et faire un don de deux hydrog??nes. D'autres mol??cules telles que fluorure d'hydrog??ne, l'ammoniac , le m??thanol liaisons hydrog??ne de forme, mais ils ne montrent pas de comportement anormal thermodynamique , propri??t??s cin??tiques ou structurelles comme celles observ??es dans l'eau. La r??ponse ?? la diff??rence apparente entre de l'eau et d'autres liquides ?? liaison hydrog??ne r??side dans le fait que, en dehors de z??ro ?? l'eau des mol??cules de liaison hydrog??ne pouvant former quatre liaisons hydrog??ne, soit en raison de l'incapacit?? de donner / recevoir des hydrog??nes ou en raison de effets st??riques dans les r??sidus encombrants. Dans l'eau locale t??tra??drique ordre en raison des quatre liaisons hydrog??ne donne lieu ?? une structure ouverte et un r??seau de liaison en 3 dimensions, qui existe ?? la diff??rence des structures serr??es simples de liquides . Il existe une grande similarit?? entre l'eau et la silice dans leur comportement anormal, m??me si une (eau) est un liquide qui poss??de un r??seau de liaisons hydrog??ne tandis que l'autre (silice) dispose d'un r??seau covalente avec un point de fusion tr??s ??lev??. Une raison pour laquelle l'eau est bien adapt??, et choisi, de formes de vie, ce est qu'elle pr??sente ses propri??t??s uniques sur un r??gime de temp??rature qui convient ?? divers les processus biologiques, y compris hydratation.
On pense que les liaisons hydrog??ne dans l'eau est en grande partie due ?? des forces ??lectrostatiques et une certaine quantit?? de covalence. La nature covalente partielle de liaison hydrog??ne pr??dit par Linus Pauling dans les ann??es 1930 est encore ?? ??tre prouv?? sans ambigu??t?? par des exp??riences et des calculs th??oriques.
Propri??t??s quantiques de l'eau mol??culaire
Bien que la formule mol??culaire de l'eau est g??n??ralement consid??r?? comme un r??sultat stable en thermodynamique mol??culaire, de r??cents travaux a commenc?? en 1995 a montr?? que dans certaines ??chelles, de l'eau peut agir plus comme H 3/2 O de H 2 O au niveau quantique. Ce r??sultat pourrait avoir des r??percussions importantes au niveau de, par exemple, le liaison hydrog??ne dans biologique , chimique et physique des syst??mes. L'exp??rience montre que lorsque les neutrons et les ??lectrons entrent en collision avec l'eau, ils se dispersent dans une mani??re qui indique que seulement ils sont affect??s par un rapport de 1,5: 1 de l'hydrog??ne ?? l'oxyg??ne , respectivement. Cependant, l'??chelle de temps de cette r??ponse est consid??r??e uniquement au niveau des attosecondes (10 -18 secondes), et est donc pertinent que dans ?? haute r??solution cin??tique et syst??mes dynamiques.
Eau lourde et isotopologues d'eau
L'hydrogène a trois isotopes. La plus courante, représentant plus de 99,98% de l'hydrogène dans l'eau, a 1 proton et 0 neutrons. Un second isotope, le deutérium (forme courte «D»), dispose de 1 proton et 1 neutron. Le deutérium, D 2 O , est également connu comme l'eau lourde et est utilisé dans les réacteurs nucléaires comme modérateur de neutrons. Le troisième isotope, le tritium, a 1 proton et deux neutrons, et est radioactif, avec une demi-vie de 4500 jours. T 2 O existe dans la nature que dans les quantités minuscules, étant produite principalement par des réactions nucléaires rayons cosmiques conduit-dans l'atmosphère. D 2 O est stable, mais diffère de H 2 O en ce qu'elle est plus dense - par conséquent, «l'eau lourde» - et en ce que plusieurs autres propriétés physiques sont légèrement différentes de celles du commun, hydrogène-1 contenant "eau légère". Eau avec un atome de deutérium HDO se produit naturellement dans l'eau ordinaire en très faibles concentrations (~ 0,03%) et D 2 O en quantités beaucoup plus faibles (0,000003%). La consommation de pur isolé D 2 O peut affecter les processus biochimiques - ingestion de grandes quantités altère la fonction du système nerveux central et les reins. Cependant, de très grandes quantités d'eau lourde doivent être consommés pour toute toxicité pour être apparente, et de plus petites quantités peuvent être consommés sans aucune séquelle à tous.
L'oxygène a également trois isotopes stables, avec16O présente dans 99,76%,17O à 0,04% et18O à 0,2% de molécules d'eau.
Transparence
La transparence de l'eau est également une propriété importante du liquide. Si l'eau était pas transparente, la lumière du soleil, essentielle pour les plantes aquatiques, ne serait pas atteindre dans les mers et océans.
Histoire
Les propriétés de l'eau ont toujours été utilisées pour définir diverses échelles de température. Notamment, le Kelvin , Celsius et Fahrenheit échelles ont été ou sont actuellement, définis par les points de congélation et d'ébullition de l'eau. Les échelles moins courantes de Delisle, Newton, Réaumur et Rømer ont été définies de manière similaire. Le point triple de l'eau est un point norme plus couramment utilisé aujourd'hui.
Le premier scientifique décomposition de l'eau en hydrogène et oxygène, par électrolyse , a été réalisée en 1800 par William Nicholson, un chimiste anglais. En 1805, Louis Joseph Gay-Lussac et Alexander von Humboldt a montré que l'eau est composée de deux parties d'hydrogène et une partie d'oxygène (en volume).
Gilbert Newton Lewis isola le premier échantillon de la pureeau lourde en 1933.
Polywater était un hypothétique forme polymérisée d'eau qui a fait l'objet de beaucoup de controverse scientifique au cours de la fin des années 1960. Le consensus est maintenant qu'il n'y en pas.
Nommage systématique
La accepténom IUPAC de l'eau est tout simplement "l'eau", mais il ya deux autres noms systématiques qui peuvent être utilisés pour décrire la molécule.
Le nom le plus simple et le meilleur systématique de l'eau est l'oxyde d'hydrogène . Ceci est analogue à des composés apparentés, tels que le peroxyde d'hydrogène , le sulfure d'hydrogène et de l'oxyde de deutérium (eau lourde). Un autre nom systématique, oxidane , est accepté par l'IUPAC comme un nom de parent pour la désignation systématique de base d'oxygène groupes substituants, mais même ceux-ci ont souvent d'autres noms recommandés. Par exemple, le nom hydroxyle est recommandé sur oxidanyl pour le groupe -OH. Le nom oxane est explicitement mentionnée par l'IUPAC comme étant impropres à cet effet, car il est déjà le nom d'un éther cyclique également connu sous le tétrahydropyranne dans le système Hantzsch-Widman ; des composés similaires comprennent le dioxanne et le trioxanne.
La nomenclature systématique et de l'humour
Monoxyde de dihydrogène ou le monoxyde de dihydrogène est un nom systématique covalente trop pédant d'eau. Ce terme a été utilisé dans des parodies de la recherche chimique qui appellent pour cette "chimique mortel" pour être interdit. En réalité, un nom systématique serait plus réaliste de l'oxyde d'hydrogène , depuis la «di-" et "singes" préfixes sont superflus. Le sulfure d'hydrogène, H 2 S, est jamais appelé "monosulfide dihydrogène", et le peroxyde d'hydrogène , H 2 O 2 , est jamais appelé "le dioxyde de dihydrogène".
Certains zélésfiches de données de sécurité pour la liste de l'eau ce qui suit: ATTENTION: Peut causer la noyade!
Autres noms systématiques pour l'eau comprennent l'acide hydroxic ou l'acide hydroxylique . De même, le nom systématique de l'eau alcalin est l'hydroxyde d'hydrogène -Les deux noms acides et alcalins existent pour l'eau car il est capable de réagir à la fois comme un acide ou un alcali, en fonction de la force de l'acide ou d'un alcali, il est mis à réagir avec ( amphotère) . Aucun de ces noms sont largement utilisés à l'extérieur des sites de monoxyde de dihydrogène.

